WNT4及其抑制因子SFRP1在糖尿病肾病大鼠肾组织中的表达
孔 静,田平平,李圆圆,石明隽,王圆圆,肖 瑛,张 帆,郭 兵,孙 兰
(1.贵州医科大学 病理生理学教研室, 贵州 贵阳 550025; 2.贵州省高校重大疾病发病机制及药物防治特色重点实验室,贵州 贵阳 550025; 3.江苏医药职业学院 病理学与病理生理学教研室, 江苏 盐城 224005)
糖尿病肾病(diabetic nephropathy, DN)是糖尿病(diabetic mellitus, DM)最严重的并发症之一,是导致慢性肾衰竭的重要原因。肾小管间质纤维化是慢性肾衰竭的重要病理改变[1],而肾小管上皮细胞向间充质细胞的转分化(epithelial-mesenchymal transition, EMT)在肾小管间质纤维化的发生发展中起着重要作用[2]。Wnt通路是诱导EMT发生的一条重要的信号通路,本课题组的前期研究和其他学者的研究证实Wnt信号通路的活化促进了单侧输尿管梗阻大鼠和糖尿病大鼠肾脏纤维化的发生发展过程。分泌型卷曲相关蛋白(secreted frizzled-relatd proteins, SFRPs)是Wnt通路的拮抗因子之一。DN时WNT4/β-catenin信号通路的异常活化是否与该通路的抑制因子SFRPs表达下调有关,目前研究甚少。因此,本研究旨在探索DN时WNT4/β-catenin信号通路相关分子及SFRP1的表达变化及其与DN肾纤维化的可能关系。
1 材料与方法
1.1 材料
1.1.1 实验动物:SD大鼠,雄性,体质量200 g±20 g,SPF级,16只(北京华阜康生物科技股份有限公司,质量合格证号:0257330)。
1.1.2 主要试剂:链脲佐菌素(streptozotocin,STZ)(Sigma公司);两步法免疫组化检测试剂、 辣根过氧化物酶标记羊抗兔IgG、DAB显色试剂盒(北京中杉金桥公司);BCA蛋白浓度测定试剂盒、一抗稀释液和超敏ECL化学发光显示剂(北京碧云天公司);过硫酸铵(APS)(武汉博士德公司);0.45 μm PVDF膜(Millipore公司);Tween- 20(北京索莱宝生物公司);RevertAidTNTMFirst Strand cDNA Synthesis Kit (Thermo公司);iQTMSYBR~Green Supermix(Bio-Rad公司);WNT4抗体(北京博奥森公司);SFRP1、糖原合成激酶- 3β(glycogen synthase kinase- 3β,GSK- 3β)、p-GSK- 3β抗体(Santa Cruz公司);β-连环蛋白(β-catenin)、上皮细胞钙黏蛋白(E-cadherin)、Ⅰ型胶原(CollagenⅠ)抗体(北京博奥森公司);α-平滑肌肌动蛋白(α-smooth muscle actin, α-SMA)、β-actin抗体(武汉博士德公司)。
1.2 实验方法
1.2.1 糖尿病大鼠模型的复制和分组:STZ法复制大鼠胰岛素依赖型糖尿病(insulin dependent diabetes mellitus,IDDM)模型,72 h后连续3 d监测空腹血糖≥16.7 mmol/L者判定为IDDM模型复制成功。于模型复制成功后1周检测大鼠尿蛋白,取8只IDDM模型复制成功且尿蛋白阳性的大鼠为DN组,取8只相同鼠龄的正常大鼠为正常对照(normal control, NC)组。
1.2.2 收集标本:于12周末处死大鼠,处死前天收集24 h尿液,记录尿量。处死时乙醚麻醉;股动脉穿刺取血,室温1 000 r/min离心分离血清;开腹取双肾,一部分肾组织固定于4%中性甲醛,其余肾组织于-80 ℃保存。
1.2.3 生化指标的测定:活体动物血糖用血糖仪尾部取血检测;处死动物取血清送贵州医科大学附属医院生化科检测血糖(blood glucose)、糖化血红蛋白(glycated hemoglobin,GHb)、尿素氮(urea nitrogen,UN)、三酰甘油(triglyceride,TG)、胆固醇(cholesterol);处死动物前收集24 h尿液送贵州医科大学附属医院生化科检测24 h尿蛋白(urine protein, UP)。
1.2.4 肾组织形态学的观察:用4%中性甲醛固定的肾脏组织制作成厚度约3 μm的石蜡切片,用HE、PAS和Masson染色,镜下观察肾组织形态学结构和纤维化病变的情况。
1.2.5 免疫组化染色:将石蜡切片进行烤片、脱蜡、PBS漂洗,3% H2O2封闭内源性过氧化物酶,柠檬酸盐缓冲液煮沸进行微波抗原修复,PBS漂洗后,给予WNT4(1∶50) 和 β-catenin(1∶100) 4 ℃孵育过夜。PBS漂洗后滴加即用型生物素标记的二抗,DAB镜下显色,苏木精复染,流水冲洗、脱水、透明、晾干、中性树胶封片,显微镜下观察并摄取图像。
1.2.6 Western blot检测目的蛋白:称取约60~100 mg肾皮质置于冰预冷的匀浆器内,加入1 mL蛋白裂解液充分裂解后冰上研磨。超声击打组织液,12 000 r/min离心10 min,将上清转移置一个新的EP管中。BCA试剂盒测定蛋白浓度,加入1.5×上样缓冲液配制成统一浓度的蛋白样品,100 ℃煮沸10 min。蛋白经SDS-PAGE分离后,转移至PVDF膜上,5%脱脂奶粉室温封闭1 h,TBST洗膜,分别加入SFRP1(1∶400)、WNT4(1∶200)、GSK- 3β(1∶500)、p-GSK- 3β(1∶600)、β-catenin(1∶300)、α-SMA(1∶200)、CollagenⅠ(1∶200)、E-cadherin(1∶500)、β-actin(1∶400)的一抗,4 ℃孵育过夜,TBS洗膜后加入相应二抗,室温孵育1 h,ECL显影,凝胶成像系统(ChemiDoc, Bio-Rad)扫描条带并分析结果。
1.2.7 Real-time PCR方法检测WNT4 mRNA表达:Trizol法提取总RNA,核酸蛋白仪检测RNA浓度和纯度,用Thermo试剂盒进行反转录。Bio-Rad CFX 96荧光定量PCR分析系统进行检测,以β-actin为内参照,目的基因的相对含量以2-ΔΔCt表示,引物序列和退火温度(表1)。
1.3 统计学分析
所有数据用SPSS 20.0统计软件分析处理,数据用均数±标准差(x±s)表示。组间比较采用独立样本t检验。

表1 PCR引物序列及扩增条件
2 结果
2.1 糖尿病肾病大鼠相关生化指标改变
DN组大鼠与NC组相比,DN组大鼠血糖、GHb、UN、TG、胆固醇和24 h UP均有显著增高(表2)。
2.2 取肾脏行病理切片观察肾组织形态学改变
HE、PAS及Masson染色显示,NC组肾小球结构完整清晰,肾小管上皮细胞排列整齐,肾间质未见炎性细胞浸润。DN组肾小球结构不清晰且系膜区扩张,部分肾小管可见空泡样变性;肾组织中PAS阳性染色物及Masson染色阳性物质明显增多(图1)。
2.3 免疫组织化学染色
与NC组相比,DN组WNT4蛋白在肾小管上皮细胞胞质表达明显增多,β-catenin蛋白在肾小管上皮细胞包膜和胞质中均有表达,并可见核表达(图2)。
2.4 蛋白印迹检测 WNT4/β-catenin信号通路相关分子及SFRP1蛋白表达
与NC组相比,DN组大鼠肾皮质中WNT4、β-catenin、p-GSK- 3β蛋白表达显著增多(P<0.05)(图3A~C);SFRP1蛋白在NC组大鼠肾皮质呈高表达,在DN组表达较NC组显著减少(P<0.05)(图3D)。
2.5 E-cadherin、α-SMA及collagenⅠ蛋白在糖尿病大鼠肾皮质中的表达
E-cadherin蛋白在NC组大鼠肾皮质的表达较多,DN组E-cadherin蛋白表达显著减少(P<0.05;图4A);α-SMA和CollagenⅠ蛋白在NC组大鼠肾皮质的表达很少,在DN组表达则显著增多(P<0.05)(图4B~C)。

表2 各组大鼠生化指标Table 2 Levels of biochemical index in each group(±s, n=8)
*P<0.05 compared with NC group.
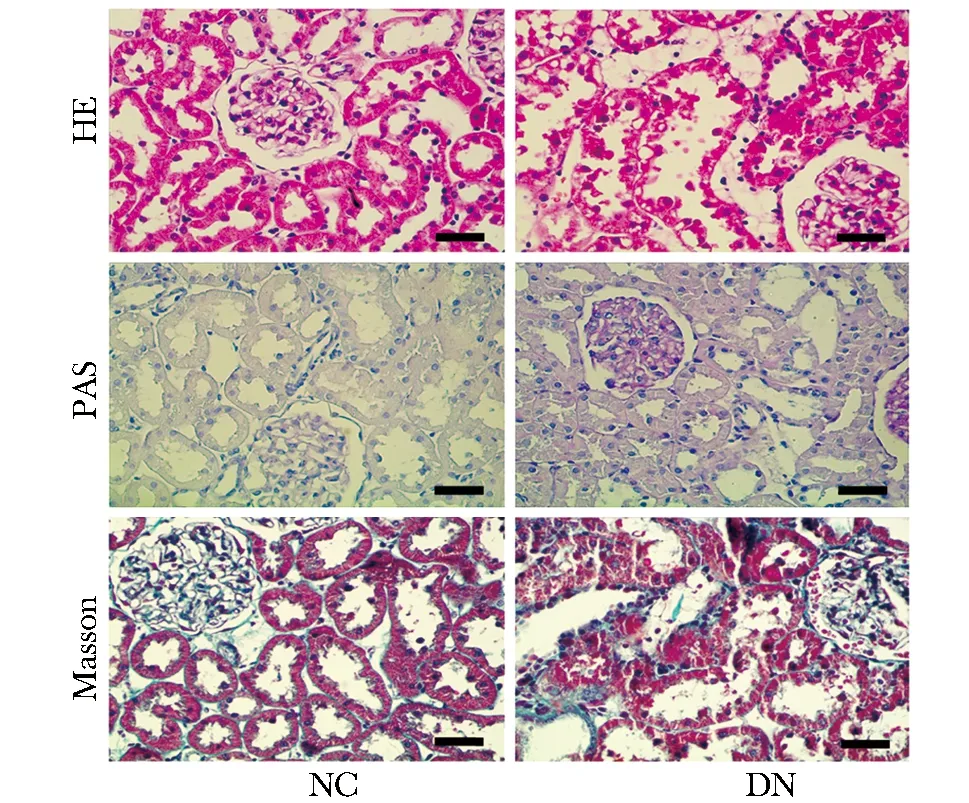
图1 12周NC和DN组大鼠肾组织HE、PAS和Masson染色Fig 1 Hemotoxyin and eosin staining, periodic acid- schiff and Masson staining of kidney tissues of NC and DN group in 12 weeks rats (scale bars =50 μm)
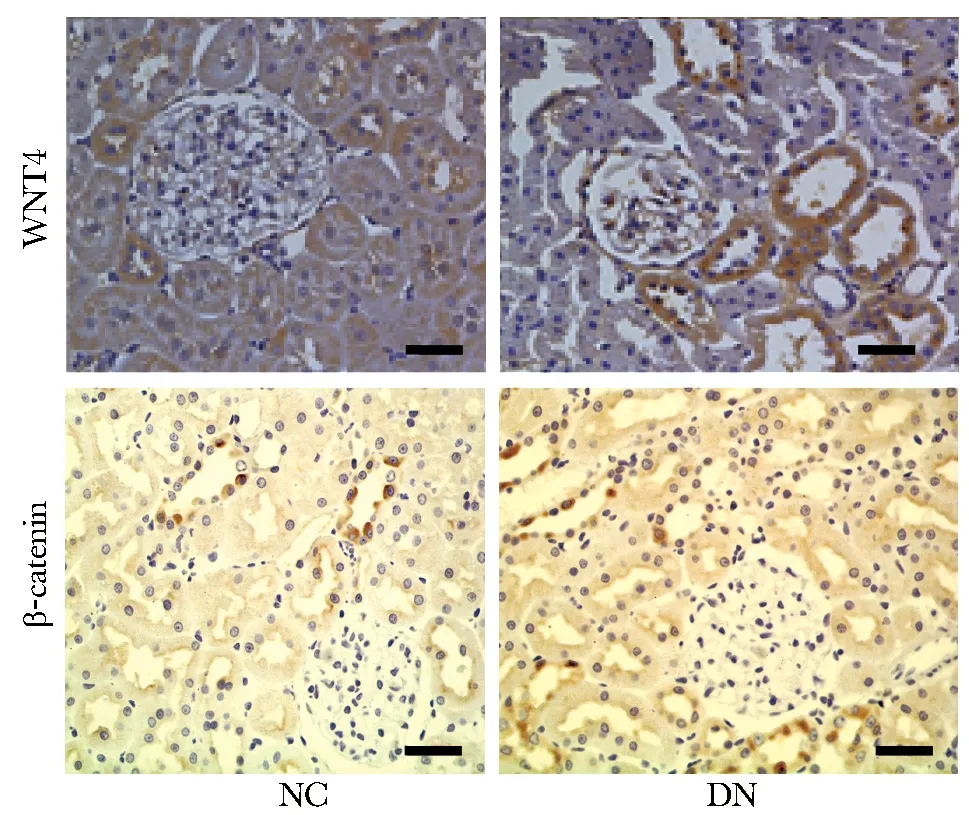
图2 WNT4和β-catenin在NC和DN组大鼠肾组织中的免疫组织化学染色Fig 2 Immunohistochemical staining of WNT4 and β-catenin in the kidney tissue of NC group and DM group rats(scale bars=50 μm)
A.protein levels of Wnt4 were determined by Western blot analysis in kidneytissue in NC group and DN group; B.Western blot analysis of β-catenin protein expression in kidneytissue in NC group and DN group; C.Western blot analysis of p-GSK- 3β/GSK- 3β protein expression in kidneytissue in in NC group and DN group; D.Western blot analysis of SFRP1 protein expression in kidneytissue in in NC group and DN group;*P<0.05 compared with NC group
图3WNT4、β-catenin、p-GSK-3β/GSK-3β和SFRP1蛋白在NC及DN组大鼠肾组织中的表达水平

2.6 real-time PCR检测WNT4和SFRP1 mRNA在DN肾皮质中的表达
WNT4 mRNA在NC组表达较少;在DN组中的表达量有显著增高(P<0.05)(图5A);SFRP1 mRNA在NC组表达较高;在DN组中的表达量有显著降低(P<0.05)(图5B)。
3 讨论
肾小管间质纤维化是DN进展到终末期的重要病理基础,而EMT在肾小管间质纤维化的发生发展中有着重要作用[3],在诱导EMT发生的信号通路中,Wnt是其中的一条关键信号通路,大量研究证明,Wnt信号通路的异常激活参与了肾脏纤维化时的EMT过程[4- 5]。 WNT蛋白家族包括19个成员[6],其中WNT4蛋白既可以通过激活经典Wnt信号通路参与肾小管的形成[7], 又可以通过启动非经典Wnt/PCP 信号通路促进肾小管的延长[8]。本实验中,DN组大鼠12周末UN、24 h UP较NC组显著增高,病理切片显示有肾纤维化病变,表明发生了糖尿病肾病。DN组肾皮质中的WNT4、p-GSK- 3β、β-catenin蛋白较NC组表达上调;DN组肾皮质中上皮细胞标志物E-cadherin蛋白表达下调,间质蛋白α-SMA、细胞外基质成分collagenⅠ蛋白表达上调,提示DN时肾组织发生了WNT4/β-catenin信号通路的异常活化,肾小管-间质发生EMT及ECM沉积增多,促进了肾间质纤维化的发生发展。这与PAX2基因在体外诱导大鼠近端肾小管上皮细胞发生间充质转分化后发现WNT4蛋白、β-catenin蛋白表达增高[9]以及在高糖培养的人近端肾小管上皮细胞中发现WNT4蛋白、β-catenin蛋白表达增高的结果一致[10]。
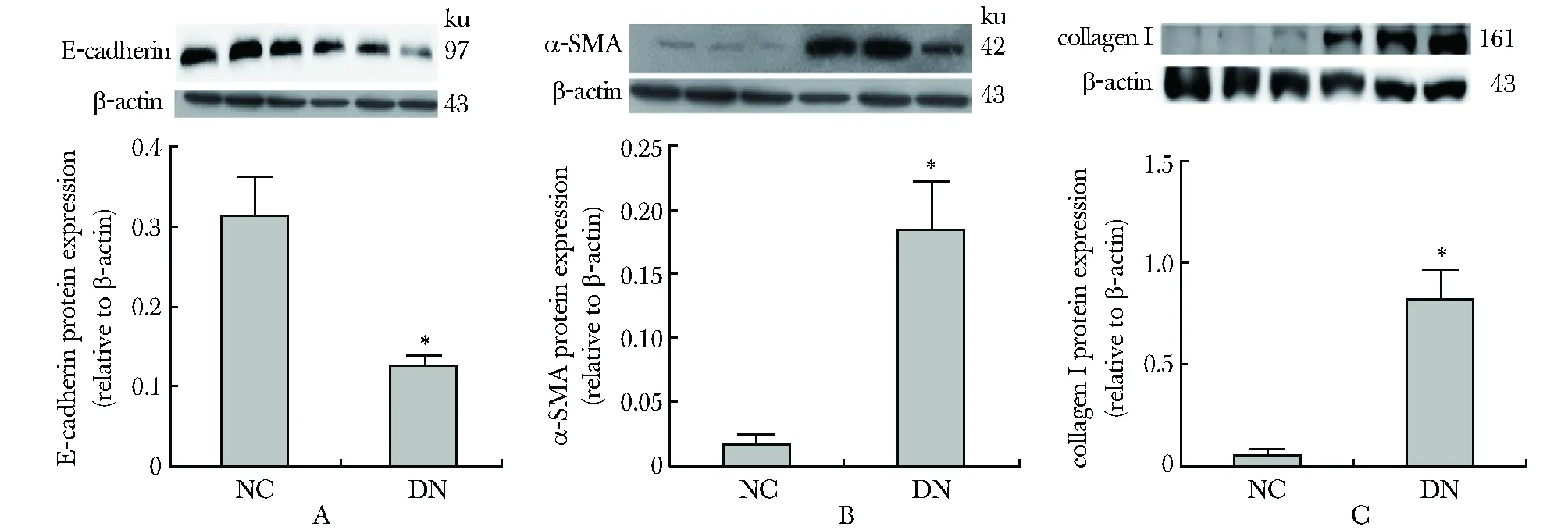
A.protein levels of Ecadherin were determined by Western blot analysis in kidney tissue in NC group and DN group; B.Western blot analysis of α-SMA protein expression in kidney tissue in NC group and DN group; C.Western blot analysis of collagenⅠ protein expression in kidneytissue in in NC group and DN group;*P<0.05 compared with NC group
图4E-cadherin、α-SMA及collagenⅠ蛋白在在NC及DN组大鼠肾组织中的表达水平

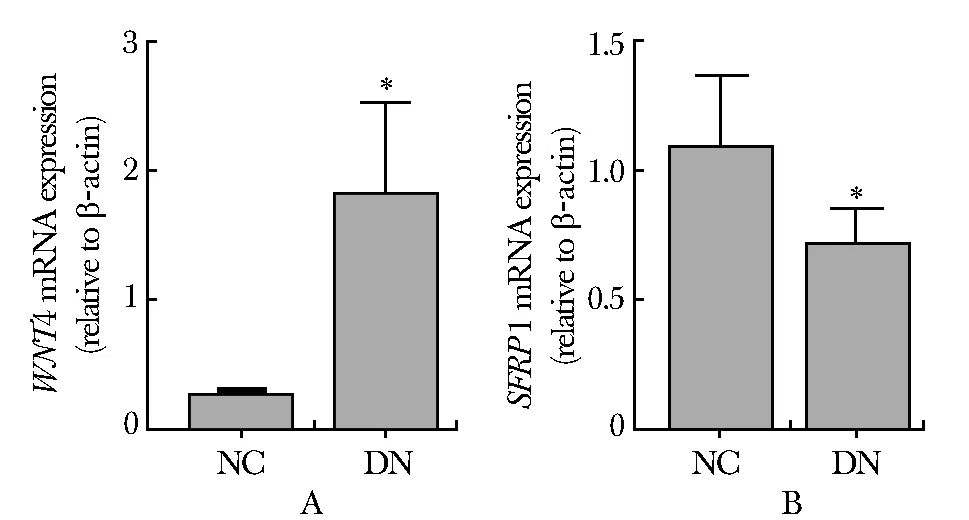
A.the mRNA levels of WNT4 were determined by real-time PCR analysis in kidney tissue in NC group and DN group;B.the mRNA levels of SFRP1 were determined by real-time PCR analysis in kidney tissue in NC group and DN group; *P<0.05 compared with NC group图5 WNT4和SFRP1 mRNA在NC及DN大鼠肾组织中的表达Fig 5 The mRNA levels of WNT4 and SFRP1 in kidney tissue in NC group and DN group
SFRPs是一类Wnt信号胞外拮抗因子,它是分泌性糖蛋白家族,在哺乳动物中包括5个成员,即SFRP1~5。最初的研究发现SFRPs通过富含半胱氨酸的区域(cysteine-rich domain,CRD)竞争性结合Frizzled受体,拮抗Wnt信号[11];然而,近期有学者发现基于不同的细胞环境及不同的frizzled受体浓度和表达模式,SFRP1也可以激活Wnt/β-catenin信号通路[12]。本实验研究显示DN组SFRP1 mRNA及蛋白表达较NC组显著性降低,说明DN时SFRP1表达下调,且其表达下调后可能对WNT4/β-catenin信号通路的抑制作用减弱,导致WNT4/β-catenin信号通路异常活化,促进了DN肾纤维化的发生发展。提示DN肾纤维化时SFRP1可对Wnt信号进行负调节。
有学者在对肾透明细胞癌、结直肠癌、胃癌等多种肿瘤的研究中发现,SFRP1启动子区呈高甲基化修饰状态,是其蛋白表达水平下调的重要原因[13- 15]。而DN时,肾组织中SFRP1 mRNA和蛋白表达下调是否与SFRP1启动子高甲基化而导致其转录失活有关,亦或还有其他原因的参与,有待于进一步的研究。
[1] Yu Y, Guan X, Nie L,etal. DNA hypermethylation of sFRP5 contributes to indoxyl sulfate-induced renal fibrosis[J]. J Mol Med, 2017, 95:601- 613.
[2] 金芬,张忠涛,黄卫锋. 上皮间质转化和内皮间质转化在肾纤维化中的研究进展[J]. 海南医学, 2014, 25:2723- 2725.
[3] 方开云, 娄晶磊, 肖瑛,等. 转化生长因子β1和Snaill参与糖尿病大鼠肾小管上皮细胞向间充质细胞转变[J]. 生理学报, 2008, 60:125- 134.
[4] Surendran K,?偅iSchiavi S,?偅iHruska KA. Wnt-dependent beta-catenin signaling is activated after unilateral ureteral obstruction, and recombinant secreted frizzled-related protein 4 alters the progression of renalfibrosis[J]. J Am Soc Nephrol, 2005, 16:2373- 2384.
[5] Zhou D, Tan RJ, Zhou L,etal. Kidney tubular β-catenin signaling controls interstitial fibroblast fate via epithelial-mesenchymal communication[J]. Sci Rep, 2013, 3:1878. doi:10.1038/srep01878.
[6] 张世蘋, 张旭. Wnt信号通路在肿瘤调控方面的研究进展[J]. 中国药理学通报, 2017, 33:14- 17.
[7] Li Y, Rankin SA, Sinner D,etal. Sfrp5 coordinates foregut specification and morphogenesis by antagonizing both canonical and noncanonical Wnt11 signaling[J]. Genes Dev, 2008, 22:3050- 3063.
[8] Satoh W, Matsuyama M, Takemura H,etal. SFRP1, Sfrp2, and Sfrp5 regulate the Wnt/β-cateninand the planar cell polarity pathways during early trunk formation in mouse[J]. Genesis, 2008, 46:92- 103.
[9] 李里,南晓娟,吴玉斌. WNT4基因沉默对PAX2诱导肾小管上皮细胞间充质转分化的影响[J]. 吉林大学学报, 2013, 39:720- 725.
[10] 闫喆,姚芳,张丽萍,等. 厄沙坦对高糖诱导肾小管上皮细胞转分化中Wnt/β-catenin信号途径表达的影响[J]. 中国药理学通报, 2009, 25:1630- 1634.
[11] Xie Q, Chen L, Shan X,etal. Epigenetic silencing of SFRP1 and SFRP5 by hepatitis B virus X protein enhances hepatoma cell tumorigenicity through Wnt signaling pathway[J]. Int J Cancer, 2014, 135:635- 646.
[12] Xaviera CP, Melikovaa M, Chuman Y,etal. Secreted Frizzledrelated protein potentiation versus inhibition of Wnt3a/β-catenin signaling[J]. Cell Signal, 2014, 26:94- 101.
[13] Ricketts CJ, Hill VK, Linehan WM,etal. Tumor-specific hypermethylation of epigenetic biomarkers, including SFRP1, predicts for poorer survival in patients from the TCGA kidney renal clear cell carcinoma (KIRC) project[J]. PLoS One, 2014, 9:e85621. doi:10.1371/journal.pone.0085621.
[15] Zhao CH, Bu XM, Zhang N. Hypermethylation and aberrant expression of Wnt antagonist secreted frizzled-related protein 1 in gastric cancer[J]. World J Gastroenterol, 2007, 13:2214- 2217.

