立方液晶纳米粒在MDCK-MDR1细胞模型中的摄取及摄取机制研究*
谭 宁,杜守颖,薛宇涛,谭 丽,陆 洋,李鹏跃
立方液晶纳米粒,又称纳米立方体或脂质立方液晶纳米粒是两亲性脂质和表面活性剂在水中自发形成的双连续的立方液晶纳米分散体系,即脂质和表面活性剂结合水形成立方液晶相,再以类似固体纳米粒的形式分散在过量的水中形成分散体系[1],是一种新型的纳米制剂。水溶性药物可以包封在类脂立方液晶的水道中,脂溶性的药物包封在脂质双分子层中,两亲性分子贯穿其中[2]。目前有研究证明立方晶在静脉、口服、口腔黏膜、阴道黏膜、经皮给药方面有明显效果[3],一些中药中成分如丹酚酸B、姜黄素、苦参碱也可包载入液晶纳米粒中[4-6],应用前景广泛。本实验室前期已优化了立方液晶纳米粒的处方和制备工艺,通过体外鼻腔灌流、细胞单层膜转运实验证明其有明显增加药物吸收和药物转运效果。
MDCK-MDR1细胞是研究药物跨细胞膜转运机制、预测药物在体内的吸收、以及药物间的相互作用、评价药物安全性的一个较为理想的体外模型,可用于模拟血脑屏障模型[7-9]。纳米粒子入胞有不同途径,包括网格蛋白介导内吞、细胞膜穴样凹陷介导内吞、大胞饮和非网格蛋白-非细胞膜穴样凹陷介导内吞,其中前3种内吞途径是纳米粒子入胞的主要内吞途径[10]。与脂溶性药物相比,水溶性药物不易进入细胞。为考察液晶纳米粒是否可增加水溶性物质透过MDCK-MDR1细胞的能力,以及确定液晶纳米粒进入细胞的通路。本实验采用钙黄绿素作为水溶性标准荧光物质,考察液晶纳米粒的摄取及摄取机制。
1 仪器与材料
1.1 细胞株 MDCK-MDR1细胞,由浙江大学曾苏教授惠赠。
1.2 药物与试剂 钙黄绿素(Calcein,Aladdin)、单油酸甘油酯(浙江嘉兴玛雅试剂)、泊洛沙姆407(北京凤礼精求商贸有限公司)、甘油(北京化工厂,分析纯)、维生素 E 醋酸酯(Adamas-beta,99%);非律平(Filipin,Harvy Bio)、细胞松弛素 D(Phytoalexins D,Aladdin)、氯丙嗪(CPZ,Sigma)、2-去氧-D-葡萄糖(2-D G,Alfa Aesar);胎牛血清(F BS,Gib-co)、DMEM培养基(Macgene)、0.25%胰蛋白酶(Macgene)、磷酸缓冲盐溶液(PBS,Amresco)、Hank’s平衡盐溶液(HBSS,Invitrogen)。
1.3 主要仪器 RE52CS旋转蒸发仪(上海亚荣生化仪器厂);电子分析天平(Sartorius BT 125D型,北京赛多利斯科学仪器有限公司);二氧化碳培养箱(seriesⅡ型,Thermo);流式细胞仪(FACSCantoⅡ型,BD);倒置显微镜(CKX-41 型,Olympus)。
2 方法
2.1 钙黄绿素液晶纳米粒(Cal-LCNPs)的制备 选用薄膜分散法制备液晶纳米粒。将处方量钙黄绿素溶解在甘油-水中,作为水相;处方量的甘油单油酸酯(GMO)等油相,采用薄膜分散法均匀涂布在圆底烧瓶玻璃壁内表面。将水相倒入圆底烧瓶中,加玻璃珠后,旋转水合得到250μg/mL钙黄绿素液晶纳米粒溶液。得到的葛根素液晶纳米粒包封率用紫外-分光光度计测定包封率可达94.28%。
2.2 细胞培养 MDCK-MDR1细胞常规复苏后,培养于含10%FBS和1%双抗的DMEM培养液中,置于 CO2培养箱(37℃),5%CO2,相对湿度 95%条件下培养。隔日更换培养基,当细胞达80%以上汇合时,以0.25%胰酶消化,按1∶3传代。取对数生长期细胞进行实验。
2.3 MTT细胞毒性实验
2.3.1 溶液的配制 用空白HBSS溶解钙黄绿素制备成 1、5、10、20、25、40、50 μg/mL 溶液为 Cal组;HBSS 将 Cal-LCNPs分别稀释 5、10、20、25、50、100 倍为Cal-LCNPs组。
2.3.2 MTT法 MTT法原理是利用活细胞线粒体中的琥珀酸脱氢酶能使外源性黄色可溶性MTT[3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐]还原为不溶于水的蓝紫色结晶甲瓒并沉积在细胞中,而死细胞无此功能。DMSO能溶解细胞中的甲瓒结晶,用酶标仪在490 nm波长处测定其吸光度值(OD值)[11]。常规条件下分别培养MDCK-MDR1细胞至70%~80%汇合时,消化细胞,以DMEM培养基(含10%FBS)终止消化,用移液器轻轻吹打后,离心弃去上清液,再加入新鲜的DMEM培养基,制得单个细胞悬液,将细胞密度调整为5×104个/mL,将细胞接种于96孔细胞培养板中,每孔100μL。培养24 h后,按照上述分组方式给药。培养箱培养24 h后每孔加入MTT溶液20μL,37℃孵育4 h,弃去孔内培养上清液,每孔加入150μLDMSO,振荡10min,使甲臜充分溶解。在酶联免疫检测仪上测定各孔OD值,记录结果。选取细胞存活率≥95%的药物浓度用于转运实验[9]。
2.4 Cal-LCNPs的MDCK-MDR1细胞摄取实验 将生长至80%~90%汇合的细胞,以0.25%胰酶消化后DMEM培养基稀释成密度4×105个/mL接种于12孔板。置于37℃,5%CO2条件下常规。生长24 h后细胞弃去培养基,用PBS洗3次后,37℃的HBSS孵育15 min,然后每组分别加入0.5 mL的Cal-LCNPs HBSS稀释溶液和10μg/mL Cal HBSS溶液,放入37℃,5%CO2培养箱培养。分别于 0.5、1、1.5、2 h 吸弃未吸收的药液,用冷的PBS洗3次后,每孔加0.25 mL胰酶培养箱中消化;待细胞消化完全后,转移至2 mL离心管中,2 000 r/min离心5 min;弃去上清液,细胞用0.5 mLHBSS稀释,吹打。处理好的样品立即用流式细胞仪检测细胞内钙黄绿素的荧光强度,绘制曲线,比较两组吸收情况。钙黄绿素的最大激发和发射波长分别为497 nm和518 nm。
2.5 Cal-LCNPs的MDCK-MDR1细胞摄取机制实验 采用通路抑制剂法研究MDCK-MDR1对立方液晶纳米粒的摄取机制。将生长至80%~90%汇合的细胞,以0.25%胰酶消化后DMEM培养基稀释成密度4×105个/mL接种于12孔板。置于37℃,5%CO2条件下常规24 h培养后弃去培养基换成含通路抑制剂的HBSS,培养0.5 h,各组溶液浓度为10μg/mL非律平、2μmol/L细胞松弛素D、10μg/mL氯丙嗪、50 mmol/L 2-D-去氧葡萄糖,空白对照组加入空白HBSS。0.5 h后加入含Cal-LCNPs的培养基培养2 h。采取2.4项下相同方法消化、离心、稀释、吹打。处理好的样品立即用流式细胞仪检测细胞内钙黄绿素的荧光强度。研究数据经SAS8.2软件处理。所有数据以均数±标准差(x±s)表示,组间比较采用单因素方差分析,以P<0.05为差异有统计学意义。
3 结果
3.1 细胞毒性实验 如图1所示,在实验选取的钙黄绿素浓度范围1~50μg/mL,Cal-LCNPs稀释25倍(Cal浓度约10μg/mL)以上对MDCK-MDR1细胞无毒性。所以,选取10μg/mLCal溶液及Cal-LCNPs稀释25倍进行细胞摄取及机制研究实验。
3.2 MDCK-MDR1 对 Cal,Cal-LCNPs的摄取结果 由图2中摄取曲线可见,在相同浓度下,MDCKMDR1 2 h内细胞对Cal-LCNPs胞内摄取量明显多于对Cal的摄取。以时间为自变量,胞内荧光强度为因变量,将2个摄取曲线进行方程拟合发现,Cal摄取符合零级方程(Y=31t+73.833,r=0.966 4),Cal-LCNPs摄取符合一级方程[Ln(Y)=0.289 3t+4.348 1,r=0.925 1]。实验结果显示立方液晶纳米粒不仅可以增加MDCK-MDR1对Cal的摄取也可改变细胞的摄取行为。
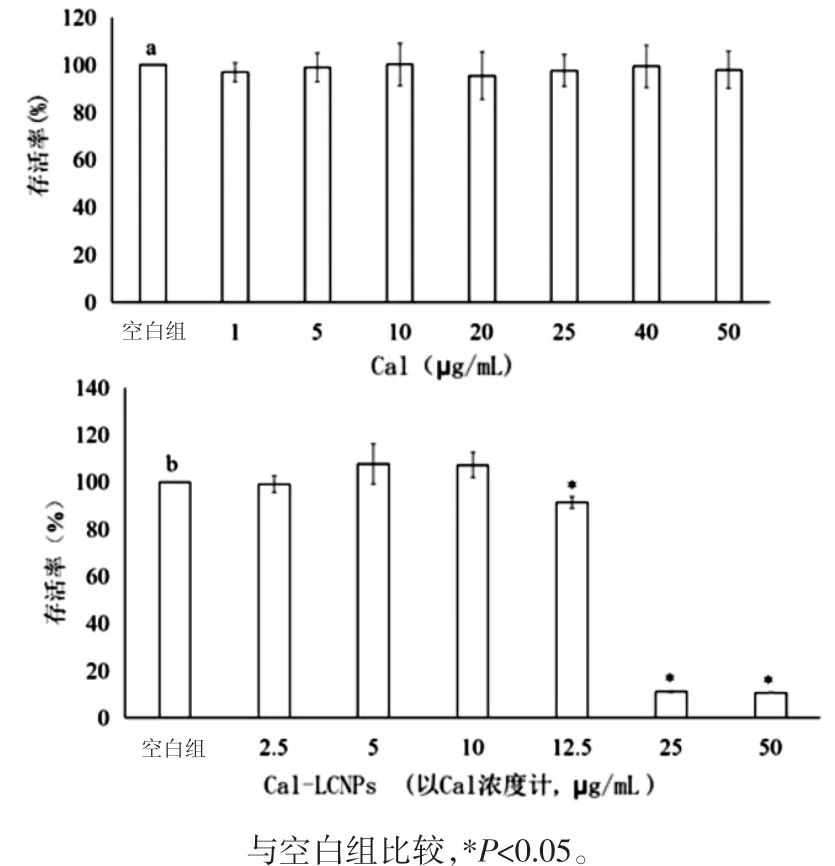
图1 MDCK-MDR1细胞MTT实验结果(n=5)Fig.1 MTT test resultsof MDCK-MDR1 cells(n=5)
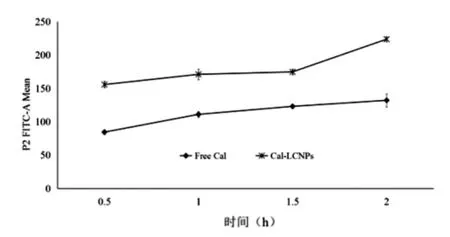
图2 MDCK-MDR1细胞对Cal、Cal-LCNPs摄取曲线(n=3)Fig.2 Uptakecurvesof Cal and Cal-LCNPsin MDCK-MDR1 cells(n=3)
3.3 MDCK-MDR1对Cal-LCNPs的摄取机制考察 在含通路抑制剂的组别中,经过氯丙嗪(CPZ)、2-去氧葡萄糖(2-DG)孵育过的细胞内含荧光比空白组少,差异具有统计学意义(P<0.05)。证明细胞摄取机制与氯丙嗪和2-D-去养葡萄糖抑制通路有关。见图3。
3 讨论

图3 MDCK-MDR1细胞对含不同通路抑制剂的Cal-LCNPs溶液摄取(n=3)Fig.3 Uptake of Cal-LCNPs in MDCK-MDR1 cells treated with different inhibitors(n=3)
MDCK-MDR1细胞系是由MDCK细胞经人源MDR1转染得到,是一种极性过表达P-gp的细胞系,和血脑屏障的外排作用非常类似,因而可利用MDCK-MDR1细胞作为血脑屏障药物透过的快速筛选模型。一些由载体介导的药物可以利用MDCK-MDR1细胞系,将其与被动扩散的物质区分开来。在细胞单层膜实验研究中,发现立方液晶纳米粒可明显提高水溶性药物葛根素的细胞吸收率。研究中细胞摄取实验又得到液晶纳米粒可通过胞内途径增加吸收,并改变了入胞方式的结论。这提示小分子水溶性药物可以通过立方液晶纳米粒包裹改变入胞途径,提高入胞能力。该结论为研究载有水溶性药物立方液晶纳米粒的细胞递送过程提供参考和依据。微粒的内吞为能量依赖过程[12]。2-DG是细胞无法利用的碳源,50 mmol/L时可阻断糖酵解。本实验中,当2-DG与细胞孵育后与空白组相比,摄取能力减弱(P<0.05),证明细胞摄取液晶纳米粒是内吞的能量依赖过程。
在细胞摄取纳米制剂的4种通路类型中,细胞膜穴样凹陷介导内吞将载体递送至pH条件和生物条件缓和的小窝体内然后被转运到内质网、高尔基体和胞浆中[13]。非律平是常用的小窝蛋白抑制剂,可抑制小窝蛋白形成从而抑制该途径。大胞饮指在某些因素刺激下,细胞膜皱褶形成大且不规则的原始内吞小泡,它们被称为大胞饮体。通常大胞饮作用能显著地被细胞松弛素和秋水仙碱抑制,被抑制的微管和微丝在这个过程中扮演重要角色[14]。其中细胞膜穴样凹陷介导内吞可避免溶酶体内聚集[15-16]。但本实验研究证明当10μg/mL非律平、2μmol/L细胞松弛素D的参与抑制了2种途径后,细胞内摄取的荧光强度和空白对照组相比并未明显降低,这证明液晶纳米粒并非通过细胞膜穴样凹陷介导或者大包饮途径进入细胞。网格蛋白介导的内吞是各类纳米颗粒内吞的主要途径,在细胞膜表面存在附有网格蛋白包被的小窝和小泡,与相应配体(被内吞的分子)结合形成复合物后集中到细胞内面有网格蛋白的质膜区,形成小窝,凹陷,最终与质膜脱离进入细胞浆,形成内体。早期内体成熟成为晚期内体,最后和其余内吞或溶酶体融合[17]。氯丙嗪可与核内体作用,使其脱落,从而阻断该途径。结果显示液晶纳米粒是以此途径进入细胞。提示液晶纳米粒载药进入细胞后可能会与溶酶体结合,这为之后液晶纳米粒制剂设计及给药途径选择提供依据。
立方液晶纳米粒与传统脂质体相比具有稳定性好、包封率高、双分子层面积大、可无限稀释等优势[18]。有报道称[19],它既能够包结水溶性药物如四环素、马来酸噻吗洛尔、头孢唑啉等,也能包结油溶性药物如阿司匹林和维生素E等。其他的一些药物如溴丙胺太林、甲硝唑、马来酸氯苯那敏和盐酸普萘洛尔以及蛋白质类药物血红蛋白和胰岛素也能包结在立方液晶中。本实验研究结果提示立方液晶纳米粒因其可改变水溶性药物进入细胞的方式、影响细胞吸收,在中药水溶性成分递药系统中具有良好应用前景。
[1]Spicer PT.Progress in liquid crystalline dispersions:cubosomes[J].Current Opinion in Colloid and Interface Science,2005,10(5):274-279.
[2]Worle G,Drechsler M,Koch MHJ,et al.Influence of composition and prepararion parameters on the properties of aqueous monoolein dispersions[J].International Journal of Pharmaceutics,2007,329(1):150-157.
[3] 陈 琰,陈建明,陈 酩,等.立方晶及其在药剂学中的研究进展[J].第二军医大学学报,2009,30(7):834-839.
[4] 郭秀君,刘志东,黄 瑜,等.丹酚酸B立方液晶纳米粒的制备及大鼠在体肠吸收[J].天津中医药大学学报,2014,33(3):177-180.
[5] 苏 旬,贺秀丽,刘秀菊,等.姜黄素脂质立方液晶纳米粒的制备及理化性质研究[J].中药材,2012,35(2):296-299.
[6] 田 圆,吴伟刚,王家平,等.苦参碱立方液晶纳米粒的制备及质量控制的研究[J].今日药学,2015,35(2):83-85.
[7] 陈振振,杜守颖,陆 洋,等.艾片与麝香酮芳香开窍作用机制研究[J].中药材,2014,37(3):460-464.
[8] 刘 强,高小玲,柴逸峰,等.四氢帕马丁在MDCK-MDR1细胞系中的跨膜转运机制[J].药学服务与研究,2012,12(1):34-37.
[9] 张承悦,赵 攀,施 喆,等.芳香开窍化合物对MDCK-MDR1单层细胞透过性的影响[J].中国药学(英文版),2011,20(6):584-589.
[10]厉 群,吴赛伟,梁文权,等.钙黄绿素脂质体的细胞转运及其机制研究[J].中国药学杂志,2014,49(15):1321-1326.
[11]蔡文涛.MTT法和CCK-8法检测中药抗病毒活性成分细胞毒性的比较[J].湖北大学学报(自然科学版),2017,19(3):305-310.
[12]Managit C,Kawakami S,Yamashita F,et al.Uptakechracteristics of galactosylated emulsion by HepG2 hepatoma cells[J].International Journal of Pharmaceutics,2005,301(1-2):255-261.
[13]Doherty GJ,Mcmahon HT.Mechanisms of endocytosis[J].Annul Review of Biochemistry,2009,78(78):857-902.
[14]秦绿叶,刘 爽,汪沉然,等.巨胞饮的机制及功能的研究进展[J].生理科学展,2006,37(1):41-44.
[15]Cohen AW,Hnasko R,Schubert W,et al.Role ofcaveolae and caveolinsinhealth and disease[J].Physiological Reviews,2004,84(4):1341-1379.
[16]Conner SD,Schmid SI.Regulated portals of entry into the cell[J].Nature,2003,422,(6927):37-44.
[17]Rappoport JZ.Focusing on clathrin-mediated endocytosis[J].Biochemical Journal,2008,412(3):415-423.
[18]Barauskas J,Johnsson M,Joabsson F,etal.Cubic phasenanoparticles(Cubosome):priciplesfor controllingsize,structure,and stability[J].Langnuir,2005,21(6):2569-2577.
[19]王志宁,郑利强.类脂立方液晶作为药物载体的研究[J].化学进展,2005,17(3):417-422.

