胰岛素泵强化治疗糖尿病并重症肺部感染及对血清和肺泡灌洗液中炎症因子的影响
刘曙艳,周雪红,陈洁
[河南理工大学第一附属医院(焦作市第二人民医院) 内分泌科一区,河南 焦作 454001]
糖尿病(diabetes mellitus,DM)是1种常见的内分泌代谢性疾病,且发病率逐年升高。糖尿病患者自身免疫功能低下,若发生肺部感染,将严重威胁生命健康[1]。持久的高血糖会进一步造成能量代谢障碍和高炎性状态,对机体内环境稳定产生破坏作用,使病情恶化甚至引发死亡[2]。20世纪90年代世界卫生组织(world health organization,WHO)提出强化胰岛素治疗方案(intensive insulin therapy,IIT),美国临床内分泌协会和美国糖尿病协会联合提出的新指南中说明,对糖尿病合并重症的患者建议血糖控制在7.8~10.0 mmol/L。2013年中国2型糖尿病防治指南,说明IIT方案包括,餐时联合基础胰岛素方案和胰岛素泵强化方案。但哪1种方案更适合糖尿病合并重症肺部感染患者研究较少,本研究通过比较胰岛素泵强化治疗和餐时联合基础胰岛素治疗方案的治疗效果和预后,将糖尿病合并重症肺部感染患者的血糖控制在7.8~10.0 mmol/L,并探讨其对患者治疗效果和预后及对炎症因子的影响。
1 资料与方法
1.1 临床资料
选取2015年11月-2016年10月在河南理工大学第一附属医院收治的糖尿病合并重症肺部感染患者172例,纳入标准:①符合重症肺部感染的诊断标准[3],经临床表现,影像学检查及痰培养证实,住院期间常规留取痰培养标本3次;②符合WHO糖尿病的诊断标准。排除标准:①患有自身免疫性疾病;②患者凝血功能障碍;③严重创伤或手术患者;④伴有精神类疾病患者;⑤恶性肿瘤患者;⑥使用激素治疗患者。将172例患者随机分为对照组(n=86)和观察组(n=86)。其中,对照组患者应用睡前甘精胰岛素(来得时,法国赛诺菲安万特制药有限公司)联合3餐前门冬胰岛素(诺和锐,丹麦诺和诺德公司)皮下注射方案,观察组患者应用内装门冬胰岛素(诺和锐,丹麦诺和诺德公司)的胰岛素泵(美国美敦力公司)强化治疗方案。全体患者均签署知情同意书,并通过本院伦理委员会批准。
1.2 方法
1.2.1 血糖控制治疗对照组患者应用睡前甘精胰岛素[2.00 u/(kg·d)]起始剂量,联合3餐前门冬胰岛素(0.05 u/kg)皮下注射控制血糖,再根据每日监测的血糖结果,调整胰岛素的用量。观察组患者应用短期胰岛素泵强化治疗,由专业的内分泌科医生,根据患者体重,结合患者目前身体状况和感染程度、空腹血糖及年龄等,设定基础量,再根据昼夜节律性,分配每小时胰岛素泵入剂量,餐前给予的餐时胰岛素量根据餐前监测血糖结果,临时泵入小剂量胰岛素。动态血糖监测患者血糖水平,每天调整胰岛素每小时用量。将两组患者的空腹血糖目标控制在7.8~10.0 mmol/L。患者如在研究期间出现低血糖,即末梢血血糖>3.9 mmol/L,应记录低血糖的发生率。
1.2.2 各项指标检测①入院第1、3及7天,清晨空腹抽取肘静脉血3~5 ml,采用酶联免疫吸附实验法检测白细胞介素6(interleukelin-6,IL-6)、白细胞介素8(interleukelin-8,IL-8)、肿瘤坏死因子α(tumor necrosis factor-α,TNF-α);②第1、3及7天,均行支气管肺泡灌洗,术中提取灌洗液,同样检测其中IL-6、IL-8及TNF-α水平。
1.3 评价指标
第1、3及7天的血清和肺泡灌洗液中的IL-6、IL-8、TNF-α水平。用动态血糖监测仪监测两组患者血糖并记录每日空腹血糖(fasting plasma glucose,FPG),并计算每天血糖的波动程度,包括标准差(S)和极差(△)。对两组患者的低血糖发生率、血糖的达标时间、28 d病死率进行比较。
1.4 统计学方法
数据分析采用SPSS 19.0统计软件,计量资料以均数±标准差(±s)表示,采用重复测量设计的方差分析或t检验,计数资料以率(%)表示,采用χ2检验,影响因素的分析用多因素Logistic回归模型,P<0.05为差异有统计学意义。
2 结果
2.1 两组患者基本资料比较
性别、年龄、体重指数(body mass index,BMI)、住院时间、入院时急性生理与慢性健康评分(acute physiology and chronic health evaluation Ⅱ,APACHEⅡ)、入院时基础血糖、动脉血二氧化碳分压PaCO2及病原菌分布的比较,差异无统计学意义(P>0.05)。见表1。
2.2 两组患者不同时间段血清各炎症因子比较
采用重复测量设计的方差分析:①不同时间的IL-6、IL-8、TNF-α均值差异有统计学意义(F=310.624、500.244和291.043,均P=0.000);②两组间3个指标均值差异有统计学意义(F=66.714、115.390和90.165,均P=0.000),对照组均值更高;③两组3个指标均值变化趋势差异有统计学意义(F=21.637、29.716和6.699,均P=0.000)。进一步采用配对t检验,对照组中血清IL-6、IL-8、TNF-α水平入院后第3天和第1天比较差异无统计学意义(P>0.05);第7天和第1天、第3天比较差异有统计学意义(P<0.05);观察组中血清IL-6、IL-8、TNF-α水平,入院后第3天和第1天比较差异有统计学意义(P<0.05),第7天和第1天、第3天比较差异有统计学意义(P<0.05);说明对照组的血清各个炎症因子水平第3天较第1天均无改善,而在第7天降低,但是观察组中血清各个炎症因子水平,随着时间的延长,呈下降趋势。观察组患者的IL-6、IL-8、TNF-α下降水平优于对照组(P<0.05)。见表 2和图 1。

表1 两组患者一般资料的比较 (n =86)表1 两组患者一般资料的比较 (n =86)
2.3 两组患者不同时间段肺泡灌洗液各炎症因子比较
采用重复测量设计的方差分析:①不同时间的IL-6、IL-8、TNF-α均值差异有统计学意义(F=620.385、533.286和535.962,均P=0.000);②两组间3个指标均值差异有统计学意义(F=115.291、102.365和98.171,均P=0.000),对照组均值更高;③两组3个指标的均值均值变化趋势有差异(F=36.602、39.068和28.359,均P=0.000)。进一步采用配对t检验,对照组肺泡灌洗液中IL-6、IL-8、TNF-α水平入院后第3天和第1天比较差异无统计学意义(P>0.05),第7天和第1天、第3天比较差异有统计学意义(P<0.05);观察组肺泡灌洗液中IL-6、IL-8、TNF-α水平,入
院后第3天与第1天比较差异有统计学意义(P<0.05),第7天和第1天、第3天比较差异有统计学意义(P<0.05);说明对照组的肺泡灌洗液各个炎症因子水平第3天较第1天均无改善,而在第7天时降低,但是观察组中肺泡灌洗液各个炎症因子水平,随着时间的延长,呈下降趋势。观察组患者的IL-6、IL-8、TNF-α下降水平优于对照组(P<0.05)。见表3和图2。
表2 两组患者不同时间段血清各炎症因子的比较 (n =86,±s)

表2 两组患者不同时间段血清各炎症因子的比较 (n =86,±s)
注:1)与第1天比较,P <0.05;2)与第3天比较,P <0.05;3)与对照组比较,P <0.05
?
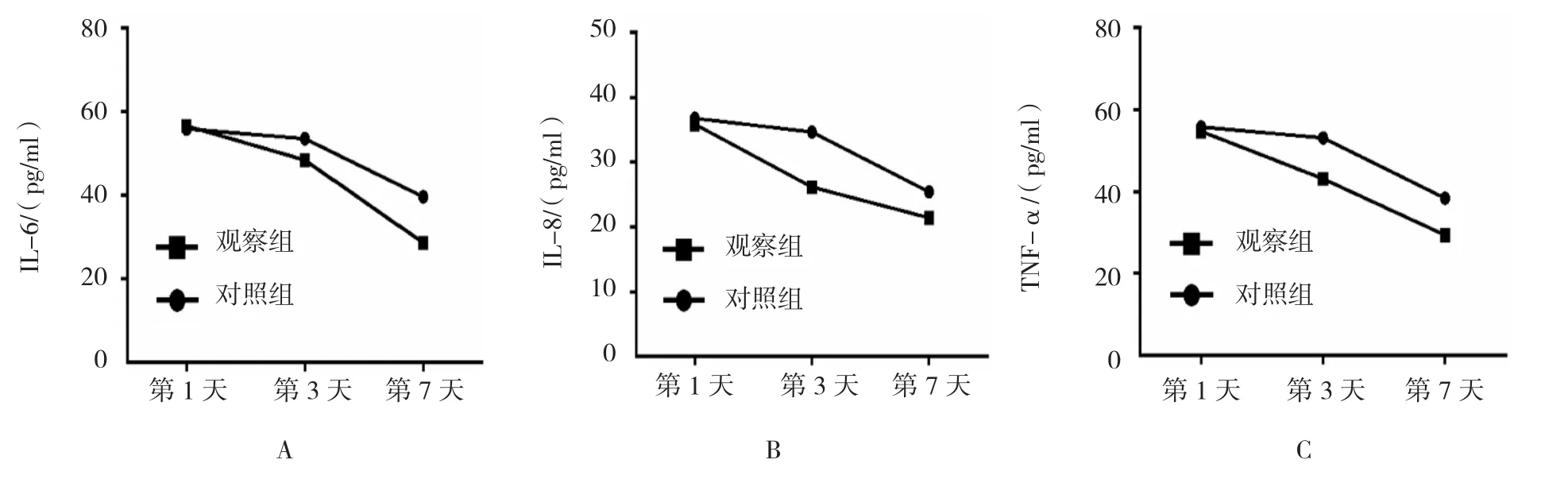
图1 两组患者不同时间段血清各炎症因子的变化趋势
2.4 院后应用动态血糖监测仪
每天记录血糖的变化,记录血糖达标时间观察组(3.45±1.32)d,比对照组(5.67±1.55)d的时间短(t=-10.122,P=0.000);同时观察组有6例(7.0%)患者发生低血糖,对照组7例(8.1%)患者发生低血糖,两组比较差异无统计学意义(χ2=0.083,P=0.073);观察组28 d内死亡10例(病死率11.6%),对照组死亡21例,(病死率24.42%),观察组低于对照组(χ2=4.761,P=0.029);两组患者血糖波动指标比较,可见两组的S和△在应用胰岛素治疗比较差异无统计学意义,当空腹血糖达标后,观察组患者的S和△均低于对照组(t=-4.391和 -4.158,均P=0.000)。见表 4。
表3 患者不同时间段肺泡灌洗液各炎症因子的比较 (n =86,±s)

表3 患者不同时间段肺泡灌洗液各炎症因子的比较 (n =86,±s)
注:1)与第1天比较,P <0.05;2)与第3天比较,P <0.05;3)与对照组比较,P <0.05
?
2.5 不同患者各指标比较
死亡患者入院时APACHE Ⅱ评分、血糖达标时间、第3、7天FPG水平、血糖波动指标差异有统计学意义(P<0.05);第1天FPG水平和低血糖发生率差异无统计学意义(P>0.05)。见表5。
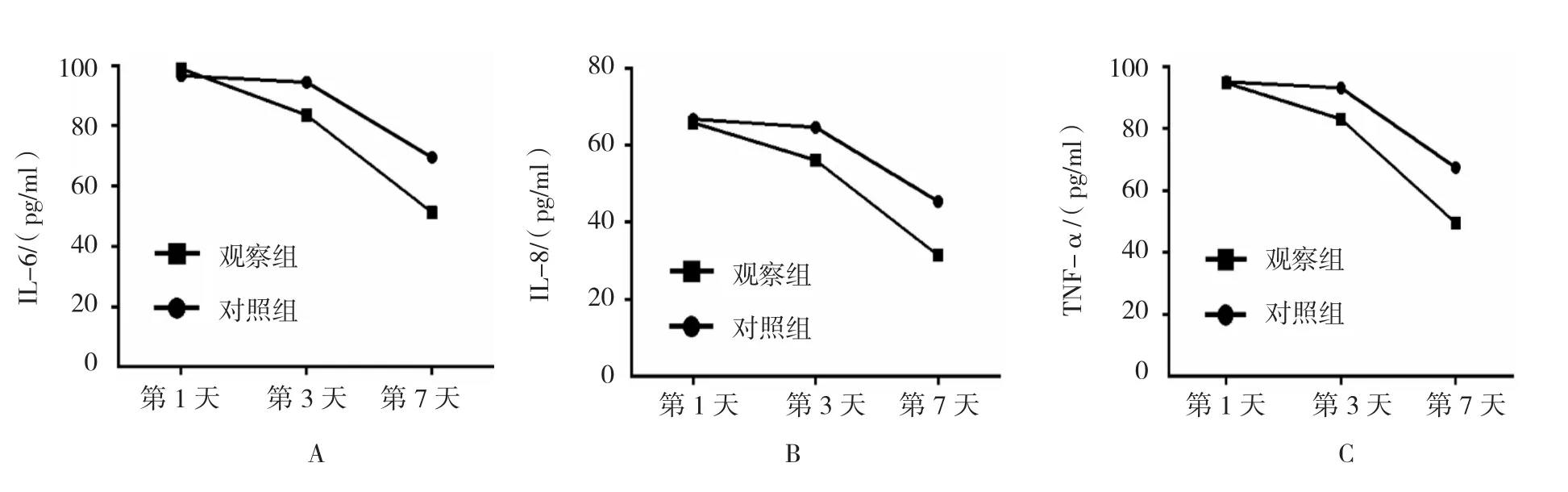
图2 组患者不同时间段肺泡灌洗液各炎症因子的变化趋势
表4 两组患者血糖波动指标比较 (n =86,±s)

表4 两组患者血糖波动指标比较 (n =86,±s)
?

表5 不同结局患者各项指标比较
2.6 对影响患者死亡因素进行Logistic回归分析
以死亡为因变量(死亡=1,存活=0),以表5两组有差异的指标:入院时APACHE Ⅱ评分、血糖达标时间、第7天△、第7天S和入院第7天FPG水平为自变量,自变量全部为连续型的计量资料纳入回归模型。结果显示,血糖达标时间、第7天△、入院第7天FPG水平的回归结果(P>0.05),说明这3个指标无独立作用,而入院时APACHE Ⅱ评分(P=0.003)和血糖变异指标S(P=0.007)纳入到回归方程,且这两个因素其O^R值均>1,代表其为危险l因素;95%CI的下限都>1,说明2个因素为患者死亡的危险因素。见表6。

表6 患者死亡影响因素Logistic回归分析
3 讨论
糖尿病可引起代谢紊乱、体质长久消耗使免疫功能减退,容易合并各种感染[4]。糖尿病并发肺部感染的发生率较高,一旦出现重症肺部感染,糖尿病患者的死亡率将会升高。重症肺部感染中,在病情进展中,炎症因子所介导的炎症反应起着重要的作用[5]。据统计,IL-6在急性肺损伤和高危患者的血清及肺泡灌洗液中含量十分高[6]。IL-6在炎症反应中的作用主要体现在其对机体多种细胞产生促炎影响和促进释放急性反应蛋白[7]。IL-8是趋化因子家族中的1种蛋白质,可以使白细胞的游走存活,过氧化物因此被嗜中性粒细胞促进形成,继而相关因子由溶酶体释放出来,导致嗜中性粒细胞被活化以及趋化[8],引起IL-8的进一步分泌,增强炎症反应,导致气道慢性炎症和持续损伤。而肺部感染时,TNF-α的产生增多是由巨噬细胞激活引起,可促进炎症细胞游走、黏附和浸润,从而引起肺损伤,所以在肺部感染时,TNF-α水平不同程度的增高[9]。
糖尿病合并重症感染时,血糖的波动会影响抗感染的效果。而且血糖波动性越大,越能促进糖尿病相关慢性并发症的发生和发展。在本研究中,胰岛素泵强化组(观察组)患者的血糖波动性低于对照组患者,在死亡因素Logistic回归分析中,得到血糖变异指标是死亡的危险因素,说明血糖波动较大的糖尿病合并重症肺部感染患者死亡率较高。
在强化治疗的选择上,根据2013年的中国糖尿病防治指南,笔者选择应用专业的美敦力胰岛素泵进行强化治疗和甘精胰岛素联合3餐前短效胰岛素最为对照方案进行比较。甘精胰岛素是1种目前临床常用的长效胰岛素类似物,皮下注射后理论上可维持>24 h,血药浓度相对平稳,无峰值现象[10]。但是应用胰岛素泵控制血糖能够根据人体的昼夜节律性设定每小时不同的胰岛素剂量,模拟人胰岛分泌的状态,能够随时调整,若测得血糖增高时可临时补充小量胰岛素降低瞬时血糖,佩戴方便,不用每次皮下注射,减少患者痛苦的同时避免多次皮下注射的感染、出血风险。从本研究中可以看到,胰岛素泵强化治疗血糖的达标时间短于对照组血糖达标时间。
综上所述,胰岛素泵强化治疗可改善糖尿病合并重症肺部感染患者的病情,降低血清和局部炎症因子水平,缩短血糖达标时间,减少血糖的波动,从而降低病死率。但本研究受样本量及时间限制,需对血糖控制时间进一步深入探讨研究,以获得最佳治疗方法。
[1]朱东, 鲁丽利, 张剑丰, 等. 糖尿病患者免疫功能改变与预防肺部感染的临床研究[J]. 中华医院感染学杂志, 2015, 25(8):1790-1792.
[2]李晓岚, 安友仲. 胰高血糖素样肽在重症患者血糖控制中的作用[J]. 中华医学杂志, 2011, 91(17): 1222-1224.
[3]刘胜华, 温建立, 邱蓓, 等. 重症肺炎患者血清及肺泡灌洗液中炎性因子水平及临床意义[J]. 中华医院感染学杂志, 2016,26(24): 5587-5589.
[4]王素琴. 282例糖尿病患者医院感染危险因素分析及对策[J].临床医药实践, 2012, 21(7): 531-532.
[5]范志涛. 血必净注射液对重症肺炎患者炎症因子及治疗效果的影响[J]. 河北医学, 2015, 21(6): 947-948.
[6]丁静, 魏希强, 孙伟. 社区获得性肺炎患者血清及支气管肺泡灌洗液中IL-6、IL-8和IL-10水平变化及其临床意义[J]. 蚌埠医学院学报, 2015, 40(6): 740-742.
[7]彭川, 韩文龙, 邱渊. 重症肺炎患者血清和肺泡灌洗液中IL-6和IL-10水平的变化及其与预后的相关性[J]. 海南医学, 2016,27(18): 2956-2958.
[8]NAKAMURA H, YOSHIMURA K, MCELVANEY N G, et al. Neutrophil elastale in respiratory epithelial lining fluid of individuals with cystic fibrosis induces interleukin-8 gene expression in a human bronchial epithelial cell line[J]. Clin Invest,1992, 89(5): 1478-1479.
[9]张月莉, 沙颖豪, 府礼刚. 老年肺部感染患者IL-6、IL-8和TNF-α测定及其意义[J]. 实用老年医学, 2001, 15(4): 196-198.
[10]BODE B W, STEED R D, SCHLEUSENER D S, et al. Switch to multiple daily injection with insulin galargine and insulin lispro from continuous subcutaneous insulin infusing with insulin lispro; a randomized open-label study using a continuous glucose monitoring system[J]. Endocr Pmct, 2005, 11(3): 157-164.

