水分胁迫对桑树生理生化特性的影响
莫荣利+李勇+于翠+邓文+朱志贤+胡兴明


摘要:以桑树(Morus alba L.)品种强桑1号(M. alba L. cv. Qiangsang No.1)、强桑2号(M. alba L. cv. Qiangsang No.2)和农桑14号(M. alba L. cv. Nongsang 14)一年生盆栽苗为试材,研究水分胁迫(干旱胁迫和淹水胁迫)对不同桑树品种生理生化特性的影响。结果显示,水分胁迫导致桑树叶片丙二醛含量随时间的延长而增加;干旱胁迫下,强桑1号丙二醛含量较低,而淹水胁迫下,农桑14号丙二醛含量较低。水分胁迫下,不同桑树品种叶片超氧化物歧化酶活性变化趋势均为先下降后升高,且无显著差异;过氧化物酶活性随时间的延长而升高,尤其是胁迫后期增加迅速,而强桑1号和农桑14号的过氧化物酶活性分别在干旱胁迫和淹水胁迫下最高;过氧化氢酶活性在干旱胁迫下表现为先增后降,而淹水胁迫下表现为先降后增。随着水分胁迫时间的延长,桑树叶片净光合速率、气孔导度、蒸腾速率不断下降,胞间CO2浓度不断增加;且不同品种间叶片净光合速率无明显差异。综合试验结果表明,强桑1号表现出较强的耐旱性,农桑14号表现出较强的耐涝性。
关键词:桑树(Morus alba L.);水分胁迫;丙二醛;抗氧化酶活性
中图分类号:S888.112+.3:Q945.78 文献标识码:A 文章编号:0439-8114(2017)24-4815-06
水是农业生产发展的要素,在植物光合作用和营养元素等物质的吸收与运输过程中起着重要作用。随着全球气候变暖,极端天气及自然旱涝灾害频发,水分胁迫成了农业生产中最为常见的一种非生物逆境胁迫。水分胁迫主要包括两个方面,即土壤水分亏缺引起的干旱胁迫和土壤含水量过剩造成的淹水胁迫。因此土壤水分过多或过少均会对植物的生长造成严重的影响。研究表明,通常抗旱的植物不耐涝,而耐涝的植物又不耐干旱[1-3]。水分胁迫成了干旱、半干旱以及荒漠化地区农业发展的瓶颈,尤其是库区消落带形成的反季节性淹水及夏季干旱频发的局部极端生態环境几乎成了大多数植物的“噩梦”。桑树(Morus alba L.)为桑科(Moraceae)桑属(Morus L.)植物,是重要的经济林木。在中国,桑树分布于南纬30°至北纬50°的广阔疆域[4],且种质资源类型丰富,桑种占有量为全世界的50%,拥有15个种4个变种近3 000多份资源[5]。桑树以适应多种生态环境的丰富资源类型和对恶劣自然环境的超强适应能力而在生态环境治理中备受青睐。近年来,随着“立桑为业,多元发展”的理念不断深入,有关桑树防风固沙、涵养水源、土壤保熵、调节气候等生态系统服务功能的研究得到长足发展[6-8]。同时,桑树被认为是经济林木里生态效益最高、生态林木里经济效益最佳的树种[9],已成为众多省区用于干旱、半干旱及库区消落带等生态脆弱区植被修复的主要经济树种[10]。试验以桑树不同品种盆栽苗为试材,探讨了干旱胁迫和淹水胁迫对桑树生理生化特性的影响,分析不同桑树品种对水分胁迫的耐受力,以期在干旱、半干旱及库区消落带等生态脆弱区环境治理中,为桑树品种的选择及其生态效益和经济效益的最优化利用提供理论依据。
1 材料与方法
1.1 材料及设计
供试材料为强桑1号(M. alba cv. Qiangsang No.1)、强桑2号(M. alba cv. Qiangsang No.2)和农桑14号(M. alba cv. Nongsang 14)一年生桑树嫁接苗,嫁接方式为袋接,砧木均为草桑(本砧)。2016年3月初将桑苗栽植于高25 cm、上口径26 cm的塑料花盆中,桑苗栽植后地上部茎干统一留20 cm定干,置于避雨大棚内。土壤配比(体积比)为园土∶蛭石∶珍珠岩∶草炭=1∶1∶1∶1。
土壤水分胁迫试验设置3个处理,分别是对照(土壤相对湿度为70%~80%)、干旱(土壤相对湿度为40%~50%)和淹水(苗根淹没),重复3次。每盆栽植1棵桑苗,每个品种分别栽植90盆,随机分成3组,每30盆为1个重复。干旱处理前,将盆栽苗浇透水后进行自然干旱,每天傍晚取土样(10~15 cm深),采用烘干称重法[11]测定土壤相对含水量,待土壤相对湿度达到40%~50%时定为干旱处理的第一天,同时进行淹水处理;而后干旱处理的水分控制采用称质量法[12],分别于处理后0、10、20、30 d进行叶片(枝条第四~第五叶位)采集及相关指标的测定。叶片样品采集后于液氮中速冻,-80 ℃保存,备用。
1.2 方法
1.2.1 抗氧化酶活性测定 称取0.3 g叶样于液氮中迅速研磨成粉末,并快速转移至5 mL离心管中,同时迅速加入3 mL 50 mmol、pH 7.8的磷酸缓冲液(含1% PVP),于涡旋器上振动重悬浮,并置于冰中抽提10 min,期间上下颠倒数次以充分提取。4 ℃ 12 000 g离心10 min,上清液即为酶液。抗氧化酶超氧化物歧化酶(Superoxide dismutase,SOD)、过氧化物酶(Peroxidase,POD)、过氧化氢酶(Catalase,CAT)活性测定采用南京建成生物工程研究所的试剂盒,其操作步骤按试剂盒说明书进行。采用考马斯亮蓝法测定各样品中的总蛋白含量[13]。
1.2.2 丙二醛(Malondialdehyde,MDA)含量测定
MDA含量的测定分别参照MDA测定试剂盒(TBA法),具体操作步骤按试剂盒说明书进行。试剂盒购买自南京建成生物工程研究所。
1.2.3 光合生理指标的测定 利用Li-6400 XT便携式光合测定仪(美国LI-COR公司),分别于水分胁迫处理后的第0、10、20、30 d的上午9:00-11:00,测定各处理植株叶片的光合生理指标,包括净光合速率(Net photosynthetic rate,Pn)、气孔导度(Stomatal conductance,Gs)、蒸腾速率(Transpiration rate,Tr)、胞间CO2浓度(Intercellular CO2 concentration,Ci),每个品种均选择植株枝条第四~第五叶位作为测定对象,每个品种随机选取3株,每株测定3片叶,每片叶重复记录3次,取均值。endprint
2 结果与分析
2.1 干旱胁迫下桑树生理生化的变化
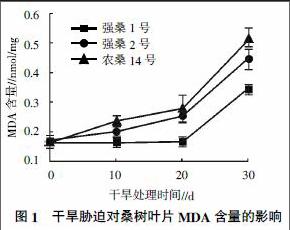
2.1.1 干旱胁迫下桑树叶片MDA含量的变化 通常干旱胁迫会扰乱植物体内自由基产生与消除之间的平衡,并倾向于自由基的累积,进而引起细胞膜脂过氧化,脂质过氧化物被进一步分解为MDA[14]。因此,MDA含量可直接反映植物受膜脂氧化伤害的程度;试验里干旱胁迫对桑树叶片MDA含量的影响情况见图1。从图1可知,在正常情况下,3个桑树品种叶片MDA含量基本相同,随着干旱胁迫时间的延长,桑树叶片MDA含量不断升高,尤其是干旱胁迫后期叶片大量累积MDA,表明在干旱胁迫后期桑树植株受膜脂过氧化伤害程度较重。不过不同品种间叶片MDA含量差异明显,其中农桑14号在整个干旱胁迫期间的MDA含量均高于其他2个品种;而强桑1号干旱处理0-20 d的MDA含量基本维持不变,直到后期才升高,且总体含量均低于其他2个品种,表明其膜脂抗氧化能力强,对干旱胁迫具有较强的耐受力。
2.1.2 干旱胁迫下桑树叶片抗氧化酶活性的变化 植物逆境胁迫下, SOD、CAT、POD作为主要的抗氧化酶类,其酶活性高低直接反映植物清除活性氧的能力;试验里干旱胁迫对桑树叶片SOD活性的影响情况见图2。从图2可知,正常条件下,3个桑树品种叶片的SOD活性基本相同;干旱胁迫初期,3个桑树品种的SOD活性迅速降低,随着干旱胁迫时间的增加,强桑1号和强桑2号叶片SOD活性又不断升高;而农桑14号叶片SOD活性随干旱胁迫时间的延长而不断降低。干旱胁迫对桑树叶片POD活性的影响情况见图3-A。从图3-A可见,干旱胁迫下,3个桑树品种叶片的POD活性变化趋势基本相似,总体呈上升趋势。干旱胁迫前期(0-20 d)3个桑树品种POD活性基本一致,且变化幅度相对稳定。胁迫后期,POD活性迅速升高,且不同品种间存在明显差异,其中强桑1号叶片POD活性明显高于其他2个品种,表明桑树植株能够通过自我调节适应外界干旱胁迫环境,但不同品种间自我调节和适应能力不一。干旱胁迫对桑树叶片CAT活性的影响情况见图3-B。从图3-B可见,正常条件下,3个桑树品种间CAT活性相差不大,随着干旱脅迫时间的增加,CAT活性均呈现先略微升高后迅速下降的变化趋势,不同品种间CAT活性差异明显,其中农桑14号叶片CAT活性总体上高于其他2个品种。
2.1.3 干旱胁迫下桑树叶片光合生理的变化 基于LI-6400型光合作用测定系统,对干旱胁迫处理后0、10、20、30 d桑树叶片Pn、Gs、Ci和Tr等光合生理参数进行了测定,结果见图4。从图4可知,随着干旱胁迫时间的延长,3个桑树品种叶片Pn、Gs、Tr不断下降,而Ci随干旱时间的延长则增加。虽然正常条件下不同品种间各光合生理参数存在品种特异性,但干旱处理30 d后基本上处于相同水平。在干旱胁迫期间,强桑1号叶片的Pn、Gs、Tr均明显高于其他品种,而农桑14号的各光合生理参数值相对较低。
2.2 淹水胁迫下桑树生理生化的变化
2.2.1 淹水胁迫下桑树叶片MDA含量的变化 试验里淹水胁迫对桑树叶片MDA含量的影响情况见图5。从图5可知,随着淹水胁迫时间的延长,桑树叶片MDA含量均呈现不断升高的变化趋势,表明随淹水胁迫时间的延长,桑树植株受膜脂过氧化损伤的程度在不断增加;并且不同品种的叶片MDA含量变化相差较大,其中强桑1号MDA含量随淹水胁迫时间的增加呈直线式上升,强桑2号和农桑14号MDA含量呈波浪式变化,以强桑2号MDA含量变化幅度相对较大,表明其能迅速响应并积极进行自我调节以适应淹水胁迫环境;农桑14号MDA含量总体低于其他2个品种,表明其膜脂过氧化损伤程度较低。
2.2.2 淹水胁迫下桑树叶片抗氧化酶活性的变化 试验里淹水胁迫对桑树叶片抗氧化酶类的影响情况见图6、图7。从图6、图7可见,在自然环境条件下,3个桑树品种间SOD、POD和CAT活性相差不大。随着淹水胁迫时间的延长,桑树叶片SOD和CAT活性均呈现先降后升的变化特点,且淹水处理20 d后2个酶活性达最低值(图6)。不同品种间以强桑2号的SOD活性明显高于其他2个品种,强桑1号和农桑14号的叶片SOD活性基本相同(图6-A);而CAT活性在3个桑树品种间相差不大,以强桑1号略高于其他2个品种(图6-B)。
与之相反,从图7可见,桑树叶片POD活性随淹水胁迫时间的增加而升高,但不同品种间存在明显的差异,强桑2号和农桑14号叶片POD活性随淹水胁迫时间的增加而升高,在处理后30 d达到最大值;而强桑1号叶片POD活性呈先升后降的变化趋势。上述结果表明,强桑2号和农桑14号对淹水胁迫的耐涝能力较强,能够通过自我调节积极适应胁迫环境;而强桑1号耐涝能力较弱,不能有效的进行自我调节。
2.2.3 淹水胁迫下桑树叶片光合生理的变化 试验里淹水胁迫对桑树叶片光合生理特性的影响情况见图8。从图8可知,淹水胁迫处理0、10、20、30 d后,随着淹水胁迫时间的延长,桑树各品种叶片Pn、Gs和Tr前期迅速降低而后缓慢下降,且30 d时基本上处于相同水平。不同品种间的Pn无明显差异,而强桑2号的Gs和Tr总体略高于其他2个品种;农桑14号的Ci随淹水胁迫时间的延长在后期迅速变化,强桑1号呈波浪式升高,而强桑2号Ci基本维持在相对稳定的水平,这表明农桑14号对淹水环境的耐受力较强。
3 讨论
水分胁迫是农作物面临的最为频繁的逆境伤害,也是限制农业生产发展的主要瓶颈问题。水分胁迫通常包括干旱胁迫(缺水)和淹水胁迫(水过剩)两个方面。胁迫逆境通常会引起植物体内自由基代谢失衡,自由基累积导致膜脂过氧化,并最终产生MDA。试验结果显示,无论是干旱还是淹水处理,均可导致桑树叶片MDA累积,且随水分胁迫时间的延长含量不断增加,表明在水分胁迫条件下,随时间的增加桑树叶片膜脂过氧化损伤程度在不断加重。这也与前人的研究结果相似[15,16]。在水分胁迫条件下,不同桑树品种间MDA的含量及累积方式也不同,即耐膜脂过氧化损伤的能力具有品种特异性。在干旱胁迫期间,0-20 d的强桑1号叶片MDA含量基本维持不变,总体含量均低于其他2个品种,农桑14号叶片MDA含量最高;淹水胁迫条件下,农桑14号叶片MDA含量总体低于强桑1号和强桑2号,但强桑2号叶片MDA含量变化幅度相对较大,表明其能迅速响应并积极进行自我调节以适应淹水胁迫环境。这个结果表明,不同品种对不同胁迫环境表现出了不同的适应性和耐受力,其中强桑1号对干旱具有较强的耐受力,而农桑14号在淹水胁迫下,具有较强的膜脂抗氧化能力,对淹水胁迫具有较强的耐受力。endprint
在胁迫环境下,植物内源抗氧化酶类对清除体内活性氧、自由基及保护生物膜稳定性发挥着重要的作用,这些抗氧化酶类主要包括SOD、POD和CAT,其酶活性高低直接反映出植物清除活性氧的能力[17,18]。不同物种(品种)及不同逆境胁迫下,SOD、POD和CAT活性是不一样,有研究发现在水分胁迫条件下,SOD、POD、CAT活性及含量与桑树品种抗性呈极显著相关性[15,16,19]。总体来看,抗逆性越强的品种,保护酶活性也越高。试验结果显示,干旱胁迫下,桑树叶片SOD活性在初期迅速降低,而后略微升高;POD活性随干旱时间的增加而提升,尤其在胁迫后期酶活性迅速升高,这在强桑1号上表现最为明显;而CAT活性先升高而后快速下降,表明在干旱胁迫下,桑树POD和CAT在清除活性氧中发挥着主要的作用,尤以POD突出。在淹水胁迫条件下,SOD和CAT活性均表现为先下降后上升,表明桑树能够通过自身的调节逐渐适应淹水环境;不过农桑14号和强桑2号叶片POD活性随淹水时間的延长而不断增加,而强桑1号POD活性呈先升后降的变化特点,表明SOD、CAT和POD在淹水胁迫不同阶段发挥了各自的抗氧化作用,尤以POD突出。SOD、POD和CAT通常是相互协调而发挥抗氧化作用的,也不排除具有物种、品种和时间上存在特异性的可能[20-24]。试验结果表明,桑树不同品种在不同逆境环境及不同阶段下,SOD、POD和CAT活性变化特点都不一样,在水分胁迫下,POD在桑树抗膜脂过氧化过程中发挥着重要的作用。
光合作用也是植物对水分胁迫的一个重要应答反应。前人的很多研究[25-30]结果显示,干旱或者淹水均会导致植物Pn、Gs和Tr降低,进而影响植物的耐水分胁迫能力。水分胁迫引起植物光合速率下降可归结为两方面因素,一是气孔限制,二是非气孔限制[31,32]。试验结果显示,水分胁迫下(干旱处理和淹水处理),3个桑树品种叶片的Pn、Gs和Tr不断下降,而Ci随胁迫时间的延长而增加。从Ci升高而Gs下降的变化趋势可以判断,水分胁迫条件下,桑树Pn下降是由非气孔因素引起的,即叶肉细胞光合能力降低所致。但不同品种、不同胁迫条件下,桑树叶片光合能力也存在差异,干旱胁迫下,强桑1号叶片Pn、Gs和Tr均明显高于其他品种,而淹水胁迫下,强桑1号、强桑2号和农桑14号光合能力无明显差异,只是强桑2号的Ci受淹水胁迫的影响较小而已。
上述结果表明,不同桑树品种对不同水分胁迫条件(干旱胁迫和淹水胁迫)表现出不同的耐受力。正如前人研究所言,通常抗旱的植物不耐涝,而耐涝的植物又不耐旱[1-3]。干旱胁迫下,桑树品种强桑1号表现出较强的耐受力;淹水胁迫下,桑树品种农桑14号表现出较强的耐涝性。水分胁迫下,桑树叶片的POD在抗氧化过程中发挥着重要的作用。
参考文献:
[1] 戴方喜,许文年,刘德富,等.对构建三峡库区消落带梯度生态修复模式的思考[J].中国水土保持,2006(1):34-36.
[2] 贺秀斌,谢宗强,南宏伟,等.三峡库区消落带植被修复与蚕桑生态经济发展模式[J].科技导报,2007,25(23):59-63.
[3] 杨朝东,张 霞,向家云.三峡库区消落带植物群落及分布特点的调查[J].安徽农业科学,2008,36(31):13795,13866.
[4] 韩世玉.桑树的生态价值及其在贵州“东桑西移”中的生态栽培[J].贵州农业科学,2007,35(5):140-142.
[5] 陈默君,贾慎修.中国饲用植物[M].北京:中国农业出版社,2002.10-18.
[6] 陈敏刚,金佩华,鲁兴萌,等.蚕桑生态系统服务功能价值的初步评估[J].蚕业科学,2005,31(3):316-320.
[7] 孙雪萍,刘某承,王 斌.山东夏津黄河故道古桑树群生态系统服务功能分析[J].世界农业,2015(11):107-114.
[8] 钟兴权,熊国普,胡文龙,等.桑树在三峡库区消落带种植试验初报[J].蚕学通讯,2016,36(4):9-12.
[9] 刘 芸.桑树在三峡库区植被恢复中的应用前景[J].蚕业科学,2011,37(1):93-97.
[10] 刘 挺,王福海.全国生态桑及桑树生态产业学术研讨会在陕西杨凌召开[J].蚕业科学,2012,38(5):806.
[11] 张晓虎,李新平.几种常用土壤含水量测定方法的研究进展[J].陕西农业科学,2008,54(6):114-117.
[12] 张爱民,耿广东,杨 红,等.干旱胁迫对辣椒幼苗部分生理指标的影响[J].山地农业生物学报,2010,29(1):35-38.
[13] 李合生,孙 群,赵世杰,等.植物生理生化实验原理和技术[M].北京:高等教育出版社,2003.182-186.
[14] AHMED S,NAWATA E,HOSOKAWA M,et al. Alterations in photosynthesis and some antioxidant enzymatic activities of mungbean subjected to waterlogging[J].Plant Sci,2002,163(1):117-123.
[15] 时连辉,牟志美,姚 健.不同桑树品种在土壤水分胁迫下膜伤害和保护酶活性变化[J].蚕业科学,2005,31(1):13-17.
[16] 郭 龙,朱大鹏,张敏娟,等.桑树同源多倍体品种在PEG模拟干旱胁迫下的相关生理生化指标变化[J].蚕业科学,2014,40(5):774-780.
[17] ARBONA V,HOSSAIN Z,L?魷PEZ-CLIMENT M,et al.Antioxidant enzymatic activity is linked to waterlogging stress tolerance in citrus[J].Physiol Plant,2008,132(4):452-466.endprint
[18] RAMACHANDRA R,CHAITANYA K,SUNDAR D.Water stress-mediated changes in antioxidant enzyme activities of mulberry (Morus alba L.)[J].Journal of Sericultural Science of Japan,2000,69(3):169-175.
[19] 任迎虹.干旱胁迫对不同桑品种保护酶和桑树生理的影响研究[J].西南大学学报,2009,31(4):94-99.
[20] REDDY A,CHAITANYA K,JUTUR P,et al.Differential antioxidative responses to water stress among five mulberry (Morus alba L.) cultivars[J].Environmental & Experimental Botany,2004,52(1):33-42.
[21] 王哲宇,童麗丽,汤庚国.淹水胁迫对构树幼苗形态及生理特性的影响[J].甘肃农业大学学报,2013,48(6):99-103.
[22] 张新兰.不同品种苜蓿叶片离体干旱胁迫过程中抗氧化酶活性动态[J].草业科学,2008,25(2):78-83.
[23] 李秀玲,刘 君,杨志民.干旱胁迫对4种观赏草枯叶率及生理指标的影响[J].草业科学,2010,27(11):26-32.
[24] 齐 琳,马 娜,吴雯雯,等.无花果品种幼苗淹水胁迫的生理响应与耐涝性评估[J].园艺学报,2015,42(7):1273-1284.
[25] 姜晓丹,郭军战.不同果桑品种在干旱胁迫下的光合生理变化[J].蚕业科学,2012,38(1):18-24.
[26] SCHWANZ P,PICON C,VIVIN P. Responses of antioxidative systems to drought stress in pendunculate oak and maritime pine as modulated by elevated CO2[J].Plant Physiology,1996, 110(2):393-402.
[27] FLEXAS J,MEDRANO H. Drought-inhibition of photosynthesis in C-3 plants,stomatal and non-stomatal limitations revisited[J].Annals of Botany,2002,89(2):183-l89.
[28] 衣英华,樊大勇,谢宗强,等.模拟淹水对池杉和栓皮栎光合生理生态过程的影响[J].生态学报,2008,28(12):6025-6033.
[29] 罗芳丽,王 玲,曾 波,等.三峡库区岸生植物野古草(Arundinella anomala Steud.)光合作用对水淹的响应[J].生态学报,2006, 26(11):360-3609.
[30] 徐子棋,饶良懿,朱金兆,等.水淹胁迫下饲料桑苗的生长及光合响应[J].农业工程学报,2015,31(22):105-114.
[31] 刘国琴,樊卫国.果树对水分胁迫的生理响应[J].西南农业学报,2000,13(1):101-106.
[32] 黄小辉,刘 芸,李佳杏,等.水分胁迫对三峡库区消落带桑树幼苗生理特性的影响[J].林业科学,2012,48(12):122-127.endprint

