樱桃谷鸭I亚群腺病毒PCR方法的鉴定
刘新勃(山东畜牧兽医职业学院 山东 潍坊 261061)孙 嘉 吴少鹏 鞠孜敬(山东农业大学 山东 泰安)唐德宏(山东省泰安市动物疫病预防控制中心)
禽腺病毒(Fowl adenovirus,FAdV)是全世界家禽和野禽常见的具有传染性的病原。许多腺病毒可在健康禽类体内复制,却不表现感染症状或只是引起轻微的病症,但发生混合感染或其它一些因素影响时,也会表现出较严重的发病症状,甚至引起死亡。禽腺病毒属中的一类毒株本身就具有较强的致病性,如火鸡出血性肠炎病毒(Hemorrhagic enteritis virus, HEV)、产蛋下降综合征病毒(Egg drop syndrome virus, EDSV)等,这些病毒本身就是原发病原[1]。根据禽腺病毒抗原性的差异,将其分为三个群:I亚群FAdV具有共同的群抗原,根据中和试验可将其分为12个血清型,Zsak等利用RFLP技术又将I亚群FAdV划分为A-E 5个基因型。I亚群FAdV呈世界性分布,各年龄段家禽均易感。临床上,病毒在鸭、鹅、鸡体内普遍存在,可引起包涵体肝炎、心包积液、肌胃糜烂等病变,且能垂直传播,污染鸡胚[2]。大多数I亚群FAdV的致病作用还位完全确定,但FAdV-1株能引起鹌鹑支气管炎,FAdV-4株是心包积水综合征的主要原因。Ⅱ、Ⅲ亚群腺病毒主要包括HEV和EDSV[3-5]等。目前,EDSV被定义为鸭腺病毒1型(Duck adenovirus 1, DAdV 1),对产蛋期成年家禽的产蛋率有较大影响。1982年从一只番鸭体内分离得到一株I亚群腺病毒,该毒株与鸡和火鸡体内分离到的毒株差异较大,被归为鸭腺病毒2型(Duck adenovirus 1, DAdV 2)[6]。
FAdV分布广泛,随着家禽养殖业的不断发展,家禽饲养基数的不断增加,FAdV每年的感染数量都在增加,尤其是近两年以包涵体肝炎和心包积液为特征的FAdV的发病情况日益严重[7,8]。PCR已被广泛应用于I亚群FAdV的检测,用病毒六邻体基因做引物可区分A-E种并定位病毒的种内血清型。本研究为采用PCR检测方法探究山东泰安地区鸭体内I亚群FAdV的感染情况,这一探索将便于该病原的检测和疾病的防控。
1 材料和方法
1.1 材料
1.1.1 样品 样品来自山东地区的病死樱桃谷鸭肝脏、脾脏共计54份,樱桃谷肉种鸭场的死胚48份。
1.1.2 主要试剂 Tris 平衡酚购自Solarbio,琼脂粉购自Biowest,2×Taq Master Mix(含Taq DNA Polymerase,dNTP,优化的缓冲体系)购自诺唯赞生物科技有限公司,pUMD19-T载体购自Thermo Fisher Scientific,Trans 5α感受态细胞购自Takara,其它试剂均为国产分析纯。
1.2 方法
1.2.1 引物信息 根据已发表的I亚群FAdV基因序列及文献报道,选取两对引物,由上海生工生物工程有限公司合成。FAdV-H1:5’-TGGACATGGGGGCGACCTA-3’;5’-AAGGGATTGACGTTGTCCA-3’,预计扩增目的片段长度为1200bp。FAV-H2:5’-AACGTCAATCCCTTCAAC CACC-3’;5’-TTGCCTGTGGCGAAAGGCG-3’,预计扩增目的片段长度为1300 bp。
1.2.2 病鸭剖检 对临床表现出明显发病症状的肉鸭进行临床剖检。
1.2.3 病毒基因组DNA提取 采用传统苯酚氯仿法提取I亚群FAdV的基因组DNA。
1.2.4 PCR体系及条件 PCR反应体系为25µl,2×Taq Master Mix 12.5µl,上下游引物各0.5µl,ddH2O 10.5µl。PCR反应程序为95℃预变性5min;94℃变性45s,56℃退火45s,72℃延伸1min,30个循环;72℃延伸10min。
1.2.5 PCR产物的鉴定 取7µl PCR扩增产物进行电泳,根据扩增产物的大小进行初步鉴定,琼脂糖凝胶浓度为1%。利用凝胶回收试剂盒回收与目的片段大小相符的特异性片段,将基因片段连接至pUMD19-T载体,连接体系为:T4 DNA Ligase 1µl,pUMD19-T Simple Vector 1µl,10×Ligase Buffer 1µl,回收的PCR产物7µl。16℃过夜连接后转化入Trans 5α感受态细胞。挑取单个转化菌落于LB培养液(Amp+)过夜培养,PCR鉴定阳性克隆送至铂尚生物技术有限公司进行测序。
1.2.6 I亚群FAdV部分核苷酸序列分析 将测得的基因片段序列与I亚群FAdV参考株基因组序列比对,进行同源性比较和基因进化树分析。用于核酸序列分析所用的I亚群FAdV各毒株名称、血清型、GenBank登录号、登录时间、分离地区见附表。

附表I 亚群FAdV参考株信息
2 结果与分析
2.1 剖检结果
心脏膨大疲软,心肌内外膜出血,有心包积液;肝脏肿大,质脆;肺部坏死,表面附有胶冻样物质;胆部肿大,呈墨绿色;胰腺出血;腺胃膜容易脱落;脾脏呈暗红色,肿大,表面有针尖大小的白色坏死点;肠道有出血;肾部表面有尿酸盐沉积(图1)。

图1 眼观病变
2.2 PCR检测结果
提取病毒DNA,PCR扩增后经1%琼脂糖凝胶电泳后,在紫外凝胶成像仪下可观察到,FAdV-H1引物扩增出约1200bp左右的条带,FAdV-H2引物条带大小约为1300bp左右(图2)。PCR检测结果显示,病料中I亚群FAdV阳性率为9.3%(5/54),未从鸭死胚中检测出I亚群FAdV感染。
2.3 I亚群FAdV部分基因序列同源性分析
随机选择PCR阳性样品进行克隆测序。序列分析发现,检测到的FAdV片段和血清4型、血清10型有较高的同源性,与两株在中国分离到的血清4型I亚群FAdV参考株(KU569296、KU981115)的同源性最高为97.7%。FAdV的部分基因片段与其它血清型的I亚群FAdV同源性较低(图3)。由此可见,该FAdV毒株为血清4型I亚群FAdV。
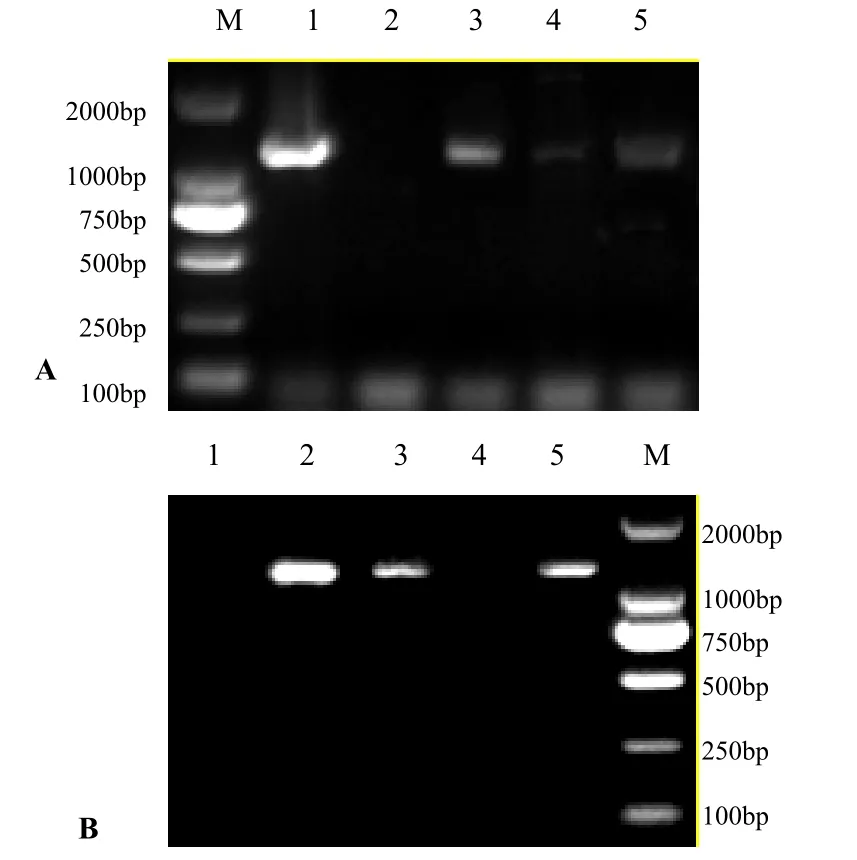
图2 部分送检样品中I亚群FAdV的PCR检测结果
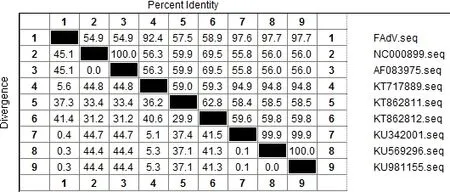
图3 I亚群FAdV部分基因片段同源性分析图
2.4 I亚群FAdV部分基因片段系统基因进化树
基因进化树显示,检测到的FAdV与两株中国的血清4型I亚群FAdV参考株(KU569296、KU981115)位于基因进化树同一分支上,与印度的血清4型I亚群FAdV位于同一次级分支上,亲缘关系较近(图4)。

图4 I亚群FAdV系统进化树
3 讨论
3.1 I亚群FAdV的控制
I亚群FAdV具有较强的抵抗力,通过严格的消毒能够消灭环境可控密闭鸡舍内的I亚群FAdV,由于I亚群FAdV可以通过种蛋垂直传播,消除商品鸡群中腺病毒存在很大困难,并且,从SPF鸡获得的经验表明,病毒水平传播的方式也是制约商品鸡群控制I亚群FAdV感染的一大问题[9],所以,控制原种鸡的腺病毒感染是实际可行的方法。
3.2 FAdV发病症状和病变
(1)I亚群FAdV发病除引起包涵体肝炎、心包积水综合征、肌胃糜烂等典型症状外,还对产蛋量、饲料转化率和生长有一定影响,并且可能与呼吸道症状和腱鞘炎的发生有很大关联。一些学者报道,某些I亚群FAdV毒株感染可使产蛋降低10%或者影响蛋壳质量。国内外已有一些关于I亚群FAdV感染导致饲料转化率降低的报道,研究发现,将自然感染的家禽在实验室条件下饲养会出现生长迟缓的现象[10,11]。家禽发生呼吸道疾病时,经常可从呼吸道中分离到I亚群FAdV,从发生腱鞘炎家禽的病变部位也分离到I亚群FAdV,呼吸道疾病和腱鞘炎的发生可能与I亚群FAdV有关。(2)在包涵体肝炎病例中,肝脏苍白、质脆、肿胀,肝脏和骨骼肌有出血点和出血斑,肝脏细胞内出现包涵体为主要的病理变化。在心包积水综合征病例中,心包腔中有淡黄色清亮积液,肺水肿,肝脏肿胀和变色,肾肿胀并伴有肾小管扩张,心脏和肝脏出现多发性局灶性坏死灶。本研究在进行临床剖检时,发现心包积液为主要的眼观病变,其它病变并不明显。
3.3 PCR对FAdV的检测
(1)PCR方法准确,灵敏,具有很好的特异性。目前对I亚群FAdV的检测主要采用PCR、ELISA实验[12-15],对于有血凝性的病毒如EDSV通过HA/HI试验检测,但敏感性不高,我们采用PCR方法从鸭群中分离I亚群FAdV,结果证明I亚群FAdV在泰安地区鸭群有流行,但是大群健康鸭带毒不发病。(2)本研究对2017年自泰安地区采集的病死鸭病料进行FAdV的分离鉴定,同时也根据剖检症状检测了其它常见具有传染性的病原体,包括H5、H7和H9亚型禽流感病毒(Avian influenza virus, AIV)、鸭圆环病毒(Duck circovirus, DuCV)等,其它病原有阳性结果,但未检测到I亚群FAdV与其它病毒同时感染的情况。另外,我们对PCR扩增的片段测序后进行序列比对和同源性分析发现,检测到的FAdV主要为血清4型,也检测到1例血清8b型,确定了用于PCR扩增的引物的准确性和特异性。
3.4 FAdV的流行及防治
有研究对I亚群FAdV进行了流行病学调查,发现近几年FAdV-2,FAdV-8,FAdV-10,FAdV-12四个血清型为优势血清型,选择这四个优势血清型的毒株制成多价油乳灭活苗,疫苗免疫5日龄白羽肉鸡后能诱导较高的抗体水平产生,在肉鸡的生长期内可抵抗I亚群FAdV的攻击[15]。在国内,I亚群FAdV还没有商品化的疫苗用于临床,使用感染禽的肝脏制成组织灭活苗对种鸡进行免疫,使后代获得了较高水平的母源抗体,对雏鸡抵抗I亚群FAdV的感染起了很好的预防作用。应用本土分离株经病毒扩大培养,或利用感染禽的肝脏制成油乳剂灭活疫苗,免疫肉鸡后能增强机体体液免疫和细胞免疫,对种鸡进行免疫后,能增强后代雏鸡的母源抗体水平,对血清型复杂的I亚群FAdV的防控具有十分重要的意义。
[1] 李海英, 尹燕博, 徐守振等. I群禽腺病毒12个血清型毒株Hexon蛋白全基因序列测定和酶切位点分析[J]. 中国兽医学报, 2012(1): 33-37,43.
[2] Guy J S, Barnes H J. Characterization of an avian adenovirus associated with inclusion body hepatitis in day-old turkeys[J]. Avian Diseases, 1997, 41(3): 726-731.
[2] 罗思思, 谢芝勋, 邓显等. I群禽腺病毒分离鉴定及hexon基因的序列分析[J]. 畜牧与兽医, 2012(1): 52-56. 4
[3] Humboldt C F, Frazier M N. Avian hepatic inclusion bodiesof unknown significance[J]. Avian Disease, 1963, 7(4): 446-450. 5
[4] Pichla-Gollon S L, Drinker M, Zhou X, et al. Structure-based identification of a major neutralizing site in an adenovirushexon[J].Journal of Virology, 2007, 81(4): 1680-1689.
[5] Bouquet J F, Y Moreau, J B McFerran, et al. Isolation and characterization of an adenovirus isolated from Muscovy ducks[J]. Avian Pathol, 1982, 11:301-307.
[6] 刘东, 刘红祥, 于静等. I亚群腺病毒在我国鸡群的流行病学调查[J]. 中国家禽, 2015(15):70-73.
[7] Zhao J, Zhong Q, Zhao Y, et al. Pathogenicity and Complete Genome Characterization of Fowl Adenoviruses Isolated from Chickens Associated with Inclusion Body Hepatitis and Hydropericardium Syndrome in China[J]. PLo S One, 2015, 10(7): e133073.
[8] 陈溥言. 禽腺病毒型鸡胚致死孤儿病毒在非免疫鸡胚中隐性感染可能己经严重危害到我国疫苗生产[J]. 畜牧与兽医, 2002, 34(6): 19.
[9] Cowen B, B W Calnek, N A Menendez, et al. Avain Adenoviruses-effct on egg production, shell quality and feed consumption[J]. Avian Disease,1987, 22: 459-470.
[10] Saifuddin M D, C R Wilks, A Murray. Character of avain adenoviruses associated with inclusion boby hepatitis[J]. N Z Vet J, 1992,40: 52-55.
[11] Dhinakar Raj G, Sivakumar S, Matheswaran K, et al. Detection of egg drop syndrome virus antigen or genome by enzyme-linked immunosorbent assay or polymerase chain reaction[J]. Avian Pathol, 2003, 32(5): 545-50.
[12] Kumar N S, Kataria J M, Koti M, et al. Detection of egg drop syndrome 1976 virus by polymerase chainreaction and study of its persistence in experimentally infected layer birds[J]. Acta Virol, 2003,47(3): 179-84.
[13] Raj G D, Ratnapraba S, Matheswaran K, et al. Comparison of hemagglutination inhibition test and ELISA in quantification of antibodies to egg drop syndrome virus[J]. Acta Virol, 2004, 48(3): 183-7.
[14] 郝东敏. 山东地区I亚群禽腺病毒的分离鉴定及多价油乳剂灭活疫苗的研制[D]. 泰安: 山东农业大学, 2014.

