猪圆环病毒2型与猪链球菌混合感染的诊治
杨年信,李帮林,向 辉,张惠明,杨克礼
(1.湖北省恩施土家族苗族自治州鹤峰县畜牧兽医局,湖北 鹤峰 445800;2.湖北省农业科学院畜牧兽医研究所,湖北 武汉 430064)
猪圆环病毒(Porcine cirovirus,PCV)是近年来危害我国养猪业发展的主要疫病之一,根据其基因组不同分为猪圆环病毒l型(Porcine cirovirus type l,PCV1)和猪圆环病毒2型(Porcine cirovirus type l,PCV2)[1]。PCV1对动物没有致病作用,PCV2是断奶仔猪多系统衰竭综合征的主要病原。该病多以5~12周龄的仔猪发病率较高,主要临床表现为呼吸困难、贫血、进行性消瘦、生长迟缓、偶有黄疽和腹泻等[2-3]。
猪链球菌病(S.suis)是由链球菌引起猪的一种急性、败血症型和脑膜炎型的人畜共患传染病[4]。按照荚膜多糖的差异,猪链球菌可分为35个血清型,引起猪和人发病的有1、2、9、7和8等血清型,以2型猪链球菌为主[5-6]。急性主要表现为败血症,一般未出现症状即死亡[7],慢性主要表现为跛行、关节肿大或麻木,耳后、腹下、肛门周围发红,有出血点等[6]。哺乳仔猪发病主要以败血症型、脑膜炎型为主,发病率和死亡率均较高;肥育猪发病多以关节炎或淋巴结脓肿为特征,死亡率较低,但影响其生长发育[9]。
2017年3月,鹤峰某猪场的猪只先后大量发病,各阶段的猪均有发病和死亡,持续近40 d,经济损失较大。笔者将猪场送检的病料送至湖北省农业科学院畜牧所重点实验室进行病原分离鉴定和PCR检测,诊断为PCV2和猪链球菌的混合感染。根据临床及实验室诊断结果,笔者提出了综合防控技术方案,经实施后,疫情得到了有效控制。
1 材料与方法
1.1主要试剂M-肉汤培养基、营养琼脂培养基、鲜血培养基以及其他生化培养基均购自青岛高科技园海博生物技术有限公司;病毒DNA/RNA提取试剂盒、dNTPs、Taq DNA聚合酶、DL 2000 DNA Marker等,均购自TaKaRa公司;PCV2检测引物由上海San-gon生物工程公司合成。
1.2样品处理对无菌采取的病料组织直接涂到载玻片上,进行革兰氏染色,无菌采集急性死亡病猪肺、脾及淋巴结等组织,制作抹片,经干燥、火焰固定后进行革兰氏染色,在显微镜下观察其形态特征。
1.3细菌分离培养于超净工作台中用接种环取肺、脾及淋巴结等病料直接接种于鲜血琼脂平板,置37℃培养箱中培养24~48 h,挑取单菌落进行革兰氏染色,符合猪链球菌的形态和溶血特征后,再挑取典型菌落接种于琼脂斜面培养基、血清肉汤培养基和普通肉汤培养基,置37℃培养24~48 h,革兰氏染色、镜检,并做进一步的生化试验。
1.4病毒核酸的提取将病料组织与DMEM溶液按1:5混合,充分匀浆,-80℃至室温反复冻融3次,立即提取核酸或置-80℃保存备用。病毒核酸的提取利用病毒DNA/RNA提取试剂盒按照说明书进行。
1.5 P C V 2 P C R扩增取提取的DNA,使用针对PCV2 ORF2基因设计的引物,进行PCR扩增。上游引物PCV2-F:5’-CGAGCTCATGACGTATCCAAGGAGGC-3’,下游引物PCV2-R:5’-CCCAAGCTTTTAGGGTTTAAGTGGGGG-3’,产物预期大小约720 bp。PCR反应体系为25 μL:10×PCR buffer 2.5 μL,dNTPs(10 mm)1 μL,上、下游引物各0.5 μL,模板DNA 3 μL,Taq酶0.25 μL(5 U/μL),加灭菌超纯水至25 μL;PCR反应参数如下:95℃变性5 min,按94℃变性1 min,56℃退火45 s,72℃延伸1 min,共进行30个循环,72℃延伸10 min。取5 μL PCR产物经1%琼脂糖凝胶电泳检测,紫外观测仪下观察记录结果。
1.6防控措施全场封群,全面消毒:在疫情期间,严禁生产区工作人员出入,饲养员和各类用具严禁串舍。出入猪场的车辆要进行严格消毒。舍外场地和猪舍空栏用2%~3%的烧碱溶液喷洒消毒。猪舍内每3 d用消毒水带猪消毒1次,走廊和过道用福尔马林液每3 d消毒1次。
紧急接种:对无明显症状的猪只,分别紧急免疫自制苗2~4 mL。
对症治疗:对出现继发感染的猪只,应用抗菌药物进行治疗,如环丙沙星、头孢类药物等;对呼吸困难的猪只使用止咳平喘药物,如麻黄碱、氨茶碱等;对高热猪只使用退烧药物,如安乃近、氨基比林等。
辅助治疗:猪圆环病毒为病毒性疫病,使用抗生素治疗无效,只能对症治疗并控制继发感染。建议配合使用病毒灵、干扰素、免疫球蛋白、高免血清等广谱抗病毒的药物进行辅助治疗,同时可配合并使用甘草合剂、黄芪多糖等增强免疫力的药物。
2 结果与分析
2.1临床症状及剖检病理变化临床症状主要表现为发热,食欲下降,呼吸困难、咳嗽,部分病猪皮肤发红,部分病猪皮肤苍白,部分母猪流产,部分仔猪有关节炎而出现运动障碍,后肢不能站立;个别猪突然发病,出现神经症状,仔猪和母猪均有死亡。剖检病变主要表现为肺脏有大面积的出血、水肿,并有局灶性坏死结节,呈败血症的特殊症状;心脏外膜出血严重,肾表面有出血点,脾肿大,淋巴结肿大;关节腔内有黄色黏稠液体。
2.2细菌分离培养和鉴定结果鲜血琼脂平板上可见灰白色表面光滑湿润、稍微隆起的半透明的小菌落,菌落周围可见约1 mm透明溶血环,呈典型的β-型溶血(图1);在普通琼脂平板上菌落较小。在血清肉汤培养基中形成均匀浑浊,试管底部有明显的沉淀,无菌膜。革兰氏染色,镜检可见大量短链状或长链状排列的革兰氏阳性球菌(图2)。对分离纯化的细菌进行生化试验,结果该菌发酵葡萄糖、乳糖、麦芽糖、甘露醇、蔗糖、水杨酸和山梨醇,不发酵木糖、阿拉伯糖,综上判定该菌为链球菌。
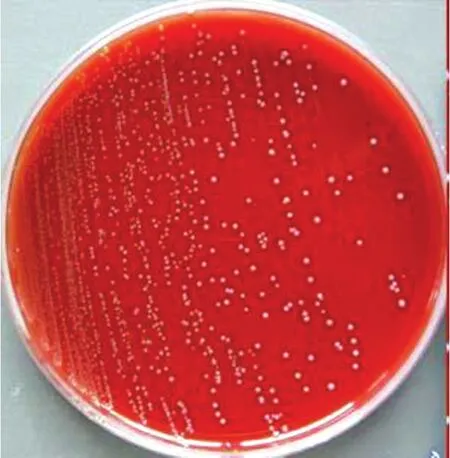
图1 鲜血琼脂平板上的菌落Fig.1 Colony on the blood AGAR plate
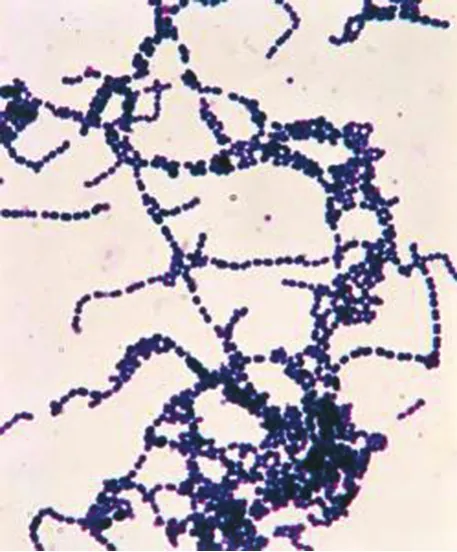
图2 显微镜下的革兰氏阳性链球菌Fig.2 The microphotograph of streptococcus suis
2.3 P C V 2 P C R检测结果以病猪组织中提取的病毒DNA为模板,利用设计的PCV2特异性引物进行PCR扩增,扩增产物经琼脂糖凝胶电泳分析,结果所检测的组织样品全部扩增出与预期产物大小一致的目的条带,即为PCV2阳性(图3)。
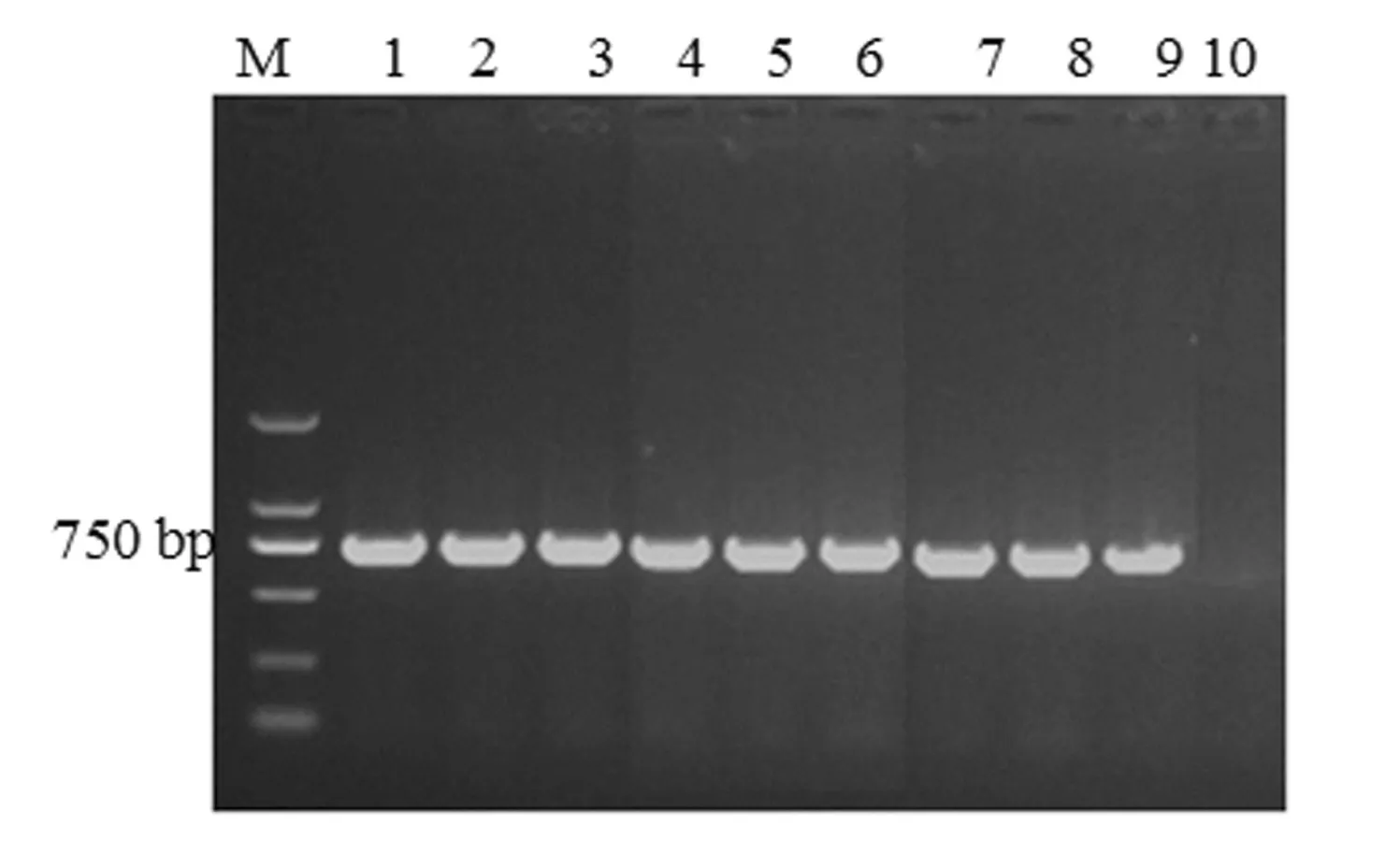
图3 PCV2 PCR扩增产物电泳图Fig.3 The electrophoresis of the PCR product of PCV2
综合以上结果可知,8份组织样品检测结果猪圆环病毒2型均为阳性,结合临床表现及细菌分离培养结果,判定该猪场本次暴发的疫情为猪圆环病毒2型和猪链球菌的混合感染所致。
2.4防控效果采用上述综合防控措施20 d后,该猪场的病情逐步得到控制,40 d后疫情平息,生产秩序恢复正常并逐步达到发病前的水平。
3 讨论
根据实验室分子生物学检测结果,PCV2的阳性率为100%(8/8),结合临床症状、剖检病理变化及细菌分离培养结果,确诊该猪场发生的疫病为PCV2与猪链球菌的混合感染。
PCV2可导致机体产生免疫抑制,使其抵抗力降低,容易引起其他病毒或细菌的继发或并发感染,从而引起感染猪的大量死亡[10-11]。临床上,PCV2的混合感染与其他病原体感染所引起的呼吸系统疫病的表现极为相似,并常伴随其他混合感染或/和继发感染。因此,仅根据流行病学、临床症状以及剖检变化很难对疫病作出正确诊断。PCR方法是当前的一种快速简便、准确可靠的检测方法,可用于临床诊断。
由于PCV2是病毒性疫病,临床上使用常规的方法控制其混合感染效果很不理想。本研究中使用自制苗进行防治,配合注射敏感抗生素、免疫增强剂液等,同时,采用加强饲养管理等综合防控措施,取得了理想的防治效果。自制苗是在无菌条件下采集病猪的肺、脾、肾、淋巴结等组织经过甲醛灭活制成的,可用于发病场或发病地区PCV2的防治,但由于安全性等因素尚不能在生产中推广应用。临床使用时应先做安全性试验,若有不良反应出现,需立即停止使用[12]。
猪链球菌病近年来发病率较高,对养猪业的影响较为严重。该病一年四季均有发生,饲养环境差、饲料营养失衡、应激等因素均可诱发本病[13]。但很多情况下,链球菌可继发于其他病原感染之后,如PRRSV感染、PCV2感染等。因为PRRSV和PCV2均可以破坏猪的免疫系统,导致免疫抑制。已有的研究表明,PRRSV和PCV2病毒在猪体内可以相互促进增殖,混合感染具有明显的协同致病作用[14]。混合感染使得猪病情复杂化,给疾病的诊治增加了难度,因此对发病猪尽早确诊、尽早治疗,以减少混合感染、继发感染病例的发生。因此,加强对PCV2和PRRSV的预防,对猪场其他疫病的防控有着重要的意义。
无论是规模化养猪场,还是农村散养户,对于疫病的防控均要贯彻“预防为主”的方针,加强饲养管理,搞好环境卫生。坚持自繁自养和全进全出的原则;同时保证猪群充足的营养,减少应激;猪舍保持良好的通风和适宜的温度、湿度;定期消毒,交替使用消毒药,防止耐药菌株的产生。只有这样才能最大限度地减少各类疫病的发生,避免不必要的经济损失。
[1]Hamel AL,Lin LL,Nayar GP.Nucleotide sequence of porcine circovirus associated with postweaning multisystemic wasting syndrome in pigs[J].Journal of Virology,1998,72(6):5262-5267.
[2]郎洪武,张广川,吴发权,等.断奶猪多系统衰弱综合征血清抗体检测[J].中国兽医科技,2000,30(3):3-5.
[3]马莉莉,王宇婷,赵微,等.多杀性巴氏杆菌和猪圆环病毒混合感染的诊断[J].现代畜牧兽医,2016(7):36-39.
[4]王宇婷,王云光,吴丹丹,等.2007-2015年黑龙江省猪链球菌病分子流行病学调查[J].黑龙江畜牧兽医,2016(18):109-111,296.
[5]杜华茂,丁玉春,王丽丽,等.4株猪链球菌的病原生物学特性分析[J].中国兽医学报,2010,30(1):24-28.
[6]马莉莉,王宇婷,倪宏波.猪圆环病毒和链球菌混合感染的诊断[J].现代畜牧兽医,2016(10):37-40.
[7]闵成军,刘亚彬.猪链球菌的致病性[J].动物医学进展,2010,31(S):257-259.
[8]蔡宝祥.家畜传染病学[M].第4版.北京:中国农业出版社,2001.
[9]刘志科,张秋雨,陈创夫.猪链球菌病原的分离鉴定与药敏试验[J].养猪,2017(2):105-108.
[10]Allan GM,Ellis JA.Porcine circoviruses:A review[J].Journal of Veterinary Diagnostic Investigation,2000,12(1):3-14.
[11]Wellenberg GJ,Stockhofe-zurwieden N,Boersma WJ,et al.The presence of co-infections in pigs with clinical signs of PMWS in the Netherlands:A case-control study[J].Research in Veterinary Science,2004,77(2):177-184.
[12]陈金山,陈俊杰,吴玉苹,等.猪圆环病毒感染组织灭活苗的临床应用效果观察[J].动物医学进展,2009,30(11):124-126.
[13]何孔旺,陆承平.猪链球菌2型的致病性与毒力因子[J].中国兽医科技,2000,30(9):17-18.
[14]王天户,娄忠子,刘思当.猪PRRSV单独感染及与PCV2混合感染的免疫病理学研究[J].西南农业学报,2008,21(1):187-190.

