慢性束缚应激对老龄大鼠空间学习和记忆能力及海马齿状回区兴奋性氨基酸水平的影响
王玮瑶,陈 玲,岳学玲,金清华
( 1. 延边大学医学院生理学与病理生理学教研室,吉林 延吉 133002;2. 吉林医药学院病理学教研室,吉林 吉林 132021)
应激是普遍存在于生活中不可避免的事件,虽然应激对维持机体生命活动具有重要意义,但其也可作为病因或诱因影响着多种疾病的发生和发展[1],因此应激对机体损伤的作用机制和防治措施正引起学术界的广泛关注。学习和记忆是非常重要的脑高级功能,决定着自我意识和对外界环境的认知,应激对不同年龄个体的学习记忆产生不同的影响。在穿梭箱回避实验中,慢性应激可导致成年大鼠学习能力下降,而不影响幼年大鼠的学习能力[2];在老年大鼠,慢性应激可增加海马内β淀粉样蛋白(amyloid β-protein,Aβ)的水平而导致认知障碍[3]。随着世界老龄化的发展,老年痴呆已成为一个严重的医学和社会问题[4],若能阐明应激对老年大鼠学习记忆的作用及其作用机制,可为改善老年人的学习记忆能力并有效防治老年性痴呆等认知功能相关疾病提供理论依据。海马是哺乳类动物学习记忆的关键结构,研究[5-6]显示:海马的结构和功能易受应激的影响,但有关应激对海马区学习记忆功能的作用机制,尤其是涉及神经递质的神经化学机制研究较少。天冬氨酸(asparate,Asp)和谷氨酸(glutamate,Glu)作为中枢神经系统中典型的兴奋性氨基酸,均作用于N-甲基-D-天冬氨酸(N-methyl-D-aspartate,NMDA)受体产生相应的生理功能[7]。本课题组前期研究[8-9]结果显示:海马齿状回(dentate gyrus,DG)区的Asp和Glu参与成年雄性大鼠的主动回避学习过程,但其在慢性应激诱发的老龄大鼠学习记忆异常中的作用目前尚未见报道。本研究应用Morris水迷宫(morris water maze,MWM)实验检测慢性束缚应激(chronic restraint stress,CRS)大鼠空间学习记忆能力,同时采用脑部微量透析法和高效液相色谱法观察大鼠海马DG区Asp和Glu水平的变化,初步探讨慢性应激影响老年大鼠空间学习记忆功能的部分神经化学机制。
1 材料与方法
1.1 实验动物、主要试剂和仪器健康雄性SD大鼠16只,18个月龄,由延边大学实验动物中心提供,动物生产许可证号:SCXK (吉) 2017-0003。水合氯醛(天津市大茂供应站),OPA(ophthaldialdehyde,美国Sigma公司),氯化钠、氯化钾、氯化钙、Asp和Glu(日本NACALAI株式会社),异氟烷(鲁南贝特制药有限公司),ELISA 试剂盒(美国CUSABIO公司)。8R-6型脑立体定位仪(日本成茂公司),HTEC-300型生物活性物质微量分析系统、ESP-64型微量灌注泵和EFC-82型自动样本收集器(日本EICOM公司),MWM实验系统(中国上海吉量科技有限公司)。
1.2 实验动物分组及处理SD大鼠随机分为对照组和CRS组,每组8只。CRS组大鼠接受CRS,具体方法如下:将清醒大鼠单独置于长18~20 cm(可调节)、宽约7 cm、两端各有一个通气孔(直径1 cm)的透明束缚器内给予束缚刺激(只允许大鼠轻微活动),束缚期间大鼠禁食禁水;大鼠在每天的同一时间接受2 h的束缚刺激1次,连续30 d。对照组大鼠不进行处理。
1.3 微量透析探针的插入最后1次束缚刺激结束后,大鼠腹腔注射10%水合氯醛(300 mg·kg-1)麻醉后固定在脑立体定位仪上。碘伏消毒,剪开头皮及脑膜,暴露前后囟,参照Paxinos和Watson图谱,将探针外套管(外径0.9 mm)固定在一侧海马高于DG区1.5 mm 的部位(坐标为:前囟后3.4 mm,旁开 1.6 mm,深3.0 mm),用牙科水泥固定于颅骨上。大鼠单独饲养并恢复3 d后,在清醒状态下经外套管向海马DG区插入自制的微量透析探针,并用蜡固定于外套管上。微量透析探针超出外套管1.5 mm,尖端为乙酸纤维素半透膜(外径0.2 mm),滤过相对分子质量小于50 000的物质。
1.4 MWM实验大鼠海马DG区插入微量透析探针后,适应MWM系统2 min,第2天开始为期5 d的MWM检测[10],检测方法及观察指标如下:MWM定位航行实验时,记录大鼠自入水到找到站台后四肢爬上站台所需的时间(即逃避潜伏期),若大鼠在120 s内找到站台,记录所需的时间作为逃避潜伏期,若大鼠在120 s内未找到站台,则将其引至站台并停留15 s,潜伏期记为120 s,大鼠每天训练1次,连续训练4 d;MWM检测第5天,撤去水池中的圆形平台进行空间探索实验,记录120 s内大鼠在每个象限游泳的时间百分比。
1.5 大鼠海马 DG区兴奋性氨基酸水平的测定[9]MWM实验开始前和每天训练结束后,将微量透析探针与微量灌注泵连接,用Ringer’s液(147 mmol·L-1NaCl,4 mmol·L-1KCl,2.3 mmol·L-1CaCl2,pH 6.5)以1.5 μL·min-1速度进行灌流,利用自动样本收集器收集大鼠海马DG区微量透析样本10 min。取12 μL的透析样本与3 μL的4 mmol·L-1OPA溶液混合,常温下反应2.5 min后抽取10 μL的反应液注入到生物活性物质微量分析系统中,经高效液相色谱分离柱和电化学检测器测定各个样本中兴奋性氨基酸(Asp和Glu)的浓度。
1.6 血清应激激素水平测定及组织学鉴定实验结束后,用异氟烷将大鼠麻醉,取心脏血,室温下3 000 r·min-1速度离心15 min,取上清置于-80℃冰箱保存。采用ELISA 法检测大鼠血清中皮质酮(corticosterone,CORT)和肾上腺素(epinephrine,EPI)水平,以确定CRS组大鼠的应激水平。将大鼠断头取脑,用10%甲醛溶液固定脑组织3 d后进行冰冻切片,中性红染色,鉴定微量透析探针到达部位,数据统计只采用探针进到海马 DG区者的数据。
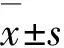
2 结 果
2.1 各组大鼠空间学习和记忆能力2组大鼠在4 d 的MWM定位航行训练过程中,逃避潜伏期均随训练天数增加而逐渐减少,与对照组比较,CRS组大鼠第2~4天的逃避潜伏期明显延长(P<0.05),提示CRS降低老年大鼠的空间学习能力。第5天MWM检测,撤去隐藏站台进行空间探索实验,2组大鼠在目标象限(第三象限)游泳的时间百分比均明显长于其他象限(P<0.05),CRS组大鼠在目标象限游泳的时间百分比明显少于对照组(P<0.05),提示CRS可降低老年大鼠的空间记忆能力。见表1和2。
表1 MWM实验中2组大鼠的逃避潜伏期
Tab.1 Escape latencies of rats in MWM test in two groups

表1 MWM实验中2组大鼠的逃避潜伏期
GroupEscapelatency(t/d) 1234Control79.53±9.1745.17±11.93△34.09±6.18△22.22±4.01△CRS94.09±16.2072.05±12.56∗63.01±5.83∗△37.88±6.73∗△
*P<0.05 compared with control group;△P<0.05 compared with 1 d.

表2 MWM实验中2组大鼠在各象限游泳的时间百分比
*P<0.05 compared with control group ;△P<0.05 compared with 25% chance level in each quadrant.
2.2 各组大鼠海马DG区Asp和Glu水平大鼠海马DG区的Asp和Glu水平以MWM训练前水平为100%计算出每天训练后的变化百分比来表示。与训练前比较,对照组大鼠训练第1天的海马DG区Asp水平明显增加(P<0.05);而CRS组大鼠海马DG区Asp水平在训练第3天明显降低(P<0.05),训练第3天时2组间比较差异有统计学意义(P<0.05)。与训练前比较,对照组(训练第2和3天)和CRS组(训练第2和4天)大鼠海马DG区Glu水平均明显增加(P<0.05),2组间比较差异无统计学意义(P>0.05)。见表3。
表3 2组大鼠海马DG区Asp和Glu水平
Tab.3 Levels of Asp and Glu in hippocampal DG of rats in two groups

表3 2组大鼠海马DG区Asp和Glu水平
GroupAsp(t/d)012345Control 100111.79±2.92△125.09±22.39141.56±24.08102.01±19.31110.23±35.39CRS 100122.85±36.6190.32±14.3272.92±13.14∗△94.99±34.7786.71±19.90GroupGlu(t/d)012345Control 100185.59±53.50245.19±58.01△343.61±110.94△349.50±163.12322.61±143.22CRS 100138.96±25.64295.40±64.01△219.23±79.14273.42±62.13△161.64±61.09
*P<0.05 compared with control group;△P<0.05 compared with 0 d.
2.3 各组大鼠血清中应激激素水平的变化采用ELISA 法测定大鼠血清中CORT与EPI的水平,以评价CRS是否引起应激反应。CRS组大鼠血清中的CORT和EPI水平较对照组明显升高(P<0.05),提示CRS组大鼠处于慢性应激状态。见表4。

表4 2组大鼠血清中CORT和EPI水平
*P<0.05 compared with control group.
3 讨 论
目前世界的人口老龄化程度不断加剧,导致老年痴呆逐年增加,并已成为医学和社会问题的焦点,而老年痴呆性认知障碍的初始表现为学习记忆能力的减退[4]。众所周知,海马是哺乳类动物学习记忆功能的关键结构。文献[11]报道:在老化大鼠出现海马内Aβ沉积、神经元变性及突触可塑性异常等,表明海马结构和功能的异常参与老年性学习记忆能力减退。应激是日常生活中普遍存在的现象,可以影响人类和动物的各种生理功能,包括学习记忆等认知功能[12]。海马是脑内对应激及相关激素最为敏感的部位之一,研究[5-6]表明:应激可诱发海马神经元形态异常、神经发生减少以及海马依赖性学习记忆能力的改变等。文献[3,5,13]报道:慢性应激可损伤老龄大鼠的海马依赖性学习记忆功能及其相关突触可塑性,但对此作用的神经化学机制目前尚不完全清楚。先前的研究[8-9]表明:海马DG区的Asp和Glu参与成年雄性大鼠的主动回避学习过程,其中Asp可能与急性应激降低成年大鼠空间学习能力有关[14],但其在慢性应激诱发的老龄大鼠学习记忆异常中的作用目前尚未见报道。本研究对18月龄的老龄大鼠给予30 d的CRS,观察其对空间学习记忆及海马DG区Asp和Glu水平的影响。应激的经典内分泌系统有交感-肾上腺髓质系统和下丘脑-垂体-肾上腺皮质轴系统,前者激活后会导致EPI的释放,而后者激活则导致糖皮质激素(啮齿类动物为CORT)的分泌。在本研究中,CRS组大鼠血清中CORT和EPI水平均明显高于对照组,提示给予CRS使大鼠处于慢性应激状态。本实验结果还显示:与对照组比较,MWM实验检测中CRS组大鼠的逃避潜伏期明显延长而在目标象限的时间明显减少,提示CRS可明显降低老龄大鼠的空间学习记忆能力。
哺乳类动物海马的主要亚区有CA1、CA3和DG区,其中DG区作为新信息进入海马的传入点在空间信息的处理和编码中起至关重要的作用。突触效应长时程增强(long-term potentiation,LTP)是突触可塑性的典型表现,也是海马依赖性学习功能的神经生理学基础。目前研究[15]认为:海马DG区的LTP是NMDA受体依赖性的,即突触后膜的NMDA受体大量激活,引起突触后膜内Ca2+浓度明显增加,触发与Ca2+相关的一系列生理生化反应,最终诱发LTP。Asp 和Glu是公认的兴奋性神经递质,在海马神经元共同分布于相同的神经末梢与突触囊泡中,均以Ca2+依赖性方式释放,前者选择性地作用于NMDA受体,而后者作用于包括NMDA受体在内的所有谷氨酸能受体上[16,7]。本课题组前期的实验结果[8-9]显示:大鼠海马DG区的Asp和Glu水平随着条件反射的建立逐渐升高且随条件反射的消退逐渐回降,此变化与学习依赖性LTP变化基本对应。上述研究提示:大鼠海马DG区的Asp和Glu可能通过NMDA受体参与海马依赖性学习记忆功能中。本实验结果显示:对照组大鼠海马DG区Asp和Glu水平在空间学习过程中有增加趋势,表明其可能参与老龄大鼠的空间认知过程。如前所述,慢性应激可导致海马的结构和功能的变化[3,5,13,17],而且慢性应激还影响海马DG区LTP的产生[18]。本实验结果显示:CRS组大鼠海马DG区的Glu水平变化和对照组相似,在空间学习过程中有所增加(在训练第2和4天与训练前比较),但2组间比较差异无统计学意义;与之相比,CRS组大鼠DG区Asp水平在空间学习过程中不仅没有增加反而有所下降(在训练第3天与训练前比较),2组间比较差异有统计学意义(训练第3天)。本研究结果提示:CRS降低老年大鼠的空间学习和记忆能力与海马DG区Asp水平降低有关,但其具体的下游机制尚有待进一步研究。
[1] Wood CS,Valentino RJ,Wood SK.Individual differences in the locus coeruleus- norepinephrine system:Relevance to stress-induced cardiovascular vulnerability [J].Physiol Behav,2017,172:40-48.
[2] Ricon T,Toth E,Leshem M,et al.Unpredictable chronic stress in juvenile or adult rats has opposite effects,respectively,promoting and impairing resilience [J].Stress,2012,15(1):11-20.
[3] Carroll JC,Iba M,Bangasser DA,et al.Chronic stress exacerbates Tau pathology,neurodegeneration,and cognitive performance through a corticotropin-releasing aactor receptor-dependent mechanism in a transgenic mouse model of tauopathy [J].J Neurosci,2011,31(40):14436-14449.
[4] Querfurth HW,LaFerla FM.Alzheimer’s disease [J].New Engl Jo Med,2010,362 (4):329-344.
[5] Zitman FM,Richter-Levin G.Age and sex-dependent differences in activity,plasticity and response to stress in the dentate gyrus [J].Neuroscience,2013,249:21-30.
[6] Naninck EF,Hoeijmakers L,Kakava-Georgiadou N,et al.Chronic early life stress alters developmental and adult neurogenesis and impairs cognitive function in mice [J].Hippocampus,2015,25 (3) :309-328.
[7] Zappettini S,Grilli M,Salamone A,et al.Pre-synaptic nicotinic receptors evoke endogenous glutamate and aspartate release from hippocampal synaptosomes by way of distinct coupling mechanisms [J].Br J Pharmacol,2010,161(5):1161-1171.
[8] 刘巧凤,金清华,姜海英,等.习得性长时程增强中清醒大鼠海马齿状回几种氨基酸的变化[J].中国临床康复,2006,10 (38):71-75.
[9] Wang S,Pan DX,Wang D,et al.Nitric oxide facilitates active avoidance learning via enhancement of glutamate levels in the hippocampal dentate gyrus [J].Behav Brain Res,2014,271:177-183.
[10]Li G,Lv J,Wang J,et al.GABAB receptors in the hippocampal dentate gyrus are involved in spatial learning and memory impairment in a rat model of vascular dementia [J].Brain Res Bull,2016,124 :190-197.
[11]Liu L,Su Y,Yang W,et al.Disruption of neuronal-glial-vascular units in the hippocampus of ovariectomized mice injected with D-galactose [J].Neuroscience,2010,169 (2):596-608.
[12]Wang B,Wang Y,Wu Q,et al.Effects of 2A adrenoceptors on norepinephrine secretion from the locus coeruleus during chronic stress-induced depression [J].Front Neurosci,2017,11:243.
[13]Alkadhi KA,Tran TT.Chronic psychosocial stress impairs early LTP but not late LTP in the dentate gyrus of at-risk rat model of Alzheimer’s disease [J].Brain Res,2014,1588:150-158.
[14]金美玉,吴建龙,金清华,等.急性应激大鼠的海马DG区兴奋性氨基酸在空间学习记忆中的变化[J].中国实验诊断学,2017,21(5):893-896.
[15]Riedel G,Platt B,Micheau J,et al.Glutamate receptor function in learning and memory [J]. Behav Brain Res,2003,140 (1/2):1-47.
[16]Fleck MW,Henze DA,Barrionuevo G,et al.Aspartate and glutamate mediate excitatory synaptic transmission in area CA1 of the hippocampus [J].J Neurosci,1993,13(9):3944-3955.
[18]Radahmadi M,Hosseini N,Nasimi A.Effect of chronic stress on short and long-term plasicity in dentate-gyrus:study of recovery and adaptation[J].Neuroscience,2014,280 :121-129.

