冬凌草乙素通过Wnt/β-catenin信号通路对裸鼠K562细胞移植瘤的抑制作用
史晓贤 李高文
冬凌草为唇形科香茶菜属植物碎米桠[Rabdosiarubescens(Hemsl.)Hara]的干燥地上部分,主要产于河南济源太行山一带,具有抗氧化、抗炎及抗肿瘤等作用[1]。由于其优秀的抗癌功能,冬凌草被誉为“紫杉醇第二”[2]。其中,从冬凌草提取的以冬凌草甲素和冬凌草乙素为代表的贝壳杉烷类二萜化合物已被广泛应用于肿瘤的治疗研究,它们不仅对多种肿瘤有效,与其他化学治疗药物联合使用时可提高疗效,还能起降低毒副作用的功效。新近的研究资料表明,冬凌草乙素不仅能通过诱导结肠癌细胞的G1期和凋亡来发挥其抗肿瘤作用,它还能够诱导胃癌细胞、肝癌细胞以及白血病细胞的凋亡[3-6]。同时,冬凌草乙素可通过诱导线粒体损伤和调节某些凋亡相关基因的变化来诱导肺癌细胞发生凋亡[7]。目前,关于冬凌草乙素对各种肿瘤细胞的抑制作用虽有报道,但其抗肿瘤的体内实验报道极少。本研究旨在进一步有效开发冬凌草素抗肿瘤作用,以皮下接种K562细胞建立裸鼠白血病皮下细胞移植瘤模型,观察不同剂量的冬凌草乙素对裸鼠K562皮下细胞移植瘤生长的抑制效果并探讨其作用机制,为冬凌草乙素的临床开发和应用提供实验理论基础。
材料与方法
一、材 料
BALB/c系裸鼠20只(雌性,4~6周,18~20 g)购自常州卡文斯实验动物有限公司。人慢性髓原白血病细胞K562细胞株购自中国科学院上海细胞生物研究所细胞库,冬凌草乙素(>98%)购自上海纯优生物科技有限公司,羟基脲购自阿拉丁(H106352,CAS号127-07-1),兔单克隆抗体β-链蛋白(β-caterin) (ab32572),兔单克隆抗体细胞周期蛋白D1(cyclin D1)(ab134175),兔单克隆抗体c-myc癌基因(c-myc)(ab32072)购自英国Abcam公司,小鼠单克隆抗体β-actin(AF0003)购自上海碧云天生物技术有限公司,实时荧光定量PCR试剂盒购自宝生物工程(大连)有限公司。
二、荷瘤小鼠模型的建立及分组给药
生长对数期的K562细胞(2.5×107/ml)接种于裸鼠前肢腋下,每只接种 0.2 ml。当肿瘤平均体积达到80~100 mm3时,将20只荷瘤裸鼠随机分为4组:冬凌草乙素低剂量组(40 mg/kg);冬凌草乙素高剂量组(80 mg/kg);阳性对照组:羟基脲(120 mg/kg);模型对照组给予等体积生理盐水。各组动物连续18 d腹腔给药,每日1次。肿瘤体积每3日测量1次,测定肿瘤最长径(a)和最短径(b)并计算各裸鼠肿瘤体积(肿瘤体积=a×b2/2)[8]。绘制各组肿瘤生长曲线并作比较。给药结束后脱臼处死全部动物并迅速剥离出完整的皮下瘤块,称其质量,并计算分析比较各组动物抑瘤率[抑瘤率= (模型对照组平均瘤质量-给药组平均瘤质量)/模型对照组平均瘤质量×100 %][9]。然后将部分瘤组织放入液氮中保存用做分子检测,部分用4%多聚甲醛固定后制备成石蜡切片进行苏木素-伊红(HE)染色。
三、逆转录-PCR(RT-PCR)检测各组肿瘤组织β-caterin、cyclin D1、c-myc的信使RNA
称取约30 mg肿瘤组织块,用Trizol裂解法提取肿瘤组织总 RNA后逆转录合成cDNA,并分别对其进行PCR目的扩增。引物序列及主要反应参数如下:β-caterin: F-AAA GCG GCT GTT AGT CAC TGG;R-CGA GTC ATT GCA TAC TGT CCA T; c-myc: F-GGC TCC TGG CAA AAG GTC A; R-CTG CGT AGT TGT GCT GAT GT; cyclin D1: F-GCT GCG AAG TGG AAA CCA TC; R-CCT CCT TCT GCA CAC ATT TGA A; β-actin: F-CAT GTA CGT TGC TAT CCA GGC; R-CTC CTT AAT GTC ACG CAC GAT。荧光定量PCR结果判定: △Ct= Ct目的基因-Ct内参,△△Ct=△Ct处理组-△Ct对照组, RQ(Relative Quantitation)处理组=2-△△Ct,其中模型对照组RQ值设为1。以GAPDH为内参,依据2-△△Ct法计算各信使RNA的相对表达量[10]。
四、蛋白免疫印迹法检测各组肿瘤组织β-caterin、cyclin D1、c-myc蛋白表达
称取50 mg新鲜肿瘤组织提取其总蛋白质,十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)分离蛋白,电泳条件为:60 V、30 min,120 V、90 min。待电泳结束后采用湿转法将其转移至聚偏二氟乙烯膜(PVDF),用5%牛血清白蛋白(BSA)室温下脱色摇床上摇动封闭1 h后,加入合适浓度的一抗(β-caterin、cyclin D1、c-myc、内参抗体β-actin工作浓度均为1∶1 000),4 °C孵育过夜。之后用TBST在室温下脱色摇床上洗3次,每次5 min后加入辣根过氧化物酶(HRP)标记的二抗稀释液于37°C孵育1 h;TBST洗膜结束后采用辣根过氧化物酶增强化学发光法(HRP-ECL)进行显色、曝光,最后使用图像分析软件定量分析阳性蛋白的表达。
五、统计学处理
结 果
一、冬凌草乙素对裸鼠白血病K562皮下细胞移植瘤生长情况的影响
如表1所示,4组荷瘤裸鼠治疗前和治疗后的体质量均差异不大,比较差异无统计学意义(P均>0. 05),见表1。如图1和表2所示,进一步分析肿瘤生长曲线发现,冬凌草乙素给药后肿瘤体积增长速度降低,用药结束后肿瘤体积显著小于模型对照组,尤其是冬凌草乙素高剂量组。同时对比冬凌草乙素高剂量组与阳性对照组发现,2组动物抑瘤率效果相当,比较差异无统计学意义(P>0.05)。综合分析瘤质量及抑瘤率数据,表明冬凌草乙素能有效抑制K562细胞移植瘤的生长。
表1 冬凌草乙素对接种K562细胞裸鼠体质量的影响

组 别剂量(mg/kg)体质量(g)用药前用药后模型对照组⁃1933±0452456±072冬凌草乙素低剂量组402041±0562271±056冬凌草乙素高剂量组801993±0622315±045阳性对照组1202072±0492324±059F值20771827P值01800220

图1 冬凌草乙素对裸鼠K562细胞皮下移植瘤体积的影响
A:肿瘤大体图; B:各组的肿瘤体积随时间的变化趋势
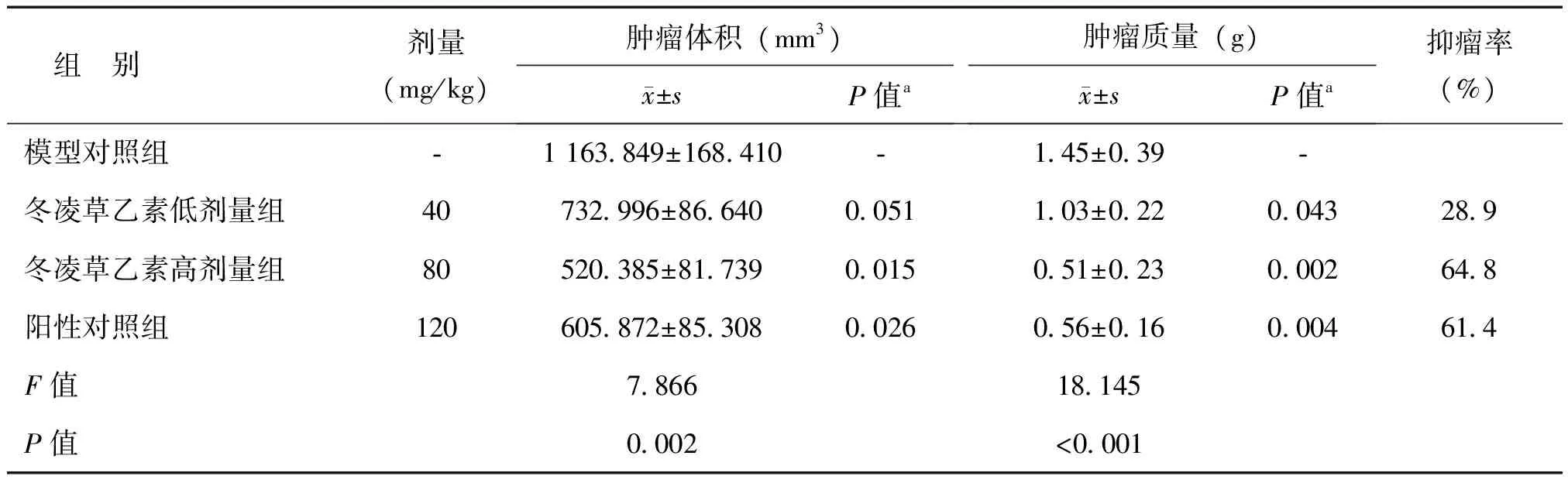
表2 冬凌草乙素对裸鼠K562细胞皮下移植瘤的生长抑制作用
注:a为与模型对照组比较的P值
二、冬凌草乙素对裸鼠白血病K562皮下细胞移植瘤组织病理情况的影响
光镜下所见凋亡一般累及单个或少数几个细胞,凋亡细胞呈圆形,胞浆红染,细胞核染色质聚集成团块状,由于凋亡细胞迅速被吞噬,又无炎症反应,因此在常规切片检查时一般不易发现。结果如图2所示,光镜检测发现模型对照组瘤组织中癌细胞核大且包膜基本保持完整,胞内染色质排列整齐、分布均匀,坏死组织部分极少(图2A);冬凌草乙素低剂量组能明显抑制肿瘤细胞体积,出血坏死较模型对照组增多且可见核分裂(图2B);冬凌草乙素高剂量组肿瘤组织可见大片无结构的坏死红染区域,呈透明样(图2C);阳性对照组少见核分裂,瘤组织出血坏死现象较为广泛且肿瘤细胞体积变小明显(图2D),治疗效果与冬凌草乙素高剂量组相差不大。

图2 光镜观察K562皮下细胞移植瘤组织(HE染色,×100)
三、肿瘤组织中 β-caterin、cyclin D1、c-myc 信使RNA 的表达
与模型对照组相比,冬凌草乙素各用药组和羟基脲组肿瘤组织β-caterin、cyclin D1、c-myc 信使RNA表达水平明显降低,其中冬凌草乙素高剂量组效果更显著,与阳性对照组相差不大,见表3。
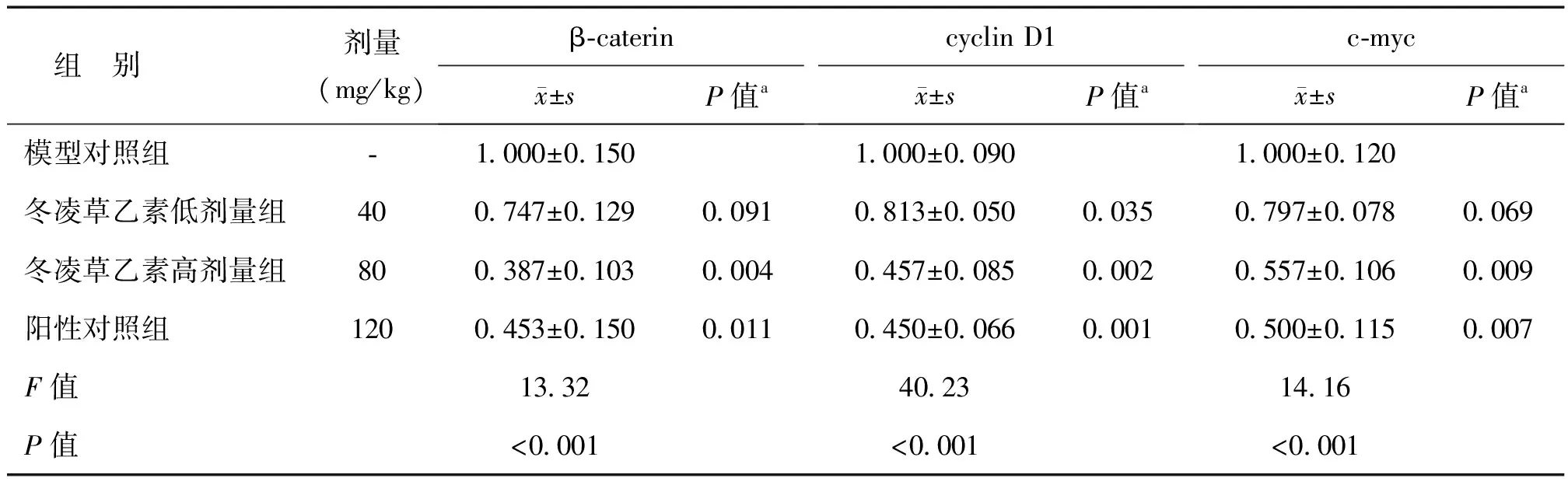
表3 模型对照组、冬凌草乙素低及高剂量组、阳性对照组β-caterin、cyclin D1、c-myc信使RNA水平
注:a为与模型对照组比较的P值
四、肿瘤组织中β-caterin、cyclin D1、c-myc蛋白的表达
进一步检测各组瘤组织中β-caterin、cyclin D1、c-myc的蛋白表达水平,发现其蛋白表达与信使RNA呈相同的趋势。与模型对照组相比,各给药组肿瘤组织β-caterin、cyclin D1、c-myc表达均下降,各剂量组间存在明显的剂量依赖。其中冬凌草乙素高剂量组抑制最强,β-caterin、cyclin D1、c-myc表达水平分别下降了53%、48%、67%。阳性对照组与冬凌草乙素高剂量组抑制率相差不大,均体现了极强的抑制作用,见表4、图3。
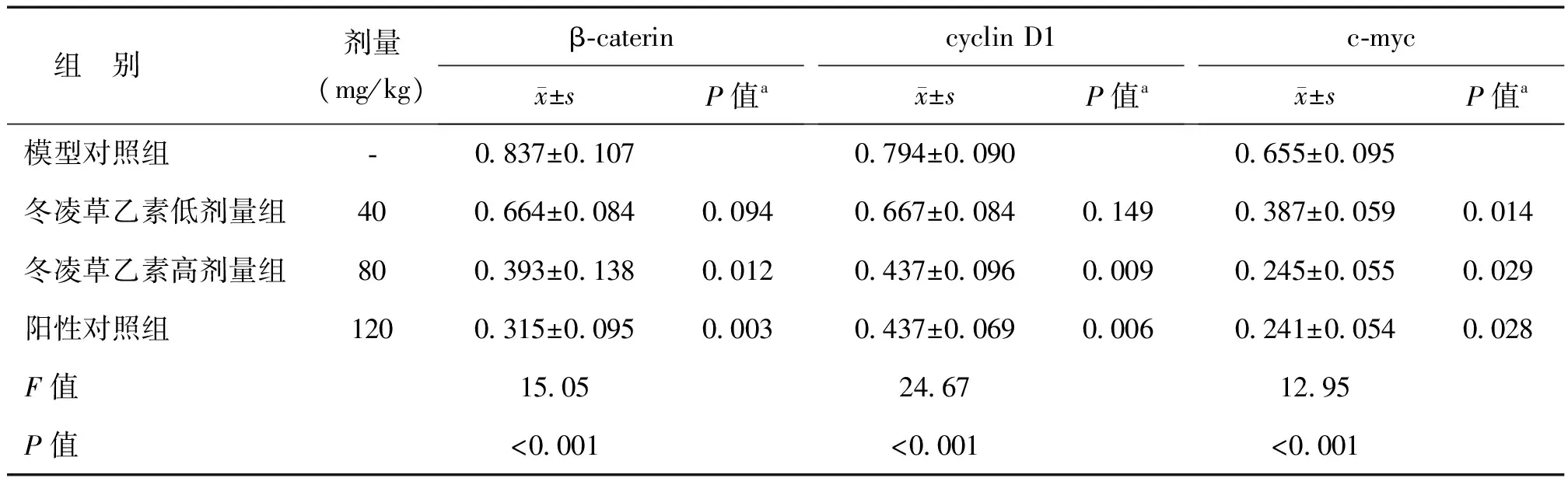
表4 模型对照组、冬凌草乙素低及高剂量组、阳性对照组β-caterin、cyclin D1、c-myc蛋白灰度值
注:a为与模型对照组比较的P值
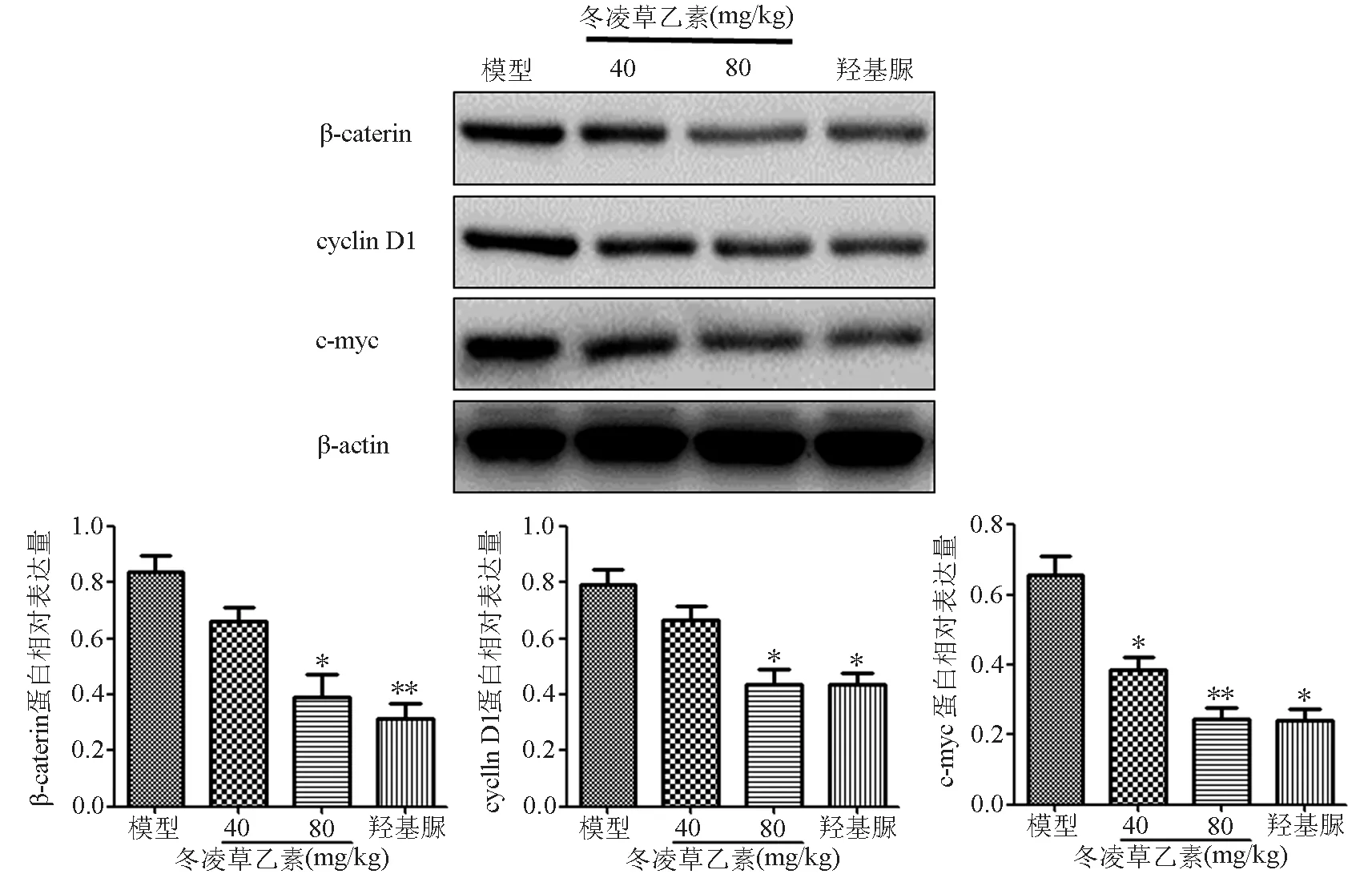
图3 冬凌草乙素对K562皮下细胞移植瘤组织β-caterin、cyclin D1和c-myc蛋白表达的影响
与模型对照组相比,*为P<0.05,**为P<0.01
讨 论
现已证实冬凌草对多种肿瘤细胞呈现较高的抑瘤作用,并且其对肿瘤细胞的细胞毒作用具有选择性且毒性低。此外,复方PC-SPES(由冬凌草等七味中草药组成)在北美地区已作为治疗前列腺癌的替代制剂为广大患者所接受[8]。作为冬凌草提取物中主要的抗癌活性成分,冬凌草甲素与冬凌草乙素具有相似的药理活性,不仅能抗突变,抑制肿瘤细胞的生长,还能使肿瘤细胞的耐药性逆转,提高抗肿瘤药的药效,从而起到抗癌作用。
作为当今肿瘤领域国际研究的一大热点,Wnt/β-catenin信号转导通路分子作为抗肿瘤治疗靶点已引起众多肿瘤和药物研究者的极大兴趣[9]。此信号通路是一种在多细胞动物体内广泛存在且作用机制已被研究得相对清楚的高度保守信号通路,它与细胞的多项生理进程密切相关,如细胞增殖、分化、凋亡以及自我更新。肿瘤疾病的发生机制可能与Wnt/β-catenin信号转导通路异常活化有关,这与该通路中某些基因的沉默、缺少或是突变密切相关[10-12]。作为Wnt/β-catenin信号通路中的关键调控因子之一,β-catenin如在细胞核内表达增加,其可通过激活下游途径引起某些特定靶基因的转录,从而引发肿瘤等疾病。Wnt基因家族是小分子量分泌型糖蛋白,具有高度保守性,由19种基因型构成,350~400个氨基酸编码组成半胱氨酸残基,不仅能调节干细胞的分化,还能在细胞增殖和凋亡等生理进程中发挥作用[13-15]。β-catenin 基因是Wnt/β-catenin通路的主要调控靶点,而cyclin D1、c-myc是Wnt/β-catenin信号通路的下游靴基因[16]。
本课题组通过比较阳性药羟基脲和高、低剂量冬凌草乙素对K562皮下细胞移植瘤模型的治疗作用,发现高剂量冬凌草乙素的抑瘤效果优于低剂量组,且与羟基脲作用相当,说明冬凌草乙素对于K562肿瘤的确有明显的抑制作用,且具有剂量依赖性。不仅如此,通过分析用药期间裸鼠体质量的变化,我们还发现即使给予很大浓度的冬凌草乙素,毒性作用依然很低,并没有相应增加。这些结果与大量前期对冬凌草乙素的体外研究不谋而合,刘家军等[12]发现冬凌草乙素在体外能使Caspase-3和Caspase-9活化,从而抑制K562肿瘤细胞。
同时,本研究的HE染色结果显示冬凌草乙素给药处理组裸鼠肿瘤细胞出现明显的凋亡和坏死现象。实时荧光定量PCR和蛋白免疫印迹结果显示,与模型对照组相比,冬凌草乙素组肿瘤组织β-caterin、cyclin D1和c-myc信使RNA的表达明显下调;与模型对照组相比,冬凌草乙素各剂量处理组均能下调肿瘤组织中的β-caterin、cyclin D1和c-myc蛋白表达。由此,我们猜测冬凌草乙素是通过影响Wnt/β-catenin信号通路来发挥对K562细胞的抑制作用。本研究为冬凌草乙素在慢性髓系白血病治疗中的应用提供了分子基础和理论依据。
[1] 高世勇,王珑. 冬凌草的化学和药理作用研究. 哈尔滨商业大学学报(自然科学版), 2014,30(1):1-6.
[2] 徐铮奎. 冬凌草有望成为“紫杉醇第二”. 中国现代中药, 2007, 9(8):43-45.
[3] Du J, Chen C, Sun Y, Zheng L, Wang W. Ponicidin suppresses HT29 cell growth via the induction of G1 cell cycle arrest and apoptosis. Mol Med Rep, 2015, 12(4):5816-5820.
[4] Liu YF, Lu YM, Qu GQ, Liu Y, Chen WX, Liao XH, Kong WM. Ponicidin induces apoptosis via JAK2 and STAT3 signaling pathways in gastric carcinoma. Int J Mol Sci, 2015, 16(1):1576-1589.
[5] Zhang JF, Liu PQ, Chen GH, Lu MQ, Cai CJ, Yang Y, Li H. Ponicidin inhibits cell growth on hepatocellular carcinoma cells by induction of apoptosis. Dig Liver Dis, 2007, 39(2):160-166.
[6] Liu JJ, Zhang Y, Guang WB, Yang HZ, Lin DJ, Xiao RZ. Ponicidin inhibits monocytic leukemia cell growth by induction of apoptosis. Int J Mol Sci, 2008, 9(11):2265-2277.
[7] Liu JJ, Huang RW, Lin DJ, Peng J, Zhang M, Pan X, Hou M, Wu XY, Lin Q, Chen F. Ponicidin, an ent-kaurane diterpenoid derived from a constituent of the herbal supplement PC-SPES, Rabdosia rubescens, induces apoptosis by activation of caspase-3 and mitochondrial events in lung cancer cells in vitro. Cancer Invest, 2006, 24(2):136-148.
[8] Bi D, Yang M, Zhao X, Huang S. Effect of cnidium lactone on serum mutant P53 and BCL-2/BAX expression in human prostate cancer cells PC-3 tumor-bearing BALB/C nude mouse model. Med Sci Monit, 2015, 21: 2421-2427.
[9] 王云飞, 顾政一, 聂勇战, 韩亚楠, 魏彦玲, 金治安. 贝母素乙增强阿霉素对胃癌多药耐药裸鼠移植瘤的抑制作用及其机制研究. 中草药, 2014, 45(5):686-690.
[10] 黄庆, 邹旻红, 邓伟雄, 罗时敏, 焦兴元, 曹杰. Tgf-p诱导肝癌细胞向肿瘤干细胞分化的研究. 新医学, 2017,48(7): 449-454.
[11] Zhong Y, Lin Y, Shen S, Zhou Y, Mao F, Guan J, Sun Q. Expression of ALDH1 in breast invasive ductal carcinoma: an independent predictor of early tumor relapse. Cancer Cell Int, 2013,13(1):60. Meade-Tollin LC, Wijeratne EM, Cooper D, Guild M, Jon E, Fritz A, Zhou GX, Whitesell L, Liang JY, Gunatilaka AA. Ponicidin and oridonin are responsible for the anti-angiogenic activity of Rabdosia rubescens, a constituent of the herbal supplement PC SPES. J Nat Prod, 2004, 67(1):2-4.
[12] 李天晓, 元刚, 叶丽君, 孙健, 黎曙霞. 棉酚衍生物apog2诱导胃癌细胞凋亡及对wnt6调控作用的研究.新医学,2014,45(6):359-363.
[13] Van Zuylen WJ, Rawlinson WD, Ford CE. The Wnt pathway: a key network in cell signalling dysregulated by viruses. Rev Med Virol, 2016, 26(5):340-355.
[14] Carotenuto P, Fassan M, Pandolfo R, Lampis A, Vicentini C, Cascione L, Paulus-Hock V, Boulter L, Guest R, Quagliata L, Hahne JC, Ridgway R, Jamieson T, Athineos D, Veronese A, Visone R, Murgia C, Ferrari G, Guzzardo V, Evans TRJ, MacLeod M, Feng GJ, Dale T, Negrini M, Forbes SJ, Terracciano L, Scarpa A, Patel T, Valeri N, Workman P, Sansom O, Braconi C. Wnt signalling modulates transcribed-ultraconserved regions in hepatobiliary cancers. Gut, 2016, doi: 10.1136/gutjnl-2016-312278.
[15] Liu JJ, Huang RW, Lin DJ, Wu XY, Lin Q, Peng J, Pan X, Song YQ, Zhang MH, Hou M, Chen F. Antiproliferation effects of ponicidin on human myeloid leukemia cells in vitro. Oncol Rep, 2005, 13(4):653-657.

