CRISPR/Cas9基因编辑技术在肿瘤免疫治疗中的应用①
龚晨雨 陈 昭 邵红伟 张文峰
(广东药科大学生命科学与生物制药学院/广东省生物技术候选药物研究重点实验室,广州 510006)
肿瘤免疫治疗是指通过增强效应细胞的杀伤能力,同时阻断或减少调节性免疫细胞对肿瘤的庇护,从而控制和杀伤肿瘤细胞[1]。早在100多年前,随着免疫学基础研究的发展,科学家就提出了用自身免疫功能杀死肿瘤细胞来治疗肿瘤的设想。肿瘤免疫疗法始于1981年,Coley等[2]用灭活的脓链球菌与黏质沙雷氏菌的过滤混合物来治疗肿瘤并取得了成功。在20世纪中期,Burnet等[3]和Thomas等[4]提出了“肿瘤的免疫监视”理论,认为免疫系统可以识别并清除机体中出现的突变肿瘤细胞,奠定了肿瘤免疫治疗的基础。随着免疫系统与肿瘤之间相互作用的深入研究,肿瘤免疫治疗在黑色素癌、肺癌、胃癌等多类癌症中都取得令人振奋的临床进展。近年来CRISPR/Cas9基因编辑技术的兴起和广泛应用为肿瘤免疫治疗研究带来了新的发展机遇。
1 CRISPR/Cas9基因编辑技术在肿瘤免疫治疗中的应用
CRISPR/Cas9(Clustered Regularly Interspaced Short Palindromic Repeat/CRISPR- associated nuclease 9)基因编辑系统是来源于细菌和古生菌的一种获得性免疫系统,可以有效地对gRNA(Guide RNA)介导的特定位点DNA进行编辑。Cas9蛋白具有核酸内切酶的功能,它首先与一个gRNA结合,在gRNA序列的引导下可以结合到DNA靶标位置,该位置通常在PAM(Protospacer Adjacent Motif)位点的上游,然后切割目标DNA导致双链断裂(Double- Strand Break,DSB),真核细胞的DSB修复包括同源重组修复(Homology- directed repair,HDR)和非同源末端连接(Non- homologous end joining,NHEJ)两种途径,NHEJ修复可能导致错误修复以及碱基的插入缺失,从而造成移码突变灭活靶基因,达到敲除靶基因的目的(图1)。因相比锌指核酸酶(Zinc finger nuclease,ZFN)技术和转录激活因子样效应物核酸酶(Transcription activator- like effector nucleases,TALENs)技术具有设计简单、操作简便等优点,已广泛应用于不同类型的基因编辑[5- 7],CRISPR/Cas9在肿瘤免疫治疗中也发挥了重要作用。
1.1在免疫检查点阻断疗法中的应用 程序性死亡分子PD- 1和细胞毒T淋巴细胞相关抗原4(Cytotoxic T lymphocyte- associated antigen- 4,CTLA- 4)等免疫检查点的表达变化会影响T细胞活化,并帮助肿瘤细胞发生免疫逃逸,导致T细胞治疗效果不理想。利用针对免疫检查点的阻断抗体可阻断这些免疫负调节物对T细胞免疫应答的抑制作用,能有效提高T细胞的免疫功能,从而发挥更好的抗肿瘤功能。
除了传统的利用人源化单克隆抗体来阻断免疫检查点之外,利用CRISPR/Cas9基因编辑技术对免疫负调节的基因进行敲除破坏也可以简单有效地达到同样的治疗效果,为免疫检查点的阻断提供了一个新的方法。例如利用电穿孔的方法将Cas9和sgRNA导入原代T细胞中敲除PD- 1基因[9],可导致PD- 1的表达明显减少,并且在长时间的体外培养过程中没有发现对T细胞活性及增殖能力产生影响;PD- 1基因的敲除消除了对T细胞的抑制,从而更好地发挥抗肿瘤作用。这种新的阻断方法通常与过继性T细胞免疫疗法联合使用,可以增强免疫细胞的活性,例如Ren等[10]利用CRISPR/Cas9快速、高效地对CAR- T细胞进行多基因编辑 ,通过这种方法得到包括免疫检查点PD- 1和CTLA- 4在内的多基因敲除CAR- T细胞,效应T细胞中PD- 1和CTLA- 4参与的抑制性通路被有效阻断,成功提高CAR- T细胞的反应性,从而取得更好的抗肿瘤效果。
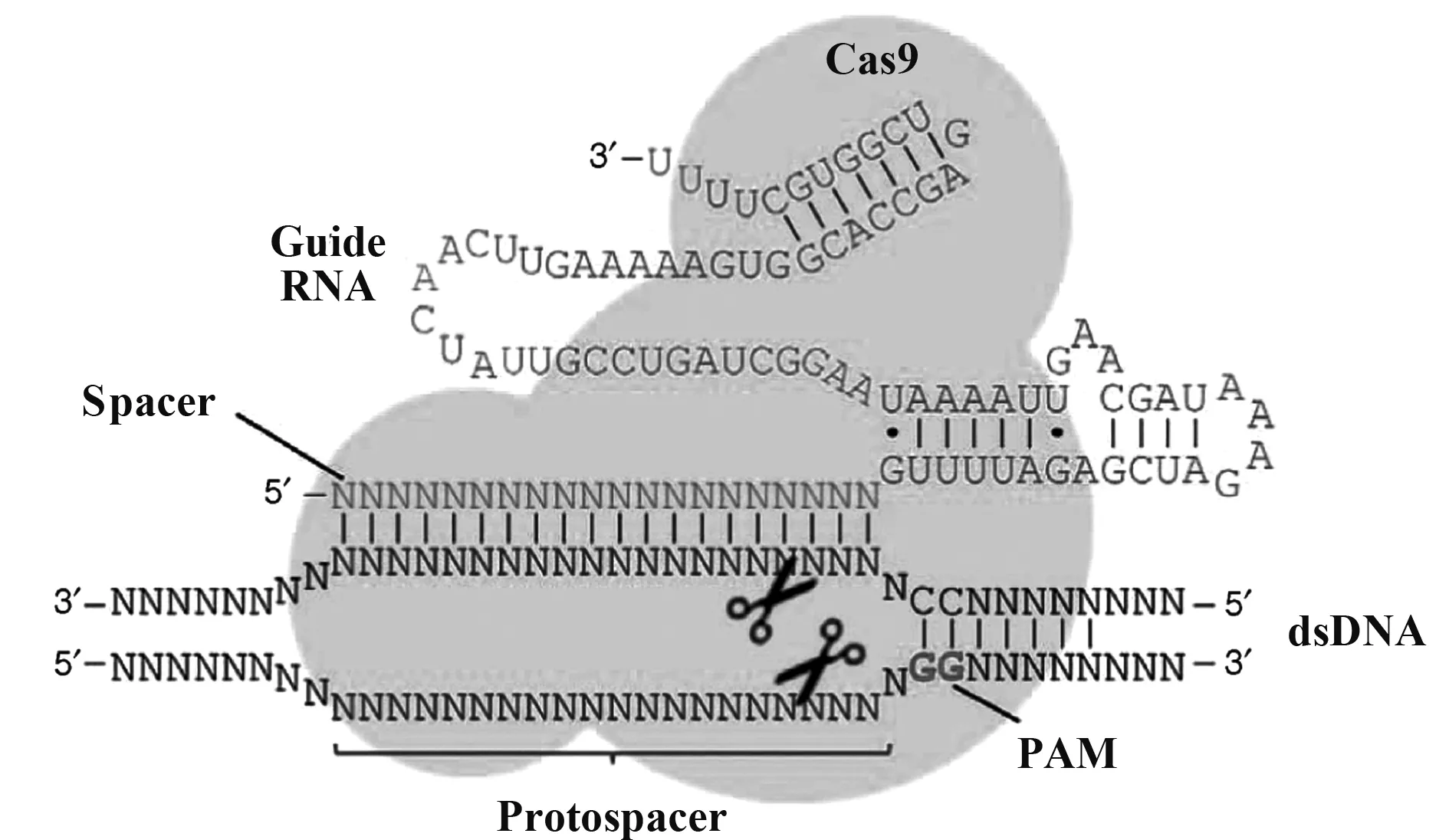
图1 化脓性链球菌Cas9- sgRNA复合物参与RNA介导的真核基因组编辑的基本构成[8]Fig.1 Basic constitution of S.pyogenes Cas9- sgRNA complex for participating in RNA mediated eukaryotic genome editing[8]
1.2在过继性细胞治疗中的应用 过继性细胞治疗是一种被动免疫治疗,即在体外刺激、扩增和激活免疫细胞并回输患者体内,以直接或间接杀伤肿瘤细胞。其中利用非特异性免疫细胞进行的过继性细胞免疫治疗,包括LAK疗法、NK疗法及CIK疗法[11- 13]。
肿瘤浸润细胞(Tumor infiltrating lymphocyte,TIL)疗法是肿瘤抗原特异性T细胞治疗中的重要组成部分[14]。DC的抗原提呈能力也大大提高了DC- TIL和DC- CIK疗法的肿瘤特异性杀伤效果[15]。近年来,外源基因修饰的T细胞过继性疗法,例如特异性T细胞受体修饰的T细胞治疗(TCR- T)和嵌合抗原受体修饰的T细胞治疗(CAR- T)在抗肿瘤治疗的临床研究中均取得了振奋人心的效果,成为肿瘤过继性治疗研究的新方向[16],它们的共同点是在T细胞表面表达特异识别肿瘤细胞的受体并介导发生针对靶细胞的免疫应答。
在TCR- T细胞治疗中,由于存在内源和外源两种TCR分子,这种情况容易形成杂合TCR分子(内源α链与外源β链或内源β链与外源α链配对),从而可能导致自身免疫性疾病的发生,有效减少杂合TCR分子的形成一直以来都是TCR- T治疗中需要解决的关键问题。利用CRISPR/Cas9基因编辑技术在T细胞中敲除内源性TCR基因可为避免杂合TCR分子形成提供一种简单有效的方法。本实验室一直致力于肿瘤免疫治疗的研究,我们前期成功筛选到针对Survivin点突变抗原肽(H80M)特异性TCRVα4和Vβ7基因,该TCR基因修饰T细胞后显示出有效的肿瘤识别和杀伤作用[17]。我们欲进一步通过CRISPR/Cas9系统敲除内源TCR基因,再用肿瘤特异性TCR进行修饰,目前已成功构建靶向TCR分子β链C区(TRBC)的CRISPR/Cas9编辑系统,并成功破坏内源TCR基因[18]。
目前在CAR- T细胞治疗中,主要通过分离患者自身的T细胞进行个体化回输,因受到分离T细胞的数量和异体排斥的影响,不利于大规模临床应用,利用CRISPR/Cas9基因编辑技术构建健康人来源的通用型T细胞则可避免这种限制(图2)。Ren等[19]发现把内源性TCR基因敲除的同种异体T细胞作为通用效应细胞,在不影响CAR- T治疗效果同时可有效避免移植物抗宿主病(GVHD)的出现。进一步结合病毒载体递送嵌合抗原受体基因和电转CRISPR编辑系统的方法,向健康志愿者的T细胞中导入靶向内源性TCR、β2微球蛋白(B2M)以及PD- 1的多个sgRNA,得到TCR、HLA Ⅰ类分子和PD- 1表达缺陷的同种异体CAR- T细胞,其表现出高效的体内抗肿瘤活性,同时有效减少了宿主机体对CAR- T细胞的免疫排斥和CAR- T细胞对宿主的排斥。通用效应T细胞的构建极大促进了T细胞治疗产业化的进程。
1.3在抗体靶向疗法中的应用 肿瘤细胞表面表达了一些异于正常细胞的抗原,这些抗原可作为单克隆抗体识别的靶点,针对这些靶点的抗体可引起肿瘤细胞的死亡达到抗肿瘤目的,目前FDA已批准的抗体类药物有抗EGFR抗体、抗HER2抗体、抗VEGF抗体、抗CD20抗体等。
CRISPR/Cas9基因编辑技术可以用来鉴定和验证肿瘤细胞表面的潜在靶点,进一步发展抗体靶向治疗。Steinhart等[20]利用CRISPR- Cas9基因编辑技术在含有RNF43突变的胰腺导管腺癌细胞中进行全基因组筛选,发现Frizzled- 5受体在促进胰腺癌细胞生长中发挥关键作用;利用特异性结合Frizzled- 5的抗体能够在荷瘤小鼠中明显抑制胰腺导管腺癌细胞生长,对肿瘤患者来源的RNF43突变胰腺导管腺癌细胞的增殖也存在显著抑制作用,表明Frizzled- 5有可能成为免疫治疗药物的新靶点。
CRISPR/Cas9基因编辑技术在抗体的制备中也发挥重要作用。根据抗体重链C区氨基酸组成的差异,对应的抗体可分为IgG、IgA、IgM、IgD和IgE五类,每类抗体在激活补体系统、触发效应细胞对靶细胞的杀伤作用即抗体依赖的细胞介导的细胞毒作用(Antibody dependent cell- mediated cytotoxicity,ADCC)存在着差异,在肿瘤的抗体靶向治疗中有着不同应用。抗体类型转换是抗体多样化中的重要一环,B细胞特异性胞苷去氨酶(Activation- induced dea minase,AID)起始了抗体类型转换过程,Ig基因发生类别转换重组(Class switch recombination ,CSR)最关键的步骤是DNA的双链断裂,通常情况下双链断裂是由B细胞特异性酶如重组激活基因蛋白1/2(RAG 1/2)和AID启动。哈佛医学院的Cheong等[21]首次利用CRISPR/Cas9技术成功编辑了小鼠和人的免疫球蛋白(Ig)基因,研究者用CRISPR/Cas9介导IgM+小鼠B细胞、杂交瘤细胞以及人类B细胞的免疫球蛋白重链恒定区基因高效快速地产生双链断裂,促使发生类别转换重组,实现从IgM到IgG再到IgA的抗体类别转换。因此基于CRISPR/Cas9基因编辑技术,可以针对B细胞或杂交瘤细胞重链恒定区基因进行靶向编辑,从而简单高效地获得特定类型的抗体。
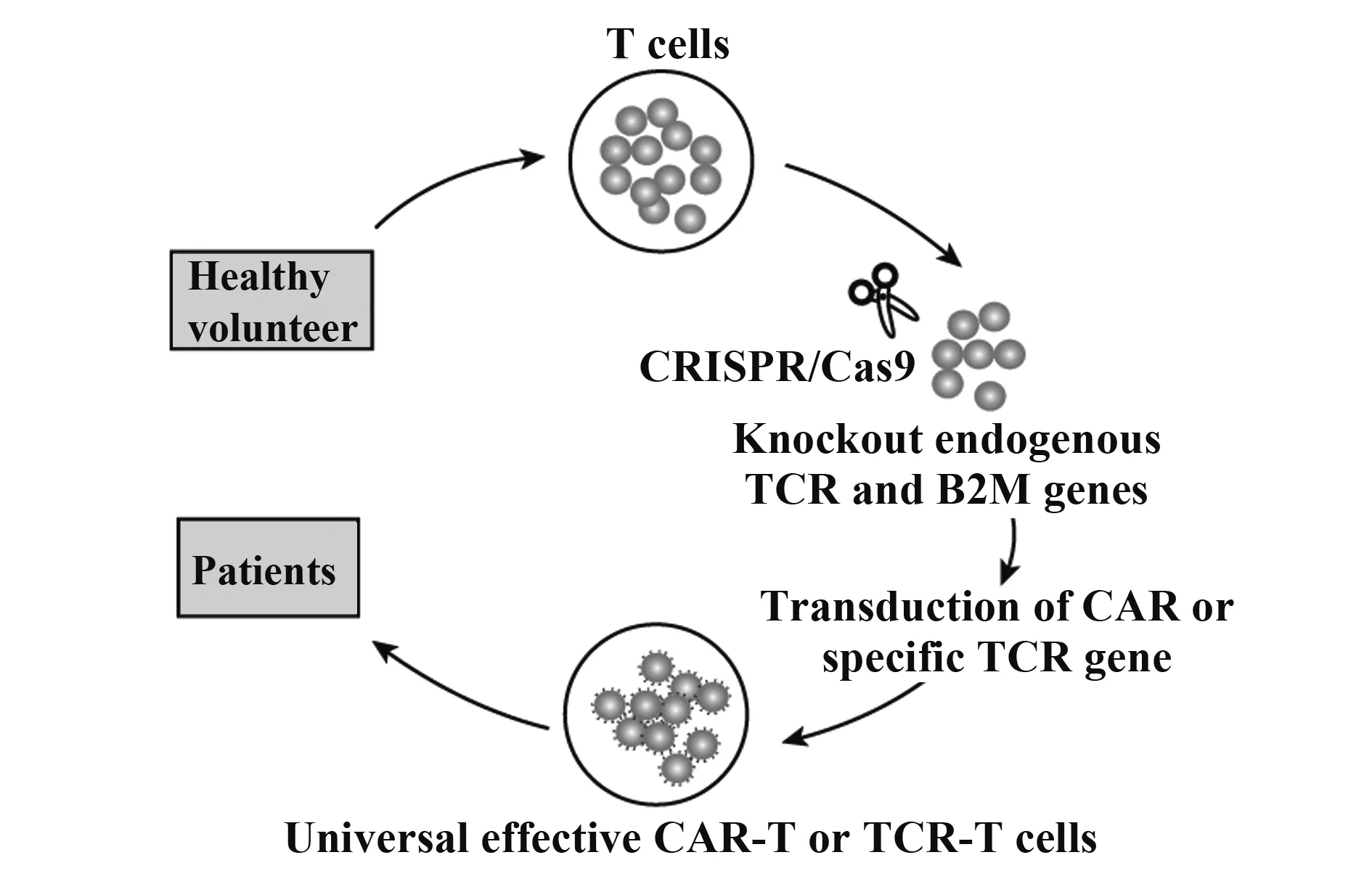
图2 通用效应T细胞用于过继性细胞治疗Fig.2 Universal effective T cells for adoptive cell therapy
抗体的抗原结合片段(Fragment of antigen binding,Fab)因其分子量小、更易渗透肿瘤组织、容易与其他药物偶联等优点,在肿瘤的抗体靶向治疗中有着更广泛的应用。研究人员目前已利用CRISPR删除小鼠杂交瘤细胞IgH的Fc段编码区基因,得到只分泌抗体Fab片段的杂交瘤细胞,这种方法极大地简化了目前基于蛋白酶切割和纯化得到目的Fab片段的复杂工艺(图3)。

图3 CRISPR- Cas9介导小鼠杂交瘤细胞生产Fab片段[21]Fig.3 Generation of Fab fragments by CRISPR- Cas9 system in mouse hybridomas[21]
2 展望
CRISPR/Cas9基因编辑技术因其操作简单、快速、高效等优点逐渐被许多研究者们作为基因编辑的首选方法,在肿瘤免疫治疗中可用来达到敲除内源性基因、促使基因发生重排等目的。但是CRISPR/Cas9基因编辑技术应用于肿瘤免疫治疗的临床应用中还存在着诸多待完善的问题。首先是CRISPR/Cas9系统在免疫细胞中的递送效率问题。脂质体法、磷酸钙法等常规方法难以实现针对免疫细胞的高效转染,目前常用电穿孔法将CRISPR/Cas9质粒转入目的细胞,但是电穿孔对细胞的损伤很大,电转处理后细胞的活力也会降低,对于免疫细胞来说回输体内后达不到理想的治疗效果。病毒载体如慢病毒载体、逆转录病毒载体和腺病毒载体在体外转染中应用比较多,考虑到逆转录病毒载体、慢病毒载体整合免疫细胞染色体带来的致瘤风险,腺病毒载体因具有较高的安全性及较好的转染效率等优点,在肿瘤的免疫治疗中具有广泛应用前景。近期Stephan博士开发出可传递CAR编码基因的生物降解纳米颗粒,从而实现CAR基因的体内转染,相比较传统的CAR- T制备过程,该方法要显得更为简单安全、艰巨而耗时的T细胞编程步骤都是在体内发生[22]。在未来的免疫细胞治疗中,可研发T细胞靶向性病毒载体,利用其介导TCR或CAR基因直接血液给药,从而实现TCR- T或CAR- T的治疗。
肿瘤过继性免疫细胞治疗中另一个影响治疗效果的重要因素即靶细胞的选择,例如T细胞具有高度异质性,TCR基因或CAR基因导入不同T细胞亚群的抗肿瘤效果存在明显差异,其中幼稚性T细胞(TN)、干细胞样记忆性T细胞(TSCM)和中枢记忆性T细胞(TCM)表现出更强的抗肿瘤活性和更长的存活时间[23,24]。因此在未来的免疫细胞治疗中,可将CRISPR/Cas9基因编辑技术与靶向性病毒载体结合,实现在以上这些细胞亚群的有效基因编辑,进一步提高临床治疗效果。
脱靶问题一直以来是阻碍CRISPR/Cas9临床应用的重要因素之一,研究者们在这一领域也做了许多努力来降低脱靶效率,例如对Cas9进行突变获得只具有单切口酶活性的dCas9[25],这种由两条sgRNA控制靶向切割DNA形成双链断裂的方法可极大地降低脱靶率。类似地,将野生型SpCas9其中4个氨基酸进行替换得到的高保真Cas9(SpCas9- HF1),能将全基因组脱靶率降低到目前最低检出限以下[26]。另外,研究表明Cas9蛋白在靶细胞中长时间高强度的表达会明显增加CRISPR/Cas9系统的脱靶效率,通过设计光照可逆调控Cas9的活性,从而有效减少Cas9蛋白的非特异性切割,降低了脱靶效率[27]。
综上所述,CRISPR/Cas9基因编辑技术在肿瘤免疫治疗中担任了很重要的角色,我们可以期待这一编辑系统的进一步完善从而在临床上发挥更出色的应用。
[1] 龚非力.医学免疫学[M].第3版.北京:科学出版社,2012:352- 353.
Gong FL.Medical Immunology[M].Third Edition.Beijing:Science Press,2012:352- 353.
[2] Coley WB.Contribution to the knowledge of sarcoma [J].Ann Surg,1891,14(3):199- 220.
[3] Burnet FM.Immunological aspects of malignant disease [J].Med J Aust,1967,1(7501):1171- 1174.
[4] Anguille S,Smits EL,Bryant C,etal.Dendritic cells as pharmacological tools for cancer immunotherapy [J].Pharmacol Rev,2015,67(4):731- 753.
[5] Pelletier S,Gingras S,Green DR.Mouse genome engineering via CRISPR- Cas9 for study of immune function [J].Immunity,2015,42(1):18- 27.
[6] Sander JD,Joung JK.CRISPR- Cas systems for editing,regulating and targeting genomes [J].Nat Biotechnol,2014,32(4):347- 355.
[7] Ran FA,Hsu PD,Wright J,etal.Genome engineering using the CRISPR- Cas9 system [J].Nat Protoc,2013,8(11):2281- 2308.
[8] Mali P,Esvelt KM,Church GM.Cas9 as a versatile tool for engineering biology [J].Nat Methods,2013,10(10):957- 963.
[9] Su S,Hu B,Shao J,etal.CRISPR- Cas9 mediated efficient PD- 1 disruption on human primary T cells from cancer patients[J].Sci Rep,2016,6:20070.
[10] Ren J,Zhang X,Liu X,etal.A versatile system for rapid multiplex genome- edited CAR T cell generation [J].Oncotarget,2017,8(10):17002- 17011.
[11] Grimm EA,Gorelik E,Rosenstein MM,etal.The lymphokine- activated killer cell phenomenon:In vitro and in vivo studies[J].Cell Immunol,1982,70(2):409- 409.
[12] Schmidt- Wolf IG,Negrin RS,Kiem HP,etal.Use of a SCID mouse/human lymphoma model to evaluate cytokine- induced killer cells with potent antitumor cell activity.[J].J Exp Med,1991,174(1):139- 149.
[13] Schmidtwolf IGH,Finke S,Trojaneck B,etal.Phase I clinical study applying autologous immunological effector cells transfected with the interleukin- 2 gene in patients with metastatic renal cancer,colorectal cancer and lymphoma[J].Br J Cancer,1999,81(6):1009- 1016.
[14] Rosenberg SA,Spiess P,Lafreniere R.A new approach to the adoptive immunotherapy of cancer with tumor- infiltrating lymphocytes[J].Science,1986,233:1318- 1321.
[15] Rosenberg SA,Restifo NP,Yang JC,etal.Adoptive cell transfer:a clinical path to effective cancer immunotherapy[J].Nat Rev Cancer,2008,8(4):299- 308.
[16] Merhavi- Shoham E,Itzhaki O,Markel G,etal.Adoptive cell therapy for metastatic melanoma [J].Cancer J,2017,23(1):48- 53.
[17] Shao H,Lin Y,Wang T,etal.Identification of peptide- specific TCR genes by in vitro peptide stimulation and CDR3 length polymorphism analysis [J].Cancer Lett,2015,363(1):83- 91.
[18] 邵红伟,陈 辉,彭 鑫,等.CRISPR- Cas9系统定向编辑TCR基因的sgRNA筛选 [J].集美大学学报(自然版),2015,20(4):265- 270.
Shao HW,Chen H,Peng X,etal.SgRNA screening of directed edited TCR gene in CRISPR-Cas9 system[J].Jimei University (Natural Edition),2015,(4):265- 270.
[19] Ren J,Liu X,Fang C,etal.Multiplex Genome Editing to Generate Universal CAR T Cells Resistant to PD1 Inhibition [J].Clin Cancer Res,2016,23(9):2255- 2266.
[20] Steinhart Z,Pavlovic Z,Chandrashekhar M,etal.Genome- wide CRISPR screens reveal a Wnt- FZD5 signaling circuit as a druggable vulnerability of RNF43- mutant pancreatic tumors [J].Nat Med,2017,23(1):60- 68.
[21] Cheong TC,Compagno M,Chiarle R.Editing of mouse and human immunoglobulin genes by CRISPR- Cas9 system [J].Nat Commun,2016,7:10934.
[22] Smith TT,Stephan SB,Moffett HF,etal.In situ programming of leukaemia- specific T cells using synthetic DNA nanocarriers [J].Nat Nanotechnol,2017,12(8):813- 820.
[23] Restifo NP,Dudley ME,Rosenberg SA.Adoptive immunotherapy for cancer:harnessing the T cell response [J].Nat Rev Immunol,2012,12(4):269- 281.
[24] Gattinoni L,Klebanoff CA,Restifo NP.Paths to stemness:building the ultimate antitumour T cell [J].Nat Rev Cancer,2012,12(10):671- 684.
[25] Cheng AW,Wang H,Yang H,etal.Multiplexed activation of endogenous genes by CRISPR- on,an RNA- guided transcriptional activator system [J].Cell Res,2013,23(10):1163- 1171.
[26] Kleinstiver BP,Pattanayak V,Prew MS,etal.High- fidelity CRISPR- Cas9 nucleases with no detectable genome- wide off- target effects [J].Nature,2016,529(7587):490- 495.
[27] Nihongaki Y,Kawano F,Nakajima T,etal.Photoactivatable CRISPR- Cas9 for optogenetic genome editing [J].Nat Biotechnol,2015,33(7):755- 760.

