旋毛虫对不同肠炎模型小鼠脾脏淋巴细胞Th1/Th2水平的影响①
赵 颖 王红月 窦海川 肖庆飞 赵悦竹 顾春梅④
(吉林大学第一医院人兽共患病教育部重点实验室,长春 130062)
蠕虫(多细胞寄生虫)与他们的脊椎动物适应性共生和进化已达数亿年或更久,且不言而喻的多以丑陋肮脏、危害宿主健康的面目出现。但随着“卫生假说”的提出,近年来越来越多的研究显示寄生虫尤其蠕虫可有效预防和治疗日益严重的免疫失衡性疾病[1]。在保护生物学多样性层面,在一定程度上更印证了黑格尔“凡是存在的即是合理的”,即寄生虫在造成危害的同时给机体带来了意想不到的益处,并预言对寄生虫的利用可能比防治具有同等或更具前景和诱惑力。
蠕虫中的旋毛形线虫(Trichinellaspiralis,T.spiralis)作用部位直接起源于肠道,最终定植于肌肉。因此,肠道局部乃至全身的免疫反应都与旋毛虫分泌的许多天然的有益抗原物质关系密切。
炎症性肠病(Inflammatory bowel disease,IBD)主要包括克罗恩病(Crohn′s disease,CD)和溃疡性结肠炎(Ulcerative colitis,UC)[2,3]。它们是一种典型的肠道黏膜免疫失衡性疾病,呈慢性病程,并且易反复发作,为顽固难治的消化道疾病。免疫反应紊乱是IBD重要发病原因之一,以肠黏膜的炎症和损伤为主要特征,并伴随肠内外的一些自身免疫性反应。患者进一步发展为结直肠癌的风险是正常人的6倍,并且恶变率很高。在中国,迅猛发展的经济和逐渐提高的卫生状况,使IBD的发病率也在逐年增长[4]。基于“卫生假说”中肠道蠕虫与IBD的关联性[5,6],一直以来,我们的研究团队开展了关于旋毛虫作为生物免疫调节剂防治炎症性肠病的多项研究。结果,预先感染旋毛虫对三硝基苯磺酸(Trinitrobenzesulfonic,TNBS)模型小鼠的肠道具有保护作用[7],本研究拟通过旋毛虫对TNBS和噁唑酮(Oxazolone,OXZ)诱导的两种不同IBD小鼠模型进行对比干预,应用流式细胞技术(Flow cytometry,FCM)在单个细胞水平上探讨T.spiralis对肠炎小鼠(TNBS、OXZ诱导)脾脏Th1/Th2表达的影响。更深一步探讨旋毛虫防治IBD的可能机制。
1 材料与方法
1.1材料 旋毛虫的收集与攻虫:消化保种小鼠(本实验室)的肌肉组织,将获得的肌幼虫(经洗涤、计数),经口攻击感染实验小鼠。
1.2方法
1.2.1造模方法及实验分组 雌性BALB/c小鼠6~8周龄,体重20~25 g,购于长春生物制品所。TNBS结肠炎模型的建立,依据Stallmach等[8]方法。随机将实验小鼠分为三组,A1为对照组(50%乙醇),B1为模型组(TNBS诱导,购于Sigma公司),C1为干预组(预先感染T.spiralis后诱导TNBS模型),保证取材时每组有6只以上小鼠。OXZ结肠炎模型的建立,依据Heller等[9]方法。同样随机将实验小鼠分为三组,A2为对照组(50%乙醇),B2为模型组(OXZ诱导,购于Sigma公司),C2为干预组(预先感染T.spiralis后诱导OXZ模型),(保证取材时每组有6只以上小鼠)。实验开始,经口感染T.spiralis400条/只(C1、C2组),接种21 d后,分别给予50%乙醇灌肠(A1、A2组)和TNBS造模(2 mg TNBS溶液150 μl直肠灌注)(B1及C1组),B2及C2组给予OXZ造模(1%OXZ溶液150 μl直肠灌注,在直肠灌注药液前5 d先予3%OXZ无水乙醇溶液皮肤致敏),造模后(TNBS、OXZ)分批处死小鼠(第3、7天),取材检测各项指标。
1.2.2成功感染旋毛虫的判定 小鼠取材后,取感染旋毛虫组小鼠膈肌,于显微镜下观察,发现肌肉虫则表明成功感染,并计算感染率及虫体寄生密度。
1.2.3分离小鼠脾脏淋巴细胞 处死小鼠,打开左侧腹部皮肤,小心分离皮下组织和腹部肌肉暴露出脾脏,提起,剪去周围结缔组织,将脾脏放入离心管中剪碎,将200目钢网置于六孔板上,用注射器头研磨成单个细胞,收集于离心管中,1 000 r/min离心10 min,弃掉上清,加入5 ml溶血剂混悬沉淀,室温静置10 min,再1 000 r/min离心10 min,PBS冲洗,调成浓度为1×106ml-1的细胞悬液。
1.2.4脾脏淋巴细胞Th1/Th2表达水平(流式细胞仪) 首先收获细胞,在脾脏淋巴细胞中加入刺激剂和蛋白转运抑制剂(2.5 μl 50 ng/ml PMA、10 μl 1 μg/ml A23187、10 μl 10 μg/ml BFA),混匀后,37℃,5%CO2培养箱培养4 h。之后,加入20 μl FITC标记的anti- CD3和20 μl PE/Cy5标记的anti- CD8进行细胞表面染色,混匀,室温暗处孵育15 min,离心500 r/min 5 min,弃上清。随后进行固定和破膜,加入0.5 ml的固定剂室温暗处孵育15 min,加入PBS,离心500 r/min 5 min,弃上清;加入1 ml 的破膜剂室温暗处孵育10 min,加PBS洗液,离心500 r/min 5 min,弃上清。最后进行细胞内染色,加入荧光素标记抗体IFN- γ- PE、IL- 4- PE,混匀,室温暗处孵育30 min。加洗液,离心500 r/min 5 min,弃上清,加入0.5 ml PBS重悬细胞上机检测。经488 nm氩离子激光激发后,在波长530 nm处,抗CD3+单克隆抗体发绿色荧光;在波长670 nm处,抗CD8+单克隆抗体发深红色荧光;在波长570 nm处,IFN- γ单克隆抗体及IL- 4单克隆抗体发桔黄色荧光。
数据分析:用FLOW CHECK标准微球校准流路和光路,利用标准补偿,作好FITC、PE、PE/Cy5之间的荧光补偿。以CD3- SSC设门,圈定CD3+淋巴细胞。以CD8、IFN- γ和IL- 4分别建立双参数点图对圈定的CD3+淋巴细胞进行分析。得出Th1(CD3+CD8-IFN- γ+)和Th2(CD3+CD8-IL- 4+)的百分比。

2 结果
2.1成功感染旋毛虫的判定 分批处死小鼠取材后,取感染旋毛虫组小鼠膈肌,于显微镜下观察,发现肌肉虫则表明成功感染,并计算感染率及虫体寄生密度。本实验攻虫组小鼠膈肌中虫体寄生密度1 500~2 000条/g。感染成功率为100%。
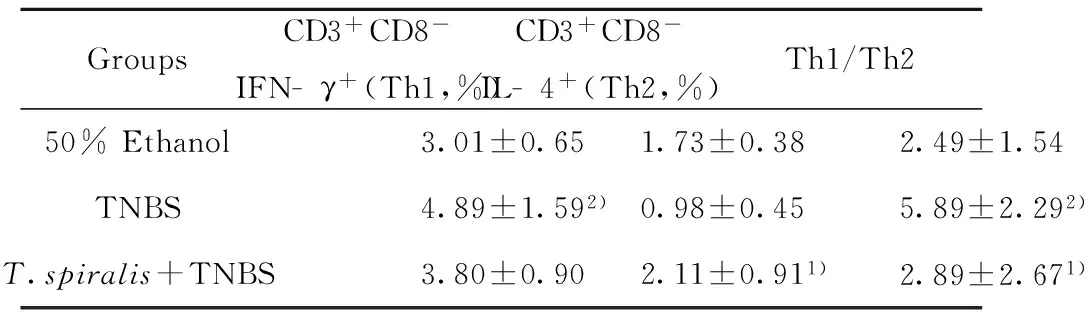
2.2T.spiralis对TNBS诱导IBD小鼠脾脏淋巴细胞Th1/Th2平衡的影响 与单纯造模组相比,预先感染T.spiralis后造模第3天及第7天CD3+CD8-IFN- γ+的Th1细胞百分比未见明显变化(P>0.05),CD3+CD8-IL- 4+的Th2细胞百分比在造模后第3天也无差异(P>0.05),第7天CD3+CD8-IL- 4+的Th2细胞百分比高于模型组(P<0.05)。与模型组相比,T.spiralis感染小鼠后造模第3天Th1/Th2比值未见明显下降(P>0.05),第7天Th1/Th2比值明显下降(P<0.05)。见图1、2,表1、2 。
2.3T.spiralis对OXZ诱导IBD小鼠脾脏淋巴细胞Th1/Th2平衡的影响 与单纯造模组相比,预先感染T.spiralis后造模第3天及第7天小鼠脾脏CD3+CD8-IFN- γ+的Th1细胞百分比明显升高(P<0.05),CD3+CD8-IL- 4+的Th2细胞百分比未见明显变化(P>0.05),预先感染T.spiralis小鼠造模后第3天及第7天脾脏Th1/Th2比值与模型组相比均明显升高(P<0.05)。见图3、4,表3、4。
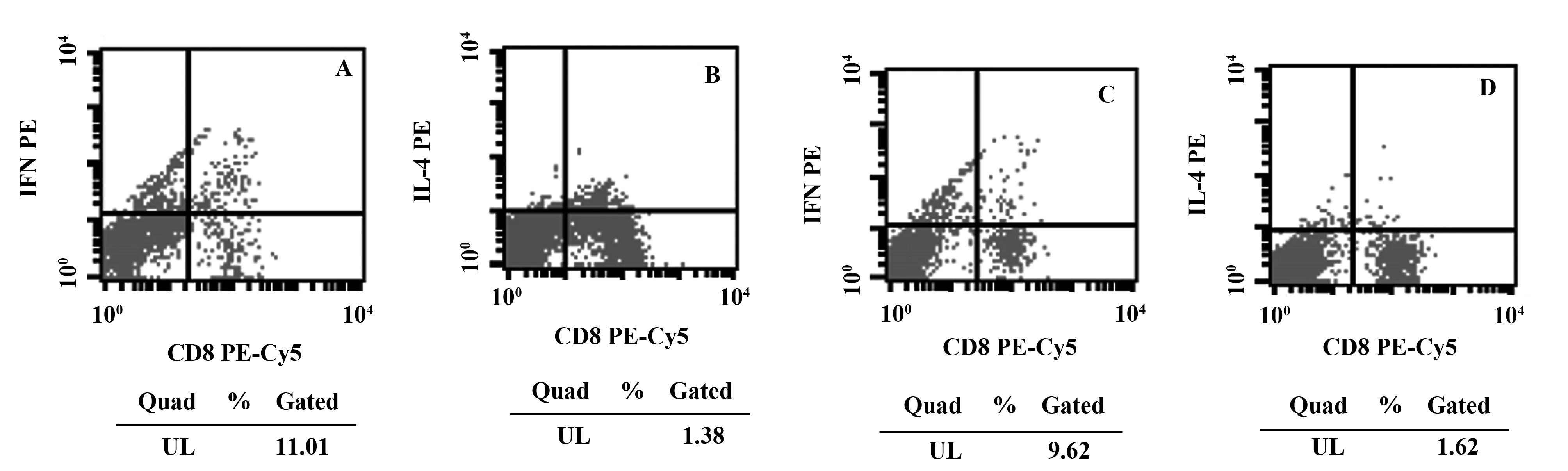
图1 TNBS造模3 d小鼠脾脏淋巴细胞百分比Fig.1 Percentage of splenic lymph cells of mouse 3 days after administration of TNBSNote: A. Percentage of splenic CD3+CD8-IFN- γ+lymph cells of mouse 3 days after administration of TNBS;B. Percentage of splenic CD3+CD8-IL- 4+ lymph cells of mouse 3 days after administration of TNBS;C. Percentage of splenic CD3+CD8-IFN- γ+ lymph cells of T. spiralis- infected mouse 3 days after administration of TNBS;D. Percentage of splenic CD3+CD8-IL- 4+ lymph cells of T. spiralis- infected mouse 3 days after administration of TNBS.
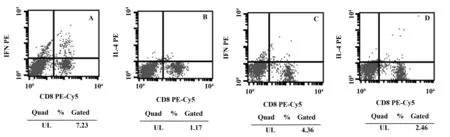
图2 TNBS造模7 d小鼠脾脏淋巴细胞百分比Fig.2 Percentage of splenic lymph cells of mouse 7 days after administration of TNBSNote: A.Percentage of splenic CD3+CD8-IFN- γ+lymph cells of mouse 7 days after administration of TNBS;B.Percentage of splenic CD3+CD8-IL- 4+ lymph cells of mouse 7 days after administration of TNBS;C.Percentage of splenic CD3+CD8-IFN- γ+ lymph cells of T.spiralis- infected mouse 7 days after administration of TNBS;D.Percentage of splenic CD3+CD8-IL- 4+ lymph cells of T.spiralis- infected mouse 7 days after administration of TNBS.

GroupsCD3+CD8-IFN-γ+(Th1,%)CD3+CD8-IL-4+(Th2,%)Th1/Th250%Ethanol5.21±1.391.40±0.764.07±1.43TNBS8.72±2.461)1.48±0.405.90±1.121)T.spiralis+TNBS7.96±1.571)1.72±0.745.83±4.181)
Note:Vs 50% Ethanol group,1)P<0.05.

GroupsCD3+CD8-IFN-γ+(Th1,%)CD3+CD8-IL-4+(Th2,%)Th1/Th250%Ethanol3.01±0.651.73±0.382.49±1.54TNBS4.89±1.592)0.98±0.455.89±2.292)T.spiralis+TNBS3.80±0.902.11±0.911)2.89±2.671)
Note:Vs TNBS group,1)P<0.05;vs 50% Ethanol group,2)P<0.05.
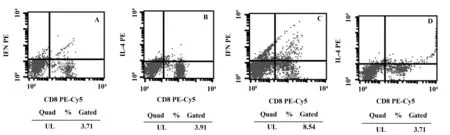
图3 OXZ造模3 d小鼠脾脏淋巴细胞百分比Fig.3 Percentage of splenic lymph cells of mouse 3 days after administration of OXZNote: A.Percentage of splenic CD3+CD8-IFN- γ+lymph cells of mouse 3 days after administration of OXZ;B.Percentage of splenic CD3+CD8-IL- 4+ lymph cells of mouse 3 days after administration of OXZ;C.Percentage of splenic CD3+CD8-IFN- γ+ lymph cells of T.spiralis- infected mouse 3 days after administration of OXZ;D.Percentage of splenic CD3+CD8-IL- 4+ lymph cells of T.spiralis- infected mouse 3 days after administration of OXZ.
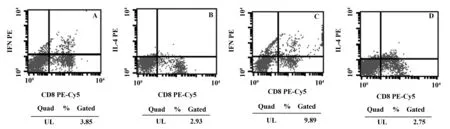
图4 OXZ造模7 d小鼠脾脏淋巴细胞百分比Fig.4 Percentage of splenic lymph cells of mouse 7 days after administration of OXZNote: A.Percentage of splenic CD3+CD8-IFN- γ+lymph cells of mouse 7 days after administration of OXZ.;B.Percentage of splenic CD3+CD8-IL- 4+ lymph cells of mouse 7 days after administration of OXZ;C.Percentage of splenic CD3+CD8-IFN- γ+ lymph cells of T.spiralis- infected mouse 7 days after administration of OXZ;D.Percentage of splenic CD3+CD8-IL- 4+ lymph cells of T.spiralis- infected mouse 7 days after administration of OXZ.
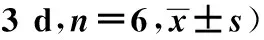
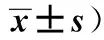

GroupsCD3+CD8-IFN-γ+(Th1,%)CD3+CD8-IL-4+(Th2,%)Th1/Th250%Ethanol5.21±1.391.40±0.764.07±1.43OXZ3.60±1.122)3.74±0.812)0.79±0.522)T.spiralis+OXZ8.45±1.851)2)3.61±0.692)2.98±0.781)2)
Note:Vs OXZ group,1)P<0.05;vs 50% Ethanol group,2)P<0.05.

Tab.4RatiosofTh1lymphcellscomparedtoTh2lymphcellson7daysafteradministrationofOXZ(n=6,
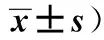

GroupsCD3+CD8-IFN-γ+(Th1,%)CD3+CD8-IL-4+(Th2,%)Th1/Th250%Ethanol3.01±0.651.73±0.382.01±0.84OXZ3.35±1.052.85±0.872)1.14±0.672)T.spiralis+OXZ8.54±1.631)2)2.51±0.793.32±1.561)2)
Note:Vs OXZ group,1)P<0.05;vs 50% Ethanol group,2)P<0.05.
3 讨论
旋毛虫属于蠕虫中的线虫,是一种人兽共患的寄生虫,肌幼虫经口进入人体肠道后,感染性肌幼虫6 h即侵入宿主肠黏膜,寄生于多细胞内龛,由一排柱状上皮细胞组成,完成蜕皮仅需要30 h,之后发育为成虫,性成熟的雌虫和雄虫立即进行交配,产生的新生幼虫(在感染后第4~5天开始)经肠黏膜淋巴管或小静脉,在宿主全身各组织器官进行移行。约35 d左右完全定植在肌肉,成为感染性肌幼虫。散在地分布于全球,以温、热带地区为主,在蠕虫中是产生免疫抑制作用最强的寄生虫之一,宿主感染旋毛虫后产生以Th2型为主的免疫反应[10,11]。
因T.spiralis的作用部位直接起源于肠道,最终定植于肌肉,因此,肠道局部乃至全身的免疫反应都与旋毛虫分泌的许多天然的有益抗原物质关系密切。
寄生虫对IBD的中枢免疫细胞T细胞有哪些影响呢?
许多研究表明,以Th1为主的免疫应答过度反应常常发生在大多数IBD模型动物中,尤其在TNBS模型的免疫反应中占主导作用[12],类似于人类CD[13]。OXZ诱导的肠炎模型往往具有UC的病理特征[14],主要由Th2型细胞介导。Th1和Th2在介导机体免疫应答过程中扮演着不同的角色,于分化和功能上相互制约,维持机体免疫平衡。两个亚群的划分基于CD4+T细胞分泌的不同细胞因子和介导的免疫功能,如IFN- γ、IL- 12、TNF- α等细胞因子的表达及其功能多代表Th1细胞亚群,IL- 4和IL- 5、IL- 13的表达多代表Th2细胞亚群[15]。任一种细胞亚群的过度免疫反应都会产生相应的疾病。正因此,TNBS模型和OXZ模型基线Th1/Th2反应有明显差异。另外,具有优势调节作用的T细胞还包括Th3、Tr1细胞亚型,它们分别产生的TGF- β和IL- 10,都能抑制Th1和 Th2炎症免疫反应。
我们的前期研究表明[7],小鼠感染T.spiralis后更易耐受化学诱导剂TNBS对结肠的损伤,T.spiralis主要是抑制了结肠炎小鼠Th1型过度免疫反应使Th1/Th2达到平衡,从分子和蛋白水平我们了解其干预作用可能是通过诱导Th2型免疫反应及Tr1型细胞因子而实现的。相比之下,感染T.spiralis未对小鼠在OXZ造模时起到保护作用,仍然出现了结肠损伤,但没有按预想的加重肠炎,也就是说,基于Th1和Th2相互制约的理论,感染T.spiralis所产生的Th2型免疫反应可能会对OXZ诱导的Th2型炎症反应起叠加作用而加重病情[16]。
本实验在原有研究基础上,通过流式细胞技术,刺激脾脏淋巴细胞后行荧光染色,在单个细胞水平上动态检测细胞内因子和表面抗原的表达,更进一步对比研究了T.spiralis对两种肠炎小鼠(TNBS、OXZ诱导)Th1/Th2偏移的影响。结果显示,与TNBS模型组相比,预先感染T.spiralis的小鼠在诱导TNBS肠炎第7天Th1/Th2比值明显下降,具有统计学意义。与OXZ模型组相比,预先感染T.spiralis的小鼠在诱导OXZ肠炎第3、7天Th1/Th2比值均明显上调,出现新的偏移,而并非是按理论所设想的T.spiralis增加了OXZ模型原有的Th2为主的免疫反应。经研究分析,可能是针对OXZ肠炎模型T.spiralis诱生出过量的IL- 10。曾有研究人员指出,由于过高浓度的IL- 10反而会激发淋巴细胞产生IFN- γ,从而使IL- 10的抗炎作用受到抑制,因此静脉应用大剂量IL- 10时反而降低了其抗炎效果[17]。正是Th1/Th2比值的上调,提示我们,感染T.spiralis使OXZ肠炎小鼠Th1/Th2出现了新的偏移,弱化了Th2表达,因此不足以加重肠道炎症。通过FCM,我们从细胞水平验证了既往的研究结论,为T.spiralis干预IBD的后续研究提供了更详实的理论依据。对今后进行提取有效抗原蛋白和无害旋毛虫防治IBD的研究奠定坚实的实验基础。
[1] Nascimento Santos L,Carvalho Pacheco LG,Silva Pinheiro C,etal.Recombinant proteins of helminths with immunoregulatory properties and their possible therapeutic use [J].Acta Trop,2017,166:202- 211.
[2] Blumberg RS,Strober W.Prospects for research in inflammatory bowel disease [J].JAMA,2001,285(5):643- 647.
[3] Braegger CP,Macdonald TT.Immune mechanisms in chronic inflammatory bowel disease [J].Ann Allergy,1994,72(2):135- 141.
[4] Li X,Song P,Li J,etal.The disease burden and clinical characteristics of inflammatory bowel disease in the chinese population:a systematic review and meta- analysis [J].Int J Environ Res Public Health,2017,14(3):pii:E238.
[5] Elliott DE,Urban JF JR,Argo CK,etal.Does failure to acquire hel minth parasites predispose to Crohn′s disease?[J].FASEB J,2000,14(12):1848- 1855.
[6] Varyani F,Fleming JO,Maizels RM.Helminths in the gastrointestinal tract as modulators of immunity and pathology [J].Am J Physiol Gastrointest Liver Physiol,2017,312(6):G537- G549.
[7] 赵 颖,杨世忠,邹洪斌,等.旋毛虫对三硝基苯磺酸诱导的实验性小鼠肠炎模型的干预研究[J].中华微生物学和免疫学杂志,2007,27(6):509- 512.
Zhao Y,Yang SZ,Zou HP,etal.Trichinella spiralis infection protects mice from TNBS- induced colitis[J].Chin J Microbiol Immunol,2007,27(6):509- 512.
[8] Stallmach A,Marth T,Weiss B,etal.An interleukin 12 p40- IgG2b fusion protein abrogates T cell mediated inflammation:anti- inflammatory activity in Crohn′s disease and experimental colitis in vivo [J].Gut,2004,53:339- 345.
[9] Heller F,Fuss IJ,Nieuwenhuis EE,etal.Oxazolone colitis,a Th2 colitis model resembling ulcerative colitis,is mediated by IL- 13- producing NK- T cells [J].Immunity,2002,17(5):629- 638.
[10] Else KJ,Finkelman FD.Intestinal nematode parasites,cytokines and effector mechanisms [J].Int J Parasitol,1998,28(8):1145- 1158.
[11] Cvetkovic J,Sofronic- Milosavljevic L,Ilic N,etal.Immunomodulatory potential of particular Trichinella spiralis muscle larvae excretory- secretory components [J].Int J Parasitol,2016,46(13- 14):833- 842.
[12] 王 开,裴志花,胡桂学,等.肠炎动物模型的研究进展[J].中国免疫学杂志,2015,31(5):704- 706.
Wang K,Pei ZH,Hu GX,etal.Advances in animal models of enteritis[J].Chin J Immunol ,2015,31(5):704- 706.
[13] Elson CO,Beagley KW,Sharmanov AT,etal.Hapten- induced model of murine inflammatory bowel disease.Mucosal immune responses and protection by tolerance [J].J Immunol,1996,157(5):2174- 2185.
[14] Boirivant M,Fuss IJ,Chu A,etal.Oxazolone colitis:a murine model of t helper cell type 2 colitis treatable with antibodies to interleukin 4 [J].J Exp Med,1998,188(10):1929- 1939.
[15] Murphy KM,Reiner SL.The lineage decisions of helper T cells [J].Nat Rev Immunol,2002,2(12):933- 944.
[16] 赵 颖,赵 英,窦海川,等.旋毛虫对噁唑酮诱导的实验性小鼠肠炎模型的干预研究[J].中华微生物学和免疫学杂志,2016,36(1):34- 41.
Zhao Y ,Zhao Y ,Dou HC,etal.Effects of Trichinella spiralis infection on a murine model of OXZ- induced colitis[J].Chin J Microbiol Immunol,2016,36(1):34- 41.
[17] Tilg H,van Montfrans C,van den Ende A,etal.Treatment of Crohn′s disease with recombinant human interleukin 10 induces the proinflammatory cytokine interferon gamma [J].Gut,2002,50(2):191- 195.

