不同树龄银杏叶片差异蛋白组学研究
周凯凯,张 胜,赵 忠
(西北农林科技大学 林学院,陕西 杨陵 712100)
古树名木是活的历史档案,是自然和先民留给我们的珍贵遗产,对于弘扬中华传统文化、发展创意产业、建设生态文明具有不可估量的价值。因此开展古树衰退(衰老)的研究,揭示古树衰老机理对于制定科学的保护措施十分重要[1-3]。
银杏(Ginkgobiloba)是我国古树中重要的树种,在黄河流域广泛分布[4]。目前,古树的研究主要集中在组织培养、抗氧化系统酶活性及胁迫响应等方面[5-7],但是,在分子水平上有关银杏抗衰老与抗逆调控的研究很少。
蛋白质既是生命活动的承担者又是生命活动的体现者,所有生命体都由蛋白质承担性状表达功能,所以通过研究不同树龄阶段的蛋白表达特征差异,有助于揭示树木衰老的分子机理,对深化古树保护研究具有重要的意义[8-11]。双向电泳技术是利用蛋白质等电点和分子量这2个维度的特性分离蛋白质群的技术[12],主要来分析和比较蛋白质的差异表达[13]。目前基于双向电泳技术(2-DE)与质谱(MS)鉴定相结合的蛋白质组学已经成为研究植物发育过程和响应环境信号的有力工具,在研究植物叶片衰老和胁迫响应方面已有很多报道。比如R.Gupta[14]等利用2-DE技术研究大豆叶片自然衰老过程中蛋白质的差异表达,发现在叶片衰老过程中,与茉莉酸生物合成和与防御相关的蛋白质丰度特异性增加,而与光合作用和ROS清除相关的蛋白质减少,其中茉莉酸在大豆叶片衰老过程中扮演着重要的作用。X.D.Wei[15]等利用2-DE技术研究银杏叶片在自然衰老过程中叶绿体蛋白的差异表达,质谱鉴定的15个差异蛋白点主要与植物光合作用、转录和翻译、细胞次生代谢和活性氧(ROS)清除有关[15]。
本研究以陕西省周至县楼观台老子手植银杏(约2 600年生)、说经台银杏古树(约800年生)和20年生银杏为研究对象,利用双向凝胶电泳(2-DE)技术分离差异表达的蛋白质,通过MALDI TOF/TOF MS/MS技术及数据库检索,鉴定差异蛋白种类并进行功能分类,讨论了这些蛋白质可能参与的植物细胞代谢途径。
1 材料与方法
1.1 材料
于2016年7月分别从老子手植银杏(约2 600年生)、说经台银杏古树(约800年生)和20年生幼龄银杏的树冠中层向阳处采集健康的叶片,用蒸馏水清洗,锡箔纸包好后迅速投入液氮罐中,带回实验室置于-80℃保存备用。
本试验所用两性电解质(Bio-Lyte 4-6、5-7)、预制IPG胶条(线性17 cm,pH 4~7)均购于Bio-Rad公司,其他试剂均为分析纯。
1.2 蛋白质的提取
参照W.Wang[16]等的方法,利用SDS-苯酚法提取蛋白质,于-80℃保存备用。每个样品进行3次生物学重复。
1.3 蛋白质的溶解和定量
将充分干燥的蛋白质沉淀溶解在裂解缓冲液中[含7 mol·L-1尿素,2 mol·L-1硫脲,4%CHAPS(w/v),1%DTT(w/v),0.25%Bio-Lyte 4-6(v/v)和0.25%Bio-Lyte 5-7(v/v)][17]。
根据M.M.Bradford[18]法测定蛋白质浓度,使用天艮Bradford蛋白质定量试剂盒,以牛血清蛋白(BSA)为标准品,作标准曲线,用分光光度计测定λ=595 nm时每个蛋白样品的吸光度,利用标准曲线方程计算蛋白质浓度。
1.4 蛋白质双向凝胶电泳
第一向等电聚焦(IEF):利用PROTAIN IEF Cell等电聚焦仪((Bio-Rad)在固定的pH梯度(IPG)胶条(pH 4~7,17 cm)进行等电聚焦。每个样品蛋白上样量为600 μg,与水化上样缓冲液[8 mol·L-1尿素,4%CHAPS(w/v),0.001%溴酚蓝,1%DTT(w/v),0.25%Bio-Lyte 4-6(v/v)和0.25%Bio-Lyte 5-7(v/v)]充分混合至上样体系为400 μL,将其加入聚焦槽中,使IPG胶条胶面朝下置于样品溶液上,确保胶条与电极紧密接触并在其上加适量矿物油。等电聚焦在20℃下进行,具体程序见表1[19-20]。

表1 银杏叶片蛋白质17 cm胶条等电聚焦程序设置Table 1 Program of isoelectric focusing of total protein of Ginkgo leaves with 17 cm IPG strips
第二向聚丙烯酰胺凝胶电泳(SDS-PAGE):在等电聚焦结束之后,将IPG胶条放入已盛有5 mL平衡缓冲液Ⅰ(6 mol·L-1尿素,2%SDS,0.375 mol·L-1Tris-HCl,20%甘油和2% DTT)的溶胀盘中平衡15 min,期间不断摇晃;用5 mL平衡缓冲液Ⅱ(6 M尿素,2%SDS,0.375 M Tris-HCl,20%甘油和2.5%碘乙酰胺)平衡15 min后,用1 x电极缓冲液冲洗平衡后的IPG胶条,使用滤纸将凝胶条上的多余液体轻轻吸干[21-23],将IPG胶条置于垂直12%聚丙烯酰胺凝胶的顶部,使IPG胶条与分离胶紧密接触并加入1%低熔点琼脂糖封胶液。将SDS-PAGE 胶架放入PROTAIN IEF Cell 型电泳系统(Bio-Rad)中,加入1 x电极缓冲液,接通冷却水,在10 mA·gel-1的恒定电流下电泳约30 min,待溴酚蓝指示线走出IPG胶条后,调大电流(30 mA·gel-1)电泳至指示线达到底部边缘时停止[24-25]。
1.5 凝胶染色、图像扫描及分析
双向电泳结束后,将凝胶取出放入固定液(50%乙醇,10%乙酸)中固定1 h,然后利用考马斯亮蓝G-250染液(10%硫酸铵,10%磷酸,20%乙醇,0.12%G-250)在摇床上过夜染色。染色结束后,将凝胶放入脱色液(5%乙醇,5%乙酸)中摇晃,可多次进行脱色至凝胶背景色变白[26-27]。
使用PowerLook 2100XL扫描仪扫描凝胶获得图像(400 dpi,全彩)并保存为TIFF文件,将图像导入PDQuest 8.0软件(美国Bio-Rad公司)进行分析[28-29],主要涉及蛋白点的检测、凝胶匹配、蛋白分子量及等电点的计算和蛋白的相对定量。
1.6 质谱鉴定及功能注释
将差异表达的蛋白质点从凝胶上切下送至上海中科新生命生物科技有限公司、采用5800 MALDI-TOF/TOF/质谱仪进行质谱鉴定[30],对鉴定成功的蛋白点进行GO功能注释。
2 结果与分析
2.1 双向电泳图谱分析
本试验分别从老子手植银杏、说经台银杏及幼龄银杏的叶片中检测到340、341和410个肉眼可辨、点形规则清晰、可重复的蛋白点(图1)。以幼龄银杏为对照,在老子手植银杏中检测到差异蛋白点(丰度变化>1.5倍,可信度95%)87个,其中丰度上调蛋白点24个,下调蛋白点63个;在说经台银杏中检测到差异蛋白点(丰度变化>1.5倍,可信度95%)130个,其中丰度上调蛋白点33个,下调蛋白点97个。可以看出,随着银杏年龄的增长,大多数差异蛋白的丰度下降而少部分差异蛋白丰度上升。
分析幼龄银杏叶片双向电泳图谱(图1-C)中410个蛋白点的分子量及等电点,结果显示:银杏叶片中的蛋白点分子质量大多分布在20~50 kDa(占70%,图2-A),而蛋白的等电点主要集中分布在pH 5~6.5(占75%,图2-B),大多数这样的蛋白点都可以利用质谱进行鉴定,但考虑到考马斯亮蓝蛋白染色方法的灵敏度有限,所以最终选择质谱鉴定的都是高表达的蛋白点。
2.2 质谱鉴定结果分析
利用PD-Quest软件分析,从凝胶上切出差异蛋白点37个进行MALDI-TOF/TOF MS和MS/MS鉴定,成功鉴定了30个蛋白点(图1中标注的蛋白点),分别在NCBI-Acro gymnospermae中检索到11个、在Uniprot-Viridiplantae中检索到19个蛋白点的信息,详细质谱鉴定结果见表2。从表2中可以看出,在这30个蛋白点中,有5个蛋白点是Rubisco活化酶蛋白种类或Rubisco的大、小亚基,分别是蛋白点4 205、7 614、5 802、3 204、3 325;3个蛋白点是乌头酸水合酶(蛋白点8 801、7 801、7 802),各有2个蛋白点是Clp蛋白酶(5 701和6 803)、70 ku热休克蛋白(3 702和3 701)、3-磷酸甘油醛脱氢酶(7 204和8 202),这些蛋白都参与了植物重要的生理生化代谢途径,包括光合作用、胁迫响应、能量和碳水化合物代谢等。
2.3 蛋白功能分类
通过GO功能注释可以将成功鉴定的蛋白质分为8个功能类别(图3),最多的是与能量及碳水化合物代谢有关的蛋白(40%),其他依次是与蛋白及氨基酸合成代谢有关的蛋白(20%)、光合作用(16.7%)、次生代谢(6.7%)、胁迫响应(6.7%)、脂质代谢(3.3%)、转录起始因子(3.3%)、未知(3.3%)。这个结果表明,参与能量及碳水化合物代谢、蛋白及氨基酸合成代谢和光合作用相关的蛋白质种类与银杏的年龄变化关系密切。
2.4 差异蛋白聚类分析
以幼龄银杏(图4中Age-1)作为对照,将成功鉴定的差异蛋白点进行分层聚类,使具有相似丰度变化模式的蛋白质分在同一组中,可以得到不同年龄的银杏叶片蛋白点丰度变化的综合概述。通过聚类分析,可将30个蛋白点分为4组,Ⅰ组中包含2个蛋白质,均在幼龄银杏中表达量最高,在中龄银杏(Age-2)中表达量最低,而在老龄银杏(Age-3)中表达量略低于幼龄银杏,这2个蛋白质分别是HSP 70和核酮糖-1,5-二磷酸羧化酶/加氧酶(RuBisCO),主要与植物的应激反应和光合作用有关;Ⅱ组中包含的8个蛋白质都随着银杏年龄的增大表达量降低,分别参与植物的能量及碳水化合物代谢(3个)、蛋白及氨基酸合成代谢(2个)、次生代谢(2个)和应激反应(1个);Ⅲ组中包括7个蛋白质,均在中龄银杏中表达量最低,其中4个在老龄银杏中上调表达,3个在老龄银杏中的表达量略低于幼龄银杏,主要参与植物的能量及碳水化合物代谢(6个)和蛋白质水解(1个);Ⅳ组中包含的11个蛋白质,除了蛋白点8907在老龄银杏中未检测到,其余10个均随着银杏年龄的增长其表达量显著升高,其中3个核酮糖-1,5-二磷酸羧化酶/加氧酶(RuBisCO)参与植物光合作用,3个参与蛋白质及氨基酸代谢的分别是谷氨酰胺合成酶、谷氨酸氨连接酶、甘氨酸脱羧酶,其他分别参与能量及碳水化合物代谢、脂质代谢等途径。
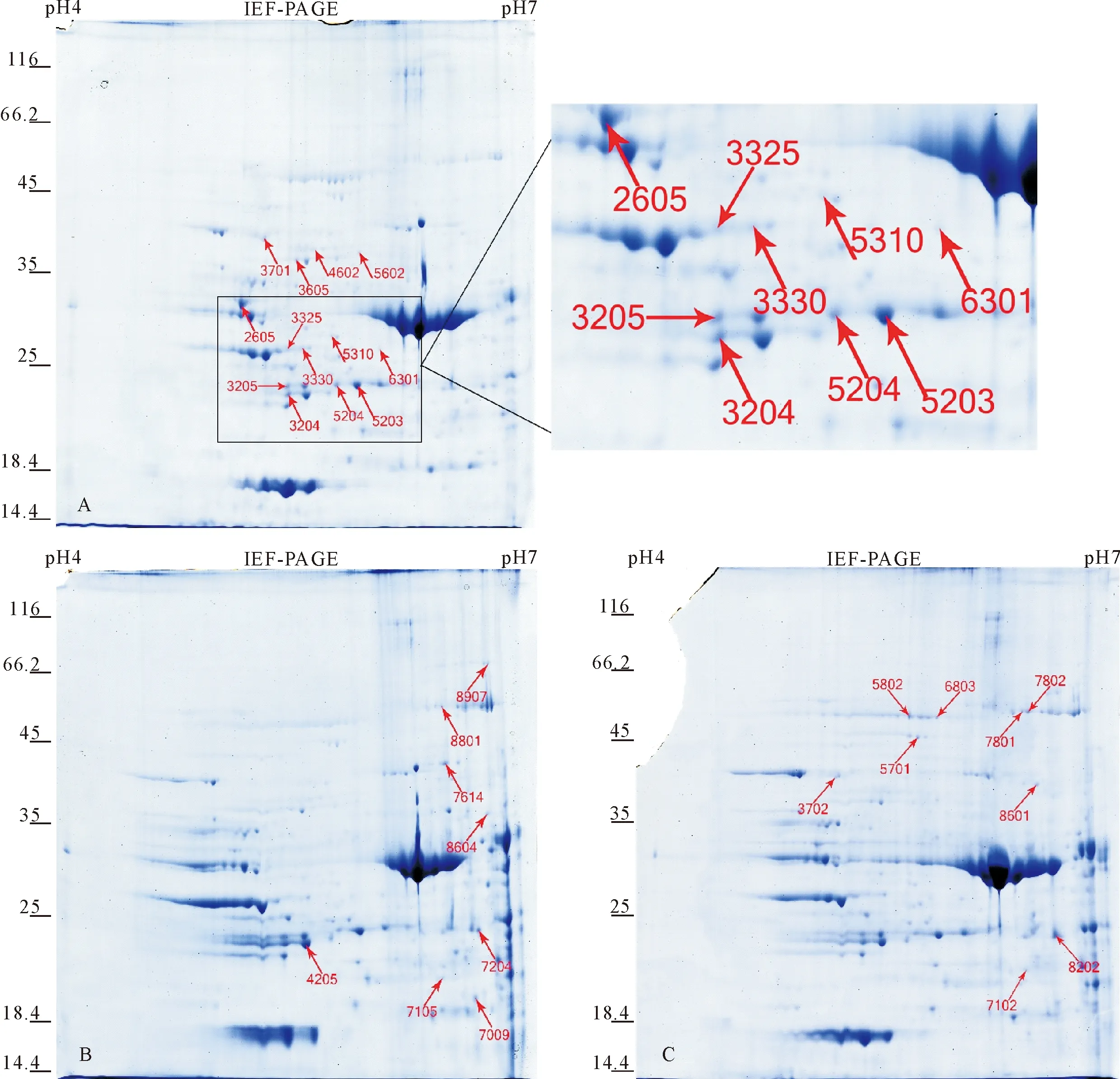
图1 不同年龄银杏叶片双向电泳图(A-2600 a,B-800 a,C-20 a)Fig.1 2-DE gels of leaf extracts from Ginkgo with 2600 (A),800 (B) and 20 (C) years of age
3 结论与讨论
本研究利用2-DE联合MALDI TOF/TOF MS/MS技术研究楼观台不同树龄银杏的叶片蛋白差异表达,初步从蛋白水平揭示了银杏响应年龄变化的机制,差异蛋白主要参与植物能量及碳水化合物代谢、蛋白及氨基酸合成代谢及光合作用等,说明银杏在响应年龄变化的过程中,首先加强蛋白及氨基酸合成代谢并以能量代谢及光合作用等途径来调节自身反应。本研究明确了不同年龄银杏叶片差异蛋白参与的代谢途径,为进一步从分子水平深入了解银杏抗衰老的机理提供了理论基础。
银杏树作为地球“活化石”,是最古老的植物,那么不同年龄阶段的银杏其蛋白表达是否有差异,这些差异主要表现在哪些方面呢?本研究利用双向凝胶电泳联合质谱鉴定的技术分析了3个年龄银杏叶片的蛋白质差异表达,蛋白质功能分析表明,差异蛋白主要参与植物的能量及碳水化合物代谢、光合作用和蛋白及氨基酸合成代谢等途径。

图2 银杏叶片蛋白分子质量和等电点分布图Fig.2 Molecular weight and isoelectric point distribution of proteins from Ginkgo leaves
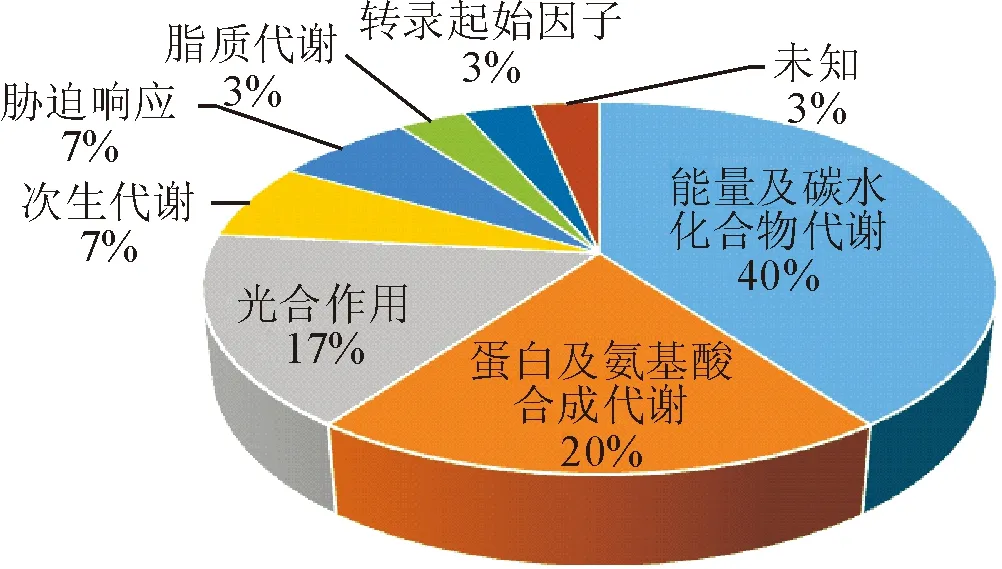
图3 差异蛋白功能分类
在植物体内,能量及碳水化合物代谢始终伴随着各种物质代谢进行,是一个极其复杂、综合调控的过程。在本次研究中,3-磷酸甘油醛脱氢酶(蛋白点7 204和8 202)、乌头酸水合酶(蛋白点7 802、8 801及7 801)等是直接参与能量代谢的重要酶类。作为细胞内的一个组成性表达的蛋白质,3-磷酸甘油醛脱氢酶(GAPDH)主要参与糖酵解途径,可以催化3-磷酸甘油醛脱氢和磷酸化,生成1,3-二磷酸甘油酸同时为细胞活动提供能量,对细胞内糖代谢起着重要的作用[31-32],本研究发现其在幼龄银杏叶中丰度表达远远高于老年银杏,说明在幼龄银杏叶片中的能量代谢更为旺盛。在本研究中有3个凝胶位置检测到同一个蛋白质——乌头酸水合酶(7 802、8 801和7 801),可能是由蛋白质翻译后修饰、同一基因的不同拷贝或蛋白质降解所引起的位置变化,在以前的研究中也报道了类似的位置变化[33]。乌头酸水合酶是参与植物细胞线粒体三羧酸循环中重要的辅酶,其在幼龄银杏叶片中的表达高于中、老年银杏,说明幼龄银杏叶片中三羧酸循环活动强于中、老年银杏,而这一规律在动物细胞中也得到证实,叶薇[34]等研究发现在大鼠细胞衰老过程中,乌头酸水合酶活性下降,继而使三羧酸循环效率及细胞能量合成降低。
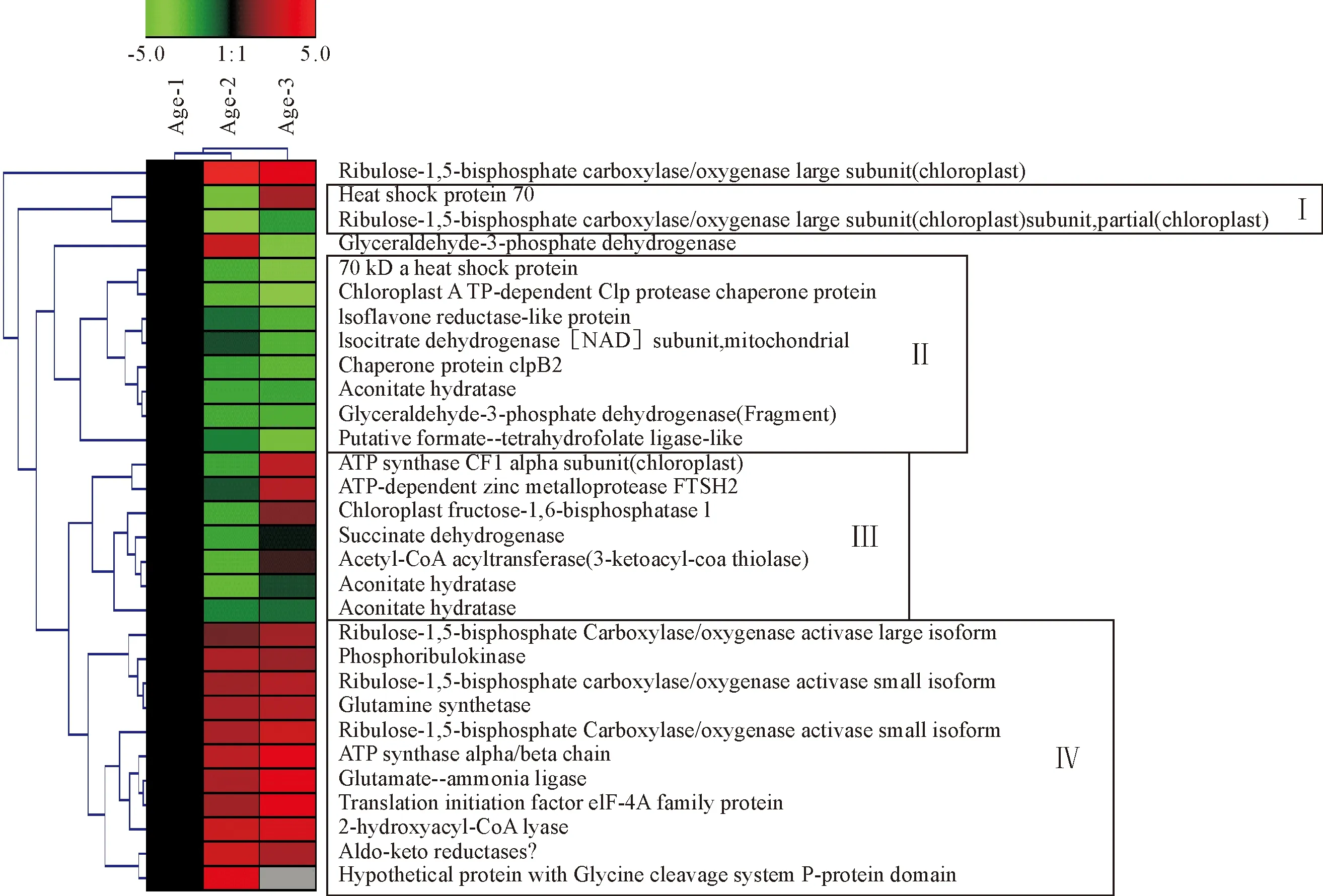
图4 不同树龄银杏叶片差异蛋白聚类分析

SpotNo.蛋白描述蛋白得分检索号理论分子量PI/ku实验分子量PI/ku被鉴定肽段覆盖率/%相匹配的肽链片段数能量及碳水化合物代谢72043磷酸甘油醛脱氢酶327tr|A0A164V0V147.99/7.5722.87/6.6147%1782023磷酸甘油醛脱氢酶(片段)164tr|A0A078JPL942.6/5.5923.39/6.5621%62605ATP合成酶亚基1110AEX98990.155.48/5.0232.23/5.1143%223330I果糖-1,6-二磷酸酶254tr|A8VYM044.11/5.2427.01/5.5329%85602琥珀酸脱氢酶237AIZ74343.169.49/6.2537.39/5.8829%123205磷酸核酮糖激酶260tr|A0A0C9RW0544.71/6.2823.55/5.4250%167802乌头酸水合酶163tr|A0A059ASC998.17/5.8961.17/6.4122%208801乌头酸水合酶179tr|A0A0E0K8H7106.19/6.6861.05/6.4914%117801乌头酸水合酶87tr|A0A0D3A1P097.99/6.0261.27/6.3815%126301(3-ketoacyl-coathiolase)乙酰辅酶A205tr|Q0837548.48/8.6626.59/6.0319%67102异柠檬酸脱氢酶171tr|A0A0D6QS5841.45/7.120.78/6.433%104602ATP合成酶209tr|A0A0C9RQ4468.39/5.2438.48/5.590.4317光合作用5802核酮糖-1,5-二磷酸羧化酶/加氧酶大亚基(叶绿体)97AAR23418.146.71/6.4259.34/5.7123%104205核酮糖-1,5-二磷酸羧化酶/加氧酶亚型214AHL24664.148.4/6.4922.86/5.5528%127614核酮糖-1,5-二磷酸羧化酶/加氧酶大亚基(叶绿体)561AFJ39054.152.7/640.79/6.4454%193204核酮糖-1,5-二磷酸羧化酶/加氧酶亚型194AHL24663.152.74/5.8922.83/5.4429%123325核酮糖-1,5-二磷酸羧化酶/加氧酶亚型171AHL24664.148.4/6.4927.08/5.4619%10蛋白及氨基酸合成代谢5204谷氨酸-氨连接酶204CAA52448.139.5/6.4223.6/5.7520%65701依赖ATP叶绿体伴侣蛋白244tr|A0A088F9I1100.62/6.1751.74/5.7625%136803伴侣蛋白clpB2325tr|A0A151T007100.22/5.6358.83/5.8830%208907甘氨酸分解酶类152JAG87694.1112.97/6.7183.72/6.727%175203谷氨酰胺合成酶205CCO25538.139.18/5.7423.37/5.8814%43605FTSH2依赖ATP锌金属蛋白酶400tr|W9RHR974.2/5.9437.31/5.4834%18胁迫响应3702热激蛋白70479tr|A0A0K9Q1T971.52/5.0740.46/5.2640%173701热激蛋白70619tr|A0A0A0KXG370.83/5.1740.69/5.2856%25次生代谢8601甲酸-四氢叶酸连接酶87tr|A0A0V0IPT653.53/6.6139.41/6.4610%37009异黄酮还原酶936AGG40646.133.27/6.1618.59/6.5770%15脂质代谢86042-羟基酰辅酶A裂解酶122tr|M7YG5236.61/5.2134.65/6.6624%7转录起始因子5310转录起始因子eIF-4A家族425tr|A9P85146.84/5.3828.16/5.7146%13未知7105醛酮还原酶157tr|E4MVL238.1/5.920/6.422%7
光合作用对于绿色植物来说是至关重要的,本研究发现与光合作用密切相关的、在植物叶片中含量最高的[14](50%~70%)核酮糖-1,5-二磷酸羧化酶/加氧酶(RuBisCO)的表达量在不同年龄的银杏中有极大的差异。蛋白点5 802、3 204、3 325、4 205和7 614均是RuBisCO,而且除了点5 802外的4个蛋白点均在中、老年银杏叶片中的表达量显著高于幼龄银杏中,说明在中、老年银杏中的光合作用强度>幼龄银杏。RuBisCO在植物遭受逆境时也表现出很重要的作用,Z.Sheng[35]等研究发现古侧柏在遭受低温胁迫时光合作用明显降低,而幼龄侧柏中RuBisCO表达量显著>古侧柏以保证其光合效率;大量研究发现,植物在遭受高温胁迫时会诱导产生新的RuBisCO多肽,说明极端条件下RuBisCO在维持植物的光合速率中发挥着重要的作用[36]。
植物对氮素(N)的吸收利用能力是决定其生长发育状况的重要因素,而谷氨酰胺合成酶(GS)是绿色植物在氮同化代谢途径中重要的酶类,它可以催化游离态铵离子同化成谷氨酰胺,后者在其他酶类的催化作用下生成谷氨酸[37]。在本研究中,谷氨酰胺合成酶(蛋白点5 203)在中、老年银杏中表达量分别是幼龄银杏中的2.8倍和3.3倍,说明在中老年银杏中氮素同化效率更高。目前,对于GS的研究主要集中在其在不同植物组织中特异性表达、在整个氮素代谢过程中的调控机制和生物学功能方面[38],而且H.C.Thomsen[39]等研究发现GS1同源体的过表达并不能提高植物的氮素利用效率,因为GS活性可以通过机制链下调,强烈地受环境条件和潜在的代谢失调的影响[39]。
[1] 王玉山,陶娟,赵进红,等.古树名木研究概述[J].安徽农业科学,2013,41(3):1196-1198.
WANG Y S,TAO J,ZHAO J H,etal.Review on ancient and famous trees in China[J].Journal of Anhui Agricultural Sciences,2013,41(3):1196-1198.(in Chinese)
[2] 王巧,朱红,王华田,等.油松古树衰老过程中的生长与生理变化[J].山东大学学报:理学版,2016,51(5):29-35.
[3] 苏莉,孟森,张胜,等.国槐氮素转运对干旱胁迫的分子响应机制[J].西北林学院学报,2017,32(1):1-11.
SU L,MENG S,ZHANG S,etal.Mechanism of molecular responses of nitrogen transport to drought stress inSophorajaponica[J].Journal of Northwest Forestry University,2017,32(1):1-11.(in Chinese)
[4] 谢斌,郭俊荣,杨培华,等.陕西省银杏古树名木调查[J].西北林学院学报,2003,18(3):31-33.
XIE B,GUO J R,YANG P H,etal.A survey on ancient and famousGinkgobilobatrees in Shaanxi Province[J].Journal of Northwest Forestry University,2003,18(3):31-33.(in Chinese)
[5] 常二梅,史胜青,刘建锋,等.古侧柏针叶活性氧产生及其清除机制[J].东北林业大学学报,2011,39(11):8-11.
CHANG E M,SHI S Q,LIU J F,etal.ROS production and its elimination in oldPlatycladusorientalis'sleaves[J].Journal of Northeast Forestry University,2011,39(11):8-11.(in Chinese)
[6] 郭希梅,丛日晨,张常青,等.古油松衰弱衰老诊断的生理指标[J].林业科学,2011,47(4):43-48.
GUO X M,CONG R C,ZHANG C Q,etal.Physiological diagnosis indices of ancient pines,Pinustabulaeformis[J].Scientia Silvae Sinicae,2011,47(4):43-48.(in Chinese)
[7] 练从龙,赖钟雄,卢秉国,等.荔枝古树胚性愈伤组织Fe-SOD成员基因克隆及生物信息学分析[J].热带作物学报,2014,35(1):74-81.
LIAN C L,LAI Z X,LU B G,etal.Cloning and bioinformatics analysis ofFe-SODgene from embryogenic callus of an ancientLitchitree[J].Chinese Journal of Tropical Crops,2014,35(1):74-81.(in Chinese)
[8] 邵彩虹,王萍,陈金,等.养分胁迫对不易早衰类型水稻生育后期叶片影响的蛋白质组学分析[J].华北农学报,2015,30(4):51-58.
SHAO C H,WANG P,CHEN J,etal.Proteomics analysis of anti-senescence rice leaf under nutrient stress condition during late development stage[J].Acta Agriculturae Boreali-Sinica,2015,30(4):51-58.(in Chinese)
[9] WU X,JIANG L,YU M,etal.Proteomic analysis of changes in mitochondrial protein expression during peach fruit ripening and senescence[J].Journal of Proteomics,2016,147:197.
[10] WEI S,WANG X,ZHANG J,etal.The role of nitrogen in leaf senescence of summer maize and analysis of underlying mechanisms using comparative proteomics[J].Plant Science,2015,233:72-81.
[11] WILSON K A,MCMANUS M T,GORDON M E,etal.The proteomics of senescence in leaves of white clover,Trifoliumrepens(L.)[J].Proteomics,2002,2(9):1114.
[12] 阮松林,童建新,赵杭苹.双向电泳技术研究进展[J].杭州农业科技,2006(5):2-5.
[13] GIRALDO E,DAZ A,CORRAL J M,etal.Applicability of 2-DE to assess differences in the protein profile between cold storage and not cold storage in nectarine fruits[J].Journal of Proteomics,2012,75(18):5774-82.
[14] GUPTA R,LEE S J,MIN C W,etal.Coupling of gel-based 2-DE and 1-DE shotgun proteomics approaches to dig deep into the leaf senescence proteome ofGlycinemax[J].Journal of Proteomics,2016,148:65-74.
[15] WEI X D,SHI D W,CHEN G X.Physiological,structural,and proteomic analysis of chloroplasts during natural senescence ofGinkgoleaves[J].Plant Growth Regulation,2013,69(2):191-201.
[16] WANG W,VIGNANI R,SCALI M,etal.A universal and rapid protocol for protein extraction from recalcitrant plant tissues for proteomic analysis[J].Electrophoresis,2006,27(13):2782.
[17] MÉCHIN V,CONSOLI L,GUILLOUX M L,etal.An efficient solubilization buffer for plant proteins focused in IPGs[J].Proteomics,2003,3(7):1299-1302.
[18] BRADFORD M M.A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J].Analytical Biochemistry,1976,72(1/2):248-254.
[19] HE M,ZHU C,DONG K,etal.Comparative proteome analysis of embryo and endosperm reveals central differential expression proteins involved in wheat seed germination[J].BMC Plant Biology,2015,15(1):97.
[20] 张胜,赵忠,刘昭军,等.四倍体刺槐枝条韧皮部总蛋白质双向电泳体系建立及应用[J].生物技术通报,2013(1):116-122.
ZHANG S,ZHAO Z,LIU Z J,etal.Establishment and application of two-dimensional gel electrophoresis for proteome from the phloem of tetraploidRobiniapseudoacacia[J].Biotechnology Bulletin,2013(1):116-122.(in Chinese)
[21] 张晓林,陆秀君,马蓓蓓,等.天女木兰种子蛋白双向电泳体系的建立[J].西北农林科技大学学报:自然科学版,2012(8):207-214.
ZHANG X L,LU X J,MA B B,etal.Establishment of two-dimensional electrophoresis system ofMagnoliasieboldiiK.Koch seeds[J].Journal of Northwest A & F University:Natural Science Edition,2012(8):207-214.(in Chinese)
[22] 万翠萍,李辉,王付平,等.小麦应答条锈病菌冬孢子产生的蛋白质组学分析[J].农业生物技术学报,2016,24(6):815-823.
WAN C P,LI H,WANG F P,etal.Proteomic analysis of wheat (Triticumaestivum) induced byPucciniastriiformisf.sp.triticiat telial stage[J].Journal of Agricultural Biotechnology,2016,24(6):815-823.(in Chinese)
[23] 王强,王娟,李宁,等.适于番茄叶片蛋白质组分析的双向电泳优化体系的建立[J].新疆农业科学,2016,53(4):610-616.
[24] 刘昭军,张胜,赵忠,等.文冠果枝条韧皮部蛋白质双向电泳体系的建立[J].西北林学院学报,2012,27(3):55-61.
LIU Z J,ZHANG S,ZHAO Z,etal.Optimization of two-dimensional gel electrophoresis for proteome from the phloem ofXanthocerassorbiinlia[J].Journal of Northwest Forestry University,2012,27(3):55-61.(in Chinese)
[25] 刘玉君,沈世华.小桐子种子油体蛋白的提取及其电泳分析[J].林业科学,2008,44(8):37-41.
LIU Y J,SHEN S H.Isolation and polyacrylamide gel electrophoresis analysis of oil body proteins fromJatrophacurcasseeds[J].Scientia Silvae Sinicae,2008,44(8):37-41.(in Chinese)
[26] WANG X,LI X,LI Y.A modified coomassie brilliant blue staining method at nanogram sensitivity compatible with proteomic analysis[J].Biotechnology Letters,2007,29(10):1599-1603.
[27] 王翠玲,张宁,周香艳,等.适用于教学的PAGE电泳染色脱色方法研究[J].实验室科学,2015,18(6):10-13.
[28] 宁传丽,蔡斌华,王涛,等.五倍体草莓及其十倍体的叶片差异表达蛋白分析[J].西北植物学报,2016,36(9):1794-1800.
NING C L,CAI B H,WANG T,etal.Differentially expressed proteins in strawberry leaves between pentaploid and its corresponding allodecaploid[J].Acta Botanica Boreali-Occidentalia Sinica,2016,36(9):1794-1800.(in Chinese)
[29] CHEN S,DING G,WANG Z,etal.Proteomic and comparative genomic analysis reveals adaptability ofBrassicanapusto phosphorus-deficient stress[J].Journal of Proteomics,2015,117:106-19.
[30] ZHANG S,ZHANG L L,ZHOU K K,etal.Evaluation of three types of protein extraction methods for tetraploid black locust (RobiniapseudoacaciaL.) phloem tissue proteome analysis by two-dimensional electrophoresis[J].Analytical Methods,2014,7(3):1008-1017.
[31] KUMARI N,TAJMUL M,YADAV S.Proteomic analysis of matureLagenariasicerariaseed[J].Applied Biochemistry and Biotechnology,2015,175(8):3643.
[32] 王幼宁,刘孟雨,李霞,等.植物3-磷酸甘油醛脱氢酶的多维本质[J].西北植物学报,2005,25(3):607-614.
WANG Y N,LIU M Y,LI X,etal.Multidimengsional nature of glyceraldehyde-3-phosphate dehydrogenase in plants[J].Acta Botanica Boreali-Occidentalia Sinica,2005,25(3):607-614.(in Chinese)
[33] VALEROGALVN J,GONZLEZFERNNDEZ R,NAVARROCERRILLO R M,etal.Physiological and proteomic analyses of drought stress response in Holm oak provenances[J].Journal of Proteome Research,2013,12(11):5110.
[34] 叶薇,陈赛慧,郝东杰,等.衰老过程中线粒体顺乌头酸酶活性变化对能量合成的影响[J].中国病理生理杂志,2013,29(7):1275-1282.
YE W,CHEN S H,HAO D J,etal.Effect of mitochondrial aconitase activity on energy synthesis during aging[J].Chinese Journal of Pathophysiology,2013,29(7):1275-1282.(in Chinese)
[35] SHENG Z,ZHANG L,CHAI Y,etal.Physiology and proteomics research on the leaves of ancientPlatycladusorientalis(L.) during winter[J].Journal of Proteomics,2015,126:263-278.
[36] 陈候鸣,陈跃,王盾,等.核酮糖-1,5-二磷酸羧化酶/加氧酶活化酶在植物抗逆性中的作用[J].植物生理学报,2016(11):1637-1648.
[37] 陈胜勇,李观康,汪云,等.谷氨酰胺合成酶的研究进展[J].中国农学通报,2010,26(22):45-49.
CHEN S Y,LI G K,WANG Y,etal.The research progress of glutamine synthetase[J].Chinese Agricultural Science Bulletin,2010,26(22):45-49.(in Chinese)
[38] 冯万军,邢国芳,牛旭龙,等.植物谷氨酰胺合成酶研究进展及其应用前景[J].生物工程学报,2015,31(9):1301-1312.
FENG W J,XING G F,NIU X L,etal.Progress and application prospects of glutamine synthase in plants[J].Chinese Journal of Biotechnology,2015,31(9):1301-1312.(in Chinese)
[39] THOMSEN H C,ERIKSSON D,MOLLER I S,etal.Cytosolic glutamine synthetase:a target for improvement of crop nitrogen use efficiency [J].Trends in Plant Science,2014,19(10):656.

