丹参川芎嗪联合综合干预对慢性阻塞性肺疾病急性加重期合并呼吸衰竭患者炎性反应及肺功能的影响
冯云霞,侯佳倩
(河北北方学院附属第二医院,河北 张家口 075100)
慢性阻塞性肺疾病(COPD)是呼吸系统常见的气流受限的气道慢性炎性反应疾病,具有不完全可逆性气流受限、进行性发展等特点。由于小气道反复感染,肺血管长期缺O2与CO2潴留,内皮功能紊乱及肺小血管内形成原位血栓等因素,导致肺循环阻力增加,出现不同程度的低氧血症和高碳酸血症,最终发生RF[1]。现阶段,COPD的治疗尚无特效药物,常采用抗菌消炎、平喘等治疗,但易出现反复发作,部分患者效果不理想[2]。丹参川芎嗪具有抗氧化应激、保护血管内皮功能、抗缺血再灌注损伤等作用,广泛应用于肺心病、心力衰竭等心脑血管疾病的治疗,且在COPD的治疗中具有独特优势[3]。本研究对慢性阻塞性肺疾病急性加重期(AECOPD)合并RF患者联合丹参川芎嗪进行治疗,并给予综合干预措施,以探讨其对炎性反应及肺功能的影响。
1 资料与方法
1.1 一般资料 选取2016年8月-2017年7月我院收治的AECOPD合并RF患者110例为研究对象,按照随机数字表法分为观察组和对照组。观察组55例,男31例,女24例;年龄56~75岁,平均(67.8±4.8)岁;病程6~18年,平均(13.1±4.3)年。对照组55例,男32例,女23例;年龄57~77岁,平均(68.1±4.9)岁;病程6~19年,平均(13.4±4.5)年。2组性别、年龄、病程相比无统计学意义(P>0.05)。
1.2 入选与排除标准 入选标准:符合AECOPD合并RF相关诊断标准[4-5];患者及家属同意并签署知情同意书。排除标准:支气管哮喘、肺结核、肺癌等疾病引起的肺功能下降者;伴有心、肝、肾等脏器严重疾病者;伴有出血性疾病、恶性肿瘤、感染性疾病、免疫系统疾病等;近1个月内未用过糖皮质激素类药物;对相关药物过敏及资料不全病例。
1.3 方法 对照组给予抗感染、支气管扩张、祛痰止咳、平喘、营养支持、序贯机械通气等治疗,监测生化指标,保持水、电解质及酸碱平衡。观察组在对照组基础上给予丹参川芎嗪(吉林四长制药,国药准字H22026448)10 mL入0.9%氯化钠或5%葡萄糖250 mL静脉滴注,1次/d。2组治疗10 d后进行疗效评价。2组患者均进行综合护理干预措施,包括心理干预、呼吸功能锻炼、排痰指导、运动指导、营养支持、健康教育、出院指导等。1.4 观察指标 血气指标:治疗前后采集晨起空腹未吸氧状态下桡动脉血,采用血气分析仪测定动脉二氧化碳分压(PaCO2)、动脉氧分压(PaO2)、动脉血氧饱和度(SaO2);炎性反应:治疗前后采集晨起空腹外周静脉血,采用免疫比浊法测定血清C反应蛋白(CRP),酶联免疫吸附法(ELISA)测定血清肿瘤坏死因子-α(TNF-α)、白细胞介素-6(IL-6)、白细胞介素-8(IL-8);肺功能:治疗前后采用肺功能仪检测用力肺活量(FVC),第1 s用力呼气量容积(FEV1)及最大呼气流量(PEF)。
1.5 统计学处理 计数资料采用χ2检验,计量资料采用t检验,以均数±标准差()表示,数据采用SPSS 19.0软件分析,P<0.05为差异有统计学意义。
2 结果
2.1 血气指标比较 2组患者治疗前PaCO2、PaO2、SaO2相比无统计学意义(P>0.05),治疗后PaCO2较同组治疗前降低,PaO2、SaO2较同组治疗前升高(P<0.05);观察组治疗后PaCO2低于对照组,PaO2、SaO2高于对照组(P<0.05)。见表1。
2.2 炎性反应比较 2组患者治疗前TNF-α、CRP、IL-6、IL-8相比无统计学意义(P<0.05),治疗后TNF-α、CRP、IL-6、IL-8较同组治疗前降低(P<0.05);观察组治疗后TNF-α、CRP、IL-6、IL-8低于对照组(P<0.05)。见表2。
表1 2组血气指标比较( ,n = 55)
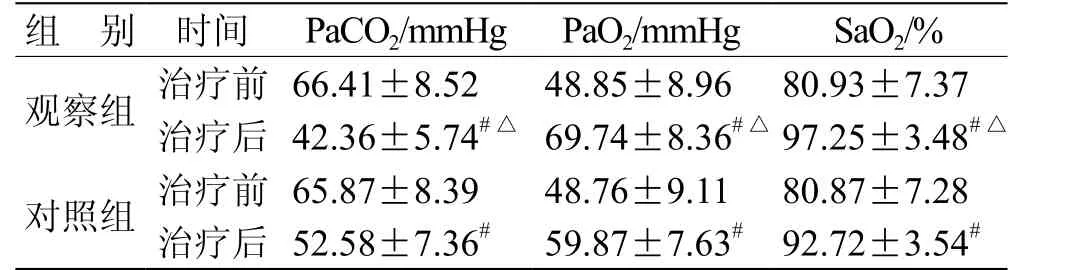
表1 2组血气指标比较( ,n = 55)
注:与同组治疗前相比,# P<0.05;与对照组相比,△ P<0.05
组 别 时间 PaCO2/mmHg PaO2/mmHg SaO2/%观察组 治疗前 66.41±8.52 48.85±8.96 80.93±7.37治疗后 42.36±5.74#△ 69.74±8.36#△ 97.25±3.48#△对照组 治疗前 65.87±8.39 48.76±9.11 80.87±7.28治疗后 52.58±7.36# 59.87±7.63# 92.72±3.54#
2.3 肺功能比较 2组患者治疗前FVC、FEV1、PEF相比无统计学意义(P<0.05),治疗后FVC、FEV1、PEF较同组治疗前升高(P<0.05);观察组治疗后FVC、FEV1、PEF高于对照组(P<0.05)。见表3。
表3 2组 肺 功 能 比 较(,n = 55)

表3 2组 肺 功 能 比 较(,n = 55)
注:与同组治疗前相比,# P<0.05;与对照组相比,△P<0.05
组 别 时间 FVC/L FEV1/L PEF/(L/s)观察组 治疗前 1.81±0.33 1.85±0.46 3.45±0.49治疗后 3.09±0.48#△ 2.83±0.57#△ 4.93±0.84#△对照组 治疗前 1.79±0.32 1.84±0.47 3.46±0.48治疗后 2.12±0.40# 2.18±0.49# 3.97±0.62#
3 讨论
COPD多由下呼吸道感染所引起,小气道重构,发生阻塞和呼气气流限制,肺毛细血管床数量减少,肺泡氧合能力进行性降低,最终形成RF[1]。COPD病因尚不明确,大多与环境、空气污染、遗传、气道高反应性等有关,临床表现为慢性咳嗽咳痰、气短喘息、呼吸困难等,部分患者出现焦虑、抑郁等症状。祖国医学认为[6],COPD属“喘证” “肺胀”“痰饮”等范畴,病机为气虚、痰浊、血瘀,治则以活血化瘀、解痉平喘、补益肺气等为主。丹参川芎嗪主要由丹参、川芎组成。其中丹参主要活性成分为丹参素、丹参酮ⅡA、原儿茶醛,具有良好的杀菌消炎、抗氧化、抗血栓等功效,在改善微循环、保护血管内皮细胞等方面具有独特优势;川芎活血化瘀,可增加冠脉血流量,改善机体微循环,还可抑制组胺、前列腺素等诱发平滑肌痉挛,从而发挥松弛呼吸道平滑肌、舒张支气管、改善肺功能等作用[7-8]。研究[9]显示,丹参川芎嗪可降低肺动脉压,防止肺小动脉血栓形成,改善机体低氧状态,改善肺著改善AECOPD合并RF患者肺功能。AECOPD合并RF患者毛细血管床数量减少,小动静脉间形成循环功能,纠正RF。本研究显示,观察组治疗后FVC、FEV1、PEF高于对照组(P<0.05),提示丹参川芎嗪可显分流,血液不能充分进行氧合而发生缺氧症状[10]。有报道[11],丹参川芎嗪能够促进COPD患者气道通气功能的恢复,降低PaCO2含量,控制气道高反应性。本研究显示,观察组治疗后PaCO2低于对照组,PaO2、SaO2高于对照组(P<0.05),提示丹参川芎嗪可有效改善AECOPD合并RF患者缺氧状态,平衡血气指标水平,促进肺功能恢复。
表2 2组炎性反应比较(,n = 55)

表2 2组炎性反应比较(,n = 55)
注:与同组治疗前相比,# P<0.05;与对照组相比,△P<0.05
组 别 时间 TNF-α/(pg/mL) CRP/(mg/L) IL-6/(pg/mL) IL-8/(pg/mL)观察组 治疗前 95.53±16.82 37.69±10.54 30.75±12.81 22.73±5.65治疗后 52.93±11.75#△ 8.64±2.57#△ 15.35±5.24#△ 9.84±3.34#△对照组 治疗前 95.47±16.65 37.47±10.29 31.28±13.26 22.59±5.36治疗后 78.33±17.52# 20.69±5.39# 24.74±6.81# 16.83±4.17#
AECOPD的发病机制主要是气道高反应性及氧化应激反应、炎症反应等。炎症因子浸润程度增加,导致大量炎症物质产生,引起支气管感染,造成黏膜充血、管腔堵塞及气道重塑,使肺功能受到严重影响[12]。COPD合并RF的发生发展常伴有细胞因子、黏附分子的异常表达。CRP为急性时相反应蛋白,较其他炎性因子表达均早,能够反映疾病整体炎性反应负荷水平,其水平升高提示病情恶化;TNF-α在细菌及病毒等因素的刺激下,激活单核细胞、淋巴细胞、中性粒细胞的致炎作用,诱导气道上皮细胞与中性粒细胞生成IL-8等细胞因子,引发气道与肺组织损伤,参与肺泡纤维化过程,导致气道出现慢性炎症与加重肺组织损伤;IL-6可刺激内皮细胞分泌白细胞趋化因子,损伤内皮功能,是机体炎性反应的主要调节因子;IL-8为中性粒细胞趋化因子,并存于气道炎症始末,趋化并激活中性粒细胞在气道黏膜的积聚,导致肺泡上皮和肺血管内壁的损伤,其表达在一定程度上反映气道炎症严重程度[13-14]。有学者采用丹参川芎嗪治疗COPD合并RF,2周后患者肺功能指标及血气指标均显著改善,炎性因子水平明显降低,认为丹参川芎嗪能够有效降低机体炎性反应,促进肺功能恢复[15]。本研究显示,观察组治疗后TNF-α、CRP、IL-6、IL-8低于对照组(P<0.05),提示丹参川芎嗪可有效抑制AECOPD合并RF患者的机体炎性反应,减轻气道高反应性,有效改善肺功能。
综上所述,综合干预可有效改善AECOPD合并RF患者的负性情绪,使其更好地配合治疗。丹参川芎嗪能够有效减轻机体炎性反应,改善血气指标,有效促进肺功能的恢复。
[1]赵振钧,邓炯.慢性阻塞性肺疾病发生相关因素的研究进展[J].上海交通大学学报, 2016, 36(1):128-132.
[2]堵钧伟,俞万钧.比索洛尔对慢性阻塞性肺疾病患者肺功能及相关炎症介质表达的影响[J].中国乡村医药, 2015,22(22):7-8.
[3]朱颖炜,韦凡平,程震锋. 丹参川芎嗪注射液对AECOPD并发肺心病患者血清SAA、BNP的影响[J].心脑血管病防治, 2017, 17(3):215-216.
[4]慢性阻塞性肺疾病急性加重(AECOPD)诊治专家组.慢性阻塞性肺疾病急性加重诊治专家共识[J].国际呼吸杂志,2014, 34(1):1-11.
[5]葛均波,徐永健.内科学[M].8版.北京:人民卫生出版社,2013:113.
[6]张文江,樊长征,高金柱,等.十味龙胆花胶囊联合西药治疗慢性阻塞性肺疾病急性加重临床研究[J].中国中医药信息杂志, 2015, 22(2):13-16.
[7]红怡. 丹参川芎嗪注射液治疗慢性阻塞性肺疾病急性加重期疗效观察[J].实用中医药杂志, 2015, 31(5):376-377.
[8] 甘文云,王腾,李海明,等. 丹参川芎嗪治疗慢性阻塞性肺疾病急性加重期并肺源性心脏病的临床观察[J].中国临床医学, 2015, 22(2):189-191.
[9]夏倩,罗光伟,张念.丹参川芎嗪注射液对慢性阻塞性肺疾病合并肺动脉高压的疗效观察[J].中国中医急症, 2014,23(9):1728-1729.
[10]张晓波,窦海艳.丹红注射液联合无创呼吸机治疗慢性阻塞性肺疾病急性加重期合并Ⅱ型呼吸衰竭80例疗效评价[J].辽宁中医杂志, 2017, 44(2):304-306.
[11]贾铷,陈运转,祝伟. 丹参川芎嗪对慢性阻塞性肺疾病合并呼吸衰竭患者肺功能炎性反应因子的变化[J].世界中医药, 2017, 12(6):1361-1364.
[12]朱勇,张浩.固肾定喘丸联合盐酸氨溴索治疗老年慢性阻塞性肺疾病急性加重期的临床研究[J].现代药物与临床,2016, 31(12):1937-1941.
[13]刘秀卿,李卓成,李延武.慢性阻塞性肺疾病患者血清维生素D与炎症因子和肺功能相关性研究[J].检验医学与临床, 2016,13(13):1781-1782,1785.
[14]邵娜,蔡琦玲,袁连方.肺肠同治法对慢性阻塞性肺疾病急性加重期肺热腑实证患者炎症指标及肺功能的影响[J].中国医药导报, 2016, 13(13):81-84.
[15]郑玉兰,付文荣,曹锋生. 丹参川芎嗪对慢性阻塞性肺疾病急性加重合并呼吸衰竭患者肺功能及炎症因子的影响[J].中国老年学杂志, 2015, 12(35):7 109-7 111.

