慢病毒介导shRNA抑制β-连环蛋白对儿童髓母细胞瘤细胞株生物学行为的影响
万 江 张海燕 刘义红 李新涛 涂胜英 吴丽敏
髓母细胞瘤(MB)是一种好发于儿童的颅内恶性肿瘤,占儿童中枢神经系统肿瘤的 10%~20%,发病高峰在7岁左右,病情进展迅速,治疗棘手[1,2]。常采用外科手术切除后辅助放化疗,疗效不理想[3,4]。MB的病因及发病机制迄今尚不明了,可能与多条细胞信号转导通路的异常有关,其中Wnt信号转导通路是调控细胞增殖和分化的重要途径,肿瘤中普遍存在Wnt信号转导通路中关键效应物β-连环蛋白(β-catenin)的异常激活[5,6]。本研究通过构建靶向干扰β-catenin基因的shRNA的慢病毒载体,感染儿童MB细胞株DOAY,建立稳定抑制β-catenin基因表达的细胞株,观察β-catenin对其增殖、凋亡、侵袭和迁移等的影响。
1 方法
1.1 实验材料 慢病毒载体包装系统购自美国System Biosciences公司,其中pCDH-CMV-MCS-EF1-copGFP质粒包含绿色荧光蛋白(GFP)基因,pRsv-REV、pMDlg-pRRE和pMD2G质粒包含病毒包装所需元件;DAOY购自中国科学院上海细胞库;DNA凝胶回收试剂盒、BamH I和EcoR I内切酶、DNA连接试剂盒购自日本TaKaRa公司;Opti-DMEM培养基、Lipofectamine 2000脂质体和TRIzol总RNA提取试剂盒购自美国Invitrogen公司;逆转录试剂盒购自美国ABI公司;兔抗人β-catenin一抗、HRP标记的羊抗兔IgG二抗和ECL显色试剂盒购自美国Santa Cruz公司;Annexin V/PI双染色流式法细胞凋亡检测试剂盒购自德国Bender公司。
1.2 靶向β-catenin的shRNA慢病毒载体的构建与包装
1.2.1 shRNA寡核苷酸链的设计合成 参照文献[7]、根据β-catenin miRNA序列(NM-BC053065.1)设计shRNA 1、2、3和阴性对照(NC),每条核苷酸链的中间添加茎环结构TTCAAGAGA,正、反义链的5'端分别引入GATCC和AATTC,分别与BamH I和EcoR I酶切后的粘性末端互补,序列见表1,经Blast比对与人类其他基因编码序列无同源性,委托上海吉玛制药技术有限公司合成。

表1 靶向β-catenin的shRNA寡核苷酸链序列
1.2.2 pCDH-shRNA慢病毒质粒构建 用BamH I和EcoR I对pCDH-CMV-MCS-EF1-copGFP慢病毒质粒进行双酶切, 将shRNA寡核苷酸链退火形成双链DNA并与双酶切后的质粒连接,连接产物转化感受态DH5α大肠杆菌,在氨苄青霉素琼脂培养基平板上培养,筛选阳性克隆后委托上海吉玛制药技术有限公司测序验证。
1.2.3 Lentivirus-shRNA慢病毒包装和滴度测定 293T细胞用RM1640 [含10﹪胎牛血清(FBS)、100 U·L-1青霉素、100 mg·L-1链霉素]培养,接种于6孔板。通过Lipofectamine 2000介导慢病毒载体包装系统的质粒共转染293T细胞。转染后收集含有慢病毒颗粒的细胞上清液,经0.45 μm的过滤器过滤后获得慢病毒纯化液,通过实时荧光定量PCR测定病毒滴度。
1.3 靶向β-catenin的shRNA慢病毒的筛选 ①DOAY细胞株用RM1640(含10﹪FBS、100 U·L-1青霉素、100 mg·L-1链霉素)于37 ℃、5% CO2条件培养,隔天更换培养液,细胞生长至85%融合时用0.25%胰蛋白酶消化、传代,取对数生长期细胞接种于6孔板。②共分为5组(每组6孔),Lentivirus(LV)-shRNA 1、2、3和NC组分别用包装好的Lentivirus-shRNA 1、2、3和NC感染细胞,每孔加入100 μL病毒液,同时设置未用病毒感染的空白对照组(Blank)。6 h后更换正常培养液继续培养。③感染72 h后,在荧光显微镜下观察各组细胞绿色荧光蛋白(GFP)的表达情况,首先在白光视野下计数细胞的总数目,再在荧光视野下计数表达荧光的细胞数目,转染效率=(荧光表达细胞数目/白光视野细胞总数)×100%,取10个视野,计算其平均值。④感染后培养96 h,收集各组细胞。 ⑤RT-PCR检测细胞中β-catenin mRNA表达:细胞总RNA的提取和逆转录按照试剂盒的说明书进行操作,A260/A280比值1.8~2.0提示样品RNA满足实验要求。以cDNA作为模板进行PCR扩增,引物系由上海吉玛制药技术有限公司设计和合成。β-catenin引物F:5’-GTGCTGAAGGTG-CTATCTGTCTGC-3’,
R:5’-TGAACAAGACGTTGACTTGGATCTG-3’;GAPDH引物F:5’-CATGAGAAGTAT-GACAACAGCCT-3’,R:5’-AGTCCTTCC-ACGATACCAAAGT-3’。扩增产物经1.5%琼脂糖凝胶电泳,Bio-Rad分析系统扫描分析,目的基因相对表达量=目的基因光密度值/GAPDH光密度值。⑥Western Blot检测细胞中β-catenin蛋白表达:提取细胞总蛋白并用BCA法测定浓度,以80 μg总蛋白上样,采用10%的SDS-PAGE胶、PVDF膜,β-catenin兔抗人一抗工作液(1∶100)4 ℃孵育过夜,HRP标记的羊抗兔二抗工作液(1∶100)37 ℃孵育1 h,ECL显色,用Bio-Rad分析系统扫描分析。目的蛋白相对表达量=目的蛋白光密度值/GAPDH光密度值。
1.4 稳定细胞株的筛选 ①取对数生长期DOAY细胞接种于6孔板,加入不同浓度(1、2、3、4和5 μg·mL-1)的嘌呤霉素,选择在10~14 d内让全部细胞死亡的最低浓度为最佳筛选浓度。②用1.3筛选实验中对β-catenin抑制效果最佳的LV-shRNA感染DOAY细胞,之后将细胞接种于6孔板,孵育24 h后加入嘌呤霉素,使之达到①中最佳筛选浓度。每隔2 d更换新的含嘌呤霉素(最佳筛选浓度)的培养液,连续培养10 d。收集抗性细胞,获得稳定抑制β-catenin表达的DOAY细胞株。以相同方法用嘌呤霉素筛选稳定感染LV-NC的DOAY细胞株。
1.5 干扰β-catenin对细胞增殖、凋亡、侵袭和迁移的影响 分3组,LV-shRNA 组:1.4中筛选得到的稳定抑制β-catenin表达的DOAY细胞株;LV-NC组:1.4中筛选得到的稳定感染Lentivirus-NC的DOAY细胞株;Blank组:未感染病毒的DOAY细胞株。
1.5.1 MTT检测细胞增殖能力 将细胞接种于96孔板,于接种后24、48、72、96、120 h每孔加20 μL 的MTT溶液(5 mg·μL-1)。继续孵育4 h后,去掉原培养液,每孔加入150 μL二甲基亚砜,室温振摇15 min,酶标仪测定各组OD(570)值并绘制曲线。
1.5.2 流式细胞术检测细胞凋亡 细胞接种于6孔板,孵育48 h后收集,按Annexin V/PI双染色流式法细胞凋亡检测试剂盒说明书操作。
1.5.3 Transwell实验检测细胞侵袭能力 使用无血清的RM1640培养液将细胞接种于自带基质胶的Transwell小室上室,下室加入RM1640+10%FBS。孵育48 h后,擦去靠近基底膜内室的细胞,另一面细胞经10%甲醇固定,PBS洗涤,结晶紫染色,PBS洗涤,显微镜下观察细胞并记数。
1.5.4 细胞划痕实验检测细胞迁移能力 细胞接种于6孔板,生长至90%融合时,于6孔板底部沿直线划痕,并更换为无血清的RM1640培养液。孵育48 h后,4%多聚甲醛固定30 min,Gimesa染色,观察细胞迁移情况。细胞相对迁移能力=0 h划痕距离-48 h划痕距离。

2 结果
2.1 慢病毒感染和稳定细胞株筛选 图1显示,感染72 h后,Blank组细胞未见GFP表达,LV-shRNA 1、 2、3和NC 组细胞感染效率分别为(91.2±3.1)%、(93.2±2.9)%、(90.6±3.2)%和(89.9±2.1)%,经方差分析各组间差异无统计学意义(P>0.05)。
图2A中RT-PCR检测显示,各LV-shRNA组β-catenin mRNA表达均低于LV-NC组(0.95±0.21)和Blank组(0.89±0.23),LV-shRNA 1组(0.24±0.09)低于LV-shRNA 2组(0.47±0.15)和LV-shRNA 3 组(0.53±0.13),差异均有统计学意义(P<0.05);图2B Western Blot显示,各LV-shRNA组β-catenin蛋白表达均低于LV-NC组(0.89±0.19)和Blank组(0.81±0.20),LV-shRNA 1组(0.15±0.07)低于LV-shRNA 2组(0.38±0.14)和LV-shRNA 3组(0.41±0.14),差异均有统计学意义(P<0.05)。

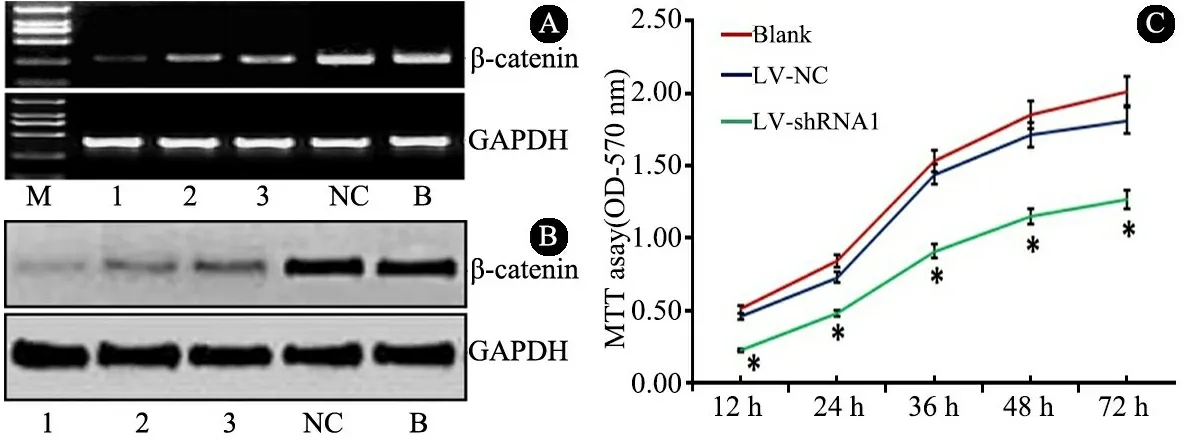
图1 荧光显微镜观察各组DOAY细胞绿色荧光蛋白(GFP)表达情况
图2各组DOAY细胞中β-catenin的mRNA(A)和蛋白(B)表达情况,LV-shRNA1对DOAY细胞增殖的影响(C)
注 M:Marker,1、2、3、NC和B分别为LV-shRNA 1、2、3、NC组和Blank组
综合病毒感染效率和LV-shRNA干扰效率,LV-shRNA 1对β-catenin抑制效果最好,以4 μg·mL-1嘌呤霉素筛选稳定表达LV-shRNA 1的DOAY细胞株。
2.2 LV-shRNA 1对DOAY细胞增殖、凋亡、侵袭和迁移的影响 ①增殖:MTT细胞生长曲线(图2C)显示,LV-shRNA 1组第12、24、36、48、72 h时OD(570)值低于LV-NC组和Blank组(P<0.05)。②凋亡:双变量流式细胞仪散点图(图3)显示,LV-shRNA 1组细胞总凋亡率[(31.3±4.2)%]高于LV-NC组[(13.3±3.3)%]和Blank组[(17.4±3.1)%],P<0.05。③侵袭:Transwell实验(图4)显示,LV-shRNA 1组穿膜细胞数目(23.4±8.3)少于LV-NC组(69.8±14.7)和Blank组(74.2±16.7),P<0.05。④迁移:细胞划痕实验(图5)显示,LV-shRNA 1组细胞迁移距离[(314.6±47.1)μm]小于LV-NC组 [(689.4±73.6)μm]和Blank组[(701.5±79.0)μm],P<0.05。

图3AnnexinV/PI双染色流式细胞术检测DOAY细胞凋亡情况
注 Q1:中晚期凋亡细胞;Q2:坏死细胞;Q3:存活细胞;Q4:早期凋亡细胞


图4 Transwell实验检测DOAY细胞的侵袭能力(×100)
图5细胞划痕实验检测DOAY细胞的迁移能力
3 讨论
研究显示,Wnt信号转导通路在调控细胞增殖和分化等过程中发挥重要作用,且与多种肿瘤的发生和发展密切相关[8]。此外,还参与神经细胞的发育、分化和成熟,对原始神经干细胞的分化和成熟以及中枢神经系统的发育至关重要[9]。β-catenin是Wnt信号转导通路中的关键效应因子,β-catenin的异常激活可使神经干细胞向肿瘤干细胞分化,从而参与MB的发生和发展[10]。当Wnt信号转导通路失活时,胞浆中的β-catenin主要与细胞膜上的E-钙黏蛋白结合,部分与胞浆中的 APC蛋白、Axin蛋白、糖原合成酶激酶-3 (GSK-3β)和酪蛋白激酶-1(CK-1)相互作用,形成β-catenin降解复合体。磷酸化的β-catenin降解复合体泛素化,经泛素-蛋白酶体系统(UPS)降解,从而使细胞内β-catenin含量维持在正常水平[11,12]。当Wnt信号转导通路激活时,
β-catenin降解复合体解散,磷酸化与泛素化过程受阻,胞质内β-catenin不断蓄积,并通过核孔转运进细胞核,作为转录启动子与T细胞因子/淋巴增强子(TCF/LEFs) 等转录因子家族结合,从而激活细胞周期蛋白-1(Cyclin D-1)和C-myc等癌基因的转录和表达,导致肿瘤的发生和发展[11,12]。马俊艳等[13]证实,β-catenin在人脑干神经胶质瘤中的表达随肿瘤分级的增加而增加,推测其可能与脑干神经胶质瘤的恶性程度有关。另有研究[14]发现, β-catenin 在MB组织中的阳性表达率高于正常组织(66.7%vs10.0%,P<0.05),推测其可能参与MB的发生和发展。因而,深入探索β-catenin与MB的关系,从分子生物学水平寻求特异性治疗靶点,将为MB的防治提供新的思路。
RNA干扰技术(RNAi)是近年来广泛用于调控生物基因表达与功能的技术,通过体外转录或体内表达的小干扰RNA(siRNA)诱导序列特异的目的基因沉默,该技术目前已成为研究基因功能和实现基因治疗的热点。如何将siRNA完整地送入靶细胞是目前制约RNAi技术广泛应用的关键。目前常用的载体主要有质粒和病毒,不同的表达载体在合成过程、转染效率和转染效果方面各有优缺点。质粒载体的制备较简单,但是导入效率低,且无法长期稳定表达。病毒载体主要有腺病毒、逆转录病毒和慢病毒等,其中慢病毒载体既能转染分裂期细胞又能转染非分裂期细胞,能够将siRNA整合至靶细胞中实现长期稳定的表达,而且转导效率高、免疫反应小[15]。在本次实验中我们构建了小发卡RNA(shRNA),以克服siRNA半衰期短和无法持久表达等缺点,进一步加工成shRNA的慢病毒载体,从而将shRNA高效导入细胞并稳定表达。在shRNA慢病毒载体加工的过程中,对于靶基因位点的选择十分关键,因此对shRNA编码序列的选择尤为重要。应尽量避免5'和3'非编码区和起始密码子区等调节蛋白结合位点区域,在本研究中我们选择了编码区起始密码子下游433、769、1 181和2 348共4个位点作为干扰靶点,有效避免了某一位点不能干扰β-catenin表达的情况,同时还设置了阴性对照序列,从而排除了转染序列本身对β-catenin表达的影响。
本研究结果发现, LV-shRNA 1对β-catenin抑制效果最好,通过嘌呤霉素筛选,获得了稳定抑制β-catenin表达的DOAY细胞株。细胞接触生长抑制性丧失是恶性肿瘤的重要特点,本研究观察了抑制β-catenin表达对细胞增殖和凋亡的影响,结果发现,LV-shRNA 1组第12、24、36、48、72 h时的OD值减小,细胞总凋亡率升高,说明抑制β-catenin表达能够显著抑制DOAY细胞增殖并促进其凋亡。MB肿瘤细胞有沿脑脊液产生播散性种植的倾向,本研究进一步观察了抑制β-catenin表达对DOAY细胞侵袭和迁移能力的影响,结果发现,LV-shRNA 1组穿膜细胞数目减少,细胞迁移距离缩短,说明抑制β-catenin表达减弱了肿瘤细胞的侵袭、迁移能力。其原因可能为:抑制β-catenin表达,一方面阻碍Wnt信号转导通路下游Cyclin D1和C-myc等癌基因的表达;另一方面增加了肿瘤细胞间的黏附作用,使癌细胞浸润性和分散性生长受阻。
综上所述,稳定抑制β-catenin表达可抑制DOAY细胞的增殖,降低其侵袭和迁移能力,促进其凋亡,β-catenin有潜力成为治疗MB的新靶点。
[1] 余云湖, 朱涛. 儿童髓母细胞瘤基础研究进展. 中华神经外科疾病研究杂志, 2011, 10(5): 475-476
[2] 段泽君, 姚坤, 边宇, 等. 髓母细胞瘤分子病理学分型及与临床治疗、预后相关性研究. 诊断病理学杂志, 2016, 23(5) :387-389
[3] 申戈, 郝瑞敏, 申文江. 儿童髓母细胞瘤治疗的新进展. 中华放射肿瘤学杂志, 2013, 22(6): 509-512
[4] 纪文元, 梁平. 儿童髓母细胞瘤术后放疗、化疗的治疗进展. 中华实用儿科临床杂志, 2011, 26(11): 884-886
[5] 江贤萍, 徐金永, 陈乾, 等. 儿童髓母细胞瘤中β-catenin的表达及意义. 临床与实验病理学杂志, 2014, 30(1): 46-50
[6] Roussel MF, Hatten ME. Cerebellum development and medulloblastoma . Curr Top Dev Biol, 2011, 94(3): 235-282
[7] 姚伟, 李凯, 董岿然, 等. 稳定抑制β-catenin表达的神经母细胞瘤细胞株的建立及其对细胞活性的影响. 中华小儿外科杂志, 2013, 34(9): 678-683
[8] Wray J, Hartmann C. WNTing embryonic stem cells . Trends Cell Biol, 2012, 22(3): 159-168
[9] 李昱, 唐俐. 髓母细胞瘤中Atoh1与Wnt/β-catenin和Shh通路的关系研究进展. 中国神经肿瘤杂志, 2012, 10(4): 267-271
[10] Rogers HA, Sousa S, Salto C, et al. Wnt/β-catenin pathway activation in Myc immortalised cerebellar progenitor cells inhibits neuronal differentiation and generates tumours resembling medulloblastoma . Br J Cancer, 2012, 107(7): 1144-1152
[11] Miki T, Yasuda SY, Kahn M. Wnt/β-catenin signaling in embryonic stem cell self-renewal and somatic cell reprogramming . Stem Cell Rev, 2011, 7(4): 836-846
[12] Sokol SY. Maintaining embryonic stem cell pluripotency with Wnt signaling . Development, 2011, 138(20): 4341-4350
[13] 马俊艳, 武文浩, 田永吉, 等. 人脑干胶质瘤 N-cadherin、E-cadherin及β-catenin 的表达及其意义. 中华神经外科杂志, 2011, 27(4) : 418-422
[14] Zhang X, Zhang HM, Li Y. Expressions of β-catenin, SUFU and VEGFR-2 Proteins in medulloblastoma . Chinese Journal of Cancer Research, 2007, 19(4): 299-303
[15] 张曼, 孙秀萍, 宋铭晶. 慢病毒载体用于转基因技术的研究进展. 中华临床医师杂志:电子版, 2014, 8(10): 1949-1953

