杏鲍菇重组漆酶对不同酚类污染物的降解研究
, , ,
(南京师范大学泰州学院,江苏泰州 225300)
工业水体污染是当今社会所面临的难题之一,酚类化合物是工业废水中常见的一类单环芳香烃污染物,其中苯酚、氯酚、壬基酚的污染更为突出,是必须严格控制的污染物[1]。壬基酚(Nonylphenol,NP)具有毒性、高吸附性、难降解性、生物累积性和雌激素活性,是一种典型的内分泌干扰物(endocrine disrupting chemical,EDCs),已被联合国环境保护署列入27种优先控制的持久性有毒污染物(persistent toxic substances,PTS)[2-4],在水体、土壤、食品中都能检测到,我国某河流中壬基酚最高检出浓度为8 μg·L-1[5-7]。2,4-二氯酚(2,4-Dichlorophenol,2,4-DCP)是一种具有强生物毒性、难降解的有机污染物[8-10],具有雌性激素活性的物质,能干扰生物体正常的激素分泌,从而影响生殖功能,故属于环境荷尔蒙物质及优先污染控制物质[11-13]。对苯二酚(Hydroquinone,HQ)是重要的化工中间体[14],1998年,国家环保总局等单位把对苯二酚列入国家危险废物名录[15]。大部分酚类易溶于水、结构稳定并且难分解和转化,使其在自然界中不断积累,给自然环境造成严重危害。
目前对酚类废水的处理主要有物理法、化学法和生物法。其中,生物法无二次污染,在治理酚类污染物方面的作用日益突出。漆酶(laccase)是一种含铜多酚氧化酶,具有较强的氧化还原能力,可以催化降解多种酚类及其衍生物[16-19],因此其在环境治理方面具有广阔的应用前景。目前利用漆酶对酚类物质进行降解被广泛报道,陈辉[20]用漆酶降解2,4-二氯酚,其降解率10 h内达到94%;李旭春[21]利用矿质盐培养基溶液(MSM)并以NP为唯一碳源分离得到一株NP高效降解菌NP-1,用该菌种对NP进行降解,培养10 d的降解率是65%,并且10 d以后基本不再降解;马燕燕[22]采用梯度稀释涂布法从李村河口底泥样品中分离出四株真菌,通过实验发现W-1,W-2对壬基酚的降解效果好,W-1和W-2培养28 d对壬基酚的降解率能达到95%。但是这些研究主要集中在真菌发酵漆酶复合同工酶对酚类物质进行降解,不能较好的研究单一漆酶同工酶对污染物的降解能力。此外,比较单一漆酶降解不同结构酚类污染物的研究也较少。
本文以来源于杏鲍菇的重组漆酶为研究对象,对该重组漆酶进行酶学性质的研究,并比较其对两种不同结构酚类污染物的降解,研究降解时间、酚的浓度、漆酶浓度以及pH对降解效果的影响,为实现酚类污染物的高效降解提供参考。
1 材料与方法
1.1 材料与仪器
毕赤酵母工程菌P.pastorisKM71H(PeLac) 南京师范大学泰州学院微生物实验室保存;2,2′-连氮-双(3-乙基苯并噻唑-6-磺酸)(ABTS) Sigma公司;无氨基酵母氮源(YNB) Gentihold公司;甲醇 色谱纯,Merck集团;壬基酚和2,4-二氯酚 分析纯,国药集团;阴离子琼脂糖凝胶(DEAE Sepharose F.F) GE公司;YPD完全培养基 1%酵母提取物,2%细菌蛋白胨,2%葡萄糖,2%琼脂;BMGY诱导培养基 1%酵母提取物,2%细菌蛋白胨,100 mmol/L pH6.0的磷酸二氢钾-磷酸氢二钾缓冲液,1.34% YNB,0.004%生物素,1%甘油。
5810型高速冷冻离心机 德国Eppendorf公司;1260型液相色谱 美国安捷伦科技有限公司;HZQ-X100恒温振荡器 上海天呈科技有限公司;PHS-25型数字pH计 上海大普仪器;FA2204电子分析天平 上海方瑞仪器;Millipore Direct 8超纯水系统 美国Millipore;Labscale超滤系统 美国Millipore公司。
1.2 实验方法
1.2.1 重组漆酶的表达 将重组漆酶毕赤酵母工程菌株P.pastorisKM71H(PeLac)接种于YPD培养基中,28 ℃培养2~3 d,待长出单菌落后,储存于冰箱中备用。挑单菌落于BMGY培养基,28 ℃,180 r/min恒温振荡培养1~2 d,按照5%的接种量转接至新鲜的BMGY培养基中,28 ℃,180 r/min恒温振荡培养,每隔24 h添加终浓度为0.5%的甲醇,诱导7 d后每隔24 h取样并测定其酶活。
1.2.2 重组漆酶酶活测定 以ABTS为底物,3 mL反应体系中含有1 mmol/L ABTS底物1 mL,50 mmol/L pH5.0柠檬酸-柠檬酸钠缓冲液和酶液共计2 mL,420 nm下测定反应液3 min内的吸光值变化。一个酶活力单位定义为在当前反应条件下每分钟氧化1 μmol ABTS所需的酶量[23]。计算重组漆酶酶活(EA)的公式如下:

式中:ΔA:吸光度的增量;Δt:反应时间的变化量;V1:总反应体积;V2:酶液的体积;ε:消光系数(εABTS=3.6×104L·mol-1·cm-1);N:酶液稀释倍数。
1.2.3 重组漆酶的纯化 每升漆酶粗酶液加入559.0 g的硫酸铵固体,其饱和度为85%,在4 ℃的冰箱静置过夜,12000 r/min离心20 min,去上清,沉淀用20 mmol/L pH6.0磷酸盐缓冲液溶解,超滤脱盐浓缩。将浓缩后的重组漆酶酶液用DEAE Sepharose F. F进行纯化,纯化条件:上样缓冲液选用20 mmol/L pH6.0磷酸盐缓冲液;洗脱缓冲液选用含有1 mol/L氯化钠的20 mmol/L pH6.0磷酸盐缓冲液;洗脱方式为用0~1 mol/L的氯化钠进行线性梯度洗脱;流速1 mL/min;在280 nm下进行吸光值检测,收集具有酶活性的漆酶酶液,脱盐浓缩并用50 mmol/L pH5.0柠檬酸-柠檬酸钠缓冲液进行置换,经过纯化浓缩后的漆酶的活性为10.2 U/mL。
1.2.4 重组漆酶的酶学性质测定
1.2.4.1 重组漆酶最适反应温度 3 mL反应体系中含有1 mmol/L ABTS底物l mL,50 mmol/L pH5.0柠檬酸-柠檬酸钠缓冲液和酶液共计2 mL,将重组漆酶于20、30、40、50、60、70、80 ℃的条件下测定酶活力,以最高酶活力为100%,计算其它温度下的相对酶活力。
1.2.4.2 重组漆酶最适反应pH 3 mL反应体系中含有1 mmol/L ABTS底物l mL,重组漆酶于pH2.0、3.0、3.5、4.0、4.5、5.0、5.5、6.0下测定酶活力,以最高酶活力为相对酶活100%,计算其它pH下的相对酶活力。
1.2.4.3 重组漆酶热稳定性 以ABTS作为重组漆酶酶活测定的底物,将重组漆酶于30、40、50、60 ℃条件下分别保温10、20、30 min、1、1.5、2、4、8、12 h取样,以不经过保温处理测定的重组漆酶酶活为100%,检测各个条件下的酶活力并计算相对酶活力。
1.2.4.4 重组漆酶pH稳定性 以ABTS作为重组漆酶酶活测定的底物,研究重组漆酶在pH2.0、3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0条件下,30 ℃保温24 h的稳定性,以不经过任何处理测定的漆酶活力为100%,计算其它条件下的相对酶活。
1.2.5 重组漆酶对酚类化合物的降解
1.2.5.1 时间对重组漆酶降解酚类化合物的影响 分别将壬基酚和2,4-二氯酚置于pH4.0的50 mmol/L柠檬酸钠缓冲液中,反应体系中酚类物质的终浓度为10 mg/L,重组漆酶的浓度为1 U/mL,于30 ℃水浴恒温振荡,在4、8、12、16、20、24 h取样,利用HPLC测定两种酚类的浓度并计算两种酚的降解率。
1.2.5.2 酚类物质的浓度对重组漆酶降解酚类化合物的影响 分别将壬基酚和2,4-二氯酚置于pH4.0的50 mmol/L柠檬酸钠缓冲液中,反应体系中酚类物质的终浓度分别为2.5、5、10、15、20 mg/L,重组漆酶的浓度为1 U/mL,于30 ℃水浴恒温振荡,在16 h取样,利用HPLC测定两种酚类的浓度并计算两种酚的降解率。
1.2.5.3 重组漆酶浓度对酚类化合物降解的影响 分别将壬基酚和2,4-二氯酚置于pH4.0的50 mmol/L柠檬酸钠缓冲液中,反应体系中酚类物质的终浓度均为10 mg/L,重组漆酶的浓度均为0.25、0.5、0.75、1、1.25 U/mL,于30 ℃水浴恒温振荡,在16 h取样,利用HPLC测定两种酚类的浓度并计算两种酚的降解率。
1.2.5.4 pH对重组漆酶降解不同酚类化合物的影响 分别将壬基酚和2,4-二氯酚置于pH3.0、3.5、4.0、4.5、5.0的50 mmol/L柠檬酸钠缓冲液中,反应体系中酚类物质的终浓度均为10 mg/L,重组漆酶的浓度均为1 U/mL,于30 ℃水浴恒温振荡,在16 h取样,利用HPLC测定两种酚类的浓度并计算两种酚的降解率。
1.2.5.5 两种酚的降解效果验证实验 在壬基酚浓度为10 mg/L,pH3.5,酶浓度为1 U/mL的条件下,于30 ℃,恒温振荡16 h测定壬基酚的浓度并计算其降解率;在2,4-二氯酚浓度为5 mg/L,pH4.0,酶浓度为1.25 U/mL的条件下,于30 ℃,恒温振荡16 h测定2,4-二氯酚的浓度并计算其降解率。
1.2.6 酚类化合物的含量测定及计算 酶解样本经乙酸乙酯(1∶1)萃取3次后,用0.22 μm有机色谱滤膜过滤,采用液相色谱仪(色谱柱:Agilent HC-C18,4.6 mm×150 mm,5μm)测定壬基酚、2,4-二氯酚含量,流速为1 mL/min,进样量为20 μL。壬基酚HPLC条件:柱温25 ℃,流动相为甲醇∶水=90∶10,检测器波长为225 nm。2,4-二氯酚HPLC条件:柱温30 ℃,流动相为甲醇∶水=40∶60,检测器波长为240 nm。
降解率(%)=(反应前酚类浓度-反应后酚类浓度)÷反应前酚类浓度×100。
1.3 数据处理
实验中每个处理重复三次,采用SPASS 17.0进行统计分析,不同处理间差异显著性用单因素方差分析进行比较(p<0.05),并采用Origin 8.0作图。
2 结果与讨论
2.1 重组漆酶的酶学性质
2.1.1 重组漆酶的最适反应温度和pH 由图1可知,在20~60 ℃范围内,随着温度的增加,其相对酶活越来越高,不同温度下各组之间的相对酶活差异显著(p<0.05)。当温度高于60 ℃,随着温度的升高,相对酶活迅速下降,60、70、80 ℃时,相对酶活分别为100%、91.0%和61.5%,各组之间差异显著(p<0.05),因此该重组漆酶的最适反应温度是60 ℃。由图2可知,重组漆酶在pH2.5和3.0酶活最高,在这两个pH条件下酶活差异不显著(p>0.05),在pH3.0~6.0范围内,随着pH的升高,相对酶活呈下降趋势,相对酶活差异显著(p<0.05),因此其最适反应的pH是2.5~3.0。

图1 温度对重组漆酶活性的影响Fig.1 The effect of temperature on activity of recombinant laccase注:不同字母表示差异性显著(p<0.05),图2、图4~图8同。
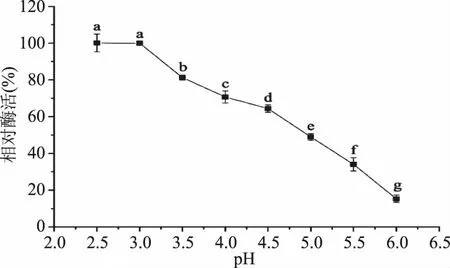
图2 pH对重组漆酶活性的影响Fig.2 The effect of pH on activity of recombinant laccase
2.1.2 重组漆酶的热稳定性和pH稳定性 由图3可知,随着温度的升高重组漆酶的稳定性逐渐下降,重组漆酶在30、40、50 ℃的条件下处理12 h,当温度超过40 ℃,重组漆酶热稳定性显著下降,60 ℃下处理4 h时酶活力几乎全部丧失,因此该重组漆酶在30 ℃下具有较好的温度稳定性。由图4可知,重组漆酶在pH2.0的缓冲溶液中处理24 h,其相对酶活力只有6.2%,在pH4.0~8.0范围内随着pH的增加,相对酶活逐渐增加,在该范围内,各组之间差异显著(p<0.05),之后随着pH继续增加,酶的稳定性逐渐上升,当在pH8.0、9.0、10.0的条件下处理24 h,其相对酶活都能维持在80%以上。
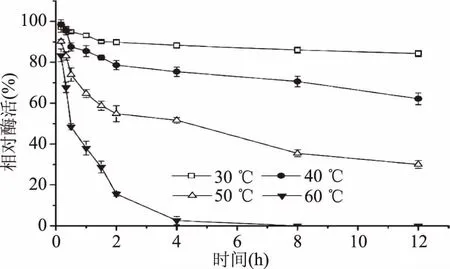
图3 重组漆酶热稳定性Fig.3 The thermal stability of recombinant laccase
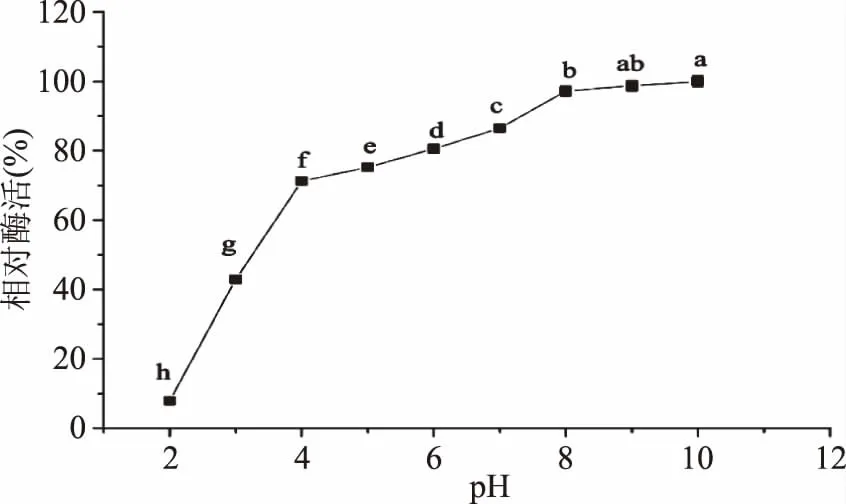
图4 重组漆酶pH稳定性Fig.4 The pH stability of recombinant laccase
2.2 重组漆酶对酚类化合物的降解
2.2.1 时间对重组漆酶降解酚类化合物的影响 由图5可知,在4~16 h范围内,随着反应时间的延长,漆酶对不同酚类的降解率逐渐增加,反应时间为4~16 h时,降解率变化显著(p<0.05);在反应达到16 h后,重组漆酶对壬基酚和2,4-二氯酚的降解率基本达到平衡,反应时间为16~24 h时降解率变化不显著(p>0.05),16 h时壬基酚和2,4-二氯酚的降解率分别为94.2%和89.3%。

图5 时间对重组漆酶降解酚类化合物的影响Fig.5 Effect of reaction time on degradation of phenols by recombinant laccase
2.2.2 酚类浓度对漆酶降解酚类化合物的影响 由图6可知,壬基酚浓度为2.5、5、10 mg/L时,各组之间的降解率差异不显著(p<0.05),当壬基酚浓度为15、20 mg/L时,降解率分别为89.4%和85.0%。当2,4-二氯酚浓度为2.5和5 mg/L时,其降解率分别为93.5%和92.5%,当2,4-二氯酚浓度为5~20 mg/L时,随着2,4-二氯酚浓度的增加,降解率显著下降(p>0.05)。

图6 酚类浓度对重组漆酶降解酚类化合物的影响Fig.6 Effect of recombinant laccase on degradation of different concentrations of phenols
2.2.3 重组漆酶浓度对酚类化合物降解的影响 由图7可知,不同的酶浓度对2,4-二氯酚降解的影响显著,当酶浓度为0.25~1.25 U/mL时,降解率显著升高(p<0.05)。酶浓度对壬基酚降解率的影响较小,在所选择的浓度范围内,壬基酚的降解率均在90%以上。当酶浓度为1.25 U/mL时,重组漆酶对壬基酚、2,4-二氯酚降解率分别达到95.1%和89.3%。
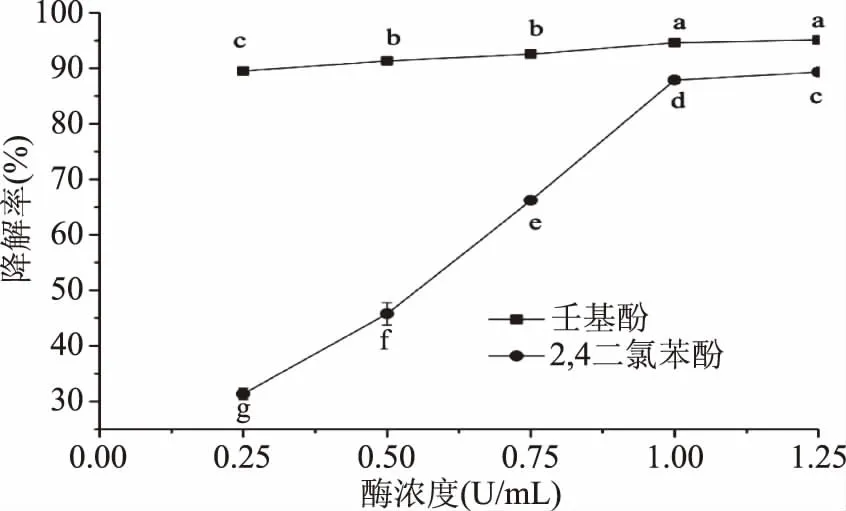
图7 重组漆酶浓度对酚类物质降解的影响Fig.7 Effect of recombinant laccase dosage on degradation of phenols
2.2.4 pH对重组漆酶降解不同酚类化合物的影响 由图8可知,重组漆酶对不同酚类降解的最适pH有所不同,重组漆酶对壬基酚的降解率随着pH的升高而下降,当pH在3和3.5时,几乎检测不到壬基酚,此时的降解率为100%。2,4-二氯酚的降解率随着pH的升高呈现先增加后减小的趋势,不同pH下的降解率差异显著(p<0.05),当pH为4.0时,降解率最高达到87.4%。pH对两种酚类降解效果影响明显,因为pH的改变会影响蛋白质的解离情况以及底物的离子平衡情况,对于不同的底物其最适作用的pH不同,因此漆酶降解两种酚类化合物时最适合的pH不同,除此之外,漆酶的催化效果可能与酚类物质的取代基的种类、数目、位置有关[24]。

图8 pH对重组漆酶降解不同酚类的影响Fig.8 Effect of pH on degradation of phenols by recombinant laccase
2.2.5 壬基酚和2,4-二氯酚降解效果验证实验 在确定的最佳条件下进行壬基酚和2,4-二氯酚的降解效果验证实验,重复三次,壬基酚的降解率为100%,壬基酚的降解率为95.1%±0.92%。用漆酶对酚类物质进行降解,具有降解率高,降解时间短的优点。王颖[10]用壳聚糖固定化漆酶对2,4-二氯酚进行降解,降解率是54.8%,潘艳[25]在漆酶酶液中添加HBT,对壬基酚的降解率为90%左右。目前所用的漆酶大多是漆酶的复合酶,用单一漆酶对酚类进行降解的报道较少。本实验用毕赤酵母工程菌P.pastorisKM71H(PeLac)所分泌的单一重组漆酶对两种酚类进行降解,该重组漆酶16 h对壬基酚的降解率能达到100%,对2,4-二氯酚的降解率为95.1%。重组漆酶对不同结构的酚类化合物降解效果有所不同,可能与酶和底物的亲和力有关。
3 结论
本实验研究了重组漆酶的酶学特性及其对两种不同结构的酚类化合物的降解,结果表明:该重组漆酶的最适反应温度是60 ℃,在30 ℃时具有较好的稳定性;最适反应pH是2.5~3.0,在pH9.0~10.0具有较好的pH稳定性。重组漆酶对两种不同结构的酚类化合物都具有较好的降解效果,当降解时间为16 h,重组漆酶浓度1 U/mL,pH3.5时,10 mg/L的壬基酚的降解率为100%;当降解时间为16 h,漆酶浓度是1.25 U/mL,pH4.0时,5 mg/L的2,4-二氯酚的降解率为95.1%。本实验研究的重组漆酶具有较强的降解不同结构酚类的能力,为处理含酚废水提供了方法以及思路。
[1]贺强礼,关向杰,黄水娥,等. 典型酚类废水的微生物处理研究现状及其进展[J].环境工程,2014,32(3):6-9.
[2]Zhang X,Li Q,Li G,et al. Levels of estrogenic compounds in Xiamen Bay sediment,China.[J]. Marine Pollution Bulletin,2009,58(8):1210.
[3]Liliana Gianfreda,Feng Xu,JeanMarc Bollag. Laccases:A Useful Group of Oxidoreductive Enzymes[J]. Bioremediation Journal,1999,3(1):1-26.
[4]Laurenzana E M,Weis C C,Bryant C W,et al. Effect of dietary administration of genistein,nonylphenol or ethinyl estradiol on hepatic testosterone metabolism,cytochrome P-450 enzymes,and estrogen receptor alpha expression[J]. Food & Chemical Toxicology An International Journal Published for the British Industrial Biological Research Association,2002,40(1):53-63.
[5]Hager C D. Alkylphenol ethoxylates-biodegradability,a-quatic toxicity and environmental activity[M]∥Karsa DR.Annual Surfactant Review. Sheffield UK:Sheffield Academic Press,1998:1-29.
[6]谢明勇,刘晓珍,陈泱杰. 壬基酚在食品中的污染现状及其生物毒性概述[J]. 食品科学技术学报,2014,32(1):1-7.
[7]夏茵茵,詹平. 壬基酚对机体影响的研究进展[J]. 环境卫生学杂志,2004,31(3):135-139.
[8]Monsalvo V M,Tobajas M,Mohedano A F,et al. Intensification of sequencing batch reactors by cometabolism and bioaugmentation with Pseudomonas putida for the biodegradation of 4-chlorophenol[J]. Journal of Chemical Technology and Biotechnoloy,2012,87(9):1270-1275.
[9]Scott-Emuakpor E O,Kruth A,Todd M J,et al. Remediation of 2,4-dichlorophenol contaminated water by visible light-enhanced WO3,photoelectrocatalysis[J]. Applied Catalysis B Environmental,2012,123-124(1):433-439.
[10]王颖,张笛,茹加,等. 壳聚糖固定化漆酶酶学性质及其催化氧化水中2,4-二氯酚的效能与途径[J]. 环境化学,2013,10(10):1901-1908.
[11]钟文辉,何国庆,郑平,等. 降解2,4-二氯酚的假单胞菌GT241-1的特性及其3,5-二氯儿茶酚1,2-双加氧酶基因定位[J]. 浙江大学学报(农业与生命科学版),2001,27(3):269-272.
[12]余宇燕,唐舒雅,庄惠生. 环境荷尔蒙类物质2,4-二氯酚人工抗原的合成与表征[J]. 化学试剂,2006,28(9):535-537.
[13]House W A,Leach D,Long J L A,et al. Micro-organic compounds in the Humber rivers[J]. Science of the Total Environment,1997,s 194-195(96):357-371.
[14]徐淑霞,宋安东,张世敏,等. 杂色云芝漆酶和发酵液降解对苯二酚研究[J]. 安全与环境学报,2007,7(6):54-57.
[15]崔静,张平,王清清,等. 固定漆酶对对苯二酚的降解研究[J]. 化工新型材料,2015(12):181-183.
[16]娄童芳. 漆酶电化学传感器的研制及在邻苯二酚和对苯二酚检测中的应用[D]. 开封:河南大学,2014:7-8.
[17]石欢欢. 漆酶催化降解杀菌剂苄氯酚和双氯酚的机理研究[D]. 南京:南京大学,2016:4-6.
[18]虞斌,季荣. 不同单质酚类调节剂对漆酶降解壬基酚的影响[C]//中国化学会学术年会环境化学分会场. 2008.
[19]吴坤. 杂色云芝(Coriolus versicolor)和杂色云芝漆酶及其对环境污染物降解的研究[D]. 杭州:浙江大学,2002:10-13.
[20]陈辉,张剑波,刘小鹏,等. 漆酶催化降解氯酚类有机污染物[J]. 北京大学学报:自然科学版,2005,41(4):605-611.
[21]李旭春. 1株壬基酚降解菌的分离筛选鉴定及其降解特性研究[D]. 哈尔滨:哈尔滨工业大学,2007:32-35.
[22]马燕燕. 李村河口底泥来源真菌对壬基酚的降解特性研究[D]. 青岛:中国海洋大学,2013:32-34.
[23]李飞,夏文静,周惠,等. 双孢菇漆酶的固定化及其对邻苯二甲酸二甲酯降解的研究[J]. 食品工业科技,2015,36(23):177-181.
[24]刘巧,赵建,李雪芝,等. 云芝漆酶粗酶液降解2-氯苯酚的研究[J]. 中国造纸学报,2004,19(1):172-176.
[25]潘艳,徐冉. 漆酶-HBT催化降解壬基酚[J]. 广东化工,2015,42(1):149-150.

