曝气生物滤池处理农村生活污水效率与微生物群落分析
李 斌,杨继富,赵 翠,纪雪梅
(1.中国水利水电科学研究院 水利研究所,北京 100048;2.济南大学 资源与环境学院,山东 济南 250022)
1 研究背景
农村供水与排水密不可分,2005年以来全国开展了大规模农村饮水安全工程建设,农村供水快速发展,生活污水量迅速增加,亟需开展适宜污水处理技术研究与应用。曝气生物滤池(Biological Aerated Filter,BAF)具有占地面积小、投资低和管理方便等特点,特别适于农村生活污水处理。目前,有关BAF处理生活污水的研究主要集中于城市污水,但农村污水是不同于城市和中小城镇的一类污水[1]。农村生活污水的水质水量特征与城市差异较大,其排放量较小、有机污染物浓度高、排放不均匀,日变化系数一般高达3.0~5.0[2],需要深入开展研究。BAF去除污染物主要依赖滤料表面形成的不同优势种群的生物膜[3],微生物群落与其所处的环境条件密切相关,不断进行着物质和信息的交换[4],进行微生物群落分析可深入认识和掌握BAF处理效率及机理。
20世纪90年代以来的研究表明,影响BAF处理效率的主要因素有填料[5]、进水污染物负荷、气水比、DO、水温和反冲洗工艺等;Pujol等[6]试验证实滤速在6、13 m/h条件下BAF对BOD5的去除率基本保持不变;Canler等[7]试验也同样证实滤速增加对出水水质影响很小;Farabegoli等[8]对BAF处理生活污水进行了3年中试研究,结果表明该工艺具有碳和氨氧化的高效率和稳定性;He等[9]分别用膨胀土和天然沸石作为BAF的滤料进行市政污水处理试验研究,认为沸石比膨胀土的抗冲击负荷、抗低温能力强。
传统的微生物分析技术以微生物纯培养为基础,但大部分微生物类群不可培养,可培养的仅占环境微生物总数的0.1%~10%[10],因此传统的微生物分析方法很难获得微生物群落结构的准确信息[11]。近年来,主要采用分子技术进行微生物群落结构分析,包括克隆文库、DGGE、FISH、T-RFLP和qPCR等[12]。本文采用的高通量测序技术被称为“下一代”测序技术,能一次并行对几十万到几百万条DNA分子进行序列测定,具有效率高、成本低、时间短、操作简便[13-14]等优点。高通量测序技术已被广泛应用于基因组[15-16]和转录组[17]。基因测序仪(Miseq)是美国Illumina公司推出的一款小型测序平台,Illumina MiSeq测序系统是国际上唯一在单个仪器上整合了扩增、测序和数据分析的新一代测序仪,由于其读长长,准确性高,通量高[18]的优点,已在微生物多样性群落分析方面得到了广大学者的认可[19]。
有关BAF对污水处理效率及微生物特性分析,邱珊[20]研究了不同结构特性滤料对BAF处理城市生活污水效果的影响,以及反应器中不同高度微生物群落结构变化,认为涂铁改性陶粒更能促进微生物的生长繁殖;窦娜莎[21]以青岛麦岛污水处理厂的BAF为研究对象,分析了主要污染物的去除效果和微生物特性,认为气水比、反冲洗和水温是影响BAF群落结构的主要环境因子;胡保卫等[22]对BAF的降解规律进行了研究,认为滤料在100~400 mm段的去除率增长速度较快,在700 mm之后去除率增长逐渐变缓;邱立平等[23]研究了BAF处理人工调配生活污水时反应器内生物种群特征,认为沿水流方向生物膜活性变化呈现明显的倒“V”性特点,高度营养级微生物占比较高。严子春等[24]研究了折流BAF中污染物与微生物沿程变化规律,认为首个单池对有机物有很好的去除效果,但对氨氮的去除效率较低,其中微生物以异养菌为主;后面单池中硝化菌增殖较快,硝化效果好。
本文以实际农村生活污水为处理对象,选用改性沸石和砾石为BAF填料,设计3种填料结构、2种气水比,在进水流量、水力停留时间和C/N一定条件下进行BAF处理效果分析,应用高通量测序技术分析微生物种群类别、数量、分布特征,为优化BAF设计、创造适宜微生物生存环境、提高农村生活污水处理效率等提供科学依据。
2 试验装置与方法
2.1 装置设计试验装置由4个反应柱组成(见图1),进行平行试验。反应柱为Ф120 mm有机玻璃柱,总高55 cm,表面积113.04 cm2;反应柱中滤池高度360 mm,进水流量72 L/d,水力停留时间18 h,C/N 8.2∶1。试验采用上向流BAF结构,对悬浮物有较强的拦截作用。

图1 BAF系统工艺流程
为比较不同填料结构对生活污水处理效率及微生物群落的影响,4个反应柱采用3种不同的填料结构。1#反应柱填料为砾石,粒径自上而下由小到大分为3层,上、中、下3层粒径分别为8~10 mm、10~20 mm、20~30 mm;2#反应柱填料为沸石和砾石,粒径为8~10 mm,按1∶1均匀混合后填充;3#反正柱填料为沸石和砾石,粒径为8~10 mm,按1∶1分层填充,上层为沸石,下层为砾石;各反应柱最下层均为鹅卵石承托层。作为对照,4#反应柱的填料结构与2#反应柱相同,气水比为3∶1,其他反应柱的气水比为5∶1。
反应柱正常运行后,滤料表面生成生物膜,膜表层有硝化作用的自养型细菌,膜里层有反硝化作用的异养型细菌,生活污水通过滤料时发生硝化、反硝化作用[25]。系统所需氧气由底部曝气泵提供,空气与污水一同向上通过滤层,滤料的阻拦能够延长气与水的接触时间,提高曝气充氧效果。装置反冲洗水流方向与过滤方向相反,采用气水联合反冲洗方式,反冲洗周期为36 h,每次持续时间20 min。
2.2 原水水质试验原水为试验站附近北京大兴区某村污水处理厂收集的生活污水,进水水质如表1。

表1 进水水质 (单位:mg/L)
2.3 采样方法为对比不同滤料结构和气水比条件下的生活污水处理效率,每个反应柱在同一高度设置出水口(距顶部70 mm),采取水样。为分析各反应柱微生物种群类别、数量及分布特征,每个反应柱设上、中、下3个取样点,距反应柱底部高度分别为435、232和75 mm,进行微生物采样。
2.4 水质分析方法根据国家环境保护总局《水和废水监测分析方法》(第4版),CODCr采用重铬酸盐法,BOD5采用非稀释法和稀释法,氨氮采用水杨酸分光光度法,TP采用钼酸铵分光光度法。
2.5 微生物群落分析方法采用16S rRNA基因-Illumina Miseq高通量测序技术,流程为:(1)聚合酶链式反应(Polymerase Chain Reaction,PCR)。提取出来的基因组DNA,在16SrRNAV3-V4区内进行扩增,通用引物序列为338F(5'-ACTCCTACGGGAGGCAGCA-3')和806R(5'-GGACTACHVGGGTWTCTAAT-3');PCR反应参数:95 °C预变性3 min,95 °C变性30 s,55 °C退火30 s,72 °C延伸30s,27个循环,72°C后保温10 min,于10°C保存。(2)荧光定量。参照电泳初步定量结果,将PCR产物应用QuantiFluor™-ST荧光定量系统进行检测定量,之后按照每个样本的测序量要求,进行相应比例的混合。(3)Miseq文库构建。连接“Y”字形接头,使用磁珠筛选去除接头自连片段,利用PCR扩增进行文库模板的富集,氢氧化钠变性,产生单链DNA片段。(4)Miseq测序。DNA片段的一端与引物碱基互补,固定在芯片上,另一端随机与附近的另外一个引物互补,也被固定,形成“桥(bridge)”;PCR扩增,产生DNA簇,DNA扩增子线性化成为单链,加入改造过的DNA聚合酶和带有4种荧光标记的脱氧核糖核苷三磷酸(deoxy-ribonucleoside triphosphate,dNTP)。每次循环只合成一个碱基,用激光扫描反应板表面,读取每条模板序列第一轮反应所聚合上去的核苷酸种类,将“荧光基团”和“终止基团”化学切割,恢复3'端黏性;继续聚合第二个核苷酸,统计每轮收集到的荧光信号结果,获知模板DNA片段的序列。
3 污染物去除效果分析
试验运行90 d,在30 d后各反应器进入成熟期。从第40 d开始取水样,每10 d取一次,进行原水和出水水质检测,分析不同反应柱污染物的去除效果。在反应器启动初期,内部填料表面尚未能形成生物膜,但由于沸石表面较为粗糙,充满很多肉眼看不见的小孔,在内部形成微空隙通道,这时主要靠过滤和物理吸附作用去除BOD和COD。普通曝气生物滤池可通过分析COD及氨氮的去除率和生物量三项指标来判断挂膜进展。通常认为,COD去除率达到70%~75%时异养菌挂膜完成,当氨氮去除率稳定时即可认为自养菌挂膜成功[26],之后进入正式运行的生物降解阶段。从试验运行情况看,在最初的20 d内,出水水质有较大波动,60 d后,出水水质较为稳定,说明反应柱进入生物降解稳定阶段,微生物生长性能良好,活性高,对有机物去除能力强。在反应柱运行中,生物膜逐渐增厚,膜的厚度一般应控制在300~400 μm,此时新陈代谢能力强,能保证较好的出水水质[27]。当膜的厚度超过范围时会导致溶解氧过低,影响微生物繁殖,生物膜活性变差,去除能力降低,出水水质变差。与此同时进水中的颗粒物被截留在填料空隙中,过量微生物也聚集在填料空隙中,造成反应器堵塞。为此,本文设计了反冲洗系统,反冲洗周期为36 h,以防止堵塞产生。图2—图4表示各反应柱出水的BOD5、CODCr、氨氮和TP值随时间变化情况。从图2—图4可以看出,60 d以后处理效果趋于稳定,说明反冲洗能够有效实现反应柱内微生物新老更替,保持生物膜活性。

图2 不同反应器BOD5出水浓度随时间变化曲线

图3 不同反应器CODCr出水浓度随时间变化曲线

图4 不同反应器氨氮出水浓度随时间变化曲线

图5 不同反应器TP出水浓度随时间变化曲线
表2为各反应柱运行期平均出水水质及污染物去除率。从表2中看到,1#、2#、3#反应柱的BOD5、CODCr和氨氮的去除率较高,达到84.51%~96.49%,出水平均浓度达到《城镇污水处理厂污染物排放标准》(GB18918-2002)一级A标准,说明在气水比5∶1条件下3个反应柱设计能够满足有机物和氨氮去除要求;4#柱与2#柱填料结构相同,但气水比小,BOD5和CODCr处理效果较差,说明较大气水比有利于提高有机物去除率;在4个反应柱中2#柱污染物综合去除效果最好,说明BAF填料采用沸石和砾石按1∶1均匀填充方式更合理。
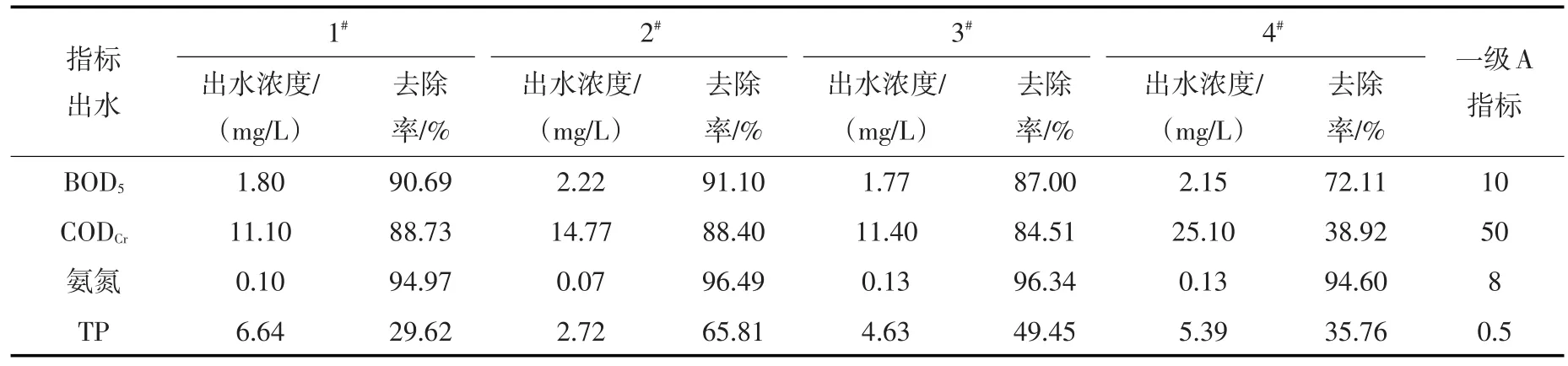
表2 各反应器运行期平均出水水质及污染物去除率
与此同时看到,4个反应柱的TP去除率比较低,在29.62%~65.81%之间,出水平均浓度达不到《城镇污水处理厂污染物排放标准》(GB18918-2002)一级A标准,说明该装置对磷的去除能力较弱,需要根据出水再利用要求采取深度处理措施。生物除磷主要依靠聚磷菌的吸磷作用。聚磷菌吸磷能力的恢复需要在厌氧条件下进行释磷,在交替好氧/厌氧条件下才能保证聚磷菌生长[28]。由于本试验为曝气生物滤池,不能保证良好的厌氧释磷环境条件,导致除磷效果差。
4 微生物群落结构分析
在试验结束前,在4个反应柱的上、中、下位置分别进行微生物采样,采样高度距反应柱底部高度分别为435、232和75 mm。在测试时将1#、2#、3#、4#反应柱上、中、下位置对应的样品编号为A1、A2、A3、B1、B2、B3、C1、C2、C3、D1、D2、D3。结果分析如下。
4.1 数据优化与统计Miseq测序得到的是双端序列数据。根据双端测序读长(PE reads,paired-end reads)之间的重叠(overlap)关系,将成对的读长(reads)拼接(merge)成一条序列;同时对读长(reads)的质量和拼接(merge)的效果进行质控过滤,根据序列首尾两端的条码(barcode)和引物序列区分样品得到有效序列,并校正序列方向。
优化数据量统计及长度分布如表3。从12个样本中获得419 241条高质量16SrDNA序列,平均长度438.67bp′。

表3 优化的序列
4.2 微生物OTU聚类及相关分析OTU(Operational Taxonomic Units)是为了便于进行分析,人为给某一个分类单元设置的同一标志,在具体分析时将测序得到的每一条序列进行归类操作,将序列按照彼此的相似性分归为许多小组,一个小组就是一个OTU。利用R语言工具统计和作图,维恩(Venn)图用于统计多个样本中共有和特有的OTU数目[29]。本文4个反应柱各样本中共有和特有的OTU数目统计分析结果如图6所示。其中图6(a)表示1#、2#、3#柱的OTU数目组成相似性及重叠情况;图6(b)表示2#与4#柱相同填料结构、不同气水比条件下OTU数目组成相似性及重叠情况;图6(c)(d)(e)表示1#、2#、3#柱同一高度处样本的OTU数目组成相似性及重叠情况。

图6 OTU分布维恩图
通过测序,对4个反应柱12个样品所产生的OTU进行统计分析,共形成1 654个OTU(97%相似度)。从图6(a)得到,1#、2#、3#号柱的OTU数量差异很小,分别为1 533个、1 550个和1 530个,且共有1 390个OTU数,说明3个柱的微生物种类数量基本相同,也可以说在1 390个OTU中包含了3个反应柱中全部优势菌群。其中2#柱的OTU数量最多,说明BAF填料采用沸石和砾石按1∶1均匀混合后填充的结构有利于微生物的生长。从图6(b)得到,2#柱特有的OTU数为158个,远大于4#柱特有的61个OTU数,说明相同填料结构时,较大的气水比更能增加微生物种类。该结果与前述各反应柱污染物去除效果分析相一致。
从图6(c)(d)(e)得到,1#、2#、3#柱上层A1样品的OTU数量1 049个,B1样品1 271个,C1样品1 184个;中层A2样品1 205个,B2样品1 237个,C2样品1 273个;下层A3样品1 348个,B3样品1 269个,C3样品1 284个。从中看到,1#和3#柱的OTU数量随滤层高度增加而减少,说明下层微生物种类最多。其中1#柱填料为砾石,分为3层,粒径自上而下由小到大,说明粒径大的滤层有利于微生物生长;3#柱上层填料为沸石,下层为砾石,说明砾石滤料有利于微生物生长;2#柱填料为沸石和砾石按1∶1混合均匀后填充,其OTU数量随高度先减少后增加,上层微生物种类最多,说明滤料相同条件下滤料高度对微生物种类也有影响。从同一高度不同滤料结构的微生物类群看,1#、2#、3#号柱上层共有OTU785个,中层共有OTU895个,下层共有OTU971个,说明3个反应柱中的微生物种类和数量均存在差异。
4.3 多样性指数分析单样本的多样性分析(Alpha多样性)包括一系列统计学分析指数,可反映微生物群落的丰度和多样性。应用Mothur软件计算得到4个反应柱上、中、下3层样品的常用生物多样性指数,见表4。
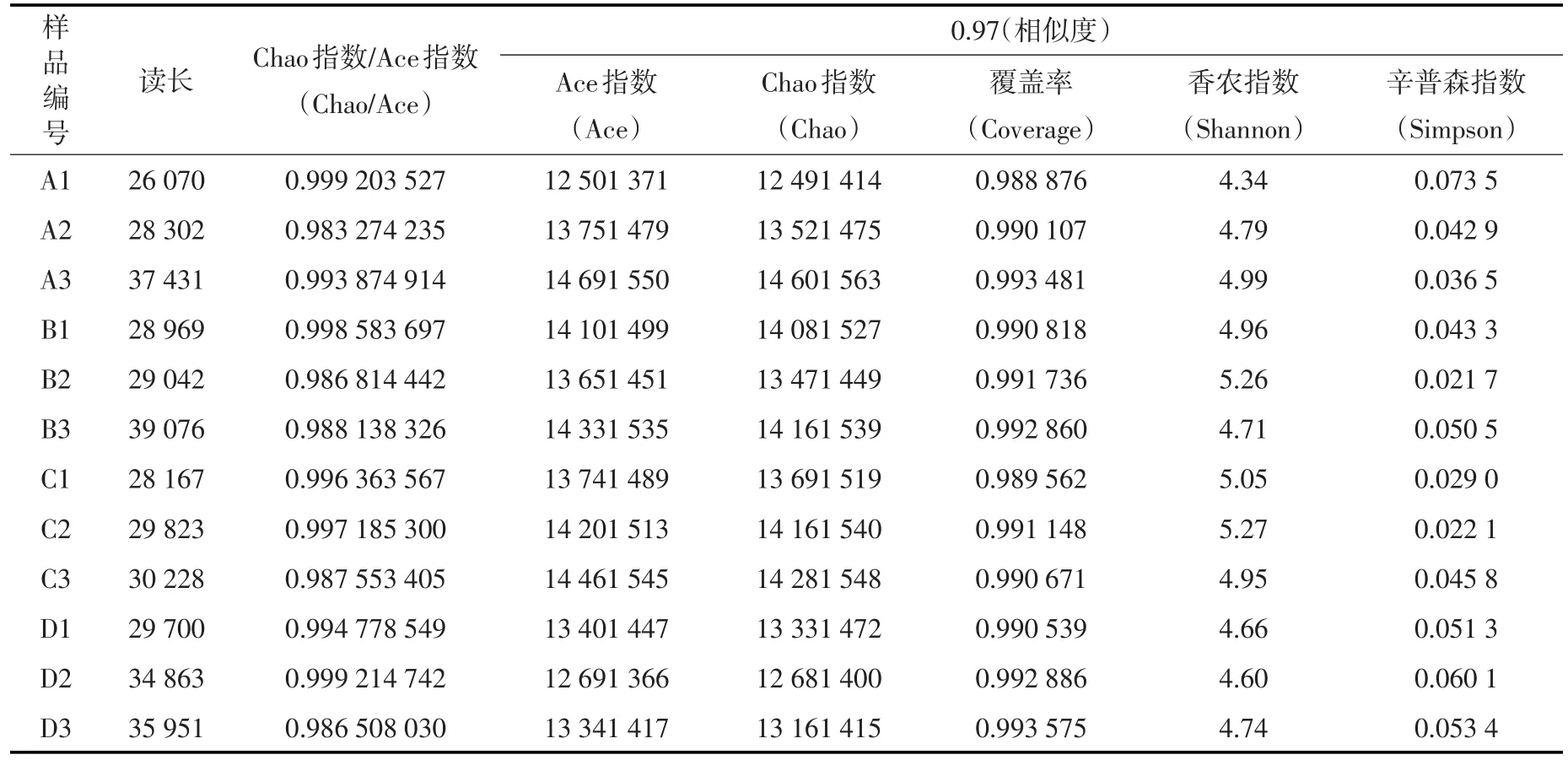
表4 生物多样性指数
表4中,Chao和Ace是表示群落丰度的指数,Chao/Ace值越大,群落丰富度越高。Shannon和Simpson是表示群落多样性的指数,Shannon值越大,多样性越高;Simpson值越大,多样性越低。Coverage是测序深度指数,其值越高样本中序列被测出的概率越高,数据越可靠。从表4看到,4个反应柱的上、中、下各层Coverage值均在0.99以上,说明本试验微生物多样性测序数据可靠性高。
从表4看到,4个反应柱的Chao/Ace值均在0.98以上,且相差很小,说明各反应柱的微生物丰富度都很高。由表4中Shannon和Simpson指数综合看出,各取样点微生物多样性相差不大,其中2#和3#柱中层滤料的微生物多样性最大。
4.4 主成分分析主成分分析(Principal Component Analysis,PCA),是一种对数据进行简化分析的技术[30],可有效找出数据中最“主要”的元素和结构,去除噪音和冗余,将原有的复杂数据降维,揭示隐藏在复杂数据背后的简单结构。对各样本的OTU数进行主成分分析,找出影响各反应柱微生物多样性的主要因素。本文在其他要素相同条件下分析4个反应柱的填料材质、粒径、高度、气水比对微生物多样性的影响,结果如图7所示。其中图7(a)(b)(c)为1#、2#、3#柱的填料材质、粒径、高度对生物多样性的影响分析,图7(d)为2#和4#柱不同气水比对生物多样性的影响分析。

图7 微生物多样性的主成分分析分布散点图
从图7(a)(b)(c)看出,各样品的分布差异大,明显分离,3个主成分的贡献率明显不同,第一主成分PC1的贡献率为79.86%,第二主成分PC2的贡献率为6.62%,第三主成分PC3的贡献率为4.48%。从图7(a)(b)看到,A1、C3分布于PC1负轴,且在同一象限内,C1分布于PC1正轴,A1、C3均为小粒径砾石,C1为沸石,说明不同填料材质对微生物多样性影响较大;从图7(a)(c)看到,A1、B1、C1分布于PC2的正轴,A3、B3分布于PC2负轴,说明不同高度对微生物多样性影响较大;从图7(b)(c)看到,A3、C1分布于PC3正轴,其他均分布于PC3负轴,说明填料粒径对微生物多样性影响较大。从图7(d)看出,第一主成分PC1的贡献率为82.4%,第二主成分PC3的贡献率为8.53%,说明气水比的不同对微生物多样性影响较大。
4.5 群落结构组分分析将多个样本的群落结构分析放在一起对比,用柱状图形式呈现。其中不同颜色代表不同菌群,高度代表数量,以确认优势菌。本文对1#、2#、3#号反应柱的9个样品进行不同菌群数量对比,结果见图8。

图8 微生物群落柱状图
从图8看出,菌群数量比较大的优势菌群主要有6种,按数量多少排序为变形菌门(Protebacteria)、芽单胞菌门(Gemmatimonadetes)、绿弯菌门(Chloroflexi)、拟杆菌门(Bacteroidetes)、放线菌门(Acfinobacteria)、酸杆菌门(Acidobacteria);3个反应柱的优势菌群种类基本相同,但数量有所差异。这些优势细菌的存在,使得BAF中生物膜结构稳固,并具有良好的抗负荷冲击能力。
根据以往研究,聚磷菌(Polyphosphate Accumulating Organisms,PAOs)类群的微生物包括产碱杆菌属、肠杆菌属、葡萄球菌属、变形菌属等[31]。由于本文未针对聚磷菌进行富集和鉴定,不能确定聚磷菌的有无及数量,但从优势菌群看出,在变形菌门中可能含有聚磷菌。下一步将通过特异性功能基因探针对聚磷菌进行深入研究,且BAF生物膜中还有一部分菌种无法确定,也需要深入研究。
5 结论
(1)1#、2#、3#反应柱BOD5、CODCr和氨氮的去除率比较高,达到84.51%~96.49%,出水平均浓度达到《城镇污水处理厂污染物排放标准》(GB18918-2002)一级A标准,说明在气水比5∶1条件下3个反应柱设计合理,能够满足有机物和氨氮去除要求;在相同填料结构条件下较大气水比5∶1对有机物的去除效果明显优于较小气水比3∶1。在4个反应柱中2#柱污染物综合去除效果最好,说明BAF填料采用沸石和砾石按1∶1均匀填充方式更合理;4个反应柱对TP的去除效果未达标。
(2)1#、2#、3#号柱的OTU数量差异很小,分别为1 533个、1 550个和1 530个,且共有OTU数为1 390个,说明3个柱的微生物种类数量基本相同。其中2#柱的OTU数量最多,说明BAF填料采用沸石和砾石按1∶1均匀混合后填充的结构有利于微生物生长。2#柱特有的OTU数为158个,远大于4#柱特有的OTU数61个,说明相同填料结构时5∶1气水比更能增加微生物的种类;4个反应柱微生物丰富度均很高,微生物多样性相差不大。
(3)1#、2#、3#柱的优势菌群主要有变形菌门、芽单胞菌门、绿弯菌门、拟杆菌门、放线菌门、酸杆菌门等6种,不同高度的优势菌群种类相同,但在数量上有所差异。在3个反应柱中只有变形菌门中可能含有聚磷菌,也是除磷效果差的原因之一,需要根据出水再利用要求采取深度处理措施。
总之,本文在气水比5∶1条件下BAF采用的填料及不同填充结构合理,微生物群落数量及优势菌基本相同,有机物和氨氮去除效果达标,采用多种填料混合填充或同种填料选用较大粒径有利于提高微生物多样性,在填料结构相同条件下采用较大气水比可有效提高BAF处理效果。
[1]张齐生.中国农村生活污水处理[M].南京:江苏科学技术出版社,2013.
[2]张列宇,王晓伟,席北斗,等.分散型农村生活污水处理技术研究[M].北京:中国环境出版社,2014.
[3]刘文洪,万甜,程文娟,等.基于图像二值化处理的气泡羽流不稳定结构分析[J].水利学报,2009,40(11):1369-1373.
[4]O′DONNELL A G,SEASMAN M,MACRAE A,et al.Plants and fertilisers as drivers of change in microbial community structure and function in soils[J].Plant and Soil,2001,232(1/2):135-145.
[5]付丹,刘柳.填料对曝气生物滤池影响的概述[J].环境科学与管理,2008,33(3):101-103.
[6]PUJOL P,LEMMEL H,GOUDSILLES M.A key point of nitrification in an upflow biofiltration reactor[J].Wat.Sci.Tech.,1998,38(3):43-49.
[7]CANLER J P,PERRETL J M.Biological aerated filters assessment of the process based on 12 sewage treatment plants[J].Wat.Sci.Tech.,1994,29(10/11):13-22.
[8]FARABEGOLI G,CHIAVOLA A,ROLLE E.The Biological Aerated Filter(BAF)as alternative treatment for domestic sewage.Optimization of plant performance[J].Journal of Hazardous Materials,2009,171:1126-1132.
[9]HE S,XUE G,KONG H.The performance of BAF using natural zeolite as filter media under conditions of low temperature and ammonium shock load[J].Journal of Hazardous Materials,2007,143:291-295.
[10]GILBRIDE K A,LEE D Y,BEAUDETTE A.Moleculartechniques in wastewater:Understanding microbial communities,detecting pathogens,and real-time process control[J].Journal of Microbiological Methods,2006,66(1):1-20.
[11]ESCHENHAGEN M,SCHUPPLER M,ROSKE I.Molecular characterization of the microbial community structure in two activated sludge systems for the advanced treatment of domestic effluents[J].Water Research,2003,37(13):3224-3232.
[12]王晓慧.城市污水处理厂中氨氧化菌及细菌群落结构与功能研究[D].北京:清华大学,2010.
[13]QUAIL M A,SMITH M,COUPLAND P,et al.Atale of three next generation sequencing platforms:Comparison of Ion Torrent,Pacific Biosciences and Illumina MiSeqsequencers[J].BMC Genomics,2012,13(1):341.
[14]FADROSH D W,MA Bing,GAJER P,et al.An improved dual-indexing approach for multiplexed 16S rRNA-gene sequencing on the Illumina MiSeq platform[J].Microbiome,2014(2):6.
[15]MARDIS E R.Next-generation DNA sequencing methods[J].Annual Review of Genomics and Human Genetics,2008,9:387-402.
[16]黄勇.基于高通量测序的微生物基因组学研究[D].北京:中国人民解放军军事医学科学院,2013.
[17]蔡元锋,贾仲君.基于新一代高通量测序的环境微生物转录组学研究进展[J].生物多样性,2013,21(4):401-410.
[18]周林文.MiSeq:新一代个人化测序仪[J].生物技术世界,2011(10):14-16.
[19]焦晶凯,莫蓓红.Illumina MiSeq平台高覆盖率测定干酪中的细菌微生物多样性[J].中国酿造,2014,33(5):34-38.
[20]邱珊.曝气生物滤池处理城市生活污水的特性研究及工艺改良[D].哈尔滨:哈尔滨工业大学,2010.
[21]窦娜莎.曝气生物滤池处理城市污水的效能与微生物特性研究[D].青岛:中国海洋大学,2013.
[22]胡保卫,程文,韩祯,等.曝气生物滤池降解规律试验研究[J].水利学报,2010,41(3):374-378.
[23]邱立平,马军.曝气生物滤池的生物膜及其微生物群落特征[J].中国环境科学,2005,25(2):214-217.
[24]严子春,何强,张涵折.流曝气生物滤池中污染物与微生物沿程变化规律[J].微生物学通报,2010,9(37):1278-1282.
[25]王琳,肖娇玲,窦娜莎.Biostyr曝气生物滤池的沿程微生物多样性[J].环境工程学报,2016,10(11):6283-6289.
[26]张红晶.侧向流曝气生物滤池处理生活污水的特性及其除磷脱氮效能研究[D].重庆:重庆大学,2006.
[27]肖文胜,徐文国,杨桔才.曝气生物滤池中生物膜的活性研究[J].北京理工大学学报,2003,23(5):655-657.
[28]王猛,钱晓东.浅论生物除磷脱氮的机理及工艺[J].污染防治技术,2005,18(1):38-41.
[29]FOUTS D E,SZPAKOWSKI S,PURUSHE J,et al.Next generation sequencing to define prokaryotic and fungal diversity in the bovine rumen[J].PloS One,2012,7(11):e48289.
[30]WANG Y,SHENG H F,HE Y,et al.Comparison of the levels of bacterial diversity in freshwater,intertidal wetland,and marine sediments by using millions of illumina tags[J].Applied and Environmental Microbiology,2012,78(23):8264-8271.
[31]王图锦,潘瑾,刘雪莲.高效聚磷菌的分离鉴定及除磷性能分析[J].水资源保护,2016,32(5):63-66.

