腹腔镜与经脐上小切口幽门环肌切开术治疗先天性肥厚性幽门狭窄的疗效比较1
明葛东,朱鸿喜,陈 晨,戴文文,孟德诚,张圣祥,李 炳
(1.盐城市妇幼保健院,江苏 盐城,224002;2.淮安市妇幼保健院)
先天性肥厚性幽门狭窄(congenital hypertrophic pyloric stenosis,CHPS)是新生儿常见的消化道畸形,临床表现为婴儿期食奶后出现呕吐,进行性加重,严重时出现营养不良、水电解质紊乱等症状,可危及患儿生命,一旦明确诊断,需及时手术治疗[1]。传统开放幽门肌切开术曾是治疗CHPS的标准术式,此术式自开展以来,不断发生变化,最先经右上腹横切口,后改进为脐上小切口,但此手术入路创伤较大,术中对腹腔脏器生理性干扰明显,术后切口容易形成瘢痕且并发症较多。自Alain等[2]1991年报道首例腹腔镜下幽门环肌切开术以来,腹腔镜下幽门环肌切开术越来越多的被应用于CHPS,并具有创伤小、术后进食时间早、康复快、并发症少等优点[3-4],但安全性、临床疗效仍缺乏足够认证。2013年6月至2016年12月我们收治43例CHPS,分别行腹腔镜幽门环肌切开术(laparoscopic pyloromyotomy,LP)及经脐上小切口幽门环肌切开术(open pyloromyotomy,OP),现对比分析两种术式的临床疗效。
1 资料与方法
1.1 临床资料 2013年6月至2016年12月共收治诊断明确的43例CHPS患儿,按家长意愿分为LP组与OP组。其中LP组18例患儿中男14例,女4例,14~42 d,平均(29±2.34) d;体重3.1~4.9 kg,平均(3.61±1.39) kg;OP组25例患儿中男18例,女7例;15~40 d,平均(28±2.69) d;体重3.0~5.2 kg,平均(3.82±1.24) kg。两组患儿临床资料差异无统计学意义(P>0.05),见表1,具有可比性。43例患儿中39例有典型CHPS表现,表现为出生后2~3周食奶后出现呕吐,呈喷射状,呕吐物不含胆汁,吐后患儿求食欲强烈。其中18例合并营养不良,25例合并低钠、低钾性碱中毒,4例合并吸入性肺炎,1例合并先天性心脏病。术前患儿均行B超检查,4周以上足月儿B超检查诊断标准:幽门管长>15 mm,幽门肌厚度≥4 mm[1];对于4周以下的新生儿、早产儿,尤其3周以下,B超检查幽门肌厚度>3 mm,幽门管长度>14 mm,且幽门狭窄指数>0.5,即可诊断为肥厚性幽门狭窄[5]。本组3例新生儿术前超声检查不能明确诊断,改行上消化道造影检查,提示幽门管呈鸟嘴征,同时伴有胃扩张。术前水合氯醛糖浆镇静后触诊,37例患儿右上腹可触及橄榄样包块。
1.2 手术方法 两组患儿入院后行胃肠减压、禁食、肌注维生素K1、补液、静脉营养等治疗,以纠正因长期呕吐导致的水电解质紊乱及营养不良,术前有吸入性肺炎的患儿,予以抗感染治疗。术前脐部备皮、开塞露通便,气管插管全身麻醉。LP组:患儿取仰卧位,胸部略垫高,显示器置于患儿头端,术者立于患儿右侧,助手立于左侧。脐窝做纵行5 mm切口,开放入腹,穿刺5 mm Trocar,置入腹腔镜,建立CO2气腹,压力维持在6~8 mmHg。确诊后直视下分别于双侧腹直肌外缘平脐位置穿刺3 mm Trocar,右侧置入幽门切开刀,左侧置入无损伤抓钳(图1)。助手用无损伤抓钳钳夹胃窦前壁近幽门处无血管区固定幽门,向外旋转,充分暴露幽门前无血管区,术者由右侧Trocar置入幽门切开刀,自幽门管胃端向十二指肠端切开部分肌层(图2),幽门钳分离至黏膜层(图3),使黏膜膨出(图4),自胃管内注入40~60 ml空气,腹腔镜下见气体通过顺利,无漏气,检查无活动性出血后排出CO2气体,解除气腹,缝合皮下组织,用医用胶粘合皮肤切口。OP组:患儿取仰卧位,垫高胸部,脐上做小切口,逐层入腹,将幽门管提出切口,于前壁无血管区纵行切开浆肌层,用幽门分离钳充分撑开肌层使黏膜膨出,检查黏膜无破损后将幽门还纳腹腔,逐层关腹。
1.3 观测指标 比较两组手术时间、术后进食时间、住院时间、术后并发症情况及复发等指标。
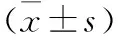
2 结 果
两组患儿术后均痊愈,无死亡病例。与OP组相比,LP组手术时间、术后进食时间及术后住院时间均明显缩短,差异有统计学意义(P<0.05)。LP组患儿术后均未出现并发症,而OP组术后3例出现并发症,其中2例切口裂开,1例应急性溃疡,经治疗后均恢复,两组差异无统计学意义(P>0.05)。见表2。两组患儿术后随访6~12个月,均恢复良好,食奶正常,无复发。LP组腹壁瘢痕细微,其中10例术后腹壁无可视性疤痕,OP组术后疤痕明显。
图1 脐窝、双侧腹直肌外缘平脐位置穿刺Trocar 图2 幽门前无血管区切开幽门肌
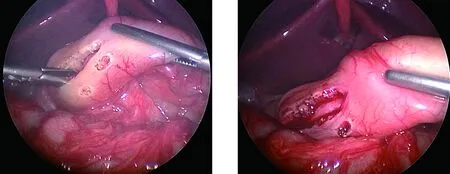
图3 幽门钳分离至黏膜层 图4 黏膜充分膨出
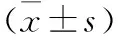
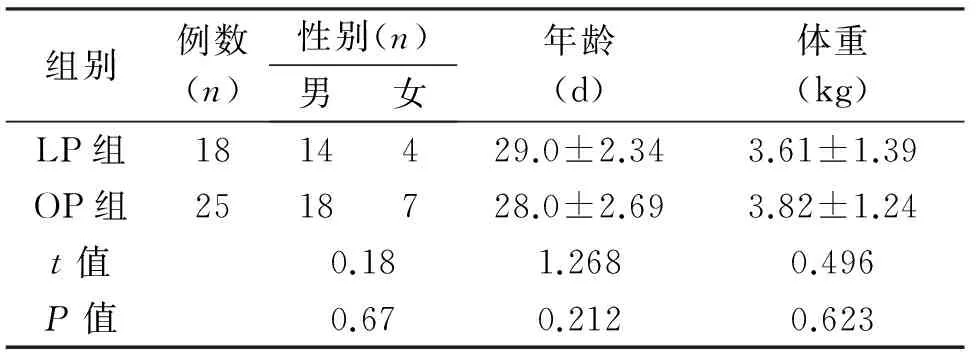
组别例数(n)性别(n)男女年龄(d)体重(kg)LP组1814429.0±2.343.61±1.39OP组2518728.0±2.693.82±1.24t值0.181.2680.496P值0.670.2120.623
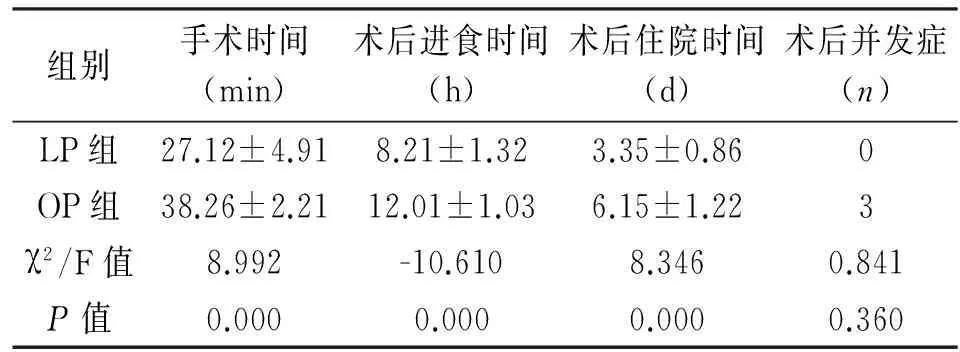
组别手术时间(min)术后进食时间(h)术后住院时间(d)术后并发症(n)LP组27.12±4.918.21±1.323.35±0.860OP组38.26±2.2112.01±1.036.15±1.223χ2/F值8.992-10.6108.3460.841P值0.0000.0000.0000.360
3 讨 论
CHPS是新生儿常见消化道畸形之一,由于幽门肌肥厚增生,导致胃出口梗阻,其发病率为0.15%~0.4%[6],男女发病率约为4∶1[7],发病年龄为2~6周,尤以生后2~5周[8]最为明显,其最佳治疗方式是行幽门环肌切开术,传统经典方式是经右上腹横切口或脐上小切口施术,但因其手术时间长、创伤大、对腹腔脏器生理性干扰明显,术后常因患儿哭闹、营养不良导致切口裂开等,目前腹腔镜手术越来越被广泛接受。本研究中,18例行腹腔镜手术,安全可靠,疗效确切,与文献报道一致[9-10]。与传统手术相比,腹腔镜手术具有视野清晰、术中出血少、损伤小、术后疤痕小、康复快且并发症少等优势,更容易被患儿家长接受。因此,随着腹腔镜技术的提高与普及,尤其新型儿童专用器械的不断研发,腹腔镜手术已成为治疗肥厚性幽门狭窄的首选术式。目前国内外许多小儿外科诊疗中心已将腹腔镜幽门环肌切开术作为治疗肥厚性幽门狭窄的标准术式[5]。
本研究中,腹腔镜组打开脐孔后,仅需在双侧腹直肌外缘穿刺两枚3 mm Trocar,手术结束后只需缝合脐环,其余切口无需缝合,用医用胶粘合,缩短了开、关腹时间,同时也减少了术中对患儿的打击。腹腔镜幽门环肌切开术,无需将幽门提出切口外操作,对腹腔脏器干扰小,因此LP组术后进食时间明显早于OP组。LP组术后无切口裂开及呕吐等并发症发生,而OP组切口较大,术前许多患儿存在营养不良,腹壁较薄,术后又因疼痛、饥饿等原因引起哭闹,导致腹压增高,容易出现切口裂开,不利于术后恢复[11]。本研究OP组25例中2例出现术后切口裂开,裂开率为8.0%;文献报道,开放手术后切口裂开率为3.3%~14.8%[12-14],本组患儿均行抗感染、静脉营养、叠形胶布固定后好转。OP组中1例患儿幽门肌肥厚明显,包块较大,经幽门钳多次反复钳夹才将包块提出腹腔外,手术操作时间长,术后第2天出现应激性溃疡,表现为呕吐咖啡样胃内容物,量多,予以胃肠减压、禁食、静脉输注奥美拉唑及止血药等治疗3 d后好转。而在腔镜下操作,则可完全避免此情况的发生。两组患儿术后随访6~12个月均无复发,但腹腔镜组患儿术后切口美观,恢复明显优于脐上小切口组,更容易被患儿家长接受。
通过回顾分析18例腹腔镜幽门环肌切开术的临床资料,我们体会:(1)患儿入院即行胃肠减压、禁食,以防止呕吐窒息及吸入性肺炎的发生。术前静脉营养支持、纠正水电解质紊乱;(2)术中患儿取仰卧位,胸部略垫高,以利暴露幽门,显示器置于患儿头端;(3)新生儿腹壁较薄,Trocar易滑脱,可采用缝扎法将其固定于腹壁,防止反复脱出,影响手术操作;(4)助手应钳夹胃窦前壁近幽门处无血管区,并适当向外旋转,以固定幽门,以利幽门管无血管区的充分暴露;(5)切开幽门肌时建议采用点切法,防止操作时误伤,将幽门刀外露2 mm,沿幽门管纵轴方向点状连续做2~3个切口,再用幽门撑开器插入点状切口内,先轻微旋转,再分离,分离肌层时用力一定要均匀;(6)幽门肌分离是否充分的判断标准:Ostlie等[15]建议术中幽门肌切开长度应达2 cm。术中我们首先将幽门肌肥厚最严重部位完全切开,充分分离黏膜层,直至黏膜膨出平切口,见切口两端肌层逐渐变薄,浆膜层切口近幽门块边缘,则表明肌层已完全分离;(7)术中分离幽门肌时,虽然选择无血管区,但难免会有少许出血,一般无需特殊处理;(8)判断黏膜有无损伤:方法一,腹腔镜直视下察看黏膜,如果黏膜层充分膨出,一般无损伤;如果黏膜层塌陷,则表明黏膜有损伤;方法二,胃管常规注入40~60 ml空气,进行鼓气试验,腹腔镜下见气体通过顺利,无溢气,则表明黏膜无损伤。
综上所述,腹腔镜技术治疗CHPS安全、有效,手术时间短、创伤小、术后康复快,手术安全、可行,值得临床推广。
[1] 施诚仁,金先庆,李仲智.小儿外科学[M].4版.北京:人民卫生出版社,2010:270-273.
[2] Alain JL,Grousseau D,Longis B,et al.Extramucosal pyloromyotomy by laparoscopy[J].J Laparoendosc Surg,1996,6 Suppl 1:S41-S44.
[3] Oomen MW,Hoekstra LT,Bakx R,et al.Open versus laparoscopic pyloromyotomy for hypertrophic pyloric stenosis:a systematic review and meta-analysis focusing on major complications[J].Surg Endosc,2012,26(8):2104-2110.
[4] Saha N,Saha DK,Rahman MA,et al.Laparoscopic versus open pyloromyotomy for infantile hypertropic pyloric stenosis:an early experience[J].Mymensingh Med J,2012,21(3):430-434.
[5] 李炳,陈卫兵,王寿青,等.单部位腹腔镜治疗小于三周的先天性肥厚性幽门狭窄[J].中华小儿外科杂志,2014,35(1):43-46.
[6] Parelkar SV,Multani PV,Sanghvi BV,et al.Trocarless laparoscopic pyloromyotomy with conventional instruments:Our experience[J].J Minim Access Surg,2013,9(4):159-162.
[7] de Laffolie J,Turial S,Heckmann M,et al.Decline in infantile hypertrophic pyloric stenosis in Germany in 2000-2008[J].Pediatrics,2012,129(4):e901-e906.
[8] Said M,Shaul DB,Fujimoto M,et al.Ultrasound measurements in hypertrophic pyloric stenosis:don't let the numbers fool you[J].Perm J,2012,16(3):25-27.
[9] Colon Cancer Laparoscopic or Open Resection Study Group,Buunen M,Veldkamp R,et al.Survival after laparoscopic surgery versus open surgery for colon cancer:long-term outcome of a randomised clinical trial[J].Lancet Oncol,2009,10(1):44-52.
[10] Yun JA,Yun SH,Park YA,et al.Single-incision laparoscopic right colectomy compared with conventional laparoscopy for malignancy:assessment of perioperative and short-term oncologic outcomes[J].Surg Endosc,2013,27(6):2122-2130.
[11] 熊启星,张正敏.腹腔镜手术与开腹手术治疗先天性肥厚性幽门狭窄的比较[J].浙江大学学报(医学版),2002,31(4):293-294.
[12] Zhang AL,Cass DT,Dubois RS,et al.Infantile hypertrophic pyloric stenosis:a clinical review from a general hospital[J].J Paediatr Child Health,1993,29(5):372-378.
[13] Saunders MP,Williams CR.Infantile hypertrophic pyloric stenosis:experience in a district general hospital[J].J R Coll Surg Edinb,1990,35(1):36-38.
[14] Maher M,Hehir DJ,Horgan A,et al.Infantile hypertrophic pyloric stenosis:long-term audit from a general surgical unit[J].Ir J Med Sci,1996,165(2):115-117.
[15] Ostlie DJ,Woodall CE,Wade KR,et al.An effective pyloromyotomy length in infants undergoing laparoscopic pyloromyotomy[J].Surgery,2004,136(4):827-832.

