Sels基因遗传多态性与冠心病的关联研究
谢 翔, 吴雪琴, 宋长来, 郑颖颖, 刘 芬, 吴婷婷, 李 龙, 马依彤
(新疆医科大学第一附属医院1心脏中心, 乌鲁木齐 830054; 2昌吉分院心血管内科, 新疆 昌吉 831100;3新疆心血管病研究重点实验室, 乌鲁木齐 830054)
近年来研究表明,冠心病(CHD)的发病率呈明显上升趋势,目前CHD已经成为成年人发病和死亡的重要原因,已经悄然成为危及人类健康的首位疾病[1]。近年来新的危险因素的发现,尤其是基因多态性的发现[2],为广大临床医生提供了新的诊疗思路。众所周知,血糖、血脂异常及炎性反应与冠心病有着密切的关联。硒蛋白 S (Sels)基因可编码 Sels 蛋白,并作为血清淀粉样蛋白 A (SAA) 的受体存在[3],通过与 SAA 相互作用参与糖、脂代谢及炎症反应[4-6],在 2 型糖尿病、炎症反应、心血管疾病以及代谢性疾病之间建立了联系。鉴于 SAA 及其受体 Sels 在炎症反应、血脂及血糖代谢中的重要作用,近年来二者在动脉硬化、糖尿病、冠心病及其它炎症方面的研究越来越多见。但是关于 Sels 遗传多态性和冠心病之间的关系尚不清楚。本课题以遗传多态性为切入点,选择 Sels 基因多态性进行分析,研究其和冠心病之间的关系,以期为冠心病的诊疗提供新思路。
1 研究内容与方法
1.1研究对象采用病例-对照研究的方法。纳入人群均为2006 年1 月-2011年10 月期间新疆医科大学第一附属医院的住院患者。病例组纳入标准:采用Judkin's 法行选择性冠状动脉造影术,冠心病诊断参照美国心脏病协会的诊断标准:结合临床症状、病史、实验室检查发现及心电图改变至少一支或以上主要冠状动脉直径≥50%。共入选冠心病患者1 416 例(冠心病组)。对照组纳入标准:无冠心病的家族史,并且胸部 X 线片、标准 12 导联心电图、血生化检查均未见异常,以胸部不适症状就诊且行冠状动脉造影正常者,共入选对照组1 373 例。
1.2采集血样、生化指标检测及DNA提取研究对象空腹12 h 以上,抽取静脉血5 mL,KEDTA抗凝于-80℃保存,备用。研究对象的血液生化指标由新疆医科大学第一附属医院医学检验中心统一测定。DNA 的提取采用北京天根生化公司生产的全血基因组提取试剂盒,按照说明书进行 DNA 提取。
1.3标签SNP的选择采用 Haploview4.2 软件查找标签SNP ,共入选4个标签SNP (rs12910524,rs1384565,rs2101171和rs4965814),如图1所示。
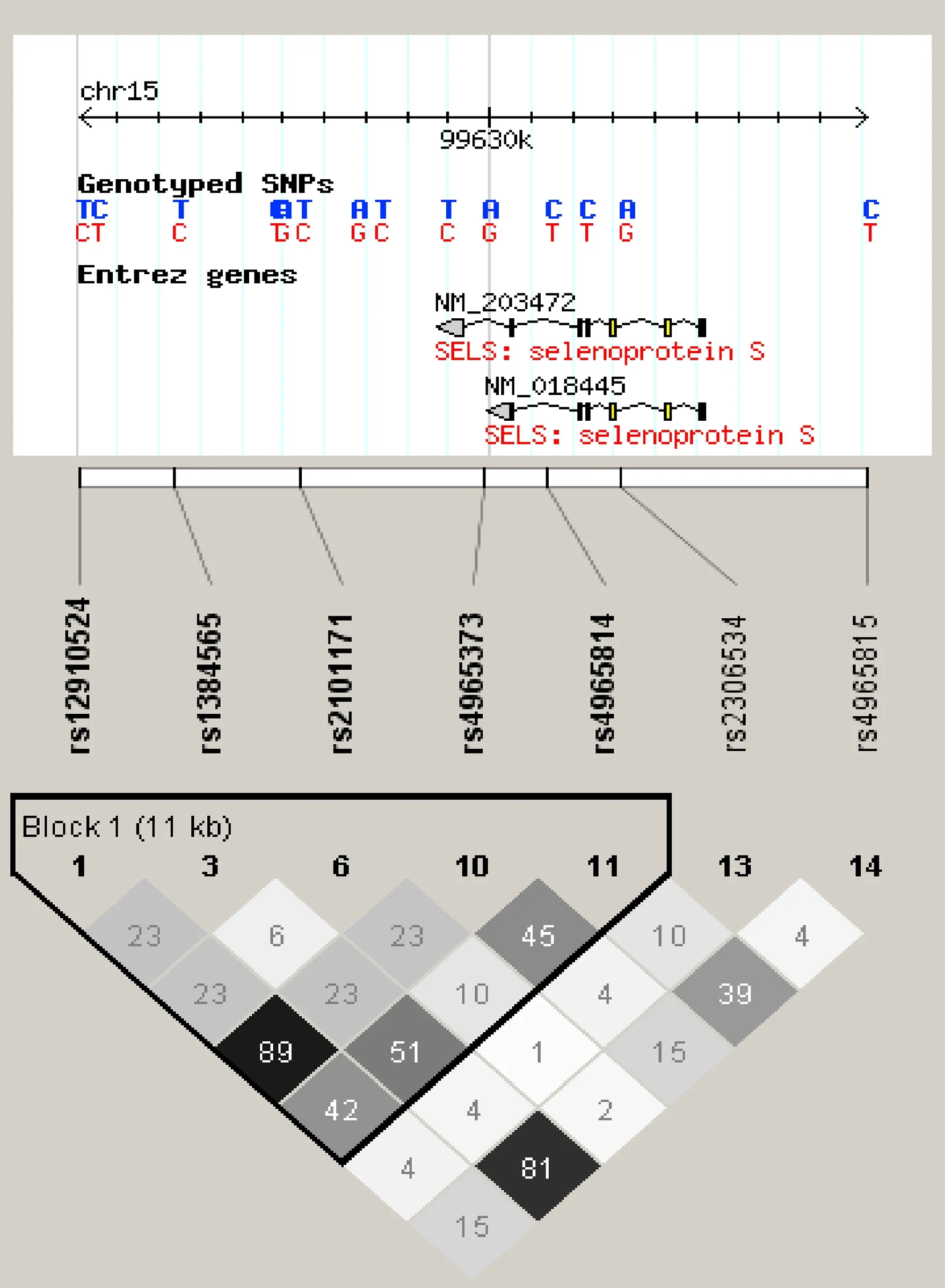

图1 采用Haploview4.2软件选择Sels基因标签SNPs
1.4基因分型采用TaqMan 技术进行基因分型。PCR方法采用Applied Biosystems公司的TaqMan Universal Master Mix,基因分型的结果采用SDSv1.63 版本的终点分析软件分析,结果如图2所示。
1.5统计学处理采用SPSS17.0统计软件对数据进行处理,计量资料的比较采用t检验;计数资料采用卡方检验,以Logistic回归分析排除其他危险因素的干扰,以P<0.05为差异具有统计学意义。
2 结果
2.1研究对象的临床资料比较冠心病组危险因素明显多于对照组,对照组的年龄均高于冠心病组,见表1。
(3种不同的颜色代表不同的基因型)
2.2Hardy-Weinberg平衡检验卡方检验结果显示,4个SNP位点在对照组中均符合Hardy-Weinberg 平衡(P>0.05)。
2.3Sels基因多态性和冠心病的关联分析结果显示,rs12910524和rs1384565 2个位点与冠心病的发生风险显著相关,见表2。
2.4Sels基因单体型分析采用Sels基因4个SNPs位点构建单体型。分析结果显示,单体型分布频率在冠心病组和对照组之间比较差异有统计学意义,见表3。
2.5多因素分析为了剔除混杂因素的干扰,本研究采用非条件 Logistic回归分析,结果显示,在排除混杂因素的影响后,rs1384565仍和冠心病的发生具有关联,见表4。

表1 研究对象的的临床资料比较
注:BMI:体质指数;SBP: 收缩压;DBP: 舒张压;BUN: 血尿素氮;GLU: 血糖;TG: 甘油三酯; TC:总胆固醇;HDL-C:高密度脂蛋白;LDL-C:低密度脂蛋白

表2 Sels 基因标签 SNP 在病例和对照组中的分布/例(%)
注:1:等位基因; 2: 少见等位基因; MAF:等位基因频率。

表3 Sels 基因单体型分布频率/例(%)
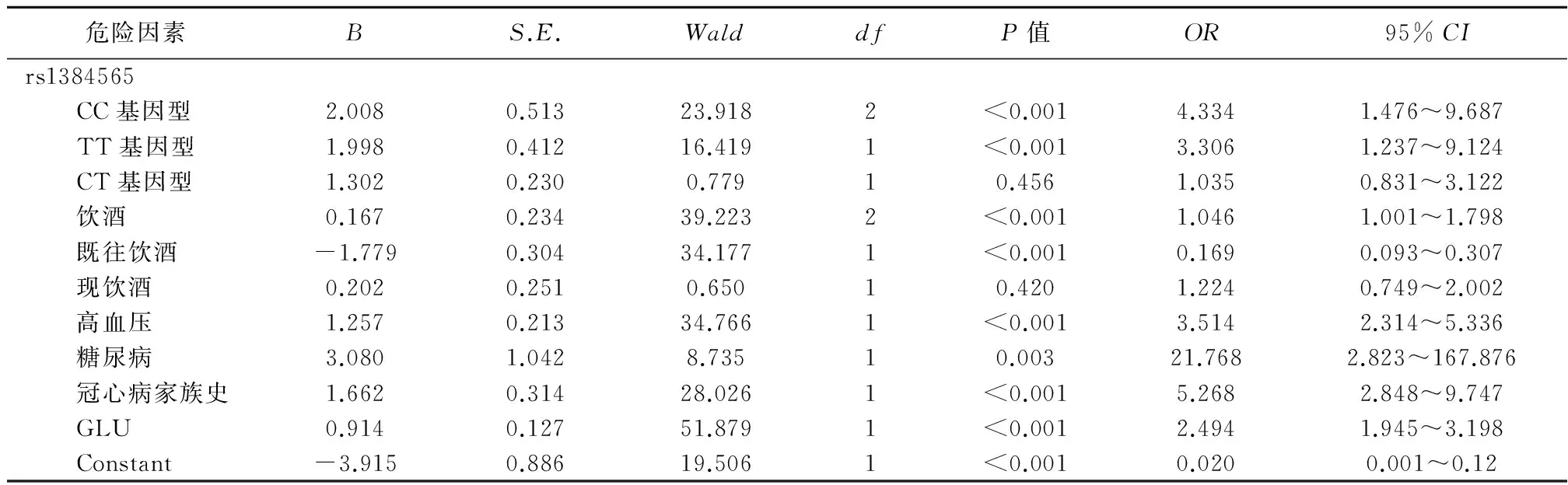
表4 非条件Logistics回归分析结果(前进法)
3 讨论
本研究发现,Sels基因多态性和冠心病存在关联性,本研究显示Sels基因rs138456、rs12910524位点基因多态性与冠心病具有密切相关性。无论是基因型还是单体型,Sels基因多态性均增加了冠心病的发生风险。
许多研究表明,Sels不仅参与血糖的代谢,而且在脂类的转运过程中具有重要的作用。Liu等[7]在糖尿病动物模型中发现,Sels 基因表达水平与血糖水平及胰岛素水平呈现负相关,与甘油三酯水则呈现正相关。Sels基因高表达时达抑制糖原合成,减少胰岛素对糖异生的关键限速酶磷酸烯醇式丙酮酸羧激酶的抑制作用,增加肝糖的输出,这一现象提示 Sels基因表达和血脂及血糖的代谢密切相关。近年来较多的研究探讨了Sels与糖尿病之间的关系[8],并已经有初步的研究结论,认为Sels及其基因可能参与糖尿病的发病机制[9]。更有学者认为Sels是搭建糖尿病与炎症反应之间的桥梁[10]。同时,大量证据显示,炎症在导致内皮功能异常方面有重要的作用,而内皮功能紊乱在动脉硬化(AS)的发病机制中起主要作用。SAA 是一种公认的炎症反应标志物,可以激活 NF-κB 进而介导和调节炎症细胞因子的表达,参与炎症反应。作为其功能受体,Sels可以通过与血清淀粉样蛋白A相互作用进而调节炎症反应[11-15]。Sels的生物学功能主要包括保护细胞免受氧化损伤、参与炎症反应和处理、降解内质网相关蛋白,同时可以保护胰岛细胞和血管内皮等细胞免受氧化应激诱导剂诱导细胞凋亡进而发挥其抗氧化损伤的作用[16]。
本研究发现 Sels 基因多态性与冠心病有密切相关性。可能与Sels上述功能相关。但本研究也存在一定局限性,Sels 基因的变异可能影响血清 Sels 水平,从而导致冠心病的风险增加,但本研究没有检测Sels水平的变化。在下一步的研究中,我们将对该基因的功能进行研究,以期为进一步揭示冠心病的发病机制打下基础。
[1] CHU L M, LASSALETTA A D, ROBICH M P, et al. Resveratrol in the prevention and treatment of coronary artery disease[J]. Curr Atheroscler Rep,2011,13(6):439-446.
[2] 王莎莎, 雷玉艳, 谢丽, 等. 新疆维、汉族人群载脂蛋白E基因多态性与冠心病的关联性研究[J]. 新疆医科大学学报,2012,35(12):1643-1645,1650.
[3] DU J L, SUN C K, LU B, et al. Association of SelS mRNA expression in omental adipose tissue with Homa-IR and serum amyloid A in patients with type 2 diabetes mellitus[J]. Chin Med J(Engl),2008,121(13):1165-1168.
[4] BANERJEE I, PANDEY U, HASAN O M, et al. Association between inflammatory gene polymorphisms and coronary artery disease in an Indian population[J]. J Thromb Thrombolysis,2009,27(1):88-94.
[5] HATANAKA E, MONTEAGODO P T, MARROCOS M S, et al. Interaction between serum amyloid A and leukocytes-a possible role in the progression of vascular complications in diabetes[J]. Immunol Lett,2007,108(2):160-166.
[6] ALWAILI K, BAILEY D, AWAN Z, et al. The HDL proteome in acute coronary syndromes shifts to an inflammatory profile[J]. Biochim Biophys Acta, 2012,1821(3):405-415.
[7] LIU J, TANG H, NIU L, et al. Upregulation of Sels mRNA expression in the liver is associated with insulin resistance in rats[J]. Tohoku J Exp Med,2009,219 (4):307-310.
[8] COX A J, LEHTINEN A B, XU J, et al. Polymorphisms in the Selenoprotein S gene and subclinical cardiovascular disease in the Diabetes Heart Study[J]. Diabetol,2013,50(3):391-399.
[9] OLSSON M, OISSON B, JACOBSON P, et al. Expression of the selenoprotein S (SELS) gene in subcutaneous adipose tissue and SELS genotype are associated With metabolic risk factors[J]. Metabolism,2011,60(1):114-120.
[10] GAO Y, XIE X, MA Y T, et al. Genetic variation in Tanis was associated with elevating plasma trigly ceride level in Chine nondiabetic subjects[J]. Lipid Healthy Dis,2013,15(12):97.
[11] DONG Z, WU T, QIN W, et al. Serum amyloid a directly accelerates the progression of atherosclerosis in apolipoprotein E-deficient mice[J]. Mol Med,2011,17(11-12):1357-1364.
[12] ANNEMA W, NIJSTAD N, TOLLE M, et al. Myeloperoxidase and serum amyloid a contribute to impaired in vivo reverse cholesterol transport during the acute phase response but not group IIA secretory phospholipase[J]. J Lipid Res,2010,51(4):743-754.
[13] TANAKA T, IKEDA K, YAMAMOTO Y, et al. Effects of serum amyloid a and lysophosphatidylcholine on intracellular calcium concentration in human coronary artery smooth muscle cells [J]. Int Heart J, 2011,52(3):185-193.
[14] CHEN G L, LIU L W, XIE S, et al. High-density lipoprotein associated factors apoA-I and serum amyloid A in Chinese non-diabetic patients with coronary heart disease.[J]. Chin Med J(Engl),2010,123(6):658-663.
[15] WANG X, CHAI H, WANG Z, et al. Serum amyloid A induces endothelial dysfunction in porcine coronary arteries and human coronary artery endothelial cells[J]. Am J Physiol Heart Circ Physiol,2008,295(6):H2 399-2 408.
[16] 杜建玲, 安利佳, 孙长凯, 等. SelS 高表达保护人脐静脉内皮细胞免于H0:诱导的细胞损伤[J]. 生物化学与生物物理进展,2007,34(4):425-430.

