化学因子对蓝曼龙精子活力的影响
王 璞,王茂林,姜玉声,王 伟
(1.大连海洋大学农业部海洋水产增养殖学重点开放实验室,辽宁大连 116023;2.上海海洋大学,上海 201306)
蓝曼龙(Trichogastertrichopterus)属于鲈形目攀鲈亚目丝足鲈科,又称丝足鲈,是蓝星鱼的人工变种品种[1]。身体为椭圆形,侧扁;尾鳍呈叉状,腹鳍胸位,为长丝状。鱼体呈蓝灰色,体侧有两块不规则的深蓝色斑块,一般情况下,这两块斑块会连接形成一条深蓝色的斑块。腹鳍边缘具有微微的浅黄色;背鳍、腹鳍和尾鳍的浅蓝灰底色上分布着艳蓝色斑点。蓝曼龙在没有性成熟之前,雌鱼和雄鱼没有太大区别。成熟后,雌鱼腹部较饱满,背鳍圆而钝,体色较黯淡,丝状胸鳍基部红色不明显,雄鱼性状与之相反。亲鱼性成熟年龄为6个月,成熟的蓝曼龙游动起来非常缓慢,但这种鱼攻击性很强,喜欢攻击比它弱小的同种或异种鱼类。蓝曼龙鱼体鲜艳好看,幼鱼经常去水面吐泡泡,十分滑稽可爱,它对水质的适应能力较强,所以是被观赏鱼爱好者广泛养殖的品种[2]。
目前只有少数学者对蓝曼龙的生长、繁殖和生物学进行了研究。魏东等[1]和董艳珍等[3]研究了蓝曼龙鱼的人工养殖及繁殖;郑曙明等[4]研究了pH和硬度对曼龙鱼孵化率和稚鱼成活率的影响;陈友铃等[5]研究了蓝曼龙的染色体组型;胡传路等[6]对蓝曼龙配合饲料中最适蛋白含量进行了初步研究。该研究分析了不同浓度KCl、NaCl、CaCl2、MgCl2溶液对蓝曼龙精子活力的影响,以期为蓝曼龙的人工繁殖提供理论依据。
1 材料与方法
1.1材料试验用鱼购自大连市香炉礁观赏鱼市场,挑选体色鲜艳、健康活泼、体型较大的雄鱼20尾,体长(15.0±0.5)cm。试验用鱼放于实验室中在水温27 ℃下进行暂养管理,为采集精液做准备。
1.2KCl、NaCl、CaCl2、MgCl2溶液配制试验采用分析纯的 KCl、NaCl、CaCl2、MgCl2试剂,再分别用纯水配制成10个浓度梯度:0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1.0 g/L,纯水作对照。
1.3精液采集及精子活力观察将捞出的雄鱼放置在冰袋上,等鱼体静止后,用纸巾擦干鱼体表的水分,解剖获取乳白色的5期性腺,再将收集到的性腺匀浆后放置在培养皿中保存。
打开显微镜,利用干燥的针头在载玻片上涂抹少量的蓝曼龙精液,放在40×10倍的光镜下,在载玻片的精液上滴1滴配制好的试剂,快速用针头搅拌均匀后观察精子活力。精子活力是指精子从开始运动起到视野内90%的精子停止颤动的时间[7],用秒表计时。每个浓度试验重复3次以上。
1.4数据处理试验数据用SPSS 13.0统计软件分析,用Excel软件绘图。
2 结果与分析
2.1KCl、NaCl溶液对蓝曼龙精子活力的影响KCl处理下对照组精子活力为56 s,试验组精子活力为34~245 s。由图1可知,KCl浓度很小时(0.1、0.2 g/L),其对蓝曼龙精子活力的影响并不大。当KCl浓度上升到0.3 g/L时,其对蓝曼龙精子活力有了提高的作用。KCl浓度从0.3~0.5 g/L时,精子活力快速增加,在浓度为0.5 g/L时达到最高,为245 s。当KCl浓度高于0.5 g/L时,精子活力逐渐下降。
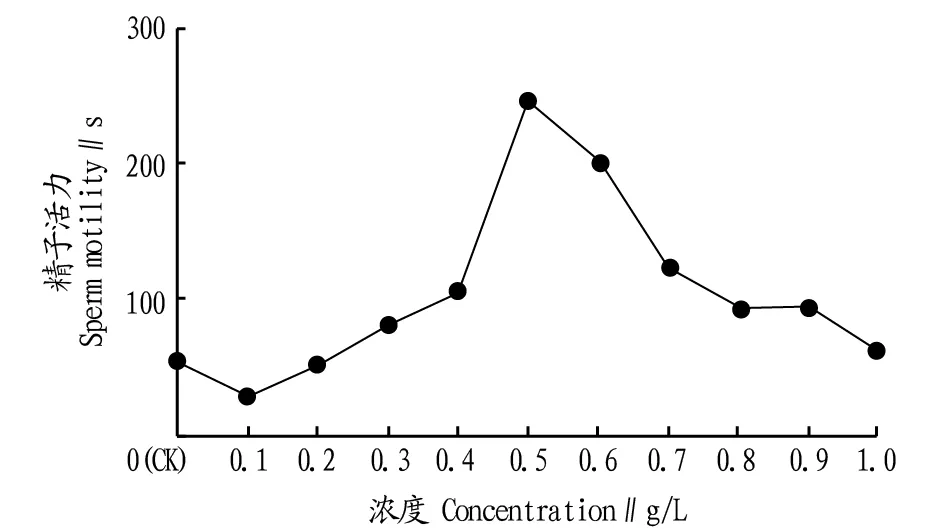
图1 不同浓度KCl溶液对蓝曼龙精子活力的影响Fig.1 The effects of different concentrations of KCl solution on sperm motility of T. trichopterus
NaCl处理下,对照组精子活力为56 s,试验组精子活力为4~103 s。由图2可知,加入较低浓度的NaCl溶液对精子活力有明显的提升作用,激活率也逐渐升高,当加入的NaCl浓度为0.1~0.4 g/L时,精子活力不断升高。当NaCl浓度为0.4 g/L时,蓝曼龙精子活力达到最高,为103 s,此后再增加NaCl浓度,精子活力呈明显下降趋势。NaCl浓度高于0.8 g/L时,已经观察不到精子活动。

图2 不同浓度NaCl溶液对蓝曼龙精子活力的影响Fig.2 The effects of different concentrations of NaCl solution on sperm motility of T. trichopterus
2.2CaCl2、MgCl2溶液对蓝曼龙精子活力的影响CaCl2处理下,对照组精子活力为56 s,试验组精子活力为0~26 s。由图3可知,加入较低浓度的CaCl2溶液对精子活力具有显著的抑制作用。当CaCl2浓度为0.4 g/L时,蓝曼龙精子活力达最高值(26 s)。此后再增加CaCl2浓度,精子活力逐渐消失。当CaCl2浓度高于0.8 g/L时,已经观察不到精子运动。

图3 不同浓度CaCl2溶液对蓝曼龙精子活力的影响Fig.3 The effects of different concentrations of CaCl2 solution on sperm motility T. trichopterus
MgCl2处理下,对照组精子活力为56 s,试验组精子活力为2~20 s。由图4可知,加入较低浓度的MgCl2溶液对精子活力具有明显的抑制作用。当MgCl2浓度为0.3 g/L时,蓝曼龙精子活力达到最高值(20 s)。此后再增加MgCl2浓度,精子活力逐渐消失。当MgCl2浓度高于0.4 g/L时,已经观察不到快速运动的精子。
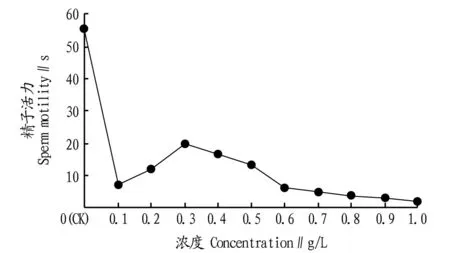
图4 不同浓度MgCl2溶液对蓝曼龙精子活力的影响Fig.4 The effects of different concentrations of MgCl2 solution on sperm motility T. trichopterus
3 讨论
3.1Na+、K+对精子活力的影响鱼类的精巢中,除了精液外,还存在许多其他物质。其中有一些抑制精子活动的因素,它们可以通过减缓运动强度来减少精子能量的消耗。一方面促进了精子的成熟,另一方面也保障了精子的储存。因此,到了繁殖季节,雄鱼可以持续不断地产出有活性的精子[8-9]。
试验结果显示Na+和K+在调控鱼类精子活力方面起到了重要作用。研究表明,Na+、K+对不同鱼类精子的调控结果不尽相同[10]。如柴毅等[10]研究表明Na+浓度为0.4%时,泥鳅的精子活力最强;而刘鉴毅等[11]研究表明Na+浓度为0.2%时,中华鲟的精子活力最强。该试验结果表明,NaCl浓度为0.4 g/L时,蓝曼龙的精子活力最强,激活率也最高。张涛等[12]研究证明了K+浓度为0.2%时,高体雅罗鱼精子活力最强;而刘鉴毅等[11]研究表明K+浓度为0.05%时,中华鲟的精子活力最强。该试验结果表明,KCl浓度为0.5 g/L时,蓝曼龙精子活力最强,激活率也最高。说明Na+、K+对不同种鱼类的最适调节浓度不同。
在鱼类的精浆中,存在着以Na+、K+为主的多种离子,导致精浆是一个高渗透压的环境,鱼类精子在这个环境中的活动受到了抑制[7]。但是当精液排出到水中,精液中的各种离子就会被水稀释,原本存在的抑制作用就会被减弱,精子被激活并开始运动。而一旦开始运动就会伴随着大量能量的消耗,此时精子活力就会逐渐减弱[13]。一定浓度的NaCl或者KCl对精子活力的减弱有限制作用,可以达到延长精子运动时间和激烈运动时间的作用[14]。因此,要注意Na+和K+浓度对精子活力的影响。当蓝曼龙精子活力达到最大后,再增加NaCl或是KCl浓度精子活力会逐渐降低。也就是说当外界激活液中离子的渗透压大于精液的渗透压,此时对精子的活动具有抑制作用。
3.2Ca2+、Mg2+对精子活力的影响在精浆的高渗透压环境中,除了存在Na+、K+外,同样存在Ca2+、Mg2+,但是试验结果显示,Ca2+、Mg2+对蓝曼龙精子活力的激活作用大体上与Na+、K+相反,对蓝曼龙精子的激活与活力存在明显的抑制作用[7]。即使是低浓度的Ca2+和Mg2+都会对精子活力产生十分明显的抑制作用,精子的快速运动时间和寿命同用纯水激活相比都是骤然下降,激活率同样如此。随着Ca2+、Mg2+浓度的继续升高,精子活力继续快速下降,抑制作用不断加大[15]。该试验中,当MgCl2浓度高于0.3 g/L时,显微镜下的视野中只有约1/5的精子在缓慢游动,并且很快就全部不动了;当CaCl2浓度高于0.4 g/L时,视野内几乎没有游动的精子,少数能动的精子也只是在原地颤动。这表明当CaCl2、MgCl2浓度过高时,其对蓝曼龙精子活力存在极强的抑制作用。究其原因,很可能还是与渗透压有关。CaCl2、MgCl2对蓝龙曼精子激活和精子活力存在明显的抑制作用。在配制激活液的时候,需尽量避免Ca2+、Mg2+浓度过高。
[1] 魏东,孙向军,梁拥军.蓝曼龙鱼的人工养殖及繁殖 [J].齐鲁渔业,2009,11(3):65-67.
[2] 施振宁,陈亚琴.蓝曼龙的生活习性、繁殖及仔稚鱼的培育[J].水产科技情报,2002,29(3):132-134.
[3] 董艳珍,吴健东.蓝曼龙鱼的人工繁殖试验[J].西昌学院学报(自然科学版),2009,23(3):44-45.
[4] 郑曙明,吴青,李玉宏,等.pH和硬度对曼龙鱼孵化率和稚鱼成活率的影响[J].水生态学杂志,1999(1):4-5.
[5] 陈友铃,吴文珊,汪彦愔.蓝曼龙(Trichogastertrichopterus)的染色体组型、Ag-NORs及C-带型的研究[J].福建师范大学学报(自然科学版),2005,21(2):86-89.
[6] 胡传路,杨超,王基伟,等.蓝曼龙配合饲料中最适蛋白含量的初步研究[J].河北渔业,2013(8):13-15.
[7] 严安生,彭安生,姚杏珍.不同浓度的电解质和非电解质溶液对花魤骨精子活动的影响[J].华中农业大学学报,1988,7(4):375-378.
[8] 鲁大椿,刘宪亭,方建萍,等.我国主要淡水养殖鱼类精浆的元素组成[J].淡水渔业,1992,22(2):10-12.
[9] 邓岳松,林浩然.鱼类精子活力研究进展[J].生命科学研究,1999,3(4):271-278.
[10] 柴毅,黄栋才,李罗新.几种化学因子对泥鳅精子活力的影响[J].安徽农业科学,2009,37(36):17981-17982.
[11] 刘鉴毅,甘芳,危起伟,等.几种不同浓度的离子及单糖对中华鲟精子活力的影响[J].水生生物学报,2007,31(6):849-854.
[12] 张涛,李胜忠,牛建功,等.Na+、K+、葡萄糖及甘油对高体雅罗鱼精子活力的影响[J].南方农业学报,2017,48(4):734-738.
[13] 张树成,王弘毅,王介东.低温冷冻保存技术与精子库、卵细胞和胚胎库[J].生物学通报,2001,36(9):4-5.
[14] 周立新,苏天风,江世贵.中华乌塘鳢精子的生物学特性的研究[J].水产科技,1995,22(4):18-20.
[15] 苏德学,严安生,田永胜,等.钠、钾、钙和葡萄糖对白斑狗鱼精子活力的影响[J].动物学杂志,2004,39(1):16-20.

