降香黄檀不同部位多酚含量的测定
马若克,陈 霞,李长鸿,符韵林
(广西大学 林学院,广西 南宁 530000)
多酚,又称单宁,是一类广泛分布在自然界的植物次生代谢物质,具有抗癌、抗氧化、抗动脉硬化和防治冠心病、脑血管疾病等多种医药价值[1]。据研究,多酚在植物的抗虫机理上有非常显著的作用[2],有报道多酚与木材心材形成机理可能相关[3]。建立多酚含量的测定方法是研究和利用多酚的基础。
降香黄檀(Dalbergiaodorifera),俗称海南黄花梨,为蝶形花科(Papilionaceae)黄檀属(Dalbergia)常绿半落叶乔木[4],其主要分布在我国海南西部、西南部,目前降香黄檀在广东、广西、福建等地区有较大面积的种植,特别在广西,受当地优化树种结构、大力发展降香黄檀等珍贵树种政策的影响,发展迅速,但大部分尚未形成心材。降香黄檀自古就是一味名贵中药,具有行气止痛、活血止血的功效而广泛应用于心胸闷痛、脘胁刺痛、外治跌打出血[5],许多药理学的研究也集中在根部心材的化学成分及生理活性方面。翁新楚等[6]筛选了700余种中药和香辛料的抗氧化活性,发现包括降香黄檀在内的24种植物的抗氧化活性很强。Wang等[7]从降香黄檀中分离得到的8种酚类物质中6种具有抗氧化性。Goda等[8]从降香黄檀分离得到15种化合物,其中肉桂基苯酚、异黄酮、异黄酮和苯甲酸衍生物能显著抑制前列腺素生物合成以及由花生四烯酸诱导的血小板聚集。An等[9]在降香黄檀中发现8种酚类化合物对HT22细胞中谷氨酸盐诱导的氧化损伤提供有效的保护作用。鉴于降香黄檀极高的应用价值,本试验采用Folin-Ciocaileu比色法研究了降香黄檀叶、根、树皮、侧枝4种不同部位多酚的含量,并对显色反应条件进行了优化,以期为研究降香黄檀心材形成机理,充分挖掘降香黄檀产业价值提供理论依据。
1 材料与方法
1.1 样品与仪器
根、叶、树皮、侧枝均采自广西大学实验种植基地8年生降香黄檀;没食子酸标品、Folin-Ciocalteu试剂(上海金穗生物科技有限公司);乙醇、甲醇、丙酮、石油醚、无水碳酸钠(分析纯)(天津市豪宇精细化工有限公司);CP214型精密分析天平(奥豪斯仪器有限公司);DFT-200粉碎机(温岭市林大机械有限公司);SP-754紫外分光光度计(上海光谱有限公司);KQ2200超声波清洗器(昆山市超声仪器公司)。
1.2 方法
1.2.1 样品多酚提取液制备与优化选择 选取一定量降香黄檀样品,洗净晾干后于50 ℃烘箱平衡4 h干燥,粉碎过40目筛,用石油醚(沸点60~90 ℃)作为溶剂,于索氏提取器中回流3次进行脱脂。精确称取各降香黄檀样品粉末12份,按照1∶20(样品∶溶剂)的比例分别加入70%乙醇、甲醇、丙酮溶液,然后分别进行超声波(脉冲频率40 kHz)提取30 min、60 min、1.5 h、2.0 h,减压抽滤,编号。
1.2.2 没食子酸标准溶液的配制 精确称取10.0 mg没食子酸标品于容量瓶中,用去离子水定容至100 mL,配成0.1 mg/mL标准溶液。
1.2.3 最大吸收波长的选择 选择4种不同部位样品的乙醇提取液和没食子酸标液各0.5 mL,于25 mL容量瓶中,各加入1 mL显色试剂、1 mL 15%碳酸钠溶液,振荡混合均匀,避光放置1 h。在700~800 nm波长范围内扫描确定最大吸收波长。
1.2.4 提取溶剂以及超声提取时间的确定 分别移取0.5 mL上述1.2.1所配12份样品提取液,各加入1 mL显色试剂、1 mL 5%碳酸钠溶液放入25 mL容量瓶中,混合均匀后用去离子水定容, 避光放置1 h,测吸光度。比较出每种样品的最佳提取溶剂及显色时间,下述实验均以最优溶剂和时间进行条件优化。
1.2.5 FoLin-CiocaLteu试剂用量的确定 取0.5 mL样品提取液6份,分别加入0.5、0.8、1.0、1.5、2.0、2.5 mL Folin-Ciocalteu试剂、1 mL 15%碳酸钠溶液于25 mL容量瓶中,混合均匀后用去离子水定容。避光放置1 h,测吸光度。
1.2.6 15% Na2CO3溶液用量的确定 取0.5 mL样品提取液6份,各加入上述最佳Folin-Ciocalteu试剂用量后,分别加入0.5、1.0、2.0、2.5、3.0、3.5 mL的15%碳酸钠溶液于25 mL容量瓶中,混合均匀后定容。比较不同Na2CO3溶液用量对显色效果的影响。
1.2.7 反应温度的确定 取0.5 mL样品提取液6份,各加入上述最佳Folin-Ciocalteu试剂及碳酸钠用量,放入25 mL容量瓶中,混合均匀后定容。分别置于25、30、35、40、45、50 ℃水浴,比较不同温度对显色效果的影响。
1.2.8 显色时间的确定 取0.5 mL样品提取液6份,各加入上述最佳Folin-Ciocalteu试剂及碳酸钠用量,混合均匀定容后置于25 mL容量瓶,置于最优反应温度下。显色时间分别为90、110、130、140、150、180 min,对比分析不同显色时间与显色效果的关系。
1.2.9 没食子酸标准工作曲线的绘制 准确移取没食子酸标准溶液0、0.1、0.2、0.3、0.4、0.5、0.6 mL于10 mL容量瓶中,再加入上述根、叶、侧枝、树皮4种样品所优化的最佳溶剂用量,混合均匀后定容,没食子酸的浓度分别为0、1、2、3、4、5、6 μg/mL,在最佳反应温度与时间条件下进行反应。绘制每种样品的标准吸光度曲线。
1.2.10 评价实验 稳定性试验:将所测降香黄檀不同部位的样品提取液按照最佳条件处理后,分别避光放置1.5、2.0、4.0、6.0 h,在最大吸收波长处测定吸光度。
重复性试验:取6份样品制得的提取液,按照上述最佳条件,在最大吸收波长处测定吸光度,计算相对标准偏差。
精密度试验:取同一提取液6份,按照上述最佳条件,在最大吸收波长处测定吸光度,并计算相对标准偏差。
加标回收率试验:向样品提取液中分别加入不同量的没食子酸标准液,在最佳条件下测定吸光度,计算回收率。
1.2.11 降香黄檀不同部位多酚含量的测定 取样品提取液0.5 mL于100 mL容量瓶中,按照上述最佳实验条件处理后测吸光度。根据所建立的没食子酸标准工作曲线计算多酚含量。
2 结果与分析
2.1 最大吸收波长的确定
选用降香黄檀叶、根、侧枝、树皮的70%乙醇提取液与Folin-Ciocalteu试剂及碳酸钠避光反应1 h后,结合文献报道[10-14]的多酚的最大吸收波长,选择测定在700~800 nm波长范围内的吸光度。从图1可以看出,吸光度在这一范围内总体变化幅度不大,但4个部位样品的最大吸收波长都出现在750~760 nm波长范围之间,因此我们选择755 nm波长作为比色测定的波长。
2.2 不同溶剂及超声时间对吸光度的影响
表1是用70%乙醇、甲醇、丙酮3种溶剂分别处理降香黄檀叶、侧枝、树皮、根0.5、1.0、1.5、2.0 h后,在最大吸收波长处所测吸光度。由于溶剂极性不同等原因,超声提取效果也不同。对比3种溶剂的提取效果,差别不大。考虑到甲醇、丙酮具有毒性,因此选择乙醇作为提取溶剂。对于提取时间,叶和树皮样品的最佳提取时间为1.5 h,侧枝为2.0 h,根部为3.0 h。不同的样品最佳提取时间不同主要是多酚含量不同,多酚含量较多的叶和树皮样品的吸光度最高点出现较早,而侧枝、根样品的最高点出现较晚。
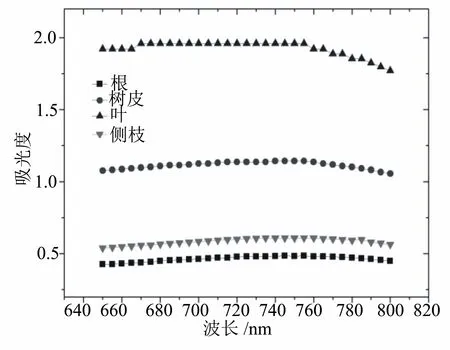
图1 降香黄檀不同部位样品的吸收光谱
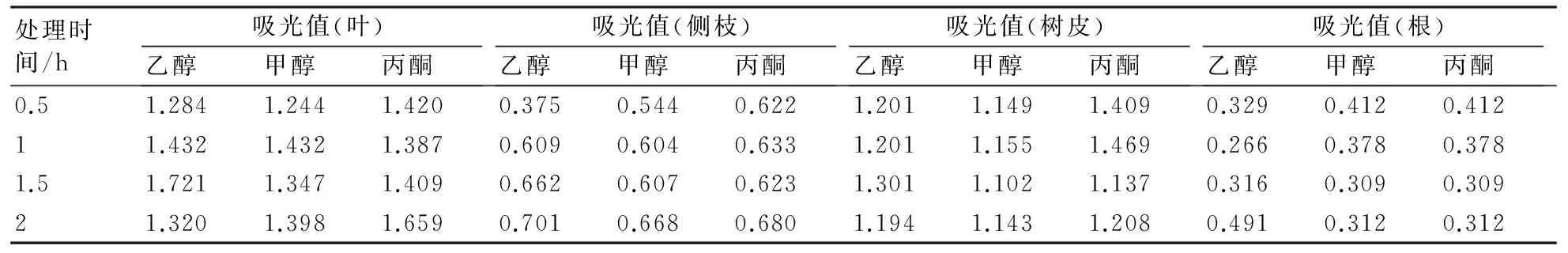
处理时间/h吸光值(叶)乙醇甲醇丙酮吸光值(侧枝)乙醇甲醇丙酮吸光值(树皮)乙醇甲醇丙酮吸光值(根)乙醇甲醇丙酮0.51.2841.2441.4200.3750.5440.6221.2011.1491.4090.3290.4120.41211.4321.4321.3870.6090.6040.6331.2011.1551.4690.2660.3780.3781.51.7211.3471.4090.6620.6070.6231.3011.1021.1370.3160.3090.30921.3201.3981.6590.7010.6680.6801.1941.1431.2080.4910.3120.312
注:乙醇、甲醇、丙酮浓度均为70%。
2.3 FoLin-CiocaLteu试剂用量对显色效果的影响
由图2可知,随着Folin-Ciocalteu试剂用量的增加,吸光度表现出先增加后降低的趋势,但是4种材料的最佳试剂用量不同,降香黄檀的叶和树皮的提取液样品在显色剂用量为1.5 mL时,吸光度达到最大,而侧枝和根的提取液样品在1.0 mL时吸光度达到最大值。这可能是叶和树皮的多酚相对含量高,所需显色剂量相对较多的原因,因此我们将4种材料的显色剂用量分别对待。
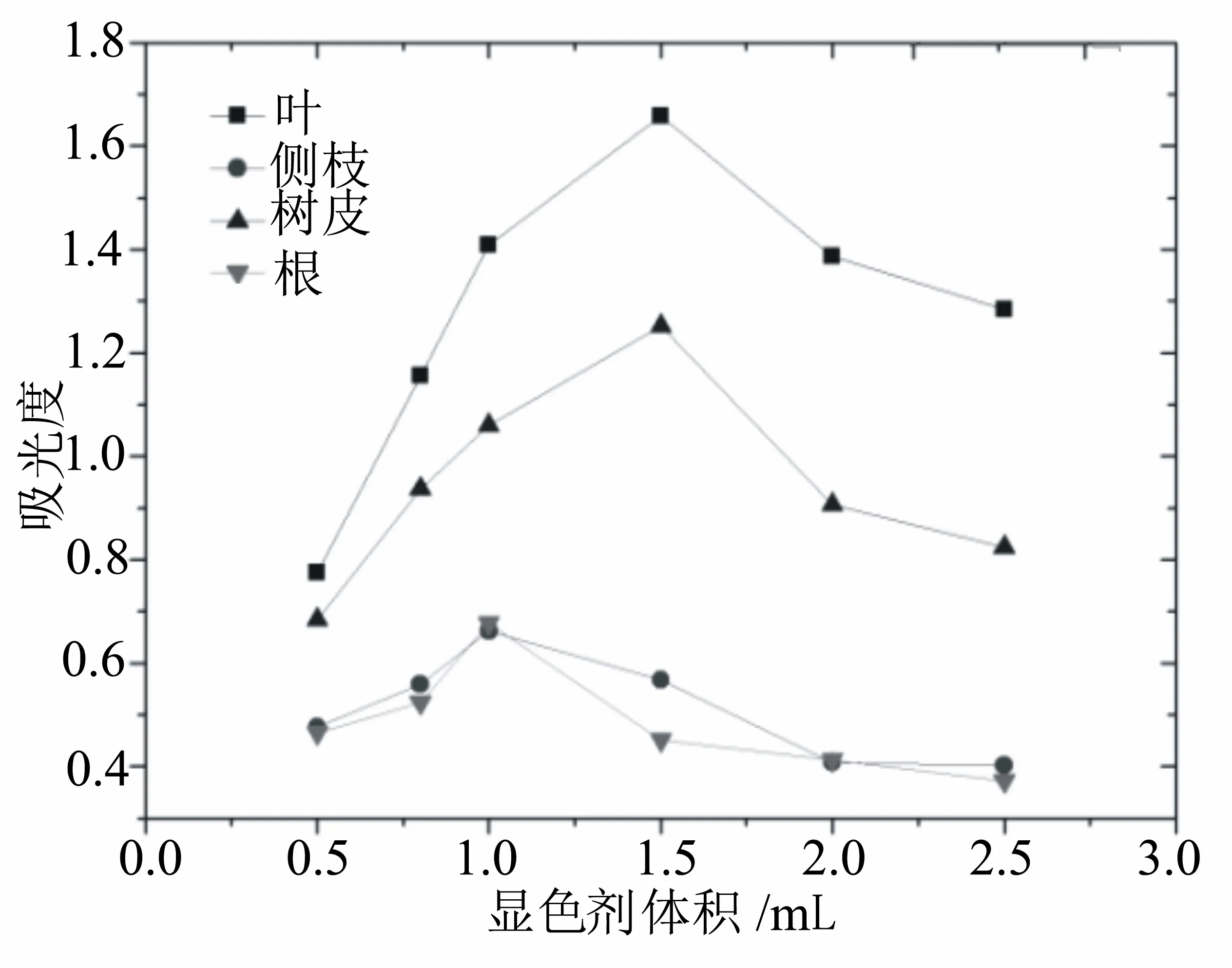
图2 Folin-Ciocalteu试剂用量对测定结果的影响
2.4 15%碳酸钠用量对显色效果的影响
Na2CO3溶液为酚类物质与Folin-Ciocalteu试剂显色提供一个碱性环境,使溶液呈现蓝色。由图3可以看出,随着15%的Na2CO3溶液用量的增加,所测吸光度表现为先增加,而后在用量1~3 mL时变化幅度变小,最后开始降低。4种材料的最佳Na2CO3溶液的用量有一定的差别,为了尽可能地提高检测的准确性,选择不同的Na2CO3溶液用量。降香黄檀叶提取液样品的Na2CO3溶液的最佳用量为2.5 mL,树皮提取液样品的最佳用量为2.5 mL,根和侧枝提取液样品的最佳用量为2.0 mL。
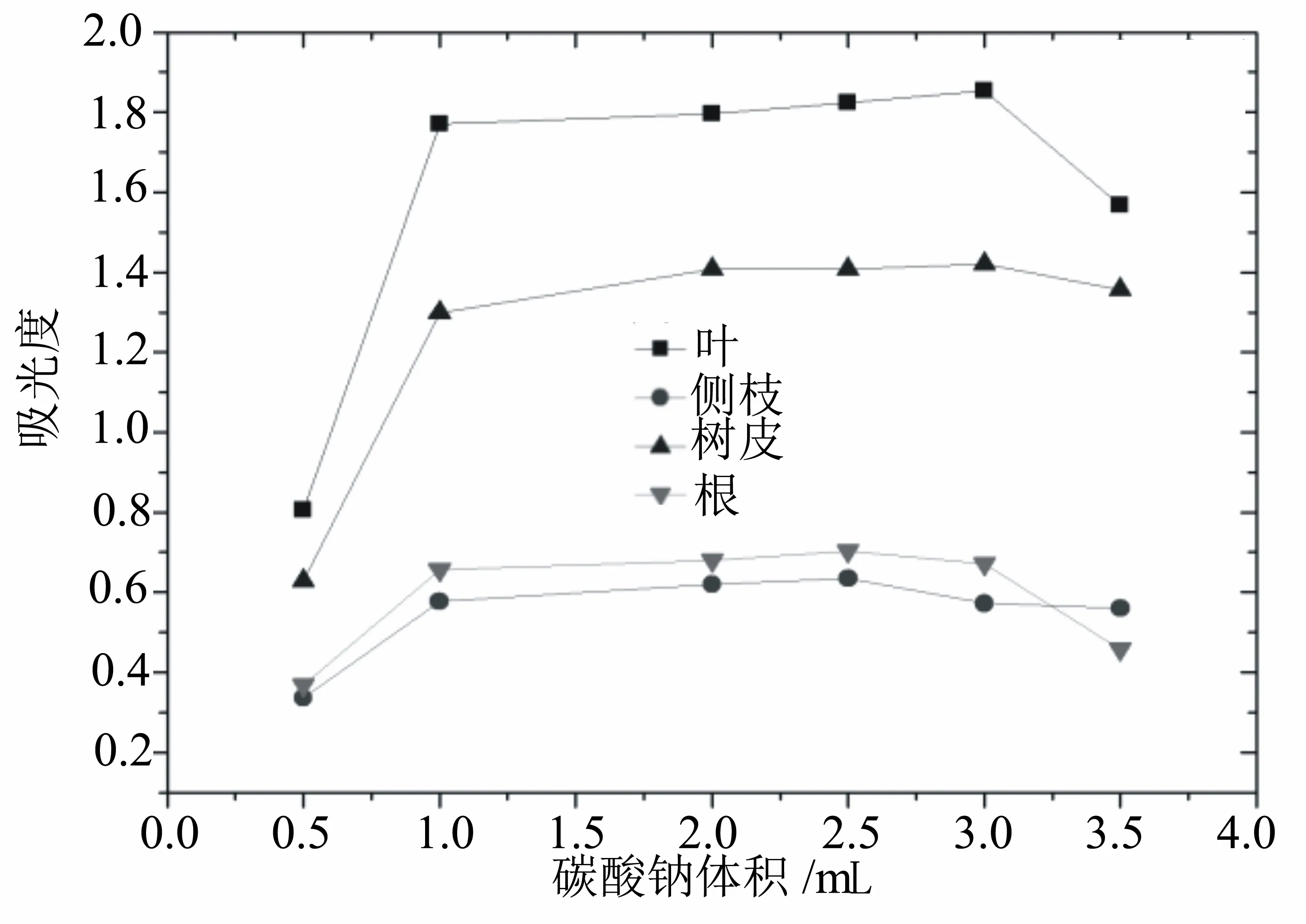
图3 15%碳酸钠用量对测定结果的影响
2.5 反应温度对比色效果的影响
显色温度对吸光度有一定的影响。总体来看,温度在45 ℃时,降香黄檀叶、侧枝、根的吸光度均有最大值,树皮提取液的吸光度略有下降,但幅度较低(图4),这可能是因为显色反应之后生成的物质在温度增高后性质不稳定。为方便集中处理,将反应温度设定为45 ℃。
2.6 反应时间对比色效果的影响
多酚化合物的显色过程需要一定的时间。反应时间对降香黄檀多酚的吸光度的影响在反应前期比较明显。当反应时间为45 min时,吸光度增加缓慢,体系反应较为完全。为使测试更加准确,选择反应时间1 h。
2.7 标准工作曲线的绘制
因为每种样品的最佳处理条件不同,图6是根据没食子酸标准品在每个样品的最佳条件下所建立的标准曲线,在4个样品中,侧枝和根的提取液的反应条件一致,得3条工作曲线。叶提取液样品的标准曲线为:y=0.125x+0.016,相关系数R2为0.994;侧枝和根提取液样品的标准工作曲线为y=0.123x+0.041,R2为0.995;树皮提取液样品的标准工作曲线为y=0.129x+0.021,R2为0.998。没食子酸质量浓度在0~6 μg/mL范围内符合朗伯比尔定律,均与其吸光度呈现良好的线性关系,可用于降香黄檀多酚含量的测定。
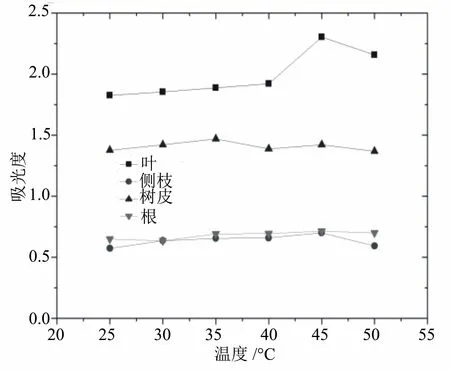
图4 反应温度对多酚测定结果的影响
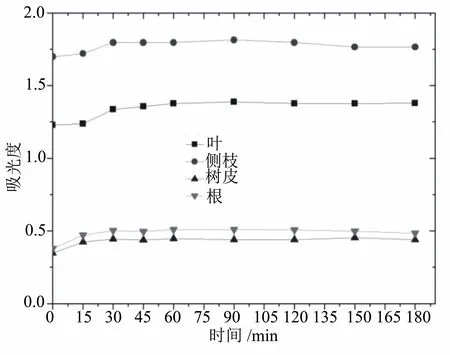
图5 反应时间对多酚测定结果的影响
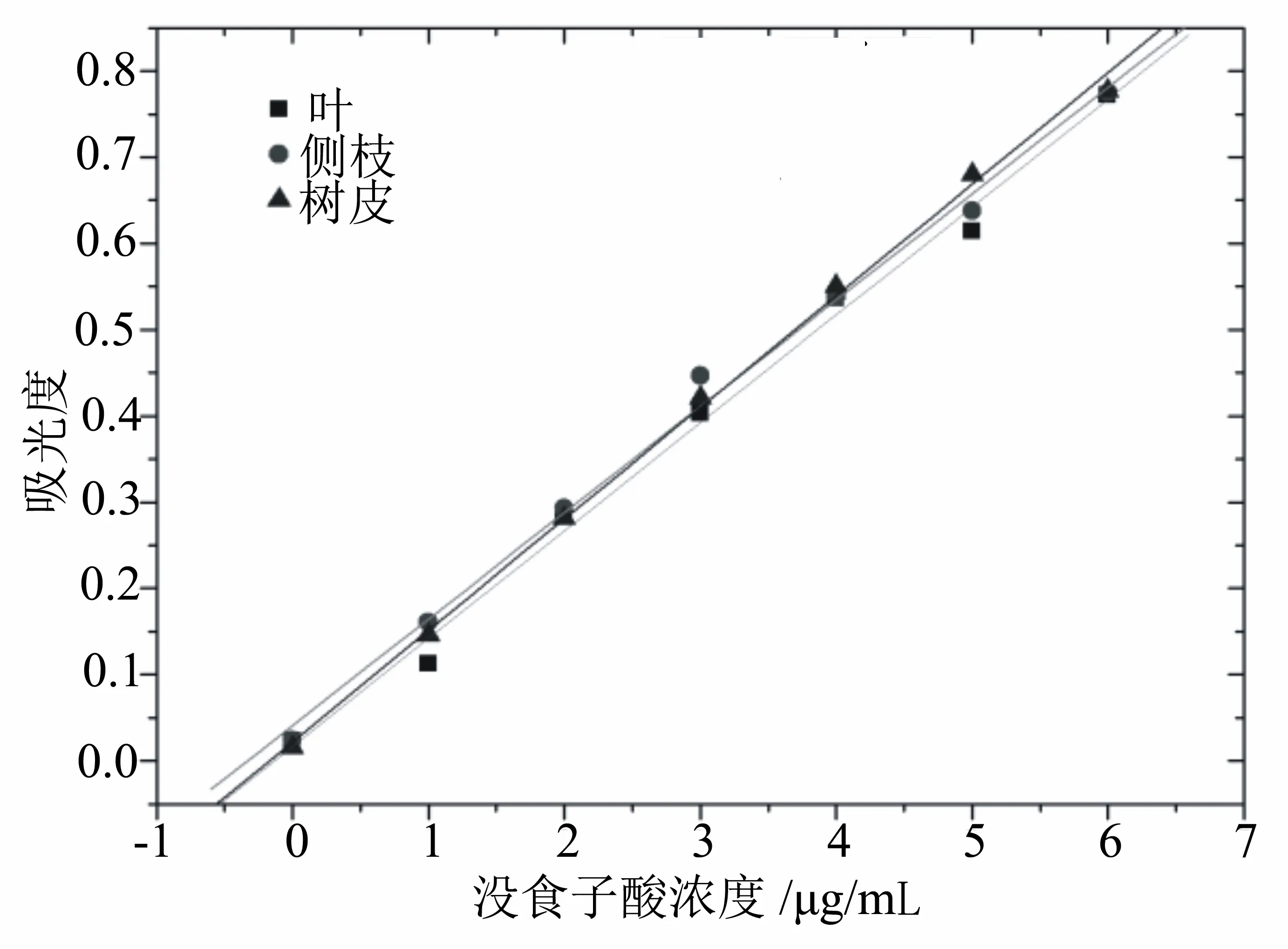
图6 不同条件对应的没食子酸标准工作曲线
2.8 稳定性试验
用Folin-Ciocalteu法测定降香黄檀4种不同部位的多酚含量,水浴1 h后,避光处理,分别放置0、0.5、1.0、1.5、2.0、3.0、6.0 h后测定吸光度。测得叶片、侧枝、树皮和根部样品提取液的吸光度的RSD分别为0.50%、0.24%、1.14%和0.19%,表明该方法体系测试后放置6 h后仍比较稳定。
2.9 重复性试验
用Folin-Ciocalteu法测定降香黄檀4种不同部位的多酚含量,在所测每个部位的6份样品中,测得叶片、侧枝、树皮和根部提取液的多酚质量分数的RSD分别为3.87%、5.75%、3.07%和4.46%,结果表明该方法重复性较好。
2.10 精密度试验
用Folin-Ciocalteu法测定降香黄檀4个不同部位的多酚含量,对降香黄檀每个部位的同一样品提取液分别测定6次,计算多酚值(以100 g样品计)。测得叶片、侧枝、树皮和根部的多酚值的RSD分别为1.28%、2.98%、1.47%和2.50%。结果显示,该方法精密度较高。
2.11 加标回收实验
对每个部位的样品按照上述所确定的最佳试验条件,进行加标回收试验。从表2中所列结果得出该方法准确可靠。
2.12 降香黄檀不同部位多酚含量的测定
按照上述方法测定了不同部位降香黄檀的多酚含量,发现降香黄檀不同部位的多酚含量差异较大,多酚含量从高到低分别为叶15.3 mg/g、树皮10.3 mg/g、侧枝4.9 mg/g和根部4.2 mg/g。
3 结论
研究了用Folin-Ciocalteu法测定降香黄檀不同部位多酚含量的适宜条件。经脱脂后样品与70%乙醇提取液按照1∶20的比例超声提取,均移取0.5 mL样品提取液进行测定。其中测定叶中多酚含量的最佳条件是:1.0 mL Folin-Ciocalteu显色剂、2.0 mL Na2CO3,用去离子水定容至100 mL。测定树皮多酚的最佳条件1.5 mL Folin-Ciocalteu显色剂、2.5 mL Na2CO3,用去离子水定容至100 mL。根和侧枝样品的测定条件相同:1.0 mL Folin-Ciocalteu显色剂、2.0 mL Na2CO3,用去离子水定容至25 mL。4种样品比色波长755 nm,反应温度45 ℃,避光反应1 h。多酚含量在1~6 μg/mL工作范围内有效。通过测定4种部位的多酚含量,叶片多酚含量最高,可达15.3 mg/g,对进一步开发降香黄檀产业价值具有十分重要的作用。

表2 加标回收试验结果
[1] Manach C, Williamson G, Morand C, et al. Bioavailability and bioefficacy of polyphenols in humans. I. Review of 97 bioavailability studies[J]. American Journal of Clinical Nutrition, 2005, 81(1 Suppl): 230.
[2] 程春龙,李俊清.植物多酚的定量分析方法和生态作用研究进展[J].应用生态学报,2006,17(12):2457-2460.
[3] Bamber R K. Heartwood, its function and formation[J]. Wood Science and Technology, 1976, 10(1): 1-8.
[4] 徐峰.红木与名贵硬木家具用材鉴赏[M].北京:化学工业出版社,2010.
[5] 郭丽冰,黄丽容,赵丽华,等.降香行气止痛、活血止血有效部位的药理筛选[J].中药材,2007,30(6):696-698.
[6] 翁新楚,任国谱,段杉,等.天然抗氧化剂的筛选[J].中国粮油学报,1998(4):46-48.
[7] Wang W, Weng X, Cheng D. Antioxidant activities of natural phenolic components fromDalbergiaodoriferaT. Chen[J]. Food Chemistry, 2000, 71(1): 45-49.
[8] Goda Y, Kiuchi F, Shibuya M, et al. Inhibitors of prostaglandin biosynthesis fromDalbergiaodorifera[J]. Chemical & Pharmaceutical Bulletin, 1987, 40(9): 2675-2677.
[9] An R B, Jeong G S, Kim Y C. Flavonoids from the heartwood of Dalbergia odorifera and their protective effect on glutamate-induced oxidative injury in HT22 cells[J]. Cheminform, 2008, 56(12): 1722-4.
[10] Liu Q, Yao H. Antioxidant activities of barley seeds extracts[J]. Food Chemistry, 2007, 102(3): 732-737.
[11] 李颖畅,吕艳芳,励建荣.Folin-Ciocalteu法测定不同品种蓝莓叶中多酚含量[J].中国食品学报,2014,14(1):273-278.
[12] 喻谨,岳永德,汤锋,等.Folin-Ciocalteu法测定竹叶中总多酚含量[J].光谱实验室,2013,30(6):2752-2758.
[13] 张军,李江遐,陆翠珍,等. Folin-ciocalteu比色法测桑叶中多酚含量[J].激光生物学报,2012,21(2):131-135.
[14] 何志勇,夏文水.Folin-Ciocalteu比色法测定橄榄中多酚含量的研究[J].林产化学与工业,2006,26(4):15-18.

