菠萝皮总黄酮和多糖双水相同时提取的研究
侯巧芝,信建豪,刘子敬
(黄河科技学院医学院,河南郑州450063)
黄酮类化合物是一类广泛存在植物中的多酚类物质,有抗菌[1]、抗氧化[2]等多种生物活性。多糖是由十个以上单糖聚合形成的高分子聚合物,具有免疫调节、抗肿瘤、抗病毒、抗氧化和降血糖等多方面非特异治疗作用[3]。双水相体系是由高聚物-高聚物或高聚物-低分子盐形成的双液体系,上相为有机溶剂相,下相为盐水相。因该体系具有技术简单、分离速度快、易于纯化,利于工业化生产等优点[4],成为目前天然产物活性成分提取的研究热点[5]。
本研究以菠萝加工过程中副产物菠萝皮为研究对象,采用双水相同时提取产物中的黄酮和多糖。根据黄酮类物质易溶于醇相(上相),多糖易溶于水相(下相)的特点,以乙醇-磷酸氢二钾为萃取介质,利用乙醇-磷酸氢二钾双水相体系同时研究菠萝皮中黄酮和多糖的最佳提取工艺,该法尚未见文献报道,以期为双水相提取天然产物中黄酮和多糖提供参考依据。
1 材料与方法
1.1 材料、仪器与试剂
菠萝皮:郑州市农贸市场采购。取皮约2 mm~3mm厚度,洗净后于烘箱50℃烘干,粉碎过80目筛后装瓶备用。
TU-1810紫外可见分光光度计:北京普析通用仪器有限公司;XFB-200粉碎机:吉首市中诚制药机械厂;KQ-300V型超声波清洗器:昆山市超声仪器有限公司。
无水乙醇、NaNO2、Al(NO3)3·9H2O、NaOH、浓H2SO4、K2HPO4·3H2O、C6H5OH:均为分析纯;芦丁标准品(GR)、葡萄糖(GR):上海阿拉丁试剂网。
1.2 试验方法
1.2.1 菠萝皮黄酮和多糖的主要提取流程
菠萝皮→粉碎→双水相萃取→抽滤→分液→取上下相测吸光度A
1.2.2 标准曲线的绘制
1.2.2.1 黄酮[6]
称取芦丁标准品37.5 mg置于25 mL容量瓶中加双水相上相溶解后定容,摇匀得1.5 mg/mL的芦丁标准溶液,分别精密吸取标准溶液 0、1、2、3、4、5 mL 于10 mL容量瓶中,加入本试验用双水相上相溶液补足至约5 mL,然后依次加入5%亚硝酸钠0.3 mL摇匀避光5 min,加入10%硝酸铝0.3 mL摇匀避光5 min,最后加入4%氢氧化钠后用上相溶液定容,摇匀后避光15 min后于510 nm处测吸光度,绘制标准曲线。
1.2.2.2 多糖[7]
称取葡萄糖标准品100 mg置于100 mL容量瓶中用双水相下相定容,摇匀得1 mg/mL的多糖标准溶液,分别精密吸取标准溶液 0、0.2、0.4、0.6、0.8、1.0 mL 于试管中,用双水相下相溶液补足至2 mL,摇匀后分别加入6%苯酚1 mL和98%浓H2SO45 mL后摇匀,冷却至30℃,以葡糖糖为0的那组作为空白对照。对该6组溶液按体积比1∶50进行稀释,在490 nm处测定稀释后溶液的吸光度A,绘制标准曲线。
1.2.3 菠萝皮中黄酮和多糖的分离提取
取1.0 g菠萝皮粉末按料液比1∶30(g/mL)加至30 mL双水相体系中,其双水相用40%磷酸氢二钾溶液和无水乙醇体积比7∶3配置的,在30℃温度下超声提取20 min,过滤后分液,分别取上下相利用1.2.2.1项方法测定黄酮的吸光度A;多糖的测定是先用sevage法除去蛋白,然后再利用1.2.2.2项方法测定多糖的吸光度A,根据标准曲线分别计算黄酮和多糖的含量。
1.2.4 菠萝皮中黄酮和多糖萃取率的测定[8-9]
黄酮萃取率Y/%=RK/(1+RK)×100,多糖萃取率Y/%=1/(1+RK)×100
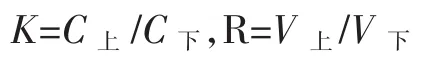
式中:K为黄酮或多糖在两相中的分配系数;C上,C下分别为黄酮或多糖上下相的浓度,mg/mL;R为上下相的体积比;V上和V下为上下相体积,mL。
1.2.5 样品含量测定[10]
根据芦丁标准曲线计算出总黄酮浓度,利用下式计算黄酮得率:

式中:C为由标准曲线计算的黄酮的浓度,mg/mL;V1为提取液的体积,mL;V2为显色反应的定容体积,mL;V3为测定取样体积,mL;m 为样品质量,g。
1.3 单因素试验
在1.2.3项条件下进行试验,保证其他条件相同的情况下改变其中的一个条件,分别考察料液比[1∶10、1 ∶20、1 ∶30、1 ∶40、1 ∶50、1 ∶60(g/mL)]、超声时间(10、20、30、40、50、60 min)、温度(10、20、30、40、50、60℃)、乙醇的体积分数(60%、70%、80%、90%、100%)和磷酸氢二钾质量分数(30%、40%、50%、60%)对萃取率的影响。
1.4 正交试验
在单因素试验基础上确定其中主要4个影响因素,然后设计四因素三水平正交试验,分别确定菠萝皮总黄酮和多糖提取的最优工艺条件。
2 结果与分析
2.1 黄酮和多糖标准曲线
以芦丁浓度C(mg/mL)为横坐标x,吸光度A为纵坐标y,得到回归方程为y=0.093 78x+0.005 2,其相关系数R2为0.999 1,在浓度0~0.75 mg/mL范围内有良好的线性关系。以多糖浓度C(μg/mL)为横坐标x,吸光度A为纵坐标y,得到回归方程为y=670.05x-0.011 1,其相关系数R2为0.999 0,在浓度0~2.5 μg/mL范围内有良好的线性关系。
2.2 单因素试验
2.2.1 料液比对黄酮和多糖萃取率的影响
料液比对黄酮和多糖萃取率的影响见图1。
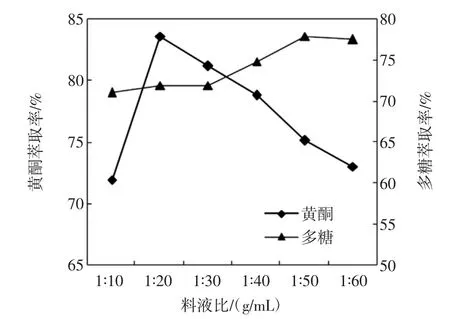
图1 料液比对黄酮和多糖萃取率的影响Fig.1 Effect of solid liquild rate on the extraction rate of flavonoids and polysaccharides
从图1可知,黄酮萃取率呈现先增后减的趋势,当料液比为1∶20(g/mL)时,萃取率达到最大为83.67%,之后又逐渐减小。多糖的萃取率则先随着料液比的增大有少许降低,料液比为1∶30(g/mL)后又增加,但料液比1∶50(g/mL)后萃取率基本不变。据此正交试验中料液比黄酮选择的3个水平分别为1∶20、1∶25、1∶30(g/mL),多糖选择的 3水平分别为 1∶35、1∶40、1 ∶45(g/mL)。
2.2.2 超声时间对黄酮和多糖萃取率的影响
超声时间对黄酮和多糖萃取率的影响见图2。
从图2知,超声时间在20 min内黄酮和多糖的萃取率基本不变,之后缓慢地降低,可能原因超声时间影响了上下相的组成,使得黄酮和多糖的萃取率均缓慢的降低。总体上看,超声时间的长短对萃取率的影响不大,说明超声20 min内黄酮和多糖已从粉末中溶出。所以正交试验没有把该因素作为考察对象,本试验超声提取时间均为20 min。
2.2.3 温度对黄酮和多糖萃取率的影响
温度对黄酮和多糖萃取率的影响见图3。
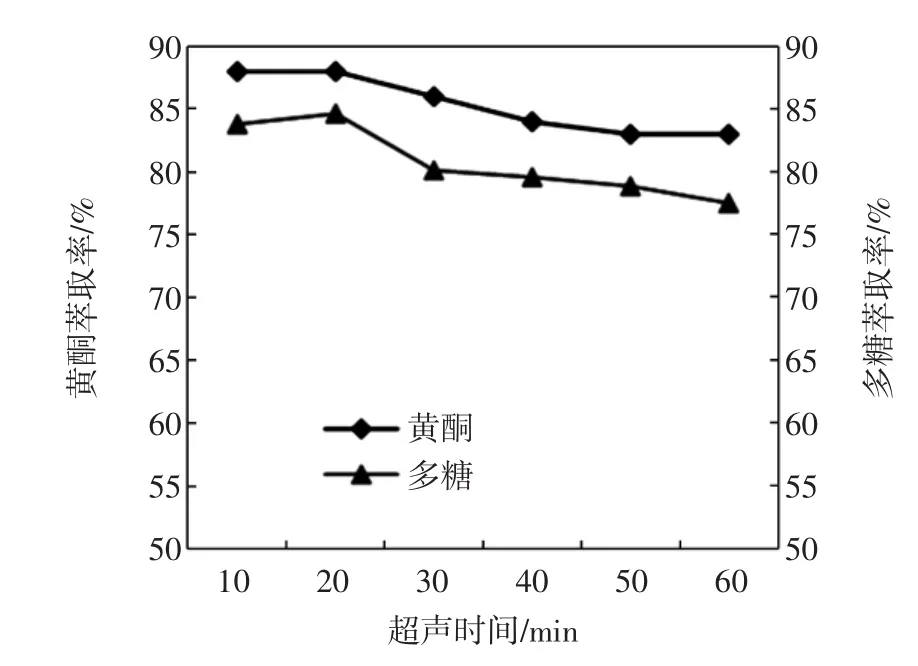
图2 超声时间对黄酮和多糖萃取率的影响Fig.2 Effect of ultrasonic time on the extraction rate of flavonoids and polysaccharides
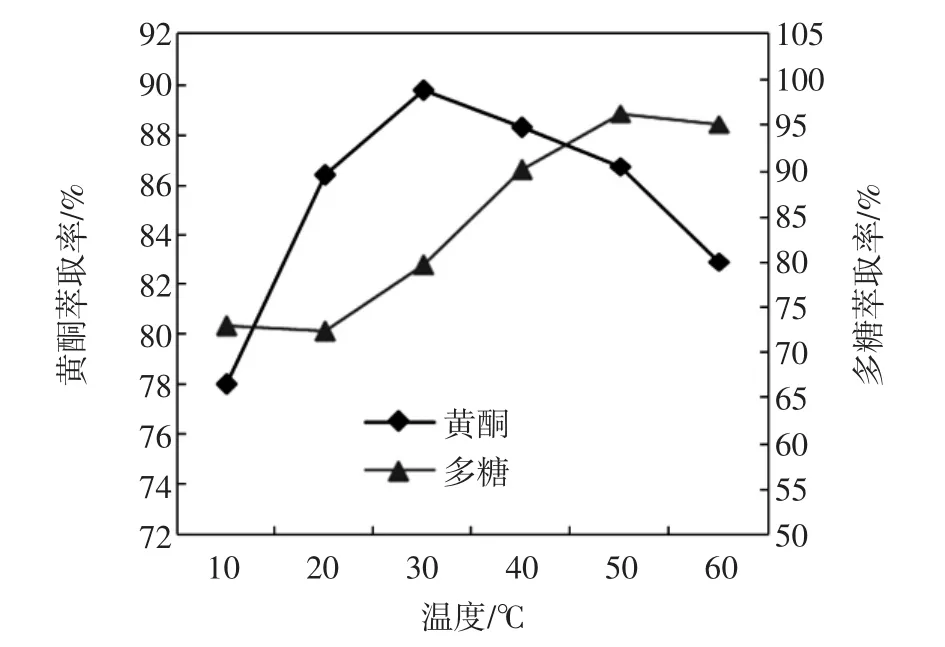
图3 温度对黄酮和多糖萃取率的影响Fig.3 Effect of temperature on the extraction rate of flavonoids and polysaccharides
从图3看,黄酮萃取率随着温度的升高呈现先增加后减小的趋势,30℃萃取率最大为89.82%,之后缓慢减小。多糖萃取率则随着温度的升高不断地增大,50℃以后萃取率基本保持不变。推测引起该变化的可能原因是温度的升高影响双水相上下相的组成。故正交试验中温度黄酮选择的3个水平分别为30、40、50℃,多糖选择的3个水平分别为40、50、60℃。
2.2.4 乙醇体积分数对黄酮和多糖萃取率的影响
试验过程中发现乙醇体积分数在60%以下的与质量分数为40%磷酸氢二钾不能形成双水相。故本试验仅选择60%、70%、80%、90%、100%5个乙醇体积分数作为单因素考察。乙醇体积分数对黄酮和多糖萃取率的影响见图4。
从图4看,随着乙醇体积分数的增加黄酮萃取率增大,乙醇体积分数100%黄酮萃取率最高为73.56%。对多糖而言,萃取率则随着乙醇浓度的增加呈现先增大后减小的趋势。可能的原因可能是适量乙醇的存在增加了脂溶性多糖的溶出。故正交试验中乙醇体积分数黄酮选择的3个水平分别为100%、95%、90%,多糖选择的3个水平分别为70%、75%、和80%。
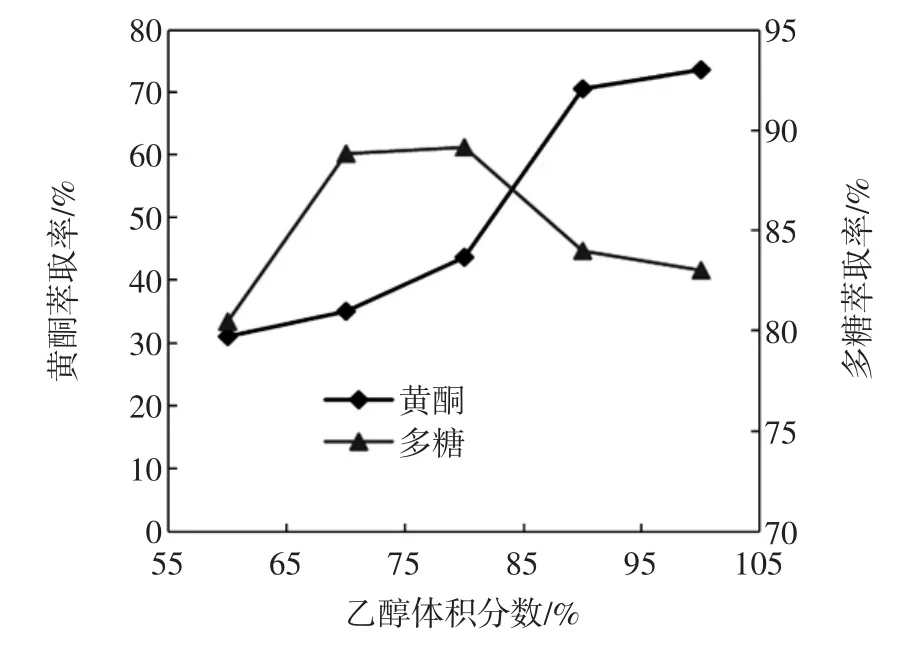
图4 乙醇体积分数对黄酮和多糖萃取率的影响Fig.4 Effect of ethanol solution concentration on the extraction rate of flavonoids and polysaccharides
2.2.5 磷酸氢二钾质量分数对黄酮和多糖萃取率的影响
试验过程中发现30%以下的磷酸氢二钾与无水乙醇不分层,60%以上的磷酸氢二钾与无水乙醇形成的双水相,上相体积过少,故本试验仅选取磷酸氢二钾质量分数30%、40%、50%、60%作为单因素考察的对象。磷酸氢二钾质量分数对黄酮和多糖萃取率的影响见图5。
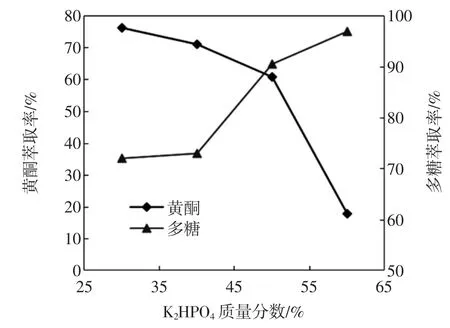
图5 磷酸氢二钾质量分数对黄酮和多糖萃取率的影响Fig.5 K2HPO4mass fraction effect on the extraction rate of flavonoids and polysaccharides
从图5知,黄酮萃取率随着磷酸氢二钾质量分数的增加而减小,多糖的萃取率则随着磷酸氢二钾质量分数的增加而增大。故正交试验磷酸氢二钾质量分数黄酮选择的3水平分别为30%、35%、40%,多糖选择的3水平分别为50%、55%、60%。
2.3 正交试验
黄酮和多糖超声提取时间均为20 min,选择乙醇体积分数(A)、料液比(B)、磷酸氢二钾质量分数(C)、提取温度(D)作为正交试验的4个因素,每个因素考察3个水平,设计L9(34)正交试验因素水平表。黄酮提取因素水平选取见表1,结果如表2。多糖提取因素水平选取见表3,结果如表4。
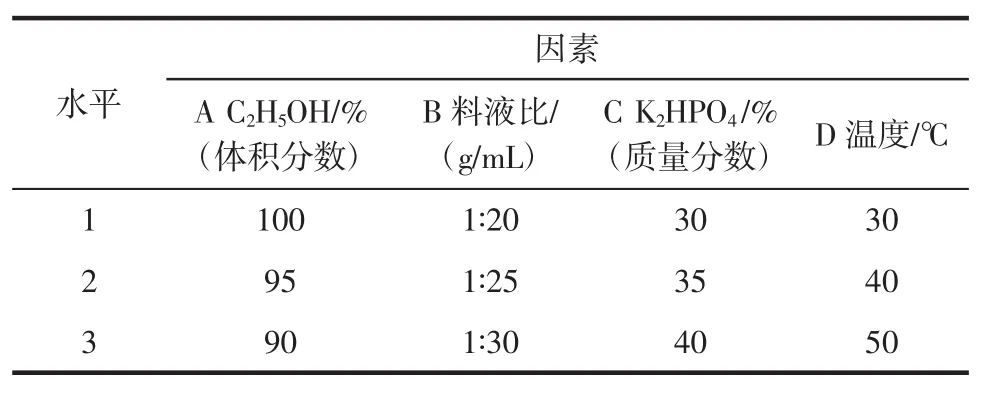
表1 黄酮正交试验因素水平表Table 1 Orthogonal experiment factors and levels table of the flavonoids
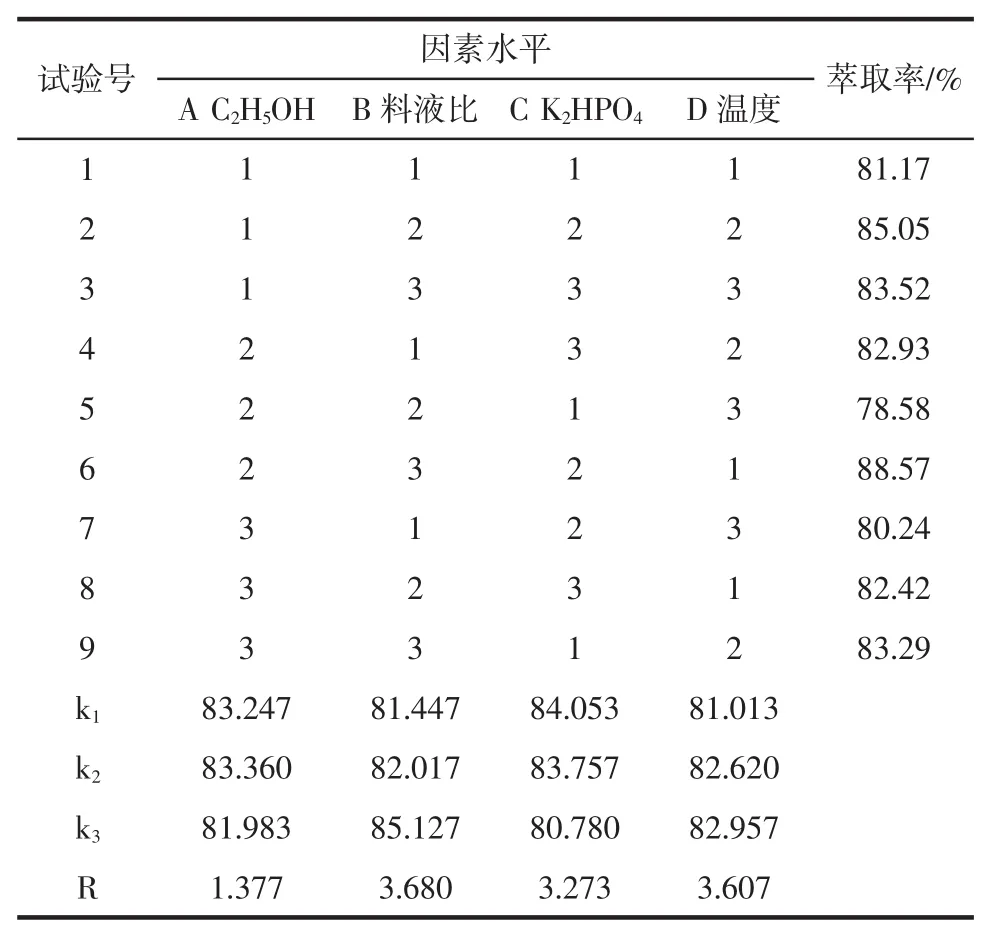
表2 黄酮正交试验结果表Table 2 Orthogonal experiment results and analysis table of the flavonoids
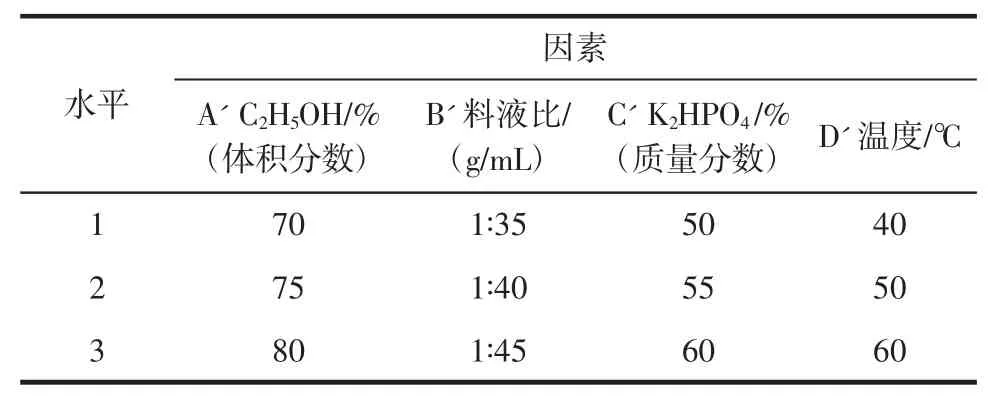
表3 多糖正交试验因素水平表Table 3 Orthogonal experiment factors and levels table of the polysaccharides
由表2黄酮正交试验结果看,影响黄酮萃取率的主次顺序为:B>D>C>A,最优水平为 A2B3C1D3,即乙醇分数为95%,料液比为1∶30(g/mL),磷酸氢二钾质量分数为30%,提取温度为50℃。由表4多糖正交试验结果看,影响多糖萃取率的主次顺序为:D'>A'>C'>B',最优水平为A'1B'3C'2D'3,即乙醇体积分数为70%,料液比为1∶45(g/mL),磷酸氢二钾质量分数为55%,提取温度为60℃。
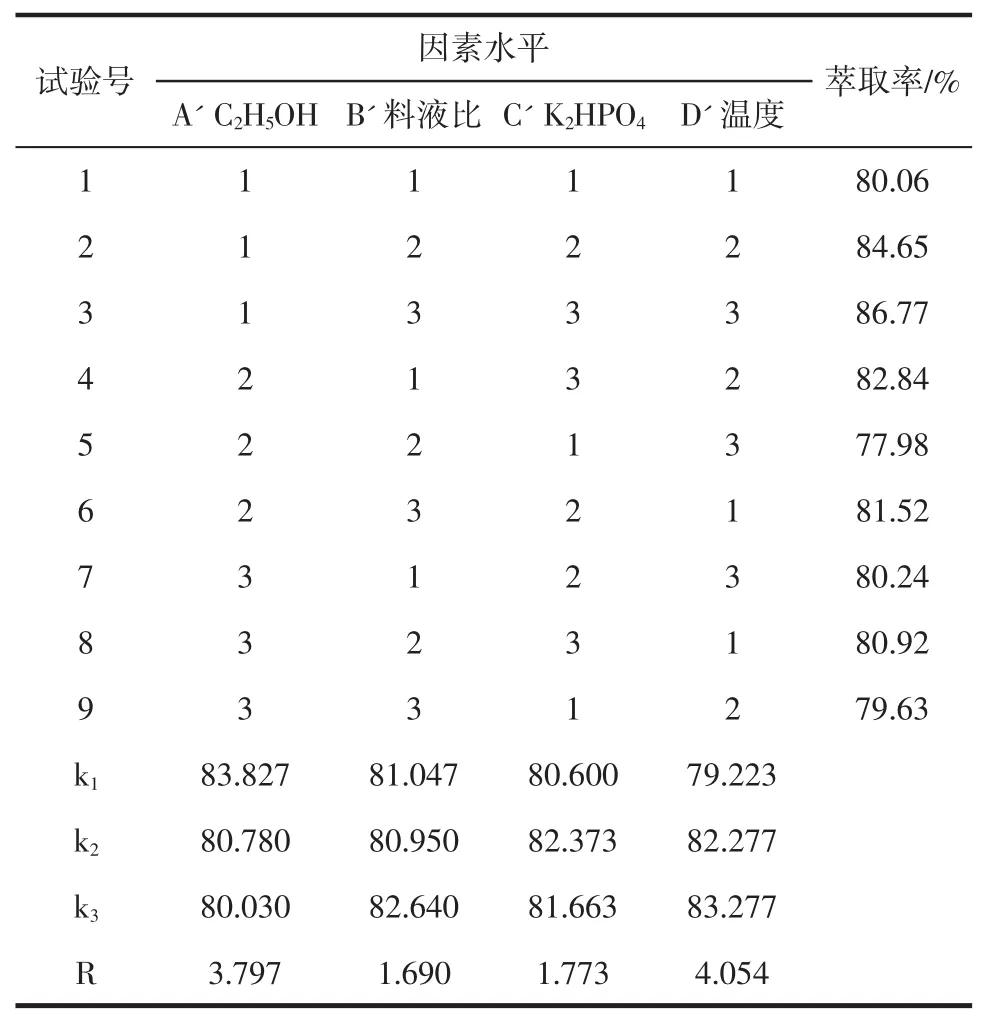
表4 多糖正交试验结果表Table 4 Orthogonal experiment results and analysis table of the polysaccharides
2.4 工艺验证
为了进一步验证正交试验的结果,分别精密称取菠萝皮粉末2 g分别在黄酮和多糖正交试验最优提取工艺条件下进行萃取,平行3份,提取次数3次,得到黄酮和多糖平均萃取率分别为88.64%和86.91%,相对标准偏差RSD分别为1.62%和1.05%,得率分别为21.33 mg/g和18.95 mg/g。说明工艺条件稳定可行,结果重现性较好。
3 结论
本研究以萃取率为指标,采用超声辅助磷酸氢二钾-乙醇双水相体系同时提取菠萝皮总黄酮和多糖,结果表明黄酮最佳提取工艺为乙醇体积分数95%,料液比1∶30(g/mL),磷酸氢二钾质量分数为30%,提取温度50℃,超声时间20 min。多糖最优提取工艺为乙醇分数为70%,料液比为1∶45(g/mL),磷酸氢二钾质量分数为55%,提取温度为60℃。超声时间20 min。在最优工艺条件下经过3次平行试验,提取3次,黄酮和多糖萃取率分别为88.64%、86.91%,得率分别为21.33、18.95 mg/g。说明工艺条件稳定可行,结果重现性较好。
[1]游庭活,刘凡,温露,等.黄酮类化合物抑菌作用研究进展[J].中国中药杂志,2013,38(21):3645-3650
[2]鲁晓翔.黄酮类化合物抗氧化作用机制研究进展[J].食品研究与开发,2012,33(3):220-224
[3]谢明勇,聂少平.天然产物活性多糖结构与功能研究进展[J].中国食品学报,2010,10(2):1-11
[4]P A J Rosa,I F Ferreira,A M Azevedo,et al.Aqueous two-phase systems:A viable platform in the manufacturing of biopharmaceuticals[J].Journal of Chromatography A,2010,1217(16):2296-2305
[5]刘磊磊,李秀娜,赵帅.双水相萃取在中药活性成分提取分离中的应用进展[J].中草药,2015,46(5):766-773
[6]元晓梅,蒋明蔚,胡正芝.聚酰胺吸附-硝酸铝显色法测定山楂及山楂制品中的总黄酮含量[J].食品与发酵工业,1996(4):27-32
[7]池源,王丽波.苯酚-硫酸法测定南瓜籽多糖含量的条件优化[J].食品与机械,2014,30(1):89-92
[8]巩育军,牛盛童,黄学锋,等.离子液体双水相萃取山楂黄酮和多糖的研究[J].化学与生物工程,2014,31(7):27-29,33
[9]李化,柯华香,李发洁,等.Box-Behnken响应面法优选五味子多糖双水相提取工艺[J].中药材,2016,39(3):593-597
[10]杭瑜瑜,励建荣,裴志胜,等.响应面法优化超声波辅助提取菠萝皮中黄酮[J].中国食品添加剂,2015(5):142-149

