响应面优化超声辅助提取豌豆总黄酮工艺研究
康永锋,薛永刚,韩巧英
(1.上海海洋大学食品学院,上海201306;2.食品科学与工程国家级实验教学示范中心(上海海洋大学),上海201306;3.农业部水产品贮藏保鲜质量安全风险评估实验室(上海),上海201306;4.正宁县人民医院,甘肃庆阳745300)
豌豆(Pisum sativum Linn)又称青豆、麦豌豆等,在我国种植范围很广,在日常饮食中也常食用或作为药用。豌豆的蛋白质含量高,还有人体所必需的氨基酸及其他矿物质和维生素等[1],营养成分丰富。豌豆性味甘平,有和中下气、利小便、解疮毒的功效[2]。目前国内对豌豆的种植、加工研究的比较多,但是对豌豆的营养成分特别是带有生物活性的黄酮类成分提取及生物活性研究的较少。黄酮类化合物是自然界中广泛存在的一类重要的天然有机化合物。黄酮类化合物具有抗肿瘤、抗氧化、抗炎、抗病毒、抗菌活性、免疫调节活性、预防心血管疾病等很多生物活性[3-8],在功能食品及医药领域广受关注。大豆异黄酮是生物黄酮的一种,是豆科植物生长过程中产生的次生代谢产物。自然界中异黄酮资源非常有限,其中豆科植物荚豆类、葛根等少数植物含异黄酮较多,其中以大豆含量最为丰富。一般每100 g大豆含有大豆异黄酮约14 mg~150 mg[9],而且大豆也是唯一被认可具有营养学价值的异黄酮食物资源。黄酮类化合物也常作为药效学指标进行定性与定量分析[10],其中分光光度法测定总黄酮含量是目前最常用的测定方法[11-12]。
超声波强烈的振动、空化效应和搅拌等作用可加速成分的溶出。超声波辅助提取工艺有效提高提取率,缩短提取时间。超声波辅助提取操作简单方便、节省溶剂,近年来已广泛应用于天然植物有效成分的提取[13-15]。本研究采用专门的超声波提取设备,以豌豆为原料测定总黄酮含量,研究超声波辅助提取豌豆总黄酮的工艺条件。采用单因素分析,对提取工艺进行初步分析,利用响应曲面法,在单因素试验的基础上对超声波辅助提取豌豆中总黄酮物质的提取工艺进行优化,得到豌豆中总黄酮的提取最佳工艺参数,在此条件下得到的最佳提取率接近文献中大豆异黄酮含量的最大值[9],为进一步开发和利用豌豆资源提供理论依据。
1 材料与方法
1.1 材料与仪器
干豌豆:上海易初莲花超市;芦丁标准品:国药化学试剂有限公司;染料木苷标准品:上海源叶生物科技有限公司;95%乙醇、硝酸铝,、亚硝酸钠、氢氧化钠、石油醚、磷酸均为分析纯试剂:国药化学试剂有限公司。试验用水为蒸馏水。除特殊标明外所有乙醇溶液均为乙醇水溶液。
PB203-N电子分析天平:梅特勒托利多;XH-2008D型超声波萃取仪:北京祥鹄科技发展有限公司;FW177型中草药粉碎机:天津市泰斯特仪器有限公司;恒温干燥箱:上海精宏实验设备有限公司;GT10-1型离心机:北京时代北利离心机有限公司;SHB-95型真空泵:巩义市英峪仪器厂;UV-2000紫外可见分光光度计:尤尼柯仪器有限公司。
1.2 试验方法
1.2.1 对照品标准曲线
精确称取10 mg染料木苷标准试剂,用体积分数为95%乙醇水溶解,并完全转入100 mL容量瓶中,用95%乙醇定容,摇匀,得0.100 mg/mL的染料木苷标准溶液。分别吸取上述染料木苷标准溶液0、0.2、0.4、0.6、0.8、1.0 mL,于6支10 mL容量瓶中并定容。用分光光度计在260 nm处测量吸光度[16],得到吸光度A与染料木苷浓度C的回归方程为:
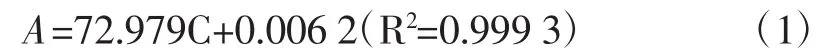
1.2.2 样品前处理
将豌豆放在恒温干燥箱中80℃干燥至恒重,然后粉碎过80目筛子。过筛后的豆粉用石油醚脱去脂肪和色素,抽滤后放置于80℃干燥至恒重。处理好的豆粉样品密封放置于冰箱中保存待用。
1.2.3 豌豆提取液黄酮含量的测定
精确称取豌豆粉1 g,置于三口圆底烧瓶中,加入提取溶剂,将圆底烧瓶装于超声波合成萃取仪中,设定好提取条件,用超声波辅助提取。提取液10 000 r/min离心10min然后抽滤,滤液用60%的乙醇定容到50mL作为待测溶液。分别取5 mL待测溶液到10 mL容量瓶中定容。按照测定染料木苷标准品的方法,在260 nm波长处测定吸光度A代入公式(1)得到提取液中总黄酮质量m(以染料木苷为对照品),并按公式(2)(3)计算总黄酮提取率Q。
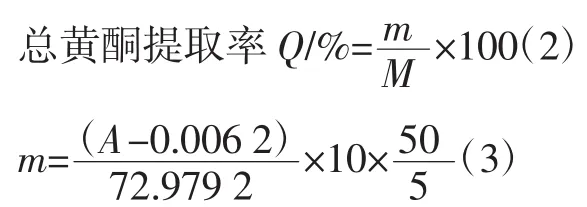
式中:m为提取液中黄酮总质量,mg;M为豌豆粉质量,g;A为260 nm波长处测定吸光度;5为5 mL待测溶液;10为5 mL待测溶液稀释到10 mL;50为1 g豌豆粉提取黄酮待测溶液的体积50 mL。
1.2.4 超声波辅助提取豌豆黄酮最佳条件的确定
在响应面优化前通过单因素试验对乙醇含量、pH值、提取时间、超声波功率、液料比、提取温度6个因素对超声波辅助提取豌豆黄酮的影响进行分析。在单因素分析的结果上选取了乙醇含量、液料比、提取温度这3个影响较大的因素进行响应面分析。响应面分析采用的是Design-Expert软件,选用了常用的Box-Behnken的中心组合分析方法设计了三因素三水平共17个试验点进行优化分析。利用响应面优化最终确定了超声波辅助提取豌豆黄酮的最佳条件。
1.2.5 抗氧化活性研究
采取邻苯三酚自氧化法测定超氧阴离子自由基(O2-·)清除率来表征抗氧化活性。取pH值为8.2的Tris-HCl缓冲液4.5 mL,25℃水浴加热20 min,分别加入不同体积的样品提取液使其最终浓度分别为20、40、60、80、100 μg/mL,再加入在25℃水浴中预热的3 mmol/L的邻苯三酚溶液0.3 mL,定容至10 mL,迅速摇匀后倒入比色皿中,以同体积的蒸馏水代替样品提取液作为空白对照,在325 nm处,每隔30秒以测一次吸光度,共反应4 min;以吸光度A对反应时间t作线性关系图,斜率即为自氧化法速率ΔA;邻苯三酚的自氧化法速率用同体积的蒸馏水代替黄酮提取液进行测定,记为ΔA0;根据公式计算清除率:

式中:ΔA0为邻苯三酚的自氧化速率;ΔA1为加入黄酮溶液后邻苯三酚自氧化速率。
2 结果与讨论
2.1 豌豆中黄酮定性分析和测定方法的确定
在黄酮类化合物的紫外吸收光谱中,主要的吸收带是300 nm~400 nm之间由B环桂皮酰基系统电子跃迁引起的吸收带Ⅰ和240 nm~285 nm之间由A环苯甲酰基系统电子跃迁引起的吸收带Ⅱ组成。因为提取物中除黄酮类化合物外,还含有酚类、脂类、脂肪酸等化合物,在带Ⅰ和带Ⅱ范围内均有一定程度的吸收,会对黄酮的测定产生干扰。因此加入铝盐等使黄酮类化合物与其形成稳定的配合物,可使吸收带Ⅰ产生明显红移的同时增加吸光度,有利于测定提取物中总黄酮的含量。但有研究表明以芦丁为对照品,以NaNO2-Al(NO3)3-NaOH为显色剂进行总黄酮含量测定的方法专属性不强[5],以此方法测定含量可能产生较大误差。因此我们分别对芦丁、染料木苷、豌豆黄酮提取液、NaNO2-A1(NO3)3-NaOH显色的芦丁和豌豆黄酮提取液进行了光谱扫描,谱图见图1。
从图1可以看出,未显色豌豆黄酮提取液的谱图与染料木苷的相似度较高,在190 nm和260 nm左右有最大吸收峰,与芦丁的谱图差异度较大,芦丁除在190nm和260nm左右有最大吸收峰,在300nm~400nm之间有一个大的吸收峰,而未显色豌豆黄酮提取液与染料木苷的谱图在这一波段只有非常小的吸收峰,这证明豌豆中黄酮主要是异黄酮类化合物,黄酮类化合物较少。从NaNO2-A1(NO3)3-NaOH显色的芦丁和豌豆黄酮提取液的谱图进行分析,也可得出相同的结论。显色芦丁在510 nm左右有最大吸收峰,显色的豌豆黄酮提取液在此波长吸收很小,而510 nm正是以芦丁为对照品,以NaNO2-A1(NO3)3-NaOH为显色剂进行总黄酮含量测定时经常所用的波长,这将导致通常采用的以芦丁为对照品,以 NaNO2-A1(NO3)3-NaOH为显色剂测定的总黄酮含量并不能真实的反映实际情况。因此本文染料木苷为对照品,以260 nm为测定波长的方法,以便更准确的测定豌豆中总黄酮含量。
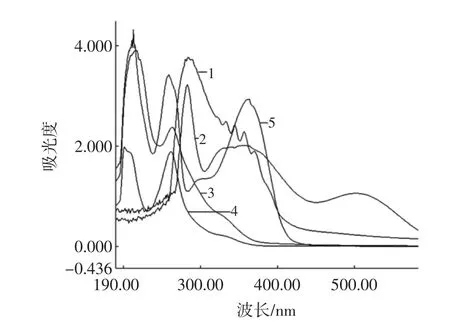
图1 对照品、提取液的紫外可见光谱图Fig.1 UV-vis spectra of reference substances and flavonoid extracting solution from beans
2.2 单因素试验
提取条件对豌豆总黄酮提取率的影响见图2。
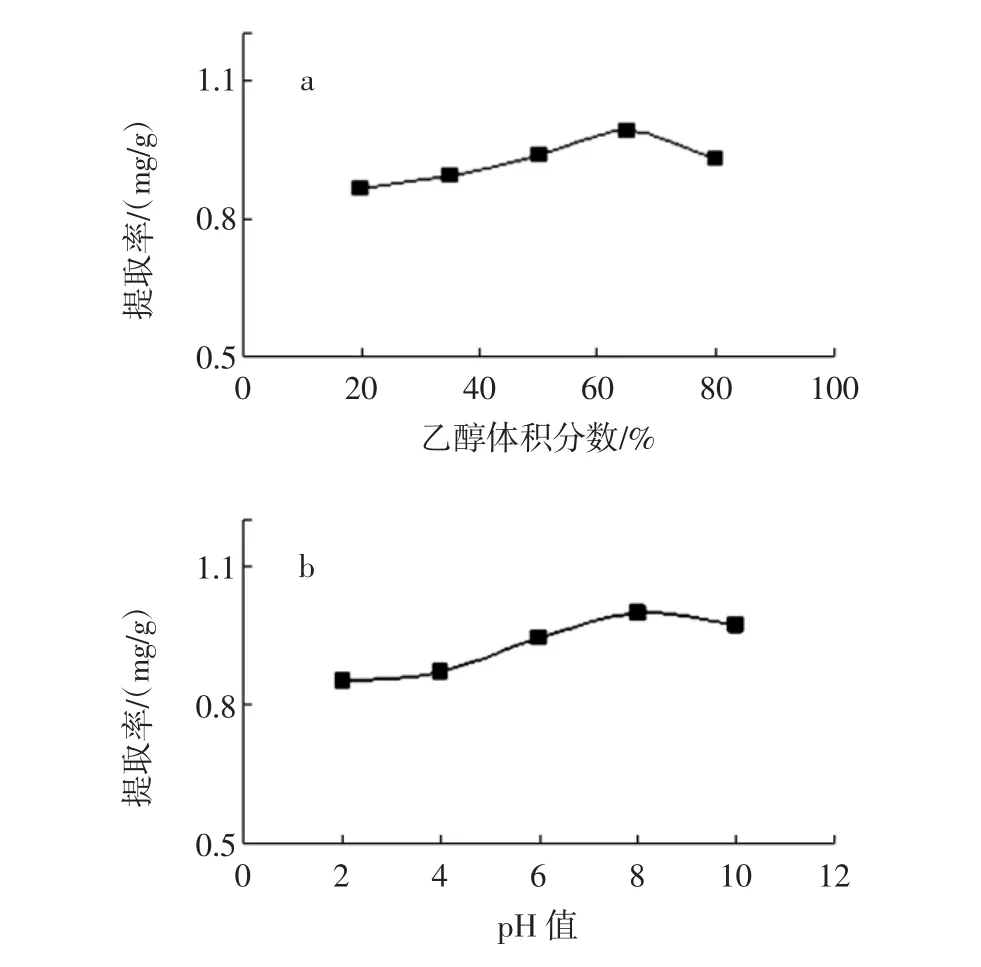
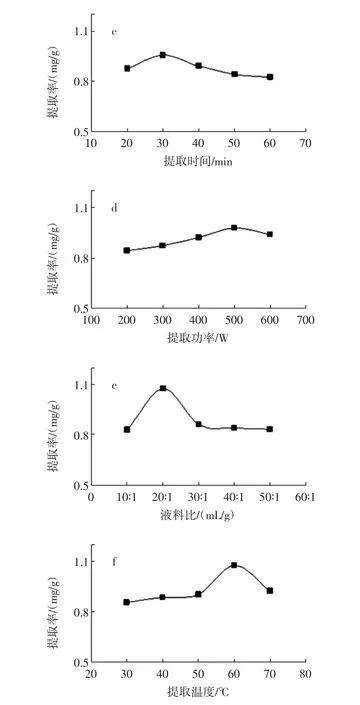
图2 提取条件对豌豆总黄酮提取率的影响Fig.2 Effect of the extraction factors on the extraction yield
2.2.1 乙醇体积分数对黄酮类化合物提取的影响
称取豆粉1 g,固定超声波功率为500 W、提取时间 30 min、提取温度 60℃、液料比为 20 ∶1(mL/g)、pH=8,分别用不同浓度的乙醇进行提取,试验结果见图2a。从图中可以看出乙醇体积分数对黄酮的提取影响比较大,低浓度时提取率随浓度增加而增加,浓度大于65%后随浓度增加下降,说明豌豆黄酮在65%左右的乙醇中溶解度最大。
2.2.2 pH值对黄酮类化合物提取的影响
称取豆粉1 g,提取溶剂为65%乙醇,固定超声波功率为500 W、提取时间30 min、提取温度60℃、液料比为20∶1(mL/g),分别在不同pH值下进行提取,试验结果见图2b。从图中可以看出,在碱性条件下豌豆中的黄酮类化合物提取率更高,这一方面可能是碱性条件下黄酮与碱反应生成了溶解性较好的盐,另一方面,可能是在此pH值下大豆蛋白质等杂质溶解性降低,促进了黄酮的溶出。
2.2.3 提取时间对黄酮类化合物提取的影响
称取豆粉1 g,提取溶剂为65%乙醇,固定超声波功率为500 W、提取温度60℃、液料比为20∶1(mL/g)、pH=8,分别在不同时间下进行提取,试验结果见图2c。从图中可以看出,30 min左右的提取时间可以达到最大的提取率,时间太短可能提取不完全,时间太长导致豌豆中其他物质溶解量增加,影响黄酮类物质的溶出。
2.2.4 超声波功率对黄酮类化合物提取的影响
称取豆粉1 g,提取溶剂为65%乙醇,固定提取时间 30 min、提取温度 60 ℃、液料比为 20 ∶1(mL/g)、pH=8,分别在不同功率下进行提取,试验结果见图2d。从图中可以看出在超声功率为200 W~500 W之间,黄酮提取率随超声功率增加而增加,在500 W时,黄酮提取率达到最大值。超声功率超过500 W后,提取率反而下降。这可能是超声功率较低时,超声波对豌豆细胞壁破碎程度随超声功率增大而加大,黄酮的浸出随之增大,提取得率逐渐增加。但当超声功率超过500 W后,超声波所产生的破碎效应和热效应同时使豌豆中杂质的溶出增加,热效应又使黄酮成分与这些杂质分子相互反应,从而导致黄酮的提取率下降。因此,超声提取黄酮的最佳功率选500 W。
2.2.5 提取液料比对黄酮类化合物提取的影响
称取豆粉1 g,提取溶剂为65%乙醇,固定超声波功率为500 W、提取时间30 min、提取温度60℃、pH=8,分别采用不同液料比进行提取,试验结果见图2e。从图中可以看出,液料比对黄酮类物质提取率影响很大,20 ∶1(mL/g)左右的液料比效果最佳。
2.2.6 提取温度对黄酮类化合物提取的影响
称取豆粉1 g,提取溶剂为65%乙醇,固定超声波功率为500 W、提取时间30 min、液料比为20∶1(mL/g)、pH=8,分别在不同温度下进行提取,试验结果见图2f。从图中可以看出,30℃~60℃范围内,总黄酮提取率随着温度的升高而上升,至60℃时达到最大值。超过60℃后,随着温度的升高,提取率反而下降。这可能是在60℃之前提高超声温度,不但可以加快溶剂分子的扩散速度,而且也促进了黄酮分子的溶出速度,使更多的黄酮成分溶出,提取率提高。但当超声温度超过60℃后,温度接近乙醇沸点,容易导致乙醇挥发,造成提取溶剂减少,同时温度过高也可能造成黄酮类物质破坏,从而导致了提取率的下降。所以,确定最佳超声提取温度为60℃。
2.3 响应面优化分析
在单因素试验的基础上,选取对提取率影响比较大的温度,液料比,乙醇体积分数3个因素进行三水平响应面优化,其他条件则按照单因素试验的最佳条件设置。试验因素与水平设计如表1。

表1 响应面试验因素与水平Table 1 Factors the levels of experiment of response surface analysis
选用Box-Behnken的中心组合试验设计原理,得到如表2所示设计方案。
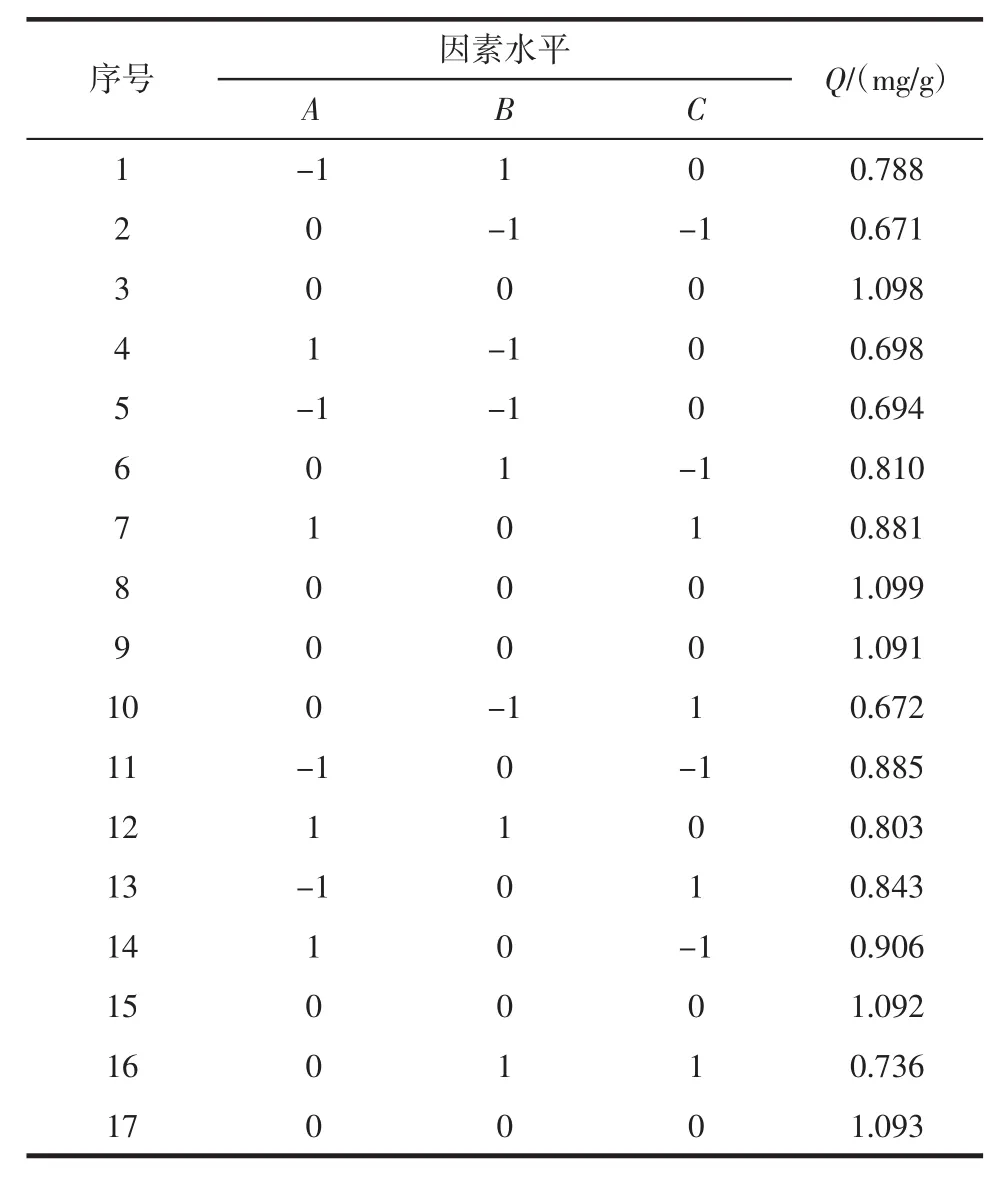
表2 Box-Behnken试验设计方案及试验结果Table 2 The Box-Behnken experimental design and results
统计分析后得到超声波提取豌豆总黄酮提取率与各个因素的关系为:
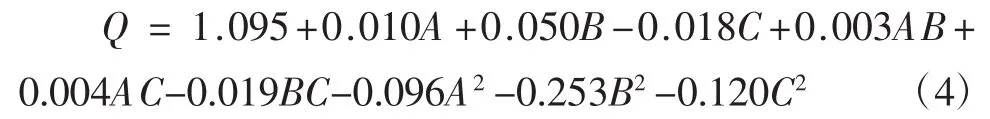
对上述回归方程进行发差分析,结果如表3。
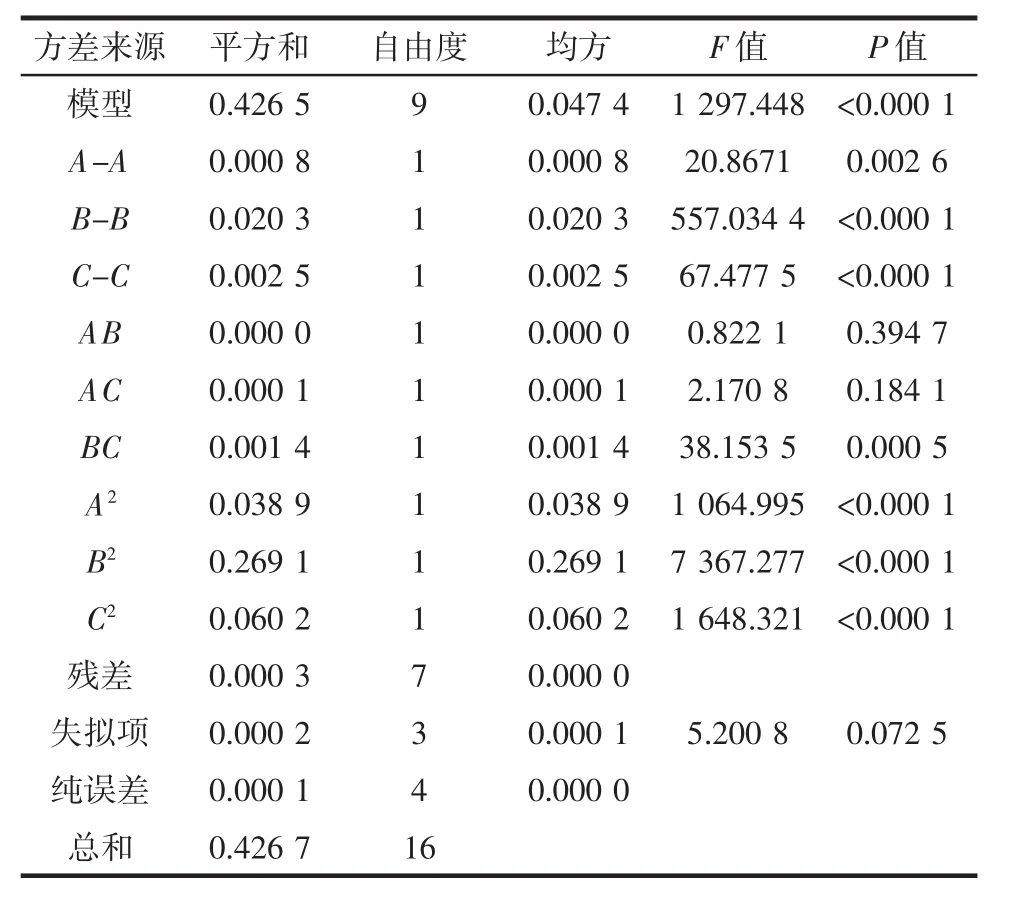
表3 提取率回归方程的方差分析表Table 3 Anova for the extraction yield
表3中模型(P<0.000 1)失拟性值为5.2,说明模型很显著。单因素决定因素(A,B,C)Prob>F值均小于0.05,但是AB,AC交互作用大于0.05,同样,单因素中A的决定值是最大的。误差可能是由A温度产生的。综合来说模型达到了理想的模拟效果。3个因素的影响作用从大到小依次为:液料比>乙醇体积分数>提取温度,其中液料比和乙醇体积分数效果显著。双因素交互对提取率Q的影响三维图见图3。
2.4 模型验证
通过对超声波辅助提取豌豆总黄酮进行响应面优化得到最佳的提取条件为提取温度:60.86℃,液料比 20.80∶1(mL/g),乙醇体积分数:63.58%。最佳的提取率为Q:1.098 mg/g。在验证试验中取温度为61℃,液料比21∶1(mL/g),乙醇体积分数为65%,做4次平行试验,平均提取率为Q:1.101 mg/g,相对误差为0.30%。说明该优化模型数据可靠,具有实用价值。

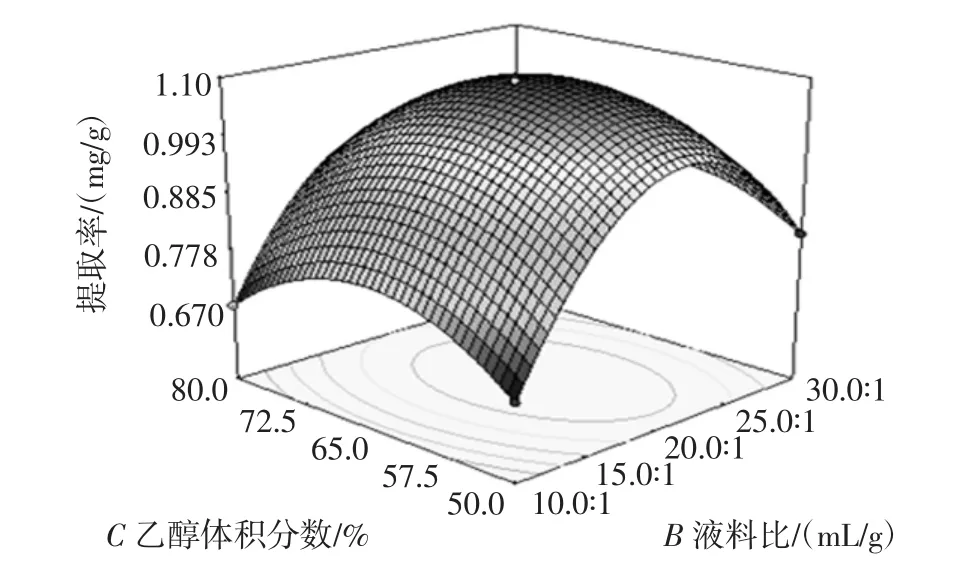
图3 提取温度与液料比、提取温度与乙醇体积分数、乙醇体积分数与液料比对提取率的影响Fig.3 The influence of extraction temperature and liquid ratio,extraction temperature and ethanol volume fraction,ethanol volume fraction and liquid ratio extraction yield
2.5 抗氧化活性研究
采用邻苯三酚自氧化法研究豌豆异黄酮提取液的超氧阴离子自由基清除作用,结果如图4。
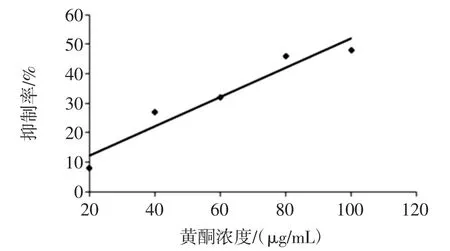
图4 黄酮对超氧阴离子自由基的清除作用Fig.4 The inhibition of flavones to O2-·
结果表明,豌豆异黄酮对超氧阴离子自由基的抑制作用具有浓度依赖关系,随着异黄酮浓度的增大,对超氧阴离子的抑制率不断增大。豌豆异黄酮对超氧阴离子自由基的抑制效果与文献[17]基本一致。
3 结论
通过对照品、提取液的紫外可见光谱图的对比分析,豌豆黄酮提取液在紫外区的吸收谱和染料木苷具有更好的拟合性,而与芦丁的紫外可见吸收峰拟合性较差,说明豌豆黄酮主要是大豆异黄酮。采用响应面优化超声波辅助提取豌豆黄酮的试验参数并建立数学模型,从模型分析中可以看出,以染料木苷作为对照品得到的数学模型是可靠的。
本试验通过响应面优化后得到超声波辅助提取豌豆黄酮类化合物的最佳工艺条件为:提取温度:60.86℃,液料比:20.80∶1(mL/g),乙醇含量:63.58%。在实际提取中选取提取温度为61℃,液料比21∶1(mL/g),乙醇含量为65%,得到的豌豆黄酮提取率为1.101 mg/g。通过方差分析和模型验证,证明该优化工艺具有实用价值。对超氧阴离子自由基的清除作用表明豌豆异黄酮提取液具有一定抗氧化作用。
[1]江洋,丁文平,庄坤,等.豌豆粉对南方馒头品质的影响[J].粮食与饲料工业,2015(8):22-26,31
[2]石永峰.豌豆的营养价值及其加工技术[J].粮食与饲料工业,1994(4):21-23
[3]Morley K L,Ferguson P J,Koropatnick J.Tangeretin and nobiletin induce G1 cell cycle arrest but not apoptosis in human breast and colon cancer cells[J].Cancer Letters,2007,251:168-178
[4]韩雅慧,陶宁萍.甘草黄酮提取及其抗氧化能力测定方法研究进展[J].山西农业科学,2010,38(11):89-93
[5]Park H,Dao T T,Kim H P.Synthesis and inhibition of PGE2 production of 6,8-disubstituted chrysin derivatives[J].Eump J Med Chem,2005,40(9):943-948
[6]Lall N,Hussein A A,Meyer J J M.Antiviral and antituberculous activity of Helichrysum melanacme constituents[J].Fitoterapia,2006,77(3):230-232
[7]Gharagozloo M,Kanmi M,Amirghofran Z.Immunomodulatory effects of silymarin in patients with beta-thalassemia major[J].Int Immunopharmacol,2013,16(2):243-247
[8]姜秀娟,王旭辉,李奕,等.木贼总黄酮对ox-LDL损伤内皮细胞保护作用的形态学观察[J].时珍国医国药,2012,23(3):637-638
[9]郭小虎,代晓曼,张波.大豆异黄酮的生物活性及毒理学研究进展[J].大豆科学,2011,30(4):693-696
[10]池玉梅,居羚,邓海山,等.分光光度测定总黄酮法的适用性[J].分析化学,2010,38(6):893-869
[11]李运,张霁,徐福荣,等.红外光谱结合化学计量学对三七总黄酮含量的快速预测研究[J].光谱学与光谱分析,2017,37(1):70-74
[12]常飞,吴文能,曹晖.白补药总黄酮含量测定方法的建立[J].天然产物研究与开发,2016,28(1):71-75,82
[13]王金柱,刘春霞,刘凤云.响应面优化超声波辅助酶法提取橘皮黄酮的研究[J].食品研究与开发,2016,37(4):56-59
[14]朱德艳,陈晗.超声波辅助提取葛根中总黄酮及其体外抗氧化性的研究[J].食品研究与开发,2017,38(2):62-65
[15]曹建华,李光辉,张敏.超声波辅助提取蓝莓总黄酮的工艺优化[J].中国药房,2015(31):4426-4428
[16]黄昀,张永忠.紫外分光光度法对大酱中异黄酮总含量的分析比较[J].大豆通报,2007(1):19-20,31
[17]徐春华,张治广,谢明杰.大豆异黄酮的抗氧化和抗肿瘤活性研究[J].大豆科学,2010(5):870-873

