滩涂土壤固氮菌群落与环境因子的典范对应分析①
蔡树美,徐四新,张翰林,张德闪,吕卫光,顾富家,诸海焘*
(1上海市农业科学院生态环境保护研究所,上海 201403;2上海市设施园艺技术重点实验室,上海 201403;3 农业部上海农业环境与耕地保护科学观测实验站,上海 201403;4申农(上海)生态农业发展有限公司,上海 202150)
我国耕地资源紧缺,滩涂是重要的后备土地资源,有着巨大的开发潜力和利用价值。然而滩涂土壤并非农用耕地,恶劣的滩涂生态环境仍是制约人们更深层次利用这片资源的瓶颈。其限制因子主要包括土壤结构差、含盐量高、有机质和全氮含量低等问题[1-3]。因此,如何合理利用和开发这片极具价值的土壤后备资源,已经成为缓解当前农业用地日益紧缺矛盾、助推农业可持续发展的难点之一。
面对滩涂资源生态不断恶化的现实,以生物利用为核心的生物改良技术近年来日趋受到重视。通过紫云英等绿肥种植和农田耕翻轮作等模式,提升土壤有机质、增加碳汇、培肥地力,已经成为近年来滩涂土壤生物改良的新趋势。目前对滩涂紫云英-水稻轮作生物改良技术的试验研究,大多集中在土壤类型、水分、施肥、植被等非微生物学因素方面[4-8],对固氮菌群落结构和多样性等微生物学因素方面的野外试验研究相对较少。虽有报道显示紫云英-水稻轮作能提高根际土壤和水稻根内生微生物多样性[9-10],但对紫云英-水稻轮作生物改良行为下滩涂土壤特殊生理类群微生物群落结构的响应机制仍不清楚,制约了滩涂土壤土地利用效率和土壤改良效率的提高。
本研究通过分析紫云英-水稻轮作模式对滩涂土壤固氮菌群落结构和土壤环境因子的影响,并通过土壤固氮菌群落结构和土壤环境因子的相关性分析,比较固氮菌群落和土壤环境对紫云英-水稻轮作模式的响应,为滩涂盐碱地的生物改良技术提供参考。
1 材料与方法
1.1 试验区概况
试验于2011年10月至2015年6月在上海崇明岛东滩优质水稻种植功能区进行(121º51′E,31º36′N)。该区域位于上海崇明东滩上实现代农业园区范围内,属北亚热带季风海洋性气候,年均日照时数2 104 h,日照百分率47%,全年无霜期229 d,平均气温15.3 ℃,年均降水量 1 022 mm。由于园区位处新近形成的潮滩湿地,1990年才开始进行大面积围垦,土壤普遍存在盐碱较重、肥力偏低等问题。在前期对200份土壤样品的调查数据中发现,pH>7.5的土壤占比95.5%,其中pH>8.5的碱性土壤占比24.0%;盐分>1 g/kg的土壤占比77.5%,部分土壤盐分含量高达6 g/kg以上;有机质含量<10 g/kg的土壤占比40.5%,部分土壤有机质含量低于2 g/kg。故此采取播种水稻、水稻-绿肥轮作等方式对园区土壤进行洗盐改造。
供试水稻为当地主栽品种“花优 14”,系上海市农业科学院选育的优质超高产、耐盐性强的水稻新品种,供试紫云英为余江大叶籽,供试土壤为长江泥沙淤积而成的盐渍沙壤土。试验区土壤地力偏低,地势平坦。0~20 cm耕层土壤性质为:全氮0.48 g/kg,全磷0.61 g/kg,全钾16.4 g/kg,速效氮36.3 mg/kg,有效磷22.3 mg/kg,速效钾198.2 mg/kg,有机质4.42 g/kg,pH 8.55,全盐 2.46 g/kg,EC 214.3 μS/cm。
1.2 试验设计
试验设置水稻-紫云英轮作区和水稻-冬季休闲区,每区面积66.7 m2。紫云英于每年10月5日播种,播种量为2.5 kg/667m2,于4月底全量翻压还田。
试验从2011年起连续进行4年,共计有4茬绿肥、4茬水稻。田间按照常规施肥方式进行水肥管理,商品有机肥用量为3 000 kg/hm2,化肥用量折算为纯N 270 kg/hm2,P2O5120 kg/hm2,K2O 150 kg/hm2。氮肥分4次施用:基肥50%,蘖肥(苗期)20%,拔节肥10%,穗肥占20%;磷肥100% 作基肥;钾肥分为基肥 50% 与拔节期追肥 50%。化肥品种选用尿素(N 46%)、复合肥(15∶15∶15)、氯化钾(K2O 60%)。田间管理按常规方法进行。
1.3 样品采集
选择水稻-休闲和水稻-紫云英轮作改良 4年以上的田块(编号分别为“1”、“2”),分别采集土壤样品。用土钻采集剖面土壤样品,采样深度分别为0~10 cm(编号“a”)、10~20 cm(编号“b”)、20 ~40 cm(编号“c”)和 40~80 cm(编号“d”)。每个采样点按连续“S”形采样法均匀布10~15个点,用土钻采集不同剖面深度土样,将10~15个点土样混合成1个混合样品,每个样地各取3个平行,共得24个混合土壤样品。将样品装入已标记的自封袋中带回实验室,去除石块、昆虫残体、植物残根等杂质后待用。
1.4 检测指标与方法
参照土壤农业化学分析方法,有机质采用重铬酸钾容量法测定;土壤样品经H2SO4-H2O2消煮后,全氮用蒸馏定氮法测定,全磷用钒钼黄比色法测定,全钾用火焰光度计测定,速效氮用蒸馏定氮法测定,有效磷用钼蓝比色法测定,速效钾用火焰光度计法测定,土壤全盐用质量法测定,EC用电导率法测定,pH用电位法测定[11]。另取部分新鲜土样放入已灭菌的 2 ml 离心管中,并置于-80 ℃ 冰箱保存,用PCR-DGGE法分析土壤固氮菌群落结构分析[12-13],具体步骤如下:
1)采用Mobio Powersoil Isolation Kit试剂盒抽提土壤基因组DNA,固氮菌nifH 基因的 PCR 扩增采用 Nested-PCR 程序。
2)第一次 PCR:所用引物为固氮菌 nifH 基因的引物 FGPH 19 和 Po1R,反应体系为:BioLinker2× Taq Mix 20 μl,每种引物 1 μl,10 倍稀释的土壤总 DNA提取液 1 μl,加 ddH2O 至反应终体积 40 μl。扩增程序为:94 ℃ 预变性 2 min;25 个循环:94 ℃变性30 s,56.4℃ 退火 30 s,72 ℃ 延伸 30 s;最后 72 ℃延伸 5 min。
3)第二次 PCR:反应体系与第一次相同,模板为第一次 PCR 产物,扩增程序为:94 ℃ 预变性 2 min;20 个循环:94 ℃ 变性 30 s,56.4℃ 退火 30 s,72 ℃ 延伸 30 s;最后一步 72 ℃延伸 5 min,获得约 320 bp(包括 40 bp 的 GC 夹)的基因片段。
4)Reconditioning PCR:继续进行 Reconditioning PCR以消除扩增产物中异二聚体。反应体系为:BioLinker2×Taq Mix 20 μl,每种引物 2 μl,巢氏扩增产物 4 μl,加 ddH2O 至反应终体积 40 μl。扩增程序为:94 ℃ 预变性 2 min;5 个循环:94℃ 变性 30 s,56.4℃ 退火 30 s,72 ℃ 延伸 30 s;最后72 ℃延伸 5 min。
5)DGGE 分析:采用 BIO-RAD DcodeTM突变检测系统(Bio-Rad Laboratories,美国)进行固氮菌 nifH 基因的 DGGE分析。聚丙烯酰胺凝胶浓度为 8%,变性剂梯度为 53%~75%(100% 的变性剂含有 7 mol/L尿素和40%(v /v)的去离子甲酰胺,电泳缓冲液为 1×TAE buffer。60 ℃、70 V 电压下电泳 15 h。电泳结束后,用Biolinker DNA Red染色液进行染色40 min,然后用 Bio-Rad 凝胶成像分析系统观察样品的电泳条带并拍照。
1.5 数据处理
采用 Canoco for Windows 4.5 软件对物种数据和相关环境因子数据进行典范对应分析(CCA)。物种数据采用固氮菌群落结构多样性指数(香农指数Shannon-Weaver、均匀度指数Pielou Evenness和丰富度指数 Richness),用 lg(x+1) 进行处理使之更趋于正态分布[14]。
2 结果与分析
2.1 土壤理化性质差异
表 1显示了土壤环境因子在不同轮作方式下的空间变化特征。在水稻-休闲方式下,0~10 cm和10 ~20 cm土壤剖面中总氮 (TN)、NH+4-N、有机质 (SOM)含量较高,随着剖面深度加深,TN、NH4+-N、SOM含量下降趋势明显。在水稻-紫云英方式下,剖面深度对 TN、NH4+-N、SOM含量的影响比水稻-休闲方式下的影响小。总体来看,水稻-紫云英轮作可以降低土壤电导率 (EC),并且使滩涂土壤中0~10 cm和10~20 cm土壤剖面的pH下降。

表1 不同轮作方式下滩涂土壤理化性质Table 1 Soil physical and chemical properties under different rotation patterns
为进一步明确土壤环境因子之间的关系,对各环境因子进行典范对应分析(表2),结果可见,土壤环境因子之间存在着相关性。TN和NH4+-N典型相关系数最高,与pH和有效磷(Olsen-P)的相关性次之;EC与、NO-3-N、Olsen-P之间的典型相关系数较高;pH与速效钾(NH4OAc-K)的典型相关性高于其他土壤环境因子。
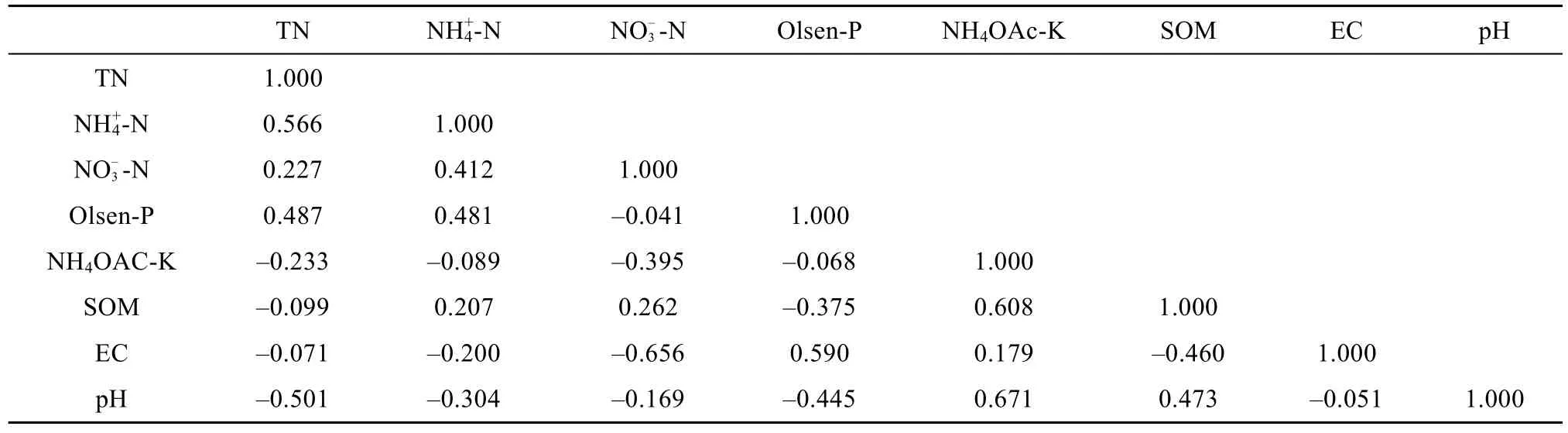
表2 环境因子之间的典型相关分析Table 2 Correlation coefficients between different environmental factors
2.2 土壤固氮菌PCR-DGGE分析
2.2.1 nifH基因的DGGE分析图谱 采用Quantity one 4.6.2 对DGGE图谱进行条带识别及相似性分析,每条泳道不同位置的条带为土壤样品中被分离的 PCR产物片段,属于不同的固氮菌类群。从图 1可以看出,DGGE电泳图中各泳道条带数目、强度、迁移率均存在一定差异,两种轮作方式下40~80 cm土壤剖面中条带数目均较少。水稻-紫云英轮作的土壤固氮菌群落丰富度高于水稻-休闲。水稻-紫云英轮作方式下,10~20 cm土壤剖面中条带数目最多。
2.2.2 nifH基因的多样性指数 群落多样性通常与物种的丰富度和均匀度密切相关。本研究采用丰富度指数Richness、香农指数Shannon-Weaver、均匀度指数Pielou Evenness对固氮菌群落多样性进行分析。香农指数可反映群落结构的复杂程度,均匀度指数用于反映群落均匀度。从表3可以看出,水稻-紫云英轮作方式下,不同剖面深度土壤的固氮菌多样性指数总体上高于水稻-休闲;10~20 cm土层水稻-紫云英轮作方式中土壤固氮微生物群落多样性表现为最高,固氮菌群落组成复杂,群落多样性高于水稻-休闲。此外,对比两种轮作方式发现,水稻-休闲40~80 cm土层土壤固氮微生物群落的多样性显著低于水稻-紫云英。
2.3 固氮菌群落结构与土壤养分因子的关系
为进一步研究土壤固氮菌群落结构与土壤理化性质的关系,将DGGE指纹图谱中每一条带的光密度值作为物种数据,使用 CANOCO软件将固氮菌群落与土壤理化性质做典范对应分析(表4)。结果显示,固氮菌群落多样性 CCA排序轴与环境因子相关。在前 3个排序轴中,固氮菌群落多样性与环境的相关性分别为 0.983、0.946和 0.971,固氮菌群落多样性与环境关系的变化累计比例分别为24.3%、41.6% 和 56.4%。前 3 个排序轴的固氮菌群落多样性与环境关系方差累计贡献率达到72.7%,排序结果可行有效,能较好地解释固氮菌群落与环境之间的相关关系。

图1 不同轮作模式下滩涂土壤nifH基因的DGGE分析图谱Fig. 1 DGGE profiles of soil nifH genes under different rotation patterns
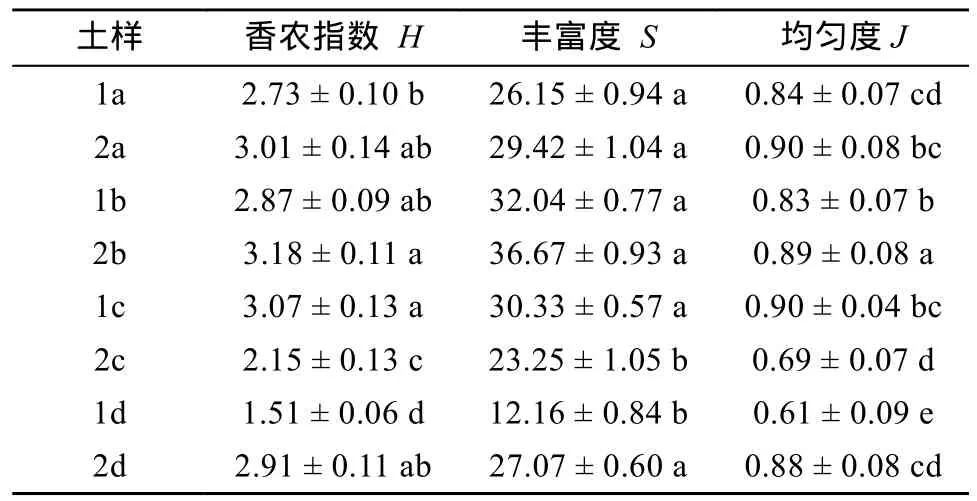
表3 不同轮作方式下土壤nifH基因的多样性指数Table 3 Diversity indexes of soil microbial nifH genes under different rotation patterns
采用典范对应分析,将样本与环境因子在同一个二维图上反映出来,可以直观地看出群落分布、物种分布与环境变量之间的关系。环境因子用箭头表示,箭头所处的象限表示环境因子与排序轴间的正负相关性,箭头连接长度代表该环境因子与样本分布相关程度的大小,而箭头连线间的夹角代表环境因子间的相关性大小[15-16]。从图2可见,第 1 象限与 NO-3-N、pH呈正相关,与 TN、 NH4+-N、NH4OAC-K、SOM呈负相关;第 2 象限与 EC、Olsen-P表现为正相关;第 3 象限与 TN、 NH4+-N、NH4OAC-K、SOM表现出正相关,与 NO-3-N、pH为负相关;第 4 象限与EC、Olsen-P为负相关。其中,SOM与NO-3-N、EC与Olsen-P之间两两距离较近,说明在不同固氮菌群落分布的影响下,这两组土壤环境因子两两之间的变异情况较为相似。从箭头的连线长度可以看出影响土壤固氮菌群落的重要环境因子依次为SOM、NH4+-N、Olsen-P>TN>pH>NH4OAC-K>EC> NO-3-N。
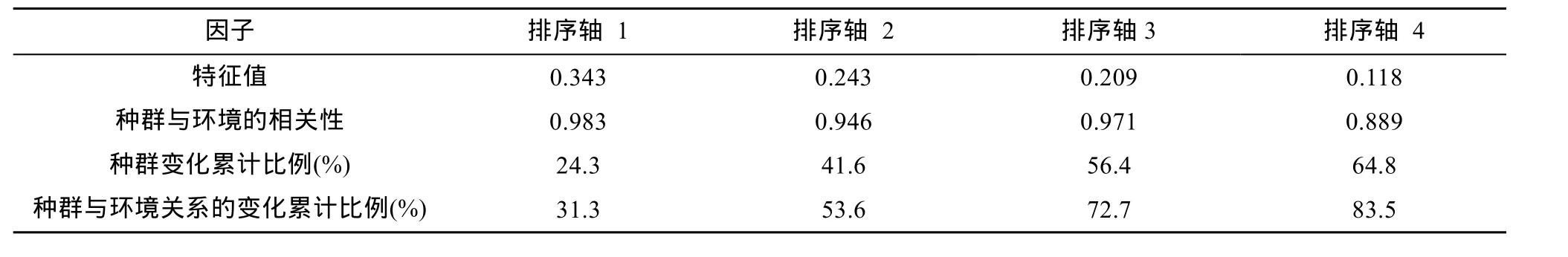
表 4 CCA排序图特征值及群落多样性与环境的典型相关分析Table 4 Eigenvalues of CCA ordination diagram and correlations between special axes and environmental axes
3 讨论
固氮菌是一类植物根际促生细菌,不仅具有固氮、溶磷、解钾等作用,还能分泌植物生长激素、抗生素类物质,促进植物生长,在维持农田生态系统健康稳定、物质转换和能量流动等方面发挥着重要作用[17-18]。作为生态系统中一类重要的功能菌群,固氮菌的分布特征和数量通常与土壤氮、碳循环密切相关,直接影响土壤肥力。Poly等[19-20]借助 RFLPPCR技术研究了植被覆盖、土壤的管理制度以及土壤理化性质对nifH基因群落结构的影响,通过主成分分析发现管理制度是影响土壤nifH基因多样性的主因,理化性质和植被覆盖的影响次之。Bannert等[22]运用定量 PCR和T-RFLP技术研究了中国浙江慈溪地区潮滩湿地与水稻田土壤固氮菌数量和结构的多样性差异,结果表明,土壤pH的改变使得50 a稻龄水稻田的固氮菌数量比潮滩湿地大大增加。
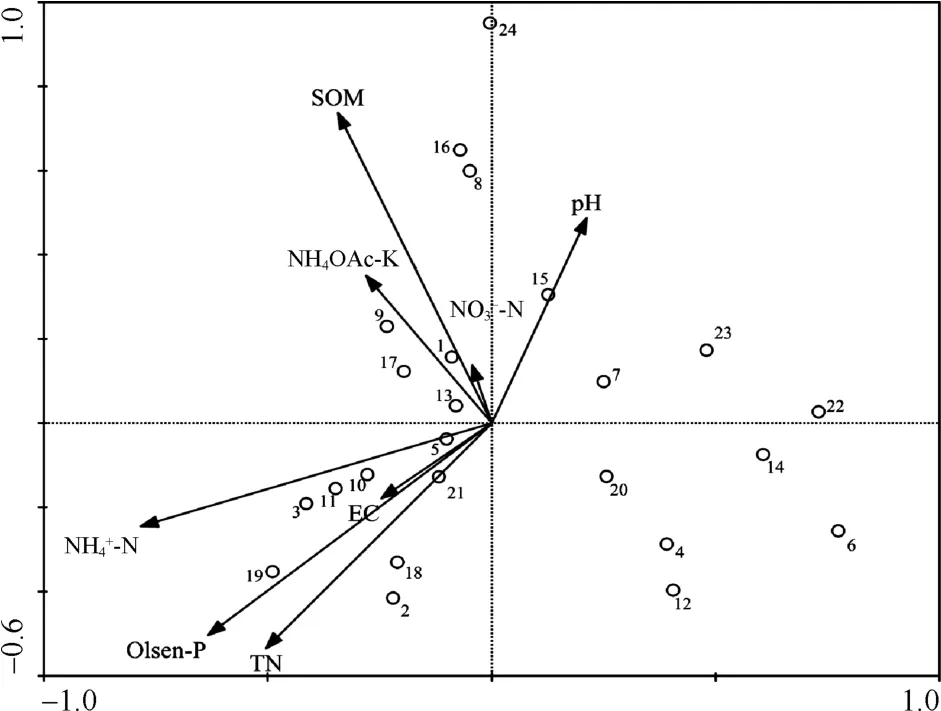
图2 固氮菌多样性与土壤环境因子的CCA二维排序图Fig. 2 Two dimensional ordination diagram of CCA of nitrogen microbial diversity and environmental variables
尽管固氮菌在不同生境中的群落结构及其多样性成为近年来国际上的研究热点,但在滩涂绿肥-水稻轮作这一特殊生境中固氮菌的相关研究还未见报道,对滩涂土壤绿肥-水稻轮作改良过程中固氮菌的分布和变化特征了解甚少,对其适应和响应机制的研究尚有待深入。本研究以滩涂土壤为研究对象,分析了滩涂紫云英-水稻轮作这一特殊生境中土壤剖面理化性质、固氮菌群落结构的变化及它们之间的关系,初步探讨了固氮菌群落在紫云英-水稻轮作过程中对滩涂土壤改良所起到的作用。研究结果表明,经过4年的连续紫云英-水稻轮作改良,土壤的理化性质得到了一定的提高,土壤的有机质含量增加、电导率和pH降低。受土壤理化性质改善的影响,土壤固氮菌群落也有了积极的响应,生物量及多样性增加,能够促进土壤氮素循环、活化土壤养分、提高土壤肥力和营养元素有效性,确保作物健康生长。因此,在固氮菌的根际促生调节功能下,通过紫云英-水稻轮作,土壤环境得到明显的改良,而土质的改良又能稳定固氮菌的群落结构,提高土壤-作物-微生物之间的协同互作作用。
已有对不同生态系统土壤中固氮菌群落结构组成的研究显示,环境因子和种植制度对固氮菌群落结构存在影响。相关研究表明通过种植绿肥来改良滩涂,可以疏松土壤,减轻板结,增强土壤透水透气性,减少表面土壤的积盐,功能微生物的根际活动可以激活土壤中 CaCO3并加速其溶解,从而改善土壤理化性质并加速土壤脱盐[23-24]。紫云英-水稻轮作由于改良措施成本低、对环境扰动小、改良效果显著的特征而被广泛应用于滩涂盐碱地生态修复工程中。在本研究中,不同轮作方式对滩涂土壤环境有着不同的改良效果,对比水稻-休闲方式,水稻-紫云英轮作对10 ~20 cm土壤剖面中电导率、pH、固氮菌群落的改善作用最为显著。两种轮作方式下,土壤固氮菌群落结构受环境因子变化的影响有较大差异,不同土壤剖面深度的固氮菌群落结构也因受环境因子影响不同而存在差异。对土壤固氮菌群落影响较大的主要环境因子为有机质、NH4+-N和有效磷。
4 结论
1)滩涂改良过程中土壤理化性质变化规律存在着一定差异。其中,总氮和NH4+-N的相关性最高,与pH、有效磷的相关性次之;EC与NO-3-N、有效磷之间的相关性较高;pH与速效钾的典型相关性高于其他土壤环境因子。
2)水稻-紫云英轮作的土壤固氮菌丰富度指数高于水稻-休闲,采用水稻-紫云英轮作方式更能提高滩涂土壤0~10 cm和10~20 cm剖面中固氮菌的Shannon-Weaver 多样性指数及其均匀度。
3)典范对应分析表明,水稻-紫云英轮作方式与水稻-休闲方式下,滩涂土壤固氮菌群落结构受环境因子变化的影响有较大差异,对土壤固氮菌群落影响较大的主要环境因子为有机质、NH4+-N和有效磷。
[1] 王雨濛, 吴娟, 张安录. 我国耕地资源问题与实现有效保护的耕地补偿机制探讨[J]. 农业现代化研究, 2010,31(1): 29-33
[2] 周健民. 我国耕地资源保护与地力提升[J]. 中国科学院院刊, 2013, 28(2): 263, 269-273
[3] 姚荣江, 杨劲松, 陈小兵, 等. 苏北海涂围垦区耕层土壤养分分级及其模糊综合评价[J]. 中国土壤与肥料,2009(4): 16-20
[4] 万建华, 徐悦, 张莉莉, 等. 滨海盐碱土资源化利用的新探索与研究[J]. 国土与自然资源研究, 2011(5):53-55
[5] Cao W, Wong M. Current status of coastal zone issues and management in China: A review[J]. Environment International, 2007, 33(7): 985-992
[6] Wang F, Wall G. Mudflat development in Jiangsu Province,China: Practices and experiences[J]. Ocean and Coastal Management, 2010, 53(11): 691-699
[7] 金海洋. 不同农艺措施对浦东滨海滩涂垦区土壤熟化的影响[J]. 上海农业学报, 2012, 28(4): 93-96
[8] 肖克飚, 吴普特, 雷金银, 等. 不同类型耐盐植物对盐碱土生物改良研究[J]. 农业环境科学学报, 2013, 31(12):2433-2440
[9] 曹艳花. 长期豆科绿肥轮作水稻根内生细菌多样性及促生功能研究[D]. 哈尔滨: 东北农业大学, 2012: 66-69
[10] Gao S J, Zhang R G, Cao W D, et al. Long-term rice-ricegreen manure rotation changing the microbial communities in typical red paddy soil in South China[J]. Journal of Integrative Agriculture, 2015, 14(12): 2512-2520
[11] 鲍士旦. 土壤农化分析[M]. 北京: 中国农业出版社,2000: 22-24
[12] 刘骁蒨, 涂仕华, 孙锡发, 等. 秸秆还田与施肥对稻田土壤微生物生物量及固氮菌群落结构的影响[J]. 生态学报, 2013, 33(17): 5210-5218
[13] 宋延静, 张晓黎, 龚骏. 添加生物质炭对滨海盐碱土固氮菌丰度及群落结构的影响[J]. 生态学杂志, 2014, 33(8):2168-2175
[14] 陈熙, 刘以珍, 李金前, 等. 稀土尾矿土壤细菌群落结构对植被修复的响应[J]. 生态学报, 2016, 36(13): 3943-3950
[15] 杨思存, 逄焕成, 王成宝, 等. 基于典范对应分析的甘肃引黄灌区土壤盐渍化特征研究[J]. 中国农业科学,2014, 47(1): 100-110
[16] 赵秀芳, 杨劲松, 姚荣江. 基于典范对应分析的苏北滩涂土壤春季盐渍化特征研究[J]. 土壤学报, 2010, 47(3):422-428
[17] Franche C, Linderstrom K, Elmerich C. Nitrogen-fixing bacteria associated with legumes and non-leguminous plants. Plant Soil, 2009, 321: 35-59
[18] Wardle D A, Bardgett R D, Klironomos J N, et al.Ecological linkages between above ground and below ground biota[J]. Science, 2004, 304(5677): 1629-1633
[19] Poly F, Monrozier L J, Bally R. Improvement in the RFLP procedure for studying the diversity ofnifHgenes in communities of nitrogen fixers in soil[J]. Research in microbiology, 2001, 152: 95-103
[20] Poly F, Ranjard L, Nazarel S, et al. Comparison of nifH gene pools in soils and soil microenvironments with contrasting properties[J]. Applied and Environmental Microbiology, 2001, 67(5): 2255-2262
[21] 李刚, 王丽娟, 李玉洁, 等. 呼伦贝尔沙地不同植被恢复模式对土壤固氮微生物多样性的影响[J]. 应用生态学报, 2013, 24(6): 1639-1646
[22] Bannert A, Kleineidam K, Wissing L, et al. Changes in diversity and functional gene abundances of microbial communities involved in nitrogen fixation, nitrification,and denitrification in a tidal wetland versus paddy soils cultivated for different time periods[J]. Applied and Environmental Microbiology, 2011, 77(17): 6109-6116
[23] Mårtensson L, Díez B, Wartiainen I, et al. Diazotrophic diversity, nifH gene expression and nitrogenase activity in a nice paddy field in Fujian, China[J]. Plant and Soil, 2009,325(2): 207-218
[24] Zhang X L, Li X, Zhang C, et al. Responses of soil nitrogen-fixing,ammonia-oxidizing,and denitrifying bacterial communities to long-term chlorimuron-ethyl stress in a continuously cropped soybean field in Northeast China[J]. Annals of Microbiology, 2013, 63(4):1619-1627

