2,3-BD多次诱导对匍匐翦股颖抗褐斑病的效果
刘兴菊,马 源,马晖玲,余倩倩
(1.甘肃农业大学 草业学院/草业生态系统教育部重点实验室/甘肃省草业工程实验室/中-美草地畜牧业可持续发展研究中心,甘肃 兰州 730070; 2.华南农业大学园艺学院,广东 广州 510642)
马晖玲为通讯作者。
植物病害是威胁草坪生产和管理的主要因素,长期以来,人们主要通过反复利用化学农药等手段来防治和减轻草坪病害[1]。化学农药的长期利用带来了一系列副作用,如病原菌产生一定的抗药性,环境受到污染,地下径流中有毒有害的残留物质增加等,使得生态系统的可持续发展受到严重威胁。因此,探寻新型、高效、安全、无害的病害防控手段成为病害防治中的新方向[2]。近代病理学研究发现,植物体中都存在着潜在的抗病基因,经过适当的外界因子的诱导,能够激发植物体内抗性基因的表达,从而使植物获得对病原物的抗性[3]。这种抗性具有广谱性、系统性等特点,而且对环境友好,无毒副作用,有利生态系统的可持续发展。故而,探究和开发诱导植物抗病的激发子成为目前植物防治领域的研究热点。而丁二醇(2,3-butanediol,2,3-BD)这一新型诱导剂是由假单胞菌等植物根际促生菌分泌的可挥发性有机物,常温下为无色无味的透明液体,微生物常形成异构体混合物[4],具有安全、无毒、对环境友好等特性,在植物抗病方面获得广泛的关注。
匍匐翦股颖(Agrostissoionifera)为禾本科翦股颖属多年生草本植物,由于其叶片质地纤细柔软,耐修剪,广泛建植于高尔夫球场、保龄球场、运动草地等地。但是,匍匐翦股颖的抗病性很差,易感病,严重影响草坪功能的发挥以及观赏价值,给草坪生产和经营带来极大损失。因此,以ISR诱导抗病机制为基础,采用新型诱导剂丁二醇诱导植株体内的抗病能力从而抑制褐斑病的大量爆发。
试验采用新型诱导剂2,3-BD对匍匐翦股颖植株进行多次诱导处理,通过病情指数和诱导效果以及抗病相关酶等观察比较2,3-BD多次诱导后,匍匐翦股颖对褐斑病的诱抗效果,以寻找2,3-BD诱导匍匐翦股颖抗褐斑病的施用次数,有效提高抗病害效果,为丁二醇诱导植物抗病害提供理论基础。
1 材料和方法
1.1 试验材料
供试匍匐翦股颖品种为Penn-A4(Agrostisstoloniferacv. Penn-A4),由北京克劳沃公司提供。诱导剂2,3-BD购自西亚试剂。病原物为立枯丝核菌(Rhizoctoniasolani),购自中国科学院菌种保存中心。
1.2 试验设计
1.2.1 材料培育 营养土、沙、蛭石混合(2∶1∶1),灭菌处理后于倒入600 mL塑料花盆,浇水,放置一夜后种植匍匐翦股颖种子。种植前种子处理,无菌水浸泡一夜,用70%乙醇溶液浸泡1 min,后用20%次氯酸钠浸泡30 min,无菌水冲洗5~6次,种植于600 mL的花盆中,每盆0.3 g。培养在25℃的恒温组培室中,出苗后进行间苗处理。
1.2.2 供试菌种制备 接种病原菌立枯丝核菌在PDA固体培养基中,25℃培养4 d,用灭菌的打孔器取6 mm直径菌丝块,于PD液体培养基,在25℃、100 r/min的摇床培养4~5 d,将培养好的立枯丝核菌用无菌水冲洗2~3次,研磨后无菌水配置成浓度为OD340=0.8的菌丝悬浮液,采用喷雾法接种。
1.2.3 种植后诱导和接种 根据前期研究采用不同浓度梯度2,3-BD诱导处理匍匐翦股颖,通过病情指数的调查和抗病相关酶等的测定,结果显示250 μmol/L的2,3-BD是诱导匍匐翦股颖抗褐斑病的最佳浓度,此次试验选用250μmol/L浓度的2,3-BD为诱导剂。在幼苗生长第16 d开始进行诱导处理。试验组分设4个处理(用D1、D2、D3、D4 ),每个处理3次重复,不做诱导处理为对照组,设计方案如下:
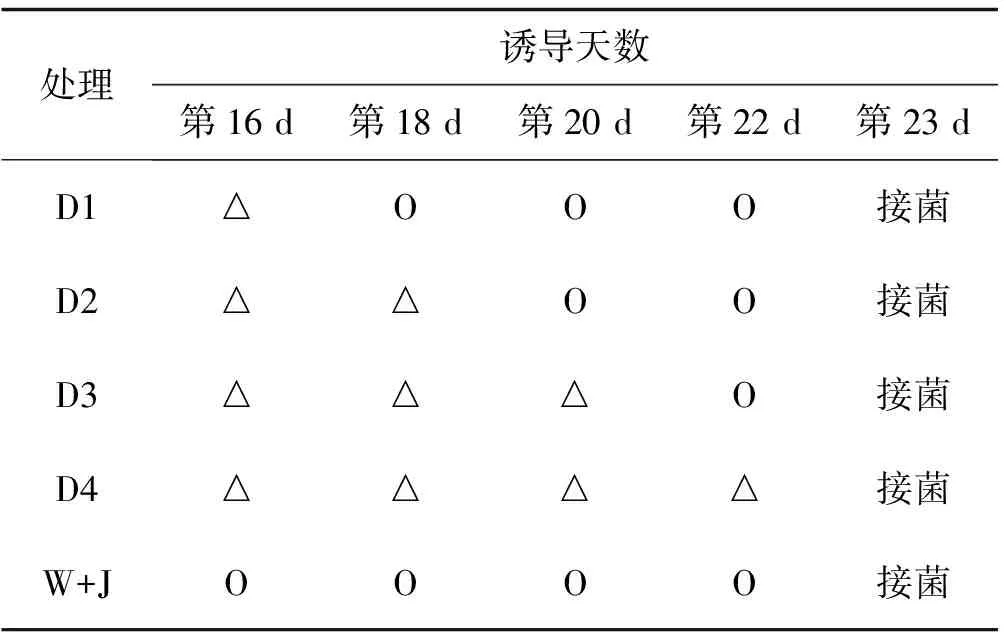
表1 试验处理设计方案
注: △为2,3-BD诱导剂处理;O为等量水处理
1.3 试验方法
1.3.1 匍匐翦股颖褐斑病发病程度基本标准 接种后第7、10、15、20、25、30、35、40 d,参照文献[5]牧草病害的调查与评定,进行病情观察,统计病叶率并计算病情指数。匍匐翦股颖褐斑病严重度的分级标准如下:0级:无症状;1级:叶片上有零星菌丝;2级:10%~40%的叶片上有菌丝;3级:40%~60%的叶片上有菌丝体生长并有坏死迹象;4级:60%~80%的叶片上有丰富的菌丝体和坏死现象;5级:全部植株普遍感病。
病情指数(%)=
1.3.2 生理指标的测定 样品喷菌处理后于第1、3、5、7、9 d进行酶活性的测定,于第1、5、10、15、20 d进行游离脯氨酸、丙二醛和叶绿素含量的测定。
(1)聚焦应用能力培养。由于“茶产品分析与检验”的实务性和技术性,教学目的主要使学生能够应用检验分析的方法。所以,教学过程中要以应用能力培养为导向,以此为目的组织教学内容、选择适合的教学方法。
超氧化物歧化酶(SOD)活性参照文献[6]的方法并做修改,以1 min内每克鲜重△OD560减少50%为1个酶活单位;
过氧化物酶(POD)活性的测定参照文献[7]的方法,以每分钟酶促反应体系吸光度变化0.01为一个POD活力单位(U);
过氧化氢酶(CAT)活力测定参照文献[8]的方法并修改,以每分钟反应体系吸光度值变化0.01定义为1个酶活性单位(U);
苯丙氨酸解氨酶(PAL)活性参照文献[9]的方法并修改,以每分钟内吸光度变化0.01为1个活性单位(U),酶活性单位为U/(min·g·FW);
丙二醛(MDA)的含量均参照文献[10]的方法;
叶绿素含量的测定参照文献[11]的测定方法略有改进。
1.4 数据分析方法
运用SPSS 19.0软件对所有数据进行统计分析,计算标准误、并对数据进行方差分析,利用Duncan法多重比较对差异性进行分析,运用Excel 2013进行图表制作。
2 结果与分析
2.1 丁二醇多次诱导对匍匐翦股颖植株病情指数的影响
2,3-BD有效降低匍匐翦股颖褐斑病的病情指数。接种后第7,10和15 d均差异显著(P<0.05)。并且植株CK的病情指数显著高于2,3-BD处理,2,3-BD处理的病情指数与CK相比有明显的抗病效果,具有显著性差异。试验发现在第15 d,W+J处理的病情指数最高,植株基本感病且大面积死亡。而2,3-BD处理下植株的病情指数明显得到了抑制,效果显著(P<0.05)。通过比较发现,诱导2次的抗病效果最佳病情指数最低,为24.6%,分别比诱导1、3、4次提高了14.2%,7.3%和8.4%。说明通过对匍匐翦股颖进行多次诱导,对植株抗病能力有一定的提高(图1)。
2.2 丁二醇多次诱导对匍匐翦股颖植株抗病效果的影响
试验比较发现,匍匐翦股颖经过多次诱导后能够显著提高植株的抗病效果,与诱导1次相比较,诱2,3和4次的处理抗病效果都有一定幅度的提升,分别是65.05%,60.31%和59.66%。说明诱导剂2,3-BD通过多次诱导处理能够在一定程度上提升翦股颖植株的抗病能力(表2)。
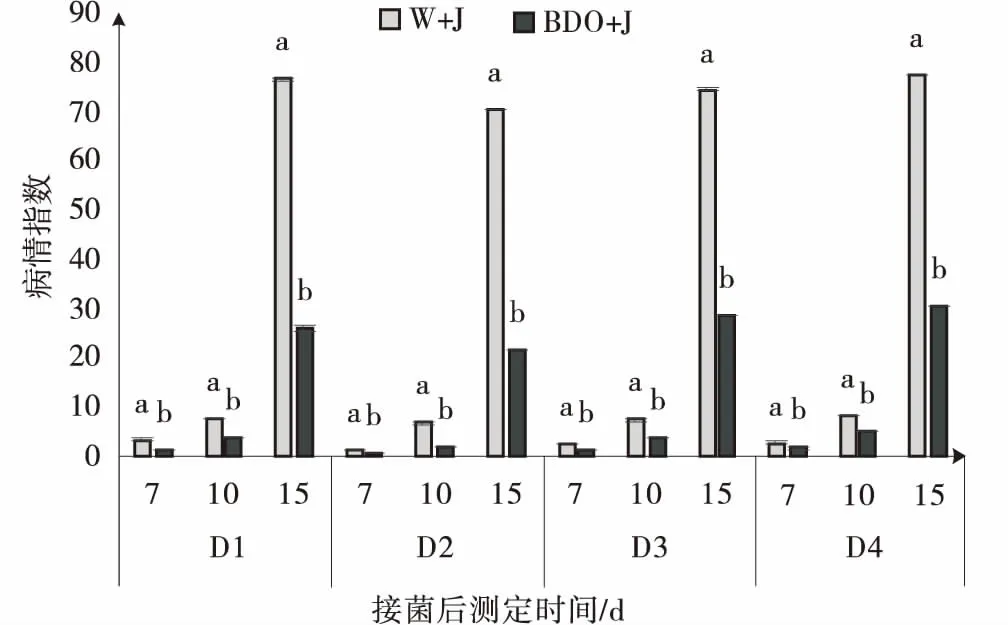
图1 丁二醇多次诱导处理下匍匐翦股颖的病情指数的影响Fig.1 Effects of 2,3-BD repeatedly induced on disease index of creeping bentgrass
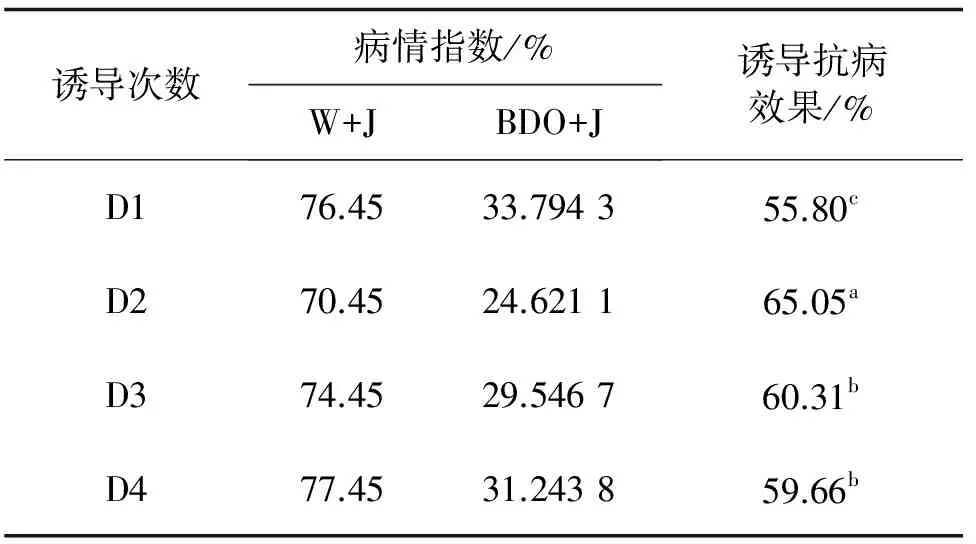
诱导次数病情指数/%W+JBDO+J诱导抗病效果/%D176.4533.794355.80cD270.4524.621165.05aD374.4529.546760.31bD477.4531.243859.66b
2.3 丁二醇多次诱导对植株抗病相关酶活性的影响
2.3.1 丁二醇多次诱导对植株SOD酶活性的影响 2,3-BD诱导处理对植株SOD活性影响显著。2,3-BD诱导处理的SOD活性在抗病初期显著高于CK,且差异显著(P<0.05),接菌后第1 d植株的SOD活性迅速上升达到峰值,随后呈逐渐降低的趋势,但始终高于CK。CK植株SOD的活性在接种后第3 d达到峰值,之后逐渐下降,可见,2,3-BD处理能有效提高植株SOD的活性(图2)。
通过多次诱导发现,D2和D3处理的SOD活性在前9 d都比CK活性高,下降趋势也较D1和D4缓慢,D2处理SOD活性在第7 d时又出现上升现象,且始终比其他处理活性高,说明两次诱导较好一些。
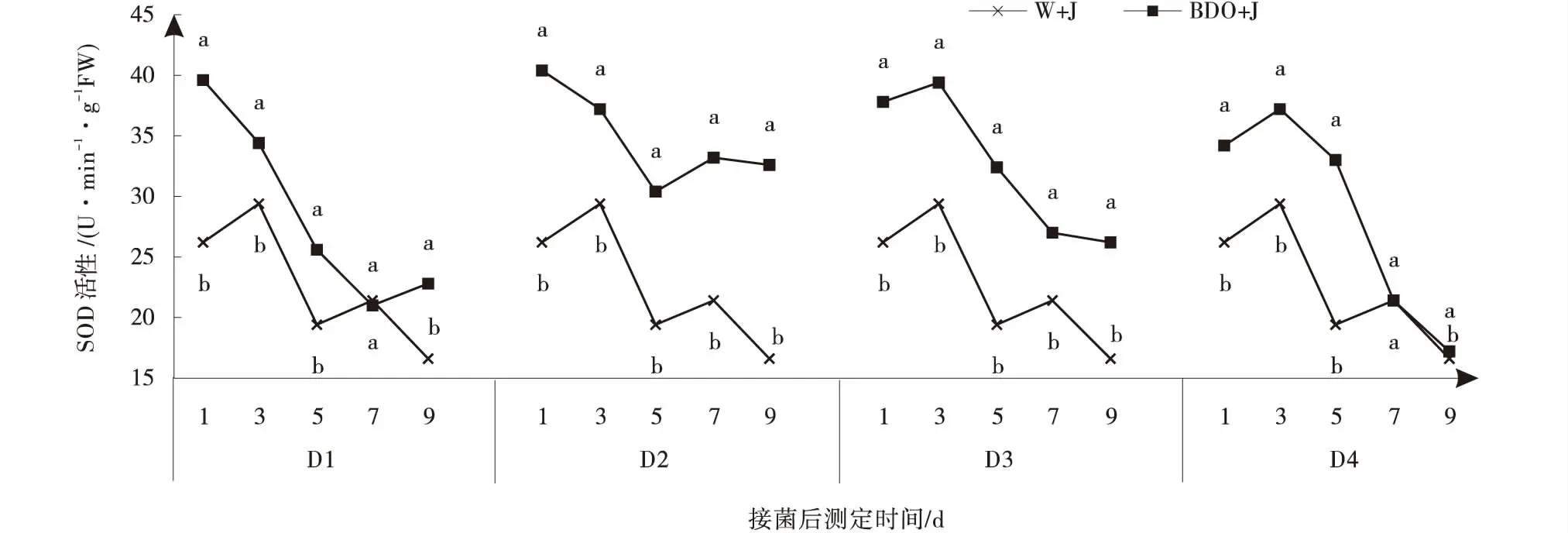
图2 丁二醇多次诱导处理下匍匐翦股颖SOD的活性Fig.2 Effects of 2,3-BD repeatedly induced on superoxide dismutase of creeping bentgrass
2.3.2 丁二醇多次诱导对植株POD酶活性的影响 与CK相比,2,3-BD诱导处理的植株能够明显提高植物体POD活性,且差异显著(P<0.05)。接菌后植株体内POD的活性大体呈先升高后降低再升高的趋势,2,3-BD诱导处理整体较高。4个处理POD的活性都在第7 d有峰值,其中D1和D3有两个峰值,且第7 d高于第3 d。D2处理的POD活性在第7 d最为活跃,分别比D1,D3 和D4处理提高了17.16%,6.67%和23.11%,是CK的1.36倍(图3)。
2.3.3 丁二醇多次诱导对植株CAT酶活性的影响 接菌后植物体内CAT活性随时间变化整体呈现下降再逐渐上升趋势。接种病原菌后CK处理在第3 d急剧下降,之后持续缓慢上升。4个处理中,2,3-BD诱导处理在第1 d植物体内CAT的活性均比CK低,且有显著差异(P<0.05),之后其活性在第3~5 d呈缓慢下降现象,第7 d时又快速上升且达到峰值,与CK相比差异显著。分别为CK的2.07、2.23、1.73、1.51倍,其中D2处理的CAT活性最强(图4)。
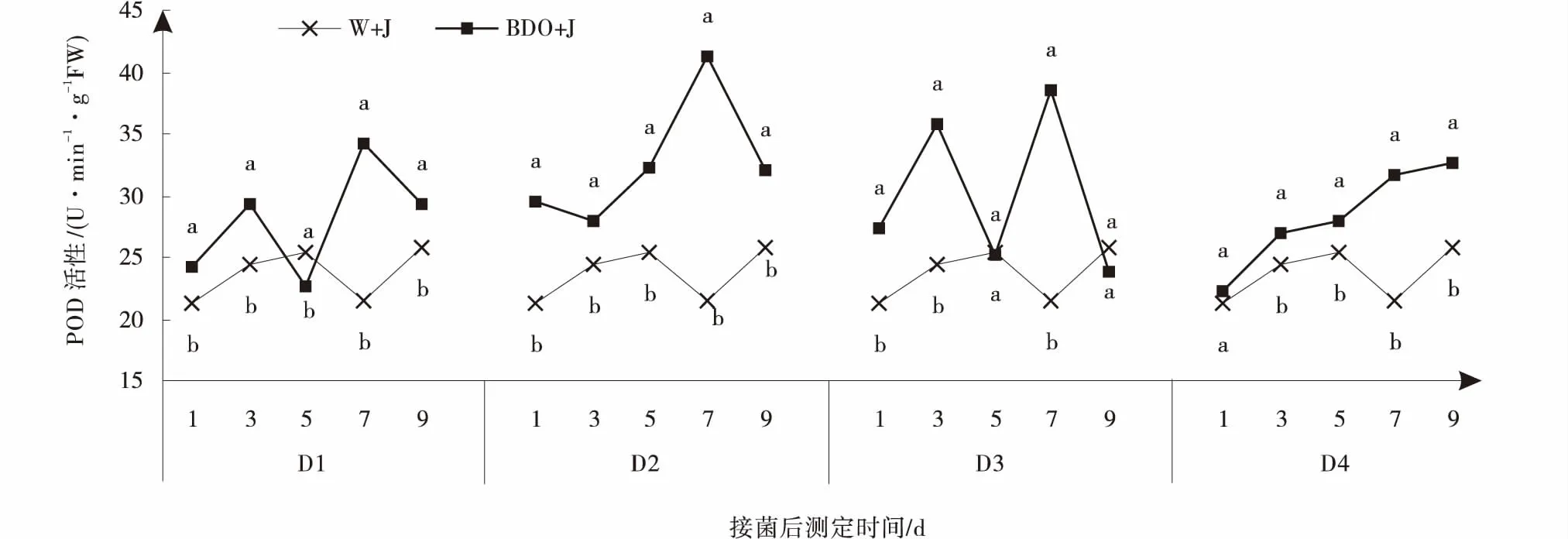
图3 丁二醇多次诱导处理下匍匐翦股颖POD的活性Fig.3 Effects of 2,3-BD repeatedly induced on peroxidase of creeping bentgrass
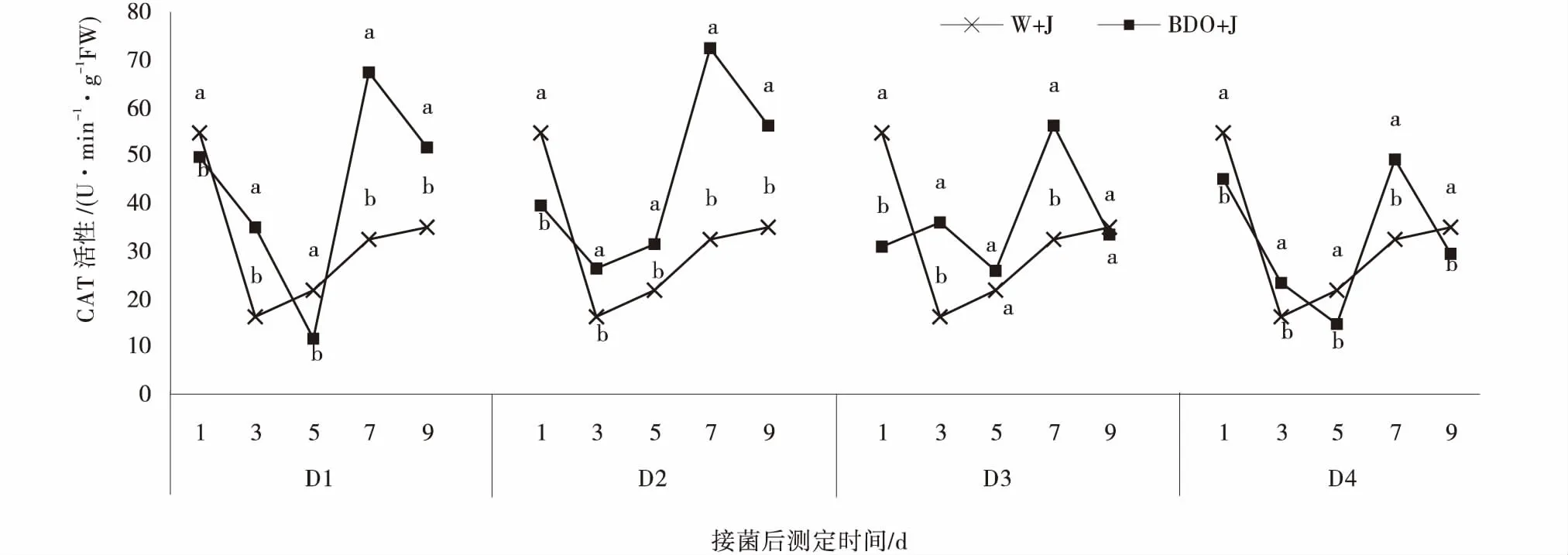
图4 丁二醇多次诱导处理下匍匐翦股颖CAT的活性Fig.4 Effects of 2,3-BD repeatedly induced on catalase of creeping bentgrass
2.3.4 丁二醇多次诱导对植株PAL活性的影响 2,3-BD处理提高了PAL的活性,但是变化幅度较大。D1处理组,PAL的活性在第1 d达到最高值,是CK的1.19倍,之后降低,在第7 d又达到一个峰值,但与CK相比差异不显著(P<0.05);D2处理组中,PAL活性在第3、7 d出现2个峰值,与CK差异性显著,其中,第3 d达到最高值,是CK的1.47倍,第7 d是CK的1.21倍。D3处理组中,2,3-BD诱导后植株体内PAL活性也在第3、7 d有峰值,第3 d酶活性达到最高,是CK的1.32倍,但比2次诱导处理低一些;D4处理组中的酶活性呈逐渐降低后增高的趋势,第7 d出现最低值,且与CK相比酶活性降低显著,第1 d最高,是CK的1.14倍(图5)。
2.4 丁二醇多次诱导对植株体内叶绿素和MDA的影响
利用250 μmol/L的2,3-BD对匍匐翦股颖进行多次诱导并接种褐斑病病原菌发现,2,3-BD对叶绿素的含量和MDA的含量有一定影响。经过2,3-BD诱导的4个处理组植株体内叶绿素的含量明显高于CK,差异显著(P<0.05),但处理组间差异不显著,说明多次诱导对叶绿素影响较小。
试验对MDA的含量比较发现,2,3-BD对MDA含量的影响较大,4个处理组中MDA的积累量均显著低于CK,其中D2处理组的MDA积累量较其他处理组相比明显最低(表3)。
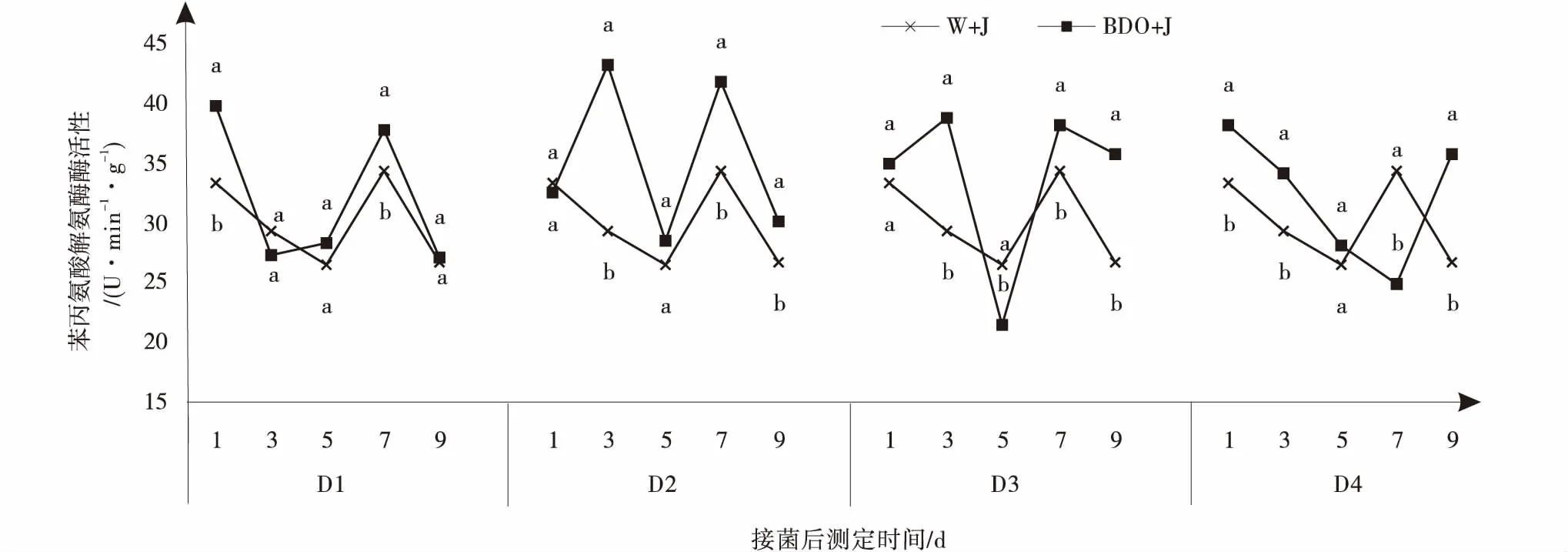
图5 丁二醇多次诱导处理下匍匐翦股颖PAL的活性Fig.5 Effects of 2,3-BD repeatedly induced on phenylalanine ammonia-lyas of creeping bentgrass
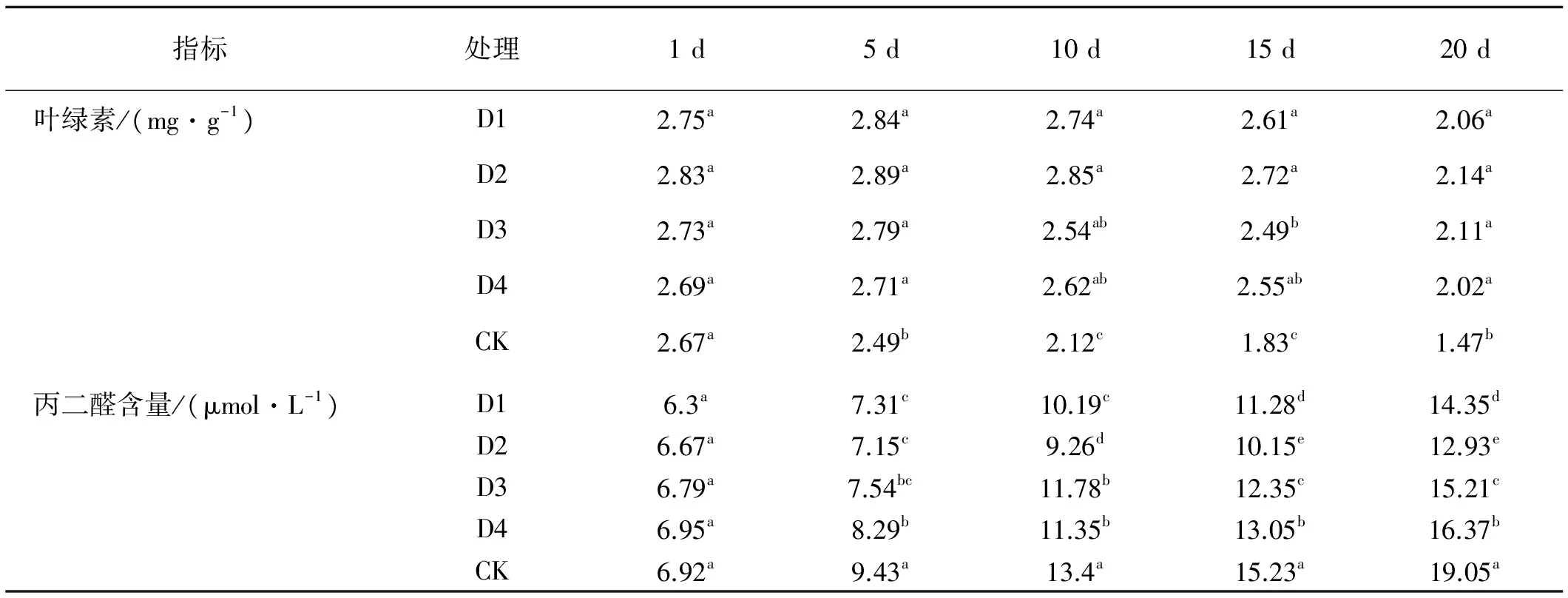
指标处理1d5d10d15d20d叶绿素/(mg·g-1)D12.75a2.84a2.74a2.61a2.06aD22.83a2.89a2.85a2.72a2.14aD32.73a2.79a2.54ab2.49b2.11aD42.69a2.71a2.62ab2.55ab2.02aCK2.67a2.49b2.12c1.83c1.47b丙二醛含量/(μmol·L-1)D16.3a7.31c10.19c11.28d14.35dD26.67a7.15c9.26d10.15e12.93eD36.79a7.54bc11.78b12.35c15.21cD46.95a8.29b11.35b13.05b16.37bCK6.92a9.43a13.4a15.23a19.05a
注:同列数据不同字母表示差异显著(P<0.05)
3 讨论
植物诱导抗病性(ISR)是通过利用外界生物或非生物等激发因子提高植株自身抗病潜能的一种方式,最终达到抵抗外界病原菌侵染,控制住植株病害的扩散或者发生,提高植物自身的抗病能力[12]。之前已经对以丁二醇作为诱导剂使匍匐翦股颖对褐斑病产生抗性做了较多研究[13-19]。引起植物诱导抗性激发子以及产生诱导抗性的植物种类都是多样,每一种诱导抗病植株都有其自身的特点。同时也包括一些共同的特征,即非特异性、不完全性、滞后性和耗能性等。高浓度的接种病原菌,尤其在低水平的诱导条件下,将会降低诱导抗病性的有效性。因此,试验目的是为了探究通过多次诱导,是否对植物的抗病能力得到增强。
3.1 丁二醇诱导对植株体内叶绿素和MDA的动态变化
试验发现,利用250 μmol/L的2,3-BD对匍匐翦股颖进行多次诱导后能显著提高植株的抗病能力。通过对接种病原菌后第1,7和15 d植株的病情指数观察发现,2,3-BD处理能有效降低植株的病情指数,经过两次诱导的翦股颖植株其在抗病过程中病情指数最低,诱导效果最佳,达到了65.05%,比其他处理组的效果明显。对植物叶绿素含量的测定以及MDA积累量的分析发现,2,3-BD处理能使叶绿素含量有所增加,当植物受到病原菌侵染后,植物体内叶绿素的含量随时间的变化呈逐渐降低的趋势,未诱导处理下降趋势明显。研究结果与徐秉良等[20]、金珠等[21]在马齿苋抗霜霉病中叶绿素含量的变化结果相似,说明,叶绿素含量的变化与植物抗病之间存在密切的关系。叶绿素是植物光合作用的基础,光合作用是衡量植物合成功能的重要生理指标。叶绿素含量高,叶片光合作用越强,积累的有机物质也就越多,为抵御病原菌入侵提供的能量就越多,抗性也随之增强。病原物侵染植物后,往往能与叶绿体发生相互作用,导致叶绿体解体,发病严重的甚至导致叶绿素合成受阻,出现叶片褪绿、黄化或花叶等症状。但通过对比多次诱导的4个处理发现,叶绿素的变化与诱导的次数没有太大的相关性,因此,多次诱导对植株的抗病能力与叶绿素的变化无相关性。
而MDA作为膜脂过氧化作用的最终产物与细胞膜的损害程度直接相关,膜脂过氧化的加剧引起质膜透性增大,致使大量电解质外渗,说明MDA含量和电导率与细胞膜的损害程度直接相关[22]。其含量与植物抗病关系密切,通过研究发现,接菌后植物体内MDA的含量随时间的增加呈逐渐上升的趋势,与CK相比,2,3-BD诱导处理明显降低了植物体内MDA的积累量。同时比较多次诱导的4个处理组发现,经过两次诱导的植株,其MDA的积累量明显比其他处理的低,说明2,3-BD多次诱导对植株的抗病能力有一定程度的提升。
3.2 丁二醇诱导对植株抗病相关酶活性的变化
植物抗病过程中伴随着一系列的生理生化变化和物质代谢,其中催化这些生理生化以及代谢反正的酶为关键因子,试验中2,3-BD诱导处理翦股颖后能在一定程度上增强SOD、POD、CAT、PAL这4种关键酶。SOD是植物体内防御活性氧毒性的保护酶,它能清除超氧化物阴离子自由基,提高植物抗逆性,SOD酶的活性在第1 d达到最高,之后逐渐下降但与CK相比差异显著且始终高于CK,通过进行多次诱导比较发现4次诱导处理SOD活性在第7 d时又出现上升现象,且始终比其他处理组活性高,试验结果表明2,3-BD处理能有效提高植株SOD的活性,且两次诱导的效果要更好一些。
POD是植物体内存在的清除活性氧自由基的一种重要酶,防止过氧化物含量增多,活性的高低能反映出植物体内自由基清除或抗氧化能力的强弱,可作为植物抗逆性的重要指标。因此POD酶活性的增加有利于提高植物的抗病能力。结果显示2,3-BD诱导处理的植株能够明显提高植物体POD活性,多次诱导的4个处理中POD的活性都在第7 d有峰值,但两次诱导处理的POD活性在第7 d表现最为活跃,为效抵御病原菌的入侵提供条件。
CAT也是植物体内重要的活性氧清除酶类,其作用是将H2O2降解成为无毒害的H2O和O2,维持体内的活性氧代谢平衡,保护膜结构,从而使植物能在一定程度上忍耐、减缓或抵抗逆境胁迫,因此,就成为植物在逆境中保护自身体系健康的酶系统中的一种。结果显示,2,3-BD诱导处理使CAT的活性增加,接种病原菌后,其下降幅度也较对照缓慢,说明2,3-BD能够使植株体内的活性氧代谢达到平衡,增加其抗病性。
PAL酶是植物产生诱导抗病性的关键酶类,多个研究表明在植物受到病原菌侵染时,在植物抗病初期体内的PAL酶活性会迅速升高,说明PAL酶活性的升高有利于提高植物对病原菌侵染的抗性。试验中在接种病原菌后,PAL酶的活性变化幅度较大,但在整体分析,2,3-BD提高了PAL酶的活性,多次诱导的4个处理,不同诱导次数对植株体内酶的活性影响也不尽相同,其中经过两次诱导处理的酶活性始终较对照高。多数的研究都表明,酶活性的提高能使植株表现出良好的抗病效果,说明2,3-BD能提高植株的抗病效果。
4 结论
使用外源诱导剂处理能提高寄主植物SOD、POD、CAT、PAL等酶的活性,与寄主抗性呈正相关性[23-27],而MDA含量的变化与植物的抗病性呈负相关[27],研究所测定的4种酶活性的变化和MDA含量的变化与匐翦股颖抗性的关系,与多数学者研究结果相似。试验结果显示2,3-BD能提高植株的抗病效果,且多次诱导抗病效果更显著,其中施用两次诱导剂的效果相对最好。
[1] 杨昆.珠江三角洲主要森林下植被和区域森林生物量的研究[D].广州:中山大学,2007.
[2] 邢家华,陈定花,朱卫刚,等.植物化学诱抗剂[J].浙江化工,2002(33):51-52.
[3] Durrant,Dong X.Systemicacquired resistance[J].Annuat Review of Phyto-pathology,2004,42:185-209.
[4] Mccorn M,Creelman R A,Bell E,etal.Jasmonate is essential for insect defenceArabidopsis[J].Proceedings of the National Academy of Seciences of USA,1997,94:5473-5477.
[5] 南志标.牧草病害的调查与评定[M]∥任继周,草业科学研究方法).北京:中国农业版社,1998:214-236.
[6] Beyer Jr W F,Fridovich I.Assaying for superoxide dismutase activity:some large consequences of minor changes in conditions[J].Analytical biochemistry,1987,161(2):559-566.
[7] JIANG Aili,TIAN Shiping,XU Yong.Effects of controlled atmospheres with high-O2or high CO2concentrations on postharvest physiology and storability of ‘Napoleon’ sweet cherry[J].Acta Botanica Sinica,2002,44(8):925-930.
[8] Havir E A,Mchale N A.Biochemical and developmental characterization of multiple forms of catalase in tobacco leaves[J].Plant Physiology,1987,84(2):450-455.
[9] Latunde-Dada A O,Lucas J A.The plant defence activator acibenzolar-S-methyl primes cowpea seedlings for rapid induction of resistance[J].Physiological and Molecular Plant Pathology,2001,58(5):199-208.
[10] 李合生.植物生理生化实验原理和技术[M].北京:高等教育出版社,2000.
[11] 邹琦.植物生理学实验指导[M].北京:中国农业出版社,2006.
[12] Ton J,Van Pelt J A,Van Loon L C,etal.Differential effectiveness of salicylate-dependent and jasmonate/ethylene-dependent induced resistance in Arabidopsis[J].Molecular Plant-Microbe Interactions,2002,15(1):27-34.
[13] Suzuki S,He Y.Indole-3-acetic acid production in Pseudomonas fluorescens HP72 and its association with suppression of creeping bentgrass brown patch[J].CurrentMicrobiology.2003,47(2):0138-0143.
[14] Ryu C,Farag M,Hu C,etal.Bacterial volatiles induce systemic resistance in Arabidopsis[J].Plant Physiology,2004,134,1017-1026.
[15] Cortes-Barco A M,Hsiang T,Goodwin P H.Induced systemic resistance against three foliar diseases of Agrostisstoloniferaby (2R,3R)-Butanediol or an isoparaffin mixture.Annals of Applied Biology[J].Plant Pathology,2010,157:179-189.
[16] Hsiang T,Goodwin P H,Cortes-Barco A M.Plant defense activators and control of turfgrassdiseases[J].Outlooks on Pest Management,2011,22(4):160-164.
[17] 马晖玲,房媛媛.植物抗病性及诱导抗病性在匍匐翦股颖病害防治中的应用[J].草业学报,2014,23(5):312-320.
[18] 马祥,马晖玲,安惠惠,等.诱导剂丁二醇对匍匐翦股颖抗病相关的防卫酶活性的影响[J].草原与草坪,2012,32(3):37-42.
[19] 房媛媛,马晖玲.2,3-丁二醇与水杨酸诱导匍匐翦股颖对镰刀菌枯萎病的抗性[J].草原与草坪,2015,35(3):83-87.
[20] 徐秉良,李敏权,郁继华,等.苜蓿对白粉病的抗性与叶绿素含量的关系[J].草业科学,2005(4):72-74.
[21] 金珠,匡晶,洪法水,等.马齿苋抗霜霉病的生理基础研究[J].淮北煤师院学报(自然科学版),1999(3):55-59.
[22] Brennan T C.Involvement of hydrogen peroxide in the regulation of senescence in pear[J].Plant Physiol,1997,59(2):411-416.
[23] 代春艳,朱振家,安翠香,等.诱抗剂BTH诱导甜瓜幼苗抗白粉病相关酶活性的研究[J].江苏农业学报,2010,26(2):286-291.
[24] 孙嘉曼,傅俊范,严雪瑞,等.相关防御酶对人参锈腐病诱导抗性的响应[J].植物病理学报,2012(4):396-403.
[25] 李堆淑,胡景江.寡聚糖激发子对杨树防御酶系活性的影响[J].西北林学院学报,2012(2):26-29.
[26] 许晴晴,郜海燕,陈杭君.茉莉酸甲酯对蓝莓贮藏品质及抗病相关酶活性的影响[J].核农学报,2014(7):1226-1231.
[27] 李波,祝一鸣,单体江,等.AXY22和苯并噻二唑的组合诱导对桉树抗病相关酶活性和丙二醛的影响[J].中国森林病虫,2016(6):1-5.

