树锦鸡儿枝条上的中国新纪录种真菌Stromatonectria caraganae1)
周仪 朝乐孟图雅 刁辰 董爱荣 刘雪峰
(东北林业大学,哈尔滨,150040) (鄂托克前旗森防站) (新宾县林业局) (东北林业大学)
树锦鸡子座丛赤壳菌(Stromatonectriacaraganae)是子囊菌门(Ascomycota)、粪壳菌纲(Sordariomycetes)、肉座菌目(Hypocreales)、生赤壳科(Bionectriaceae)、子座丛赤壳属(Stromatonectria)真菌。主要分布于维也纳的豆科植物树锦鸡儿(Caraganasp.)、鱼鳔槐(Coluteaarborescens)、金链花(Laburnumanagyroides)的树枝上[1]。Höhnel在1905年根据维也纳植物园收集的材料,最初将这种真菌命名为Myrmaeciellacaraganae。在他对M.caraganae的描述中,Höhnel认识到M.caraganae没有侧丝[2],但是在Myrmaeciella的关键词中,他列出了侧丝的存在是这个属的一个重要的标准[3]。后来Höhnel发现Myrmaeciella中的M.moriformis是Nectriaparaguayensis的同物异名,并将该分类群和M.caraganae转移到肉座菌科(Hypocreaceae)中的EndothiaFr.中[4-5]。同时他也将ValsonectriaSpeg.作为Endothia的同物异名[6]。1994年Samuels和Brayford[7]证实M.moriformis和N.paraguayensis是同物异名,这是在温带的南美洲发生在榆科(Ulmaceae)朴属(Celtis)树皮上的真菌,但是他们将其归类为丛赤壳属(Nectria)的1个种。至此M.caraganae的分类地位也变得模糊起来。2011年Jaklitsch et al.[1]重新描述了M.caraganae,并利用分子生物学技术阐明了其分类学和系统发育的位置,将其归类于生赤壳科的新属——子座丛赤壳属(Stromatonectria),并将其命名为树锦鸡子座丛赤壳菌(S.caraganae)。笔者在研究树锦鸡儿病害标本时,经切片镜下观察,发现该菌从形态学上与树锦鸡子座丛赤壳菌的无性型十分相似,随后进行分离纯化,获得该菌的纯菌种,并进行了形态学和分子生物学鉴定,证明该菌为树锦鸡子座丛赤壳菌,在我国未见报道,为中国新纪录种。
1 材料与方法
2016年12月,在东北林业大学校园采集到具有典型特征的树锦鸡儿枯死枝干标本数枝,标本号为Sc-1。
菌种分离:将所采集具有典型特征的枝干标本用自来水冲洗干净,然后将病部组织的子实体沿枝干切下,75%酒精表面消毒后,用刀片切成小薄片,置于灭菌后的离心管中,加入1 mL无菌水,振荡数次后制成孢悬液。取一滴制备好的孢悬液于载玻片,并在显微镜下镜检计数,将孢子浓度调节到4×10倍镜下每视野40个孢子左右,取20 μL孢悬液,涂布在PDA平板上。之后置于培养箱中25 ℃培养,约3 d萌发长出单菌落,于解刨镜下挑取单菌落,纯化培养后获得纯菌株S1,将S1分别接种在PDA培养基、添加20%树锦鸡儿树皮煎汁的PDA培养基以及20%麦芽提取物培养基(MAE)上观察其培养特性。菌种保存于PDA斜面培养基上。
形态学鉴定:借助手持放大镜以及实体解剖镜观察病枝标本Sc-1以及人工培养基上S1产生的子实体。同时徒手切片,用水作浮载剂制成临时玻片标本,然后在显微镜下观察病原菌的分生孢子器、分生孢子、分生孢子梗的形态,拍摄照片,并测量其大小。
分子生物学鉴定:将S1菌株从PDA平板转移到PD液体培养基中,黑暗条件下,25 ℃,160 r·min-1摇培7 d,经无菌纱布过滤,获得菌丝体。选取快捷型植物基因组DNA提取试剂盒(Tiangen Biotech (Beijing) Co.,LTD.)提取菌丝真菌基因组DNA。获得DNA后使用核糖体ITS区段通用序列ITS1(5′-TCCGTAGGT-GAACCTGCGG-3′)和ITS4(5′-TCCGCTTATT-GATATGC-3′)作为引物,对样品的rDNA ITS1-ITS4区域进行扩增。PCR反应体系,模板DNA 1.50 μL,引物各0.50 μL,dNTP 2.50 μL,10×Buffer 2.50 μL,Taq酶0.25 μL,灭菌ddH2O定容至25.00 μL。PCR反应条件参数,预热94 ℃、5 min,变性94 ℃、30 s,退火55 ℃、30 s,延伸72 ℃、1 min,补平72 ℃、7 min;35个循环。扩增后进行琼脂糖凝胶电泳检测。PCR产物委托上海生工测序公司进行纯化和测序。使用NCBI网站中的BLAST工具将测得的DNA序列进行比对分析,根据比对结果,并与培养特性和形态学鉴定相结合确定该病原菌的种类。
2 结果与分析
2.1 形态学鉴定
Stromatonectriacaraganae(Höhn.) Jaklitsch & Voglmayr
≡MyrmaeciellacaraganaeHöhn.
≡Endothiacaraganae(Höhn.) Höhn.
该菌多寄生在老龄或枯死的树锦鸡儿枝条上,分生孢子器聚集或簇生。其无性阶段产生的子座,初埋生于寄主皮下,肉眼可见树皮下有小突起,后横向开裂,突破树皮,裂口处乳白色到淡黄色,光滑,裂口长1.7~3.0 mm。子座逐渐外露,裂口处向外凸起,每个子座上产生1至多个分生孢子器,颜色逐渐加深变为橙黄色,半球形或不规则形,表面不均匀,子座大小(0.80~4.62)mm×(1.00~4.64)mm(图1a)。分生孢子器多腔,不规则形(图1c),在潮湿的情况下通常融合大量分生孢子在孔口处形成孢子黏液(图1b)。分生孢子梗透明至半透明,产生于单个圆柱形细胞或不规则膨胀的菌丝上,瓶梗轮生2~8或单侧再分枝,梗基包括瓶梗长21.5~37.5 μm(n=30),瓶梗(8.3~16.3)μm×(1.1~2.5)μm(n=50)(图1d-e)。分生孢子单细胞,无色,透明,光滑,圆柱形或轻微弯曲,(3.1~5.4)μm×(0.8~1.5)μm(n=50)(图1g)。
无性阶段培养特性:分生孢子萌发慢,菌丝生长缓慢,在25 ℃黑暗条件下培养时,10 d在PDA培养基上直径18~19 mm,菌落表面白色,背面淡黄色。与在添加20%树锦鸡儿树皮煎汁的PDA培养基上生长速度相似,但在后者菌丝明显更加致密。而在MAE培养基上,菌丝生长明显变慢,10 d仅1~2 mm。暗培养30 d后取出见光,见光10 d后在菌落的中央及边缘部分开始产生白色球状的子座,表面密布白色绒毛样菌丝,每个子座上产生1~3个半透明的孔口,随着分生孢子器的成熟,颜色逐渐加深,成熟后变为橙黄色,直径0.60~1.68 mm(n=30),个别直径达到3.5 mm(图1i)。另外,从菌丝的分支上也可以产生分生孢子,产孢细胞瓶梗形,(6.2~16.0)μm×(1.7~3.0)μm(n=30)。分生孢子顶生或侧生,单细胞,无色,与自然寄主上产生的分生孢子形状相同,(4.2~5.5)μm×(1.1~2.1)μm(n=50)(图1f)。分生孢子24 h左右开始萌发,从两头分别长出芽管(图1h)。
2.2 分子生物学鉴定
经序列分析,菌株S1的rDNA-ITS序列长616 bp。将所测rDNA-ITS序列在NCBI的BLAST上进行比对,其中S1与GenBank中S.caraganae(Gen Bank ID:HQ112288,菌株号:CBS 125579)的相似度为99%。用菌株S1与BLAST结果中的近缘菌株构建系统发育树,结果表明S1与菌株S.caraganae在同一分支上,亲缘关系最近,可信度为100(图2)。
3 结论与讨论
在国外树锦鸡丛赤壳菌在维也纳的豆科植物树锦鸡、鱼鳔槐、金链花的树枝上被发现,而在中国仅在树锦鸡儿枝条上发现其无性阶段。根据资料记载,该菌的无性型在自然寄主上产生的子座大小为0.3~0.9 mm,梗基包括小瓶梗20~37 μm长,瓶梗(8.5~12.7)μm×(1.4~2.0)μm,分生孢子(4.0~5.5)μm×(1.2~1.5)μm。与标本Sc-1稍有差异。同时资料记载其在人工培养基上瓶梗(8.0~13.5)μm×(2.0~2.5)μm,分生孢子(4.5~6.0)μm×(1.5~2.2)μm,在PDA培养基及MEA培养基上10 d的生长量分别为7~8 mm和3~5 mm,与笔者人工培养的测量数据也有一定差异。推测这些差异可能与其分布地区以及培养条件的差异有关,但依据其主要形态特征及分子生物学鉴定确认此菌为树锦鸡子座丛赤壳菌(Stromatonectriacaraganae),在我国未见报道,为中国新纪录种。

a、b.分生孢子器;c.分生孢子器切片;d、e.分生孢子器中产生的分生孢子梗(标本Sc-1);f.菌丝上产生的分生孢子梗;g.分生孢子;h.萌发的孢子;i.菌落形态特征(PDA培养基)。
图1树锦鸡子座丛赤壳菌(S.caraganae)
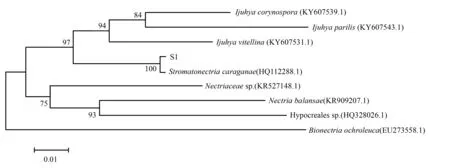
图2 S1菌株与GenBank数据库中近缘菌株的系统发育树
[1] JAKLITSCH W M, VOGLMAYR H.Stromatonectriagen. nov. and notes onMyrmaeciella[J]. Mycologia,2011,103(2):431-440.
[2] HÖHNEL F. Mycologisches[J]. Österr Bot Zeitschr,1905,55(2):51-55.
[3] HÖHNEL F. Mycologisches[J]. Österr Bot Zeitschr,1905,55(3):97-101.
[4] HÖHNEL F, WEESE J. Zur synonymie in der gattungNectria[J]. Annals Mycol,1910,8:464-468.
[5] HÖHNEL F V, AKAD K M K. Fragmente zur mykologie XIV. Mitteilung (No.719 bis 792)[J]. Sitzungsber Akad Wiss Wien, Mathem Naturwiss Kl, Abt I,1912,121:339-424.
[6] HÖHNEL F V, AKAD K M K. Fragmente zur mykologie IX. Mitteilung (No.407 bis 467)[J]. Sitzungsber Akad Wiss Wien, Mathem Naturwiss Kl, Abt I,1909,118:1461-1552.
[7] SAMUELS G J, BRAYFORD D. Species ofNectria(sensu lato) with red perithecia and striate ascospores[J]. Sydowia,1994,46:75-161.

