睡眠时长对抑郁症患者胰岛素抵抗水平的影响
张 健,邹 琳
(天津市安定医院,天津 300222)
睡眠时长对抑郁症患者胰岛素抵抗水平的影响
张 健,邹 琳
(天津市安定医院,天津 300222)
目的研究抑郁症患者不同睡眠时长对其胰岛素抵抗水平的影响,为抑郁症患者糖尿病的病因学机制研究提供参考。方法于2012年10月-2015年12月在天津市精神卫生中心精神科门诊及住院患者中抽取86例重度抑郁症患者,均符合《精神障碍诊断与统计手册(第4版)》(DSM-IV)诊断标准。检测患者空腹血糖(FBG)、空腹血清甘油三酯(FTG)水平;采用FBG和FTG水平计算所得简易胰岛素抵抗指数(TyG)评估受试者胰岛素抵抗水平;采用匹兹堡睡眠指数量表(PSQI)评估患者睡眠情况,根据评估结果计算患者近1个月的日均睡眠时长,按日均睡眠时间长短将患者分为极短时组(<4h)、短时组(4~6h)、参照组(6~8h)和长时组(≥8h),比较四组胰岛素抵抗水平;采用多重线性回归分析胰岛素抵抗水平的影响因素。结果与参照组比较,极短时组与短时组FBG和FTG水平更高,但各组之间差异无统计学意义(P均>0.05);极短时组与短时组的平均简易胰岛素抵抗指数高于参照组(P<0.05);多重线性回归分析结果显示,胰岛素抵抗指数与年龄(β=0.005,P<0.05)、BMI(β=0.012,P<0.05)正向关联,与睡眠时长(β=-0.014,P<0.05)负向关联。结论短时睡眠可能是抑郁症患者发生胰岛素抵抗进而诱发糖尿病的危险因素之一。
胰岛素抵抗;重度抑郁;睡眠紊乱
抑郁症以显著而持久的心境低落、愉悦感减退、精力下降为主要临床特征,且大多数抑郁症患者均伴有明显的睡眠紊乱及睡眠时长减少[1]。2型糖尿病通常是由胰岛素抵抗或胰岛素分泌缺陷引起,最终造成血糖升高的一种代谢紊乱疾病[2]。有研究表明,抑郁症患者更易感糖代谢紊乱或糖尿病等代谢性疾病[3-4],但其之间的关联机制仍然不明。胰岛素抵抗(IR)是指机体对胰岛素的敏感性及反应性降低的状态,是糖代谢紊乱或糖尿病发生发展的重要病理生理基础[1],可以通过患者的胰岛素抵抗水平来客观评价其罹患糖代谢疾病的风险,已有研究显示,抑郁症状更容易导致胰岛素抵抗,但其相关发病机制或危险因素仍未阐明[5-6]。既往在普通人群中开展的相关研究结果显示,睡眠时间减少易使胰岛素抵抗水平增高[7-8],而且是增加糖代谢紊乱或糖尿病发病风险的危险因素[9-11]。考虑到近80%的抑郁障碍患者具有睡眠障碍及睡眠时间减少,假设抑郁症患者睡眠时间的减少是导致其胰岛素抵抗水平增高,进而易感糖代谢紊乱或糖尿病的危险因素。本研究比较抑郁症患者不同睡眠时长对其胰岛素抵抗水平的影响,为探讨抑郁症患者易感糖代谢紊乱及糖尿病的病理机制提供参考。
1 对象与方法
1.1 对象
于2012年10月-2015年12月在天津市精神卫生中心门诊及住院患者中选取研究对象。入组标准:①符合《精神障碍诊断与统计手册(第4版)》(Diagnostic and Statistical Manual of Mental Disorders, fourth edition,DSM-IV)重度抑郁发作诊断标准;②年龄18~60岁;③汉密尔顿抑郁量表17项版(Hamilton Depression Scale-17 item,HAMD-17)评分>17分;④近一个月未使用任何精神科药物治疗;⑤对本研究知情同意并签署知情同意书。排除标准:①精神发育迟滞、器质性精神障碍、物质滥用及依赖患者;②有糖尿病、高血脂及既往明确有其他形式的糖脂代谢异常者;③既往有降糖、降脂类药物治疗史。符合入组标准且不符合排除标准共86例,其中男性38例(44.2%),女性48例(55.8%);年龄21~59岁,平均(38.03±10.14)岁;HAMD-17评分19~35分,平均(24.8±4.23)分;体质量指数(BMI)平均值为(22.79±1.8);腰臀比(WHR)平均值为(0.8±0.06);空腹血糖(FBG)平均值为(4.45±0.31)mmol/L;空腹甘油三酯(FTG)平均值为(1.53±0.29)mmol/L;有糖尿病家族史者16例(18.6%)。本研究遵照赫尔辛基宣言,并经过天津市安定医院伦理委员会审查。入组患者在充分了解研究目的并签署知情同意书后,完成血液标本及临床资料采集。
1.2 方法
1.2.1 FBG、FTG检测
患者在入组后次日晨进行FBG、空腹血清FTG检测,要求患者至少禁食8个小时后抽取肘静脉血进行测定。采用日本东芝公司的TBA120FR型全自动生化分析仪完成检测,FBG检测试剂为宁波美康公司提供的葡萄糖检测试剂盒,FTG检测试剂由日本积水医疗科技公司提供。
1.2.2 胰岛素抵抗评估
虽然高胰岛素正葡萄糖钳夹技术是目前评价胰岛素抵抗的金标准[12],但因其操作复杂、费用高等缺点而限制了其广泛使用[13]。由空腹血清FTG和空腹血浆葡萄糖水平计算而得的简易胰岛素抵抗指数近年来逐渐得到推广应用,且其对胰岛素抵抗评价的可靠性已被研究所证实[13-14]。本研究即采用空腹血清FTG和FBG计算所得的简易胰岛素抵抗指数(TyG指数)评估胰岛素抵抗水平,计算公式:TyG指数=ln (FTG×FBG)/2,其中FTG、FBG单位均为mg/dL[14]。
1.2.3 睡眠时长评估
使用匹兹堡睡眠指数量表(Pittsburgh Sleep Quality Index,PSQI)评定患者近一个月的睡眠状况,并根据评定结果计算患者近一个月的每日平均睡眠时长。有系统综述报道睡眠时间小于6 h者,相较于睡眠7 h或更长者,其罹患包括代谢综合征等躯体疾病的风险更高[9],因而本研究将日均睡眠时长小于6 h视为短时睡眠。根据患者日均睡眠时长将患者分为四组:极短时组(睡眠时长<4 h)、短时组(4 h≤睡眠时长<6 h)、参照组(6 h≤睡眠时长<8 h)、长时组(睡眠时长≥8 h)。
1.3 统计方法
2 结 果
2.1 不同睡眠时长组相关风险因素比较
全部样本睡眠时长分布:极短时组26例,短时组23例,参照组21例,长时组16例。各组在性别、年龄、HAMD-17评分、BMI、WHR及糖尿病家族史方面比较差异均无统计学意义(P均>0.05)。见表1。
2.2 不同睡眠时长组血糖水平、胰岛素抵抗指数水平比较
不同睡眠时长组FBG、FTG水平比较差异均无统计学意义(P均>0.05),各组TyG水平比较差异有统计学意义(P<0.05),睡眠时长越短者,其胰岛素抵抗指数越高。见表2。
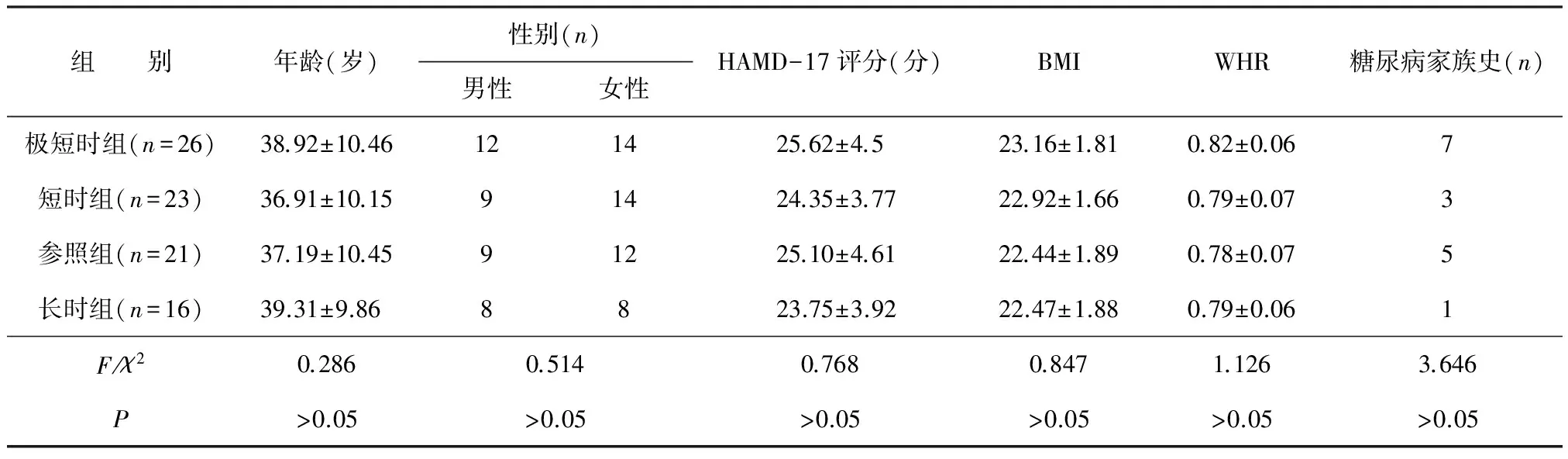
表1 不同睡眠时长组相关风险因素比较
注:HAMD-17,汉密尔顿抑郁量表17项版;BMI,体质量指数;WHR,腰臀比
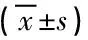
表2 不同睡眠时长组FBG、FTG和TyG水平比较
注:FBG,空腹血糖;FTG,空腹甘油三酯;TyG,简易胰岛素抵抗指数
2.3 抑郁症患者胰岛素抵抗指数相关影响因素的多重线性回归分析
以TyG水平为因变量,以年龄、性别、BMI、WHR、糖尿病家族史、HAMD-17评分及睡眠时长为自变量采用逐步法进行多重线性回归分析(变量纳入概率为P≤0.05),最终,年龄、BMI及睡眠时长进入回归方程,年龄的标准化回归系数为0.47,BMI的标准化回归系数为0.199,睡眠时长的标准化回归系数为-0.274。见表3。
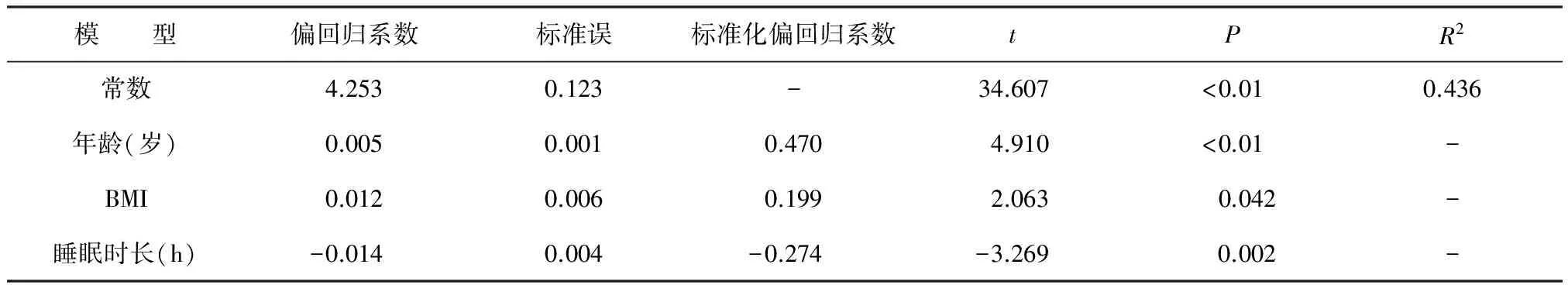
表3 胰岛素抵抗指数影响因素的多重线性回归分析
注:BMI,体质量指数
3 讨 论
本研究结果显示,抑郁症患者的睡眠时长越短,其FBG和FTG水平越高,但相较于正常睡眠时长的患者,差异无统计学意义(P>0.05);睡眠时间更短的患者组TyG指数更高,且各组间差异有统计学意义(P<0.05);多重线性回归分析显示,睡眠时长与TyG指数呈负相关,提示随着睡眠时长减少,患者的胰岛素抵抗水平越高。
Ford等[5-6]研究结果均表明,短时睡眠会影响患者的血糖水平,可造成血糖水平显著升高。本研究也得出同样的结果,即睡眠时长越短的患者FTG水平更高,但与正常睡眠时长组比较差异无统计学意义。这一结果的差异可能由于样本量的限制,因前期研究结论大多出自大规模流行病学调查研究,而本研究的样本量远远小于前期研究。本研究结果显示抑郁症患者短时睡眠组的FTG水平与正常睡眠时长组比较差异无统计学意义(P>0.05),与Chaput等[15-16]研究结果一致,其原因可能是FTG水平的改变是一种较为缓慢的生理变化,相较于血糖水平的变化具有延迟性,因而未能及时反应出短期内的代谢变化[16]。
与正常睡眠时长组相比,抑郁症患者的睡眠时长越短,其胰岛素抵抗指数水平越高,且差异有统计学意义(P<0.05)。虽然各组FBG和FTG水平差异无统计学意义,但TyG指数计算公式将二者的微小差异叠加并放大,使其差异显著化。其意义在于,胰岛素抵抗通常是发生在血糖、血脂出现显著变化之前,TyG指数具有提前发现患者罹患糖代谢异常风险的预警作用。进一步的回归分析显示胰岛素抵抗水平与患者年龄、BMI及睡眠时长相关,其中年龄与BMI是公认的与高血糖或糖尿病发病相关的危险因素[17]。而睡眠时长与胰岛素抵抗水平呈负相关,提示短时睡眠可能是引起抑郁症患者胰岛素抵抗的危险因素,这与在正常人群中进行的相关研究结果一致[7-9]。而本研究在抑郁症患者群中再次验证短时睡眠与胰岛素抵抗相关,提示抑郁症患者糖代谢异常或糖尿病高发的高危因素之一也是其睡眠时间的减少,而与抑郁症的严重程度不相关。
抑郁症患者的短时睡眠对其胰岛素抵抗水平影响的原因,可能存在以下病理生理机制:早期的睡眠剥夺实验结果显示,极度困倦的受试个体在白天其大脑活动及糖代谢水平均降低[18],大脑是人体消耗能量最多的器官,日间大脑血糖代谢水平下降,将导致人体血糖水平处于升高的状态,长时间累积的结果将导致胰岛功能水平下降;睡眠障碍所引起的昼夜节律异常会引起下丘脑-垂体-肾上腺轴功能异常,患者会出现血浆皮质醇升高,皮质醇作为体内的升糖激素通过抑制胰岛素促进组织摄取葡萄糖的效果而发挥作用,长期的睡眠紊乱造成的高皮质醇水平将导致机体对胰岛素的敏感性降低[19];正常人体的交感神经和迷走神经处于一种张力平衡的状态,对于维持机体脏器功能和节律具有重要作用,而睡眠紊乱会打破正常的交感—迷走神经平衡,可引起机体胰岛功能水平下降[20]。
综上所述,短时睡眠可造成抑郁症患者胰岛素抵抗水平显著升高,胰岛素抵抗水平升高的可能结局是罹患糖代谢异常或糖尿病,短时睡眠是抑郁症患者易感糖代谢异常及糖尿病可能的病理机制。由于本研究样本量较小,其结果需要更大样本量的研究进一步验证,且受限于横断面研究的性质,抑郁症患者睡眠时间的减少与其胰岛素抵抗水平升高二者间是否存在明确的因果关系,尚有待相关前瞻性研究加以验证。
[1] 李凌江, 马辛. 中国抑郁障碍防治指南[M]. 2版. 北京: 中华医学电子音像出版社, 2015: 6-7.
[2] 葛均波, 徐永健. 内科学[M]. 8版. 北京: 人民卫生出版社, 2013: 733-737.
[3] 夏青春, 王高华, 陈海支, 等. 首发抑郁症患者糖代谢的研究[J]. 浙江大学学报(医学版), 2011, 40(2): 213-216.
[4] Deschênes SS, Burns RJ, Graham E, et al. Prediabetes, depressive and anxiety symptoms, and risk of type 2 diabetes: a community-based cohort study[J]. J Psychosom Res, 2016, 89: 85-90.
[5] Ford AH, Flicker L, Hankey GJ, et al. Insulin resistance and depressive symptoms in older men: the health in men study[J]. Am J Geriatr Psychiatry, 2015, 23(8): 872-880.
[6] Vrany EA, Berntson JM, Khambaty T, et al. Depressive symptoms clusters and insulin resistance: race/ethnicity as a moderator in 2005-2010 NHANES data[J]. Ann Behav Med, 2016, 50(1): 1-11.
[7] Damanti S, Bourron O, Doulazmi M, et al. Relationship between sleep parameters, insulin resistance and age-adjusted insulin like growth factor-1 score in non diabetic older patients[J]. PLoS One, 2017, 12(4): e0174876.
[8] Anothaisintawee T, Reutrakul S, Van Cauter E, et al. Sleep disturbances compared to traditional risk factors for diabetes development: systematic review and meta-analysis[J]. Sleep Med Rev, 2016, 30:11-24.
[9] Iftikhar IH, Donley MA, Mindel J, et al. Sleep duration and metabolic syndrome. an updated dose-risk metaanalysis[J]. Ann Am Thorac Soc, 2015 12(9): 1364-1372.
[10] Shan Z, Ma H, Xie M, et al. Sleep duration and risk of type 2 diabetes: a meta-analysis of prospective studies[J]. Diabetes Care, 2015, 38(3): 529-537.
[11] 苏健, 陶然, 周金意, 等. 成年人睡眠状况与糖尿病患病关系的研究[J]. 中华流行病学杂志, 2017, 38(5): 597-601.
[12] DeFronzo RA, Tobin JD, Andres R. Glucose clamp technique: a method for quanitifying insulin secretion and resistance[J]. Am J Physiol, 1979, 237(12): E214-223.
[13] 张翼飞, 顾卫琼, 晏群, 等. 由血清甘油三酯和血糖所得简易指数用于评估胰岛素抵抗的临床研究[J]. 中华内分泌代谢杂志, 2012, 28(5): 392-396.
[14] Guerrero-Romero F, Simental-Mendia LE, González-Ortiz M, et al. The product of triglycerides and glucose, a simple measure of insulin sensitivity comparison with the euglycemic -hyperinsulinemic clamp[J]. J Clin Endocrinol Metab, 2010, 95(7): 3347-3351.
[15] Chaput JP, Després JP, Bouchard C, et al. Association of sleep duration with type 2 diabetes and impaired glucose tolerance[J]. Diabetologia, 2007, 50(11): 2298-2304.
[16] Shin HY, Kang G, Kim SW, et al. Associations between sleep duration and abnormal serum lipid levels: data from the Korean National Health and Nutrition Examination Survey (KNHANES)[J]. Sleep Med,2016, 24:119-123.
[17] Mordarska K, Godziejewska-Zawada M. Diabetes in the elderly[J]. Prz Menopauzalny, 2017, 16(2): 38-43.
[18] Spiegel K, Leproult R, Van Cauter E. Impact of sleep debt on metabolic and endocrine function[J]. Lancet, 1999, 354(9188): 1435-1439.
[19] Westerterp-Plantenga MS. Sleep, circadian rhythm and body weight: parallel developments[J]. Proc Nutr Soc, 2016, 75(4): 431-439.
[20] Spiegel K, Leproult R, L'hermite-Balériaux M, et al. Leptin levels are dependent on sleep duration: relationships with sympathovagal balance, carbohydrate regulation, cortisol, and thyrotropin[J]. J Clin Endocrinol Metab, 2004, 89(11): 5762-5771.
Impactofsleepdurationoninsulinresistanceofpatientswithmajordepression
ZhangJian,ZouLin
(TianjinMentalHealthCenter,Tianjin300222,China)
ObjectiveTo explore the influence of sleep duration on insulin resistance of patients with major depression, andto providereferences for explaining the etiologic mechanism of the highsusceptibility of diabetes within depressed group.Methods86 patientswho were diagnosed as major depression disorder according to Diagnostic and Statistical Manual of Mental Disorders, fourth edition (DSM-IV) were recruited from the psychiatric clinic of Tianjin Mental Health Center from October 2012 to December 2015. The level of FBG and FTG was detected, and the TyG calculated from FBG and FTG was used to evaluate the insulin resistance levels in subjects. The Pittsburgh Sleep Quality Index (PSQI) was used to assess the patient's sleep status. Based on the results of the assessment, the average daily sleep duration of patients within one month was calculated.They were divided into 4 different groups according to the mean sleep duration, which were extremely short sleep group(<4 h), short sleep group(4~6 h), reference group(6~8 h) and long sleep group(≥8 h).Then the difference of the insulin resistance index and the related influencing factors on insulin resistanceamong these 4 groups were analyzedby the method of Multiple Linear Regression.ResultsCompared with the reference group, FBG and FTG levels of the extremely short sleep group and the short sleep group were higher (P>0.05), and the TyG was higher (P<0.05). The correlations of insulin resistance index with age (β=0.005,P<0.05) and BMI(β=0.012,P<0.05) were positive, but with sleep duration was negative(β=-0.014,P<0.05).ConclusionShort sleep duration may be one of the risk factors for the onset of insulin resistance and even diabetes among depressed patients.
R749.4
A
10.11886/j.issn.1007-3256.2017.06.011
2017-05-18)
陈 霞)

