三种抗结核药物血药浓度调控成功率的比较分析
周俊 吕小会 郑修齐 熊朝刚 赵嫄 党丽云
治疗药物监测(therapeutic drug monitoring,TDM)的意义在于实时监测给药后治疗药物在外周血中或其他局部组织液及体液中的浓度,以判断药物的体内暴露水平是否达到有效治疗浓度范围、服药剂量或给药方式等是否合适,并可根据需要对给药方案做出适当调整。TDM对于不良反应较重且需长期足量用药的抗结核药物治疗的意义更是如此,且有助于从药代动力学和药效学方面促进结核化疗的最优化[1]。临床常用的一线抗结核药物异烟肼(INH)、利福平(RFP)和吡嗪酰胺(PZA)等均需要较长时程的服用。患者的个体间药代动力学差异可导致INH等药物在常规用量时,体内最低浓度和最高浓度相差数十倍[2-3]。由药代动力学的个体间差异引起的低药物浓度是诱导结核分枝杆菌(MTB)耐药性的主要原因[2, 4]。而药物浓度过高时,又容易因高剂量和长期应用而引起肝、肾和神经等多方面的药物不良反应[5-7]。因此,临床上为这些药物制定了兼顾有效性和安全性的治疗浓度范围。同时也有必要对这类抗结核药物在临床使用中进行TDM监测,以便为患者制定个体化最佳用药剂量。
笔者所在医院药物浓度监测系统对常用抗结核药物如RFP、INH、PZA、乙胺丁醇、利奈唑胺等,都具备成熟而稳定的基于高效液相色谱法(HPLC)和超高效液相串联质谱法(LC-MS/MS)的分离分析方法[8-9]。根据长期的TDM实践来看,许多药物品种在常规使用剂量时,会有相当比例的患者血药浓度不在临床治疗浓度范围内。同时,给予剂量调整后,也有相当一部分患者的血药浓度仍不能达到治疗浓度范围。因此,对于个别药物品种需要实施再次或多次的TDM,并在对患者、药物及血药浓度多方面情况进行综合考虑后,制定更具体和细化的剂量调整方案。笔者统计了西安市胸科医院1年内抗结核药物INH、RFP和PZA血药浓度的非治疗浓度范围值及剂量调整后的血药浓度,并将这3种药物的血药浓度调控成功率进行了比较分析。
资料和方法
1.资料收集:利用西安市胸科医院信息管理系统,收集2016年11月至2017年11月期间,根据临床治疗的需要,进行剂量调整及有实施前后2次及以上血浆药物浓度监测资料的初治确诊肺结核患者作为研究对象,共132例。其中,INH、RFP和PZA等3种一线抗结核药物实施2次及以上TDM监测患者数及剂量调整患者数为:INH组符合两种情况的患者数分别为50例和19例;RFP组分别为47例和9例;PZA组分别为35例和11例。本研究即分析比较INH、RFP和PZA等3种常用抗结核药物血药浓度的调整情况及调控成功率。
2.方法:每种口服药物均为在口服后2 h的时间点上抽取静脉血2 ml,抗凝和离心后取上层血浆并立即做蛋白质沉淀处理,然后即进行血药浓度检测。首次检测时服药剂量为:INH片300 mg/d,RFP胶囊8~10 mg·kg-1·d-1,PZA片1500 mg/d,均为每日1次顿服。调整后剂量为根据TDM监测结果而具体设定。INH、RFP、PZA等药物的首选口服剂量参考“Globaltuberculosisreport2016”[10]选定。所有抗结核药物的TDM均在实施药物治疗的早期即开始进行,前后2次检测相隔时间一般为1~2 周。INH、RFP和PZA的治疗峰浓度范围分别是3~6 μg/ml、8~24 μg/ml和20~60 μg/ml,当监测到血药峰浓度值低于治疗峰浓度范围下限时,预示杀菌效力较差;而高于治疗峰浓度上限值时,则预示药物不良反应较大[9, 11]。因此,血药峰浓度超出治疗峰浓度范围是提示给药剂量需要调控的直接指标。血药浓度调控成功的标志是调整给药剂量后再行血药浓度监测,测定结果显示血药峰浓度已在所服用药物的治疗峰浓度范围内。血药浓度调整率和血药浓度调控成功率的计算公式:血药浓度调整率=调整给药剂量的例数/实施2次及以上血药浓度测定的例数;血药浓度调控成功率=血药浓度调控成功例数/实施给药剂量调整的例数。
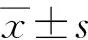
结 果
1.基本情况:INH组调整剂量者19例,其中女9例,男10例,平均年龄(33.6±15.4)岁;RFP组调整剂量者9例,其中女4例,男5例,平均年龄(30.8±14.6)岁;PZA组调整剂量者11例,其中女3例,男8例,平均年龄(34.2±12.3)岁。三组间性别构成和年龄差异均无统计学意义(χ2=1.24,P=0.586;F=0.16,P=0.850)。INH、RFP和PZA组血药浓度调整率分别为38.0%(19/50)、19.1%(9/47)和31.4%(11/35)。
2.INH血药浓度调整情况:调整剂量前INH组血药浓度为2.37(1.49,6.82) μg/ml,浓度范围为0.60~16.86 μg/ml。调整剂量后,血药浓度为4.30(2.21,6.64),浓度范围为0.87~10.50 μg/ml。INH的治疗浓度范围为3~6 μg/ml,血药浓度调控成功率为31.6%(6/19)。
3.RFP血药浓度调整情况:调整剂量前RFP组平均血药浓度为(5.24±0.98) μg/ml,浓度范围为3.63~6.55 μg/ml。调整剂量后平均血药浓度为(11.56±3.95) μg/ml,浓度范围为6.89~17.71 μg/ml。RFP的治疗浓度范围为8~24 μg/ml,其血药浓度调控成功率为7/9。
4.PZA血药浓度调整情况:调整剂量前PZA组平均血药浓度为(13.64±4.92) μg/ml,浓度范围为4.87~18.76 μg/ml。调整剂量后平均血药浓度为(33.54±8.87) μg/ml,浓度范围为19.64~45.66 μg/ml。PZA的治疗浓度范围为20~60 μg/ml,其血药浓度调控成功率为81.8%(9/11)。
5.各药物血药浓度调控成功率的比较:INH、RFP和PZA的血药浓度调控成功率差异有统计学意义(Fisher精确概率法,P=0.013),INH组血药浓度调控成功率明显低于PZA组和RFP组。
讨 论
药物的药理作用和治疗效应与体内(包括血液)的药物浓度密切相关。人体对药物处置中的每一环节均会影响体内治疗药物的浓度及药物对人体的作用。人体处置药物的功能状态受自身遗传因素及环境因素的影响。每个人的遗传背景不尽相同,体内外环境也存在着差异和变化,导致几乎任何一个具体的化学药物,在不同个体之间均表现出不同程度的代谢水平及血药浓度上的差异。因此,对于许多治疗指数低、不良反应大的药物,需进行TDM,以便及时反映并调控针对患者个体的实际药物浓度和给药剂量,为药物的个体化合理应用提供重要指导依据[1]。
结核分枝杆菌具有生长缓慢且广泛存在休眠菌潜伏感染的特点,一旦进入生长繁殖期即造成具有明显症状和可传播性的活动性感染。因此,在结核病的治疗过程中应使抗结核药物在体内长期保持有效浓度,做到规律、适量和全程用药,避免低剂量诱导耐药的发生,这是化疗成功的关键[12]。从结核病临床治疗的有效性、安全性及防范低剂量耐药情况的发生出发,临床上为一线抗结核药物制定了兼顾有效性和安全性的治疗浓度范围(治疗窗),其中INH治疗峰浓度范围为3~6 μg/ml,RFP为8~24 μg/ml,PZA为20~60 μg/ml。
本次研究收集的50例进行2次及以上INH的TDM监测的病例中,有19例因首次监测的血药浓度不在治疗浓度范围内而进行了INH给药剂量的调整,调整率为38.0%,较RFP和PZA的调整率高。同时,INH的血药浓度调控成功率又较RFP和PZA低。这说明INH与RFP和PZA相比较,其血药浓度的变异程度较大,因此其剂量调整的可控性较差。这与笔者前期的研究所得结论相符,即INH与RFP和PZA相比,其血药浓度的个体间变化差异较大[13]。造成INH剂量应用的准确性和血药浓度的可控性较差的原因如下:(1)可能与人体的INH代谢基因的表达和酶的活性较复杂、个体间变异更明显、更容易受到各种内外环境因素的影响相关[14-16];(2)同时从药物本身的性质方面考虑,INH的治疗窗又相对较窄,也可能是导致其剂量调整较难掌控的原因之一。
药物代谢特征的个体间差异和药物的作用性质、临床治疗浓度范围等共同影响体内血药浓度的可变性及其调控的成功率,进而决定了药物治疗的最终效果[1, 17]。药物本身对肝、肾等器官及药物代谢酶有调节作用,同时药物的体内处置过程又易受联合用药时药物间相互作用等多方面因素影响,如一线抗结核药物INH和RFP等,较难准确把握其调整的目标剂量[18-19]。
如上所述,抗结核药物RFP和PZA的血药浓度调控成功率与INH相比虽较高,但仍分别有2/9(RFP)和2/11(PZA)的比例失败,这提示基于TDM制定给药剂量方案还不能够完全实现一步到位,针对具体患者和药物品种还有进一步加强TDM观察和剂量调整的必要性。同时,还应尽可能改善每次服药时内外环境因素的均衡性和可控性,以增加血药浓度调整的可操作性和TDM的有效性,促进实时的个体化合理用药。

