噬菌体裂解酶结构域重构及其裂解功能分析
张 辉,周 艳,包红朵,杨振泉,朱如意,周晨露,张莉莉,王 冉,2
(1.江苏省食品质量安全重点实验室-省部共建国家重点实验室培育基地,江苏省农业科学院,江苏 南京 210014;2.江苏省肉类生产与加工质量安全控制协同创新中心,江苏 南京 210095; 3.扬州大学 食品科学与工程学院,江苏 扬州 225009)
噬菌体裂解酶(Bacteriophage lysin)是噬菌体在感染宿主末期表达的晚期蛋白,它通过水解细菌细胞壁的肽聚糖使子代噬菌体释放,从而杀死细菌[1]。由于其杀菌高效、作用特异且不易产生耐受等特性,已成为新药及抗菌制剂的优选[2-3]。目前有关金黄色葡萄球菌(Staphylococcusaureus)和单核细胞增生性李斯特菌(Listeriamonocytogenes,以下简称李斯特菌)噬菌体裂解酶报道不断涌现,前期已有LysZ5用于豆浆及LysH5应用于牛奶的致病菌生物防控[4-5],亦有将裂解酶用于动物模型治疗眼内炎等的研究报道[6],然而由于裂解酶具有种属特异性,其结构域的特殊性,使酶作用范围受到局限,因此不得不将其进行多功能设计,从而满足其广谱的需求。
裂解酶及其他水解酶具有特殊的结构域,其作用方式及模块都有所不同,如肺炎球菌噬菌体裂解酶的Cholin-binding 结构域发挥重要催化功能[7],而金黄色葡萄球菌及乳球菌以细胞壁水解功能为主[8-9],李斯特菌噬菌体裂解酶则以酰胺酶为主[10]。虽然裂解酶因其结构功能的特性被分为不同类型,但其最根本还是以酰胺酶及内肽酶为主要作用形式。在这些酶中,有一类常见的蛋白家族CHAP (Cysteine,histidine-dependent amidohydrolase/peptidase),在作为催化结构域时其表现为酰胺酶活性亦会表现出内肽酶的功能,在裂解过程中发挥重要作用。金黄色葡萄球菌噬菌体裂解酶LysK及Φ11具有高度同源的N末端CHAP及酰胺酶结构域[11-12],因此,将其CHAP作为主要催化基团,并加入特殊的细胞结合结构域(CBD)SH3b(Bacterial src homology 3),将有望放大其裂解功能[6]。而针对李斯特菌噬菌体,与金黄色葡萄球菌噬菌体裂解酶裂解功能类似,其也是通过催化切割 N-乙酰胞壁酸和 N-乙酰葡糖胺残基将宿主细胞壁裂解,其裂解酶CBD不仅为种属特异,甚至是血清或菌株特异[13],因此,将其与金黄色葡萄球菌噬菌体裂解酶的酰胺酶活性进行结合,其多功能活性将会同时作用于2种病原菌。针对前期研究报道,将金黄色葡萄球菌噬菌体裂解酶Ply187-KS和李斯特菌噬菌体裂解酶LysZ5进行结构域结合设计[6],构建出能够同时裂解2种致病菌的重构酶,并对该酶进行裂解鉴定和抑菌分析,为今后广谱抗菌裂解酶的研制及开发提供新思路。
1 材料和方法
1.1 菌株与试剂
1.1.1 菌株及质粒 大肠杆菌(Escherichiacoli)BL21(DE3)、金黄色葡萄球菌 ATCC25923,用TSB在37 ℃培养;李斯特菌分离株Lm007(血清型2a),用BHI在30 ℃培养;质粒pET 28a及质粒pET-LysZ5[5],以上试验材料均由江苏省畜禽产品安全性研究重点实验室保存。
1.1.2 主要试剂 TSB-YE、LB肉汤、琼脂等购自北京陆桥技术有限责任公司;脑心浸液(BHI)购自美国BD公司;DNA Marker、限制性内切酶等分子生物学试剂购自宝生物工程(大连)有限公司;BCA蛋白定量测定试剂盒购自北京庄盟国际生物基因科技有限公司;Ni2+-NTA亲合层析柱购自GE公司;PEG8000等生化试剂等购自汕头市西陇化工厂有限公司。
1.2 试验方法
1.2.1 表达质粒构建 质粒ply187-KS序列参考文献[7]合成并插入原核表达载体pET 28a相应酶切位点,即构成表达质粒ply187-KS,将裂解酶LysZ5 C末端CBD以LysZ5为模板PCR扩增并克隆至ply187-KS序列下游,构建出ply187KS-Z5重构酶融合表达质粒,PCR及测序鉴定其正确性。
1.2.2 重构酶质粒在大肠杆菌中的表达 将质粒ply187-KS及ply187KS-Z5分别转化至大肠杆菌BL21(DE3)筛选阳性克隆,挑取克隆鉴定并通过IPTG进行小量诱导表达,通过IPTG在26 ℃诱导4 h,收集菌体并通过超声波破碎,离心过滤上清,SDS-PAGE鉴定蛋白表达情况。
1.2.3 蛋白的纯化及裂解活性鉴定 将表达正确的克隆接种LB中(Kan 50 μL/mL),37 ℃过夜培养,次日以1∶100再次转接至100 mL LB中,于OD600在0.5~0.8 h,加入1 mmol/L IPTG 进行诱导,并再次置于26 ℃摇振培养5 h;4 ℃,8 000 r/min离心10 min,PBS重悬,超声波破碎细胞,离心收集上清,Ni2+-NTA亲合层析柱纯化表达蛋白。BCA法测定蛋白浓度,并对不同浓度蛋白进行平板点样分析其裂解活性及裂解范围。
1.2.4 MIC试验 将酶蛋白从100 μg进行倍比稀释,即100.000 0,50.000 0,25.000 0,12.500 0,6.250 0,3.125 0,1.562 5 μg分别加入100 μL菌液,置于37 ℃,分别在15,30,60 min测定其OD600,分析最小抑菌浓度。
1.2.5 生肉表面抑菌分析 将生牛肉切成4 cm × 4 cm 肉块,表达用70%无水乙醇进行杀菌消毒,待表面干燥后,均匀滴加105cfu 金黄色葡萄球菌和105cfu 李斯特菌,同时设立单独菌株对照及PBS空白对照;待菌液吸收后,再次分别滴加酶蛋白50 μg/100 μL(浓度以MIC结果为准),作用1,2,3 h后,分别将肉切成小块置于锥形瓶中,加入PBS振摇1 h,取上清检测细菌数量。
2 结果与分析
2.1 重构酶的鉴定及表达纯化
质粒通过限制性内切酶消化及PCR方法鉴定表明,构建的片段大小与预期相符,测序结果表明,所构建的质粒中重构酶序列正确。将质粒转化至大肠杆菌BL21(DE3)中,对鉴定正确的克隆进行小量诱导表达,表达结果表明所构建的重构酶Ply187KS-Z5在上清中为可溶性表达,蛋白大小约为58 kDa,Ply187-KS约37 kDa,二者均与预期相符(图1)。
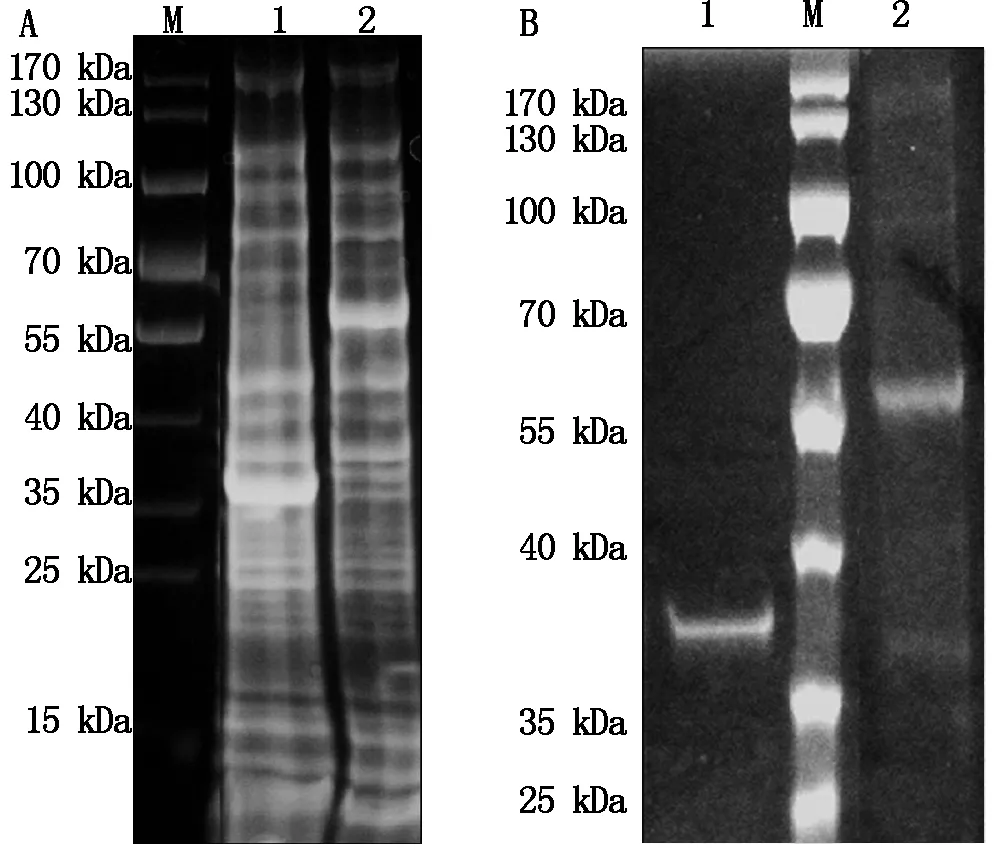
A.表达上清;B.纯化蛋白;M.蛋白分子量;1.Ply187-KS;2.Ply187KS-Z5。A.Supernatant of whole expression strain; B. Purified protein;M.Protein Marker; 1.Ply187-KS;2.Ply187KS-Z5.
2.2 重构酶的酶活性检测
对纯化的裂解酶Ply187-KS及重构酶Ply187KS-Z5进行裂解活性鉴定,将纯化蛋白均点样于金黄色葡萄球菌 ATCC25923平板,作用8 h后观察,重构酶Ply187KS-Z5及Ply187-KS均能裂解金黄色葡萄球菌,从图2-A中可以看到明显的抑菌圈,即结构域的重组并没有影响裂解酶对金黄色葡萄球菌的抑菌效果。同样将重构酶作用于李斯特菌时(图2-B),其与裂解酶LysZ5均能产生透明的裂解圈,与此同时,Ply187-KS不能够裂解李斯特菌,LysZ5对金黄色葡萄球菌无裂解作用。由此可见,重构酶Ply187KS-Z5能够同时裂解金黄色葡萄球菌及李斯特菌。

A.金黄色葡萄球菌;B.李斯特菌。A.Staphylococcus aureus; B.Listeria monocytogenes.
2.3 MIC检测最佳抑菌浓度
BCA法测定蛋白浓度,其纯化蛋白浓度均高于1 mg/mL,纯化效率较高。通过不同时间测定OD600表明,裂解酶Ply187-KS及重构酶Ply187KS-Z5的MIC分别为40,48 μg/mL。 因此,在应用中以其MIC为参照标准。
2.4 在食品中的抑菌效果评价
将裂解酶Ply187-KS及重构酶Ply187KS-Z5分别应用于生牛肉表面,分析其在表面的抑菌活性,结果裂解酶Ply187-KS在作用1 h 后,金黄色葡萄球菌降至1.72 log,重构酶Ply187KS-Z5能够将其降至2.16 log;而在李斯特菌抑菌组中,Ply187KS-Z5能够将其降至2.02 log,Ply187-KS无抑菌效果(图3)。由此表明,重构酶Ply187KS-Z5能够同时抑制金黄色葡萄球菌及李斯特菌在生牛肉表面的污染。

图3 重构酶在生肉表面的抑菌效果分析Fig.3 Inhibition activity of reconstruction lysin on raw beef
3 讨论
针对金黄色葡萄球菌高度耐药以及食源性李斯特菌污染及对化学消毒剂的抵制[14-16],应用噬菌体裂解酶已有报道,然而裂解酶具有高效特异的特征,如何使其能作用快、范围广更能满足不同需求,就需要进行相应的完善。先前的研究中提到裂解酶在多次使用后并不产生抗性[17-18],通过其结合结构域作用于细胞壁,水解细胞壁最终摧毁细胞,作用高效且不易产生抗性。研究首次利用金黄色葡萄球菌噬菌体裂解酶Ply187 N端的内肽酶活性,在其C端引入金黄色葡萄球菌 SH3b区域(Cell wall-binding domain,CBD)及李斯特菌噬菌体裂解酶LysZ5的C末端CBD区域的 191 aa,尝试获得能够同时裂解金黄色葡萄球菌及李斯特菌的重构裂解酶,分析结构域重构是否与全长拥有同样的裂解效果,从而改善多种酶融合导致的表达效果不高或失败等问题[6]。
针对其融合蛋白表达活性分析表明,酶蛋白均有部分可溶性表达,通过表达纯化,能够获得毫克级的蛋白量,先前有研究证实裂解酶抑菌量可达102~108cfu/mg[19],而在研究中其抑菌总量可大于106,表明其良好的杀菌活性。在平板中,重组裂解酶蛋白能够在菌毯表面形成透明裂解圈,在作用1~3 h后,在金黄色葡萄球菌及李斯特菌平板均能观察到抑菌圈逐渐清晰,由此表明,重组酶蛋白能够有效抑制2种菌的生长。对其酶活性分析表明,Ply187-KS针对金黄色葡萄球菌较Ply187KS-Z5更佳,这有可能是蛋白分子量较高后导致的反应活性降低,而对李斯特菌Ply187KS-Z5亦有良好的裂解活性。MIC结果表明,2种蛋白最小抑菌浓度有所不同,其中Ply187-KS较重构酶抑菌工作浓度低。此外,将Ply187-KS及李斯特菌噬菌体裂解酶LysZ5进行等量混合并同时作用2种菌后,其抑菌效果良好,但其用量较重构酶高(分别为 60,80 μg/mL)。研究亦证实,Ply187-KS并不会在多次使用后作用力降低,即不产生抵制现象,从而免除了蛋白类抑菌制剂产生耐受等隐患[6]。由此可见,裂解酶结构域重构可以作为多功能酶蛋白构建的新方法[20],而把裂解酶蛋白进行有效配比亦能获得的复合裂解效果也将是获得广谱抗菌的新途径。此外,亦有将多肽等小分子进行联合构建等方法使酶谱扩大[21],同样早期还有将酶与抗生素联用等发挥协同抗菌等的研究[22],这些不仅能放大酶的作用同时也会降低抗生素的用量,都将会给裂解酶产品的开发提供依据。
将重构酶进行抑菌应用效果分析,在作用1 h后,能够分别抑制金黄色葡萄球菌及李斯特菌的生长,Ply187-KS及Ply187KS-Z5均能够抑制金黄色葡萄球菌,作用效果相当,但同时也能够有效抑制2种病原菌的生长,目前还没有将2种菌进行重构的报道,从而表明其在广谱活性研发方面,结构域的重组将具有良好的开发潜力。目前,已有嵌合裂解酶如ClyS、P128等进入了临床试验阶段,美国Contrafect公司也推出针对金黄色葡萄球菌的酶产品CF-301,因此,通过结构域的重新结合将有可能获得更为高效的多功能酶产品。
由于裂解作用高效,在30 min就能够发挥效果,且在抑制菌的过程中自身亦会随着时间的增加而降解,因此,无残留不易产生抗性。面对目前的耐药现状,裂解酶显示其较抗生素优越的特征,在未来抗菌药物开发过程中都具有潜在的价值,而结构域重构能够使酶获得多重功能且不影响其活性,必将成为新型功能酶合成的全新方式。
[1] Pastagia M,Schuch R,Fischetti V A,et al.Lysins:the arrival of pathogen-directed anti-infectives[J].Journal of Medical Microbiology,2013,62(10):1506-1516.
[2] Schmelcher M,Donovan D M,Loessner M J.Bacteriophage endolysins as novel antimicrobials[J].Future Microbiology,2012,7(10):1147-1171.
[3] Schuch R,Pelzek A J,Raz A,et al.Use of a bacteriophage lysin to identify a novel target for antimicrobial development[J].PLoS One,2013,8(4):e60754.
[4] Zhang H,Bao H,Billington C,et al.Isolation and lytic activity of theListeriabacteriophageendolysin LysZ5 againstListeriamonocytogenesin soya milk[J].Food Microbiology,2012,31(1):133-136.
[5] Obeso J M,Martinez B,Rodriguez A,et al.Lytic activity of the recombinant staphylococcal bacteriophage Phi H5 endolysin active againstStaphylococcusaureusin milk[J].International Journal of Food Microbiology,2008,128(2):212-218.
[6] Singh P K,Donovan D M,Kumar A.Intravitreal injection of the chimeric phage endolysin Ply187 protects mice fromStaphylococcusaureusendophthalmitis[J].Antimicrobial Agents and Chemotherapy,2014,58(8):4621-4629.
[7] Croux C,Ronda C,López R,et al.Interchange of functional domains switches enzyme specificity:construction of a chimeric pneumococcal-clostridial cell wall lytic enzyme[J].Molecular Microbiology,1993,9(5):1019-1025.
[8] Oshida T,Sugai M,Komatsuzawa H,et al.AStaphylococcusaureusautolysin that has an N-acetylmuramoyl-L-alanine amidase domain and an endo-beta-N-acetylglucosaminidase domain:cloning,sequence analysis,and characterization[J].Proceedings of the National Academy of Sciences of the United States of America,1995,92(1):285-289.
[9] Sheehan M M,García J L,López R,et al.Analysis of the catalytic domain of the lysin of the lactococcal bacteriophage Tuc2009 by chimeric gene assembling[J].FEMS Microbiology Letters,1996,140(1):23-28.
[10] Milohanic E,Jonquières R,Cossart P,et al.The autolysin Ami contributes to the adhesion ofListeriamonocytogenesto eukaryotic cells via its cell wall anchor[J].Molecular Microbiology,2001,39(5):1212-1224.
[11] Becker S C,Foster-Frey J,Stodola A J,et al.Differentially conserved staphylococcal SH3b_5 cell wall binding domains confer increased staphylolytic and streptolytic activity to a streptococcal prophage endolysin domain[J].Gene,2009,443(1/2):32-41.
[12] Horgan M,O′flynn G,Garry J,et al.Phage lysin LysK can be truncated to its CHAP domain and retain lytic activity against live antibiotic-resistant staphylococci[J].Applied and Environmental Microbiology,2009,75(3):872-874.
[13] Schmelcher M,Shabarova T,Eugster M R,et al.Rapid multiplex detection and differentiation ofListeriacells by use of fluorescent phage endolysin cell wall binding domains[J].Applied and Environmental Microbiology,2010,76(17):5745-5756.
[14] 张志军,曹海燕,刘延媛,等.医院感染金黄色葡萄球菌耐药表型与耐药基因研究[J].中华医院感染学杂志,2015,25(9):1924-1926.
[15] 赵 薇,刘桂华,王艳秋,等.食品中单核细胞增生性李斯特菌污染及耐药状况调查[J].中国卫生检验杂志,2012(6):1394-1395.
[16] Romanova N,Favrin S,Griffiths M W.Sensitivity ofListeriamonocytogenesto sanitizers used in the meat processing industry[J].Applied and Environmental Microbiology,2002,68(12):6405-6409.
[17] Rodríguez-Rubio L,Martínez B,Rodríguez A,et al.The phage lytic proteins from theStaphylococcusaureusbacteriophage vB_SauS-phiIPLA88 display multiple active catalytic domains and do not trigger staphylococcal resistance[J].PLoS One,2013,8(5):e64671.
[18] Shen Y,Mitchell M S,Donovan D M,et al.Phage-based Enzybiotics[M]//Hyman P,Abedon S T.Bacteriophages in health and disease.Wallingford,UK:CAB International,2012:217-239.
[19] Fukushima T,Yao Y,Kitajima T,et al.Characterization of new L,D-endopeptidase gene productCwlK(previous YcdD) that hydrolyzes peptidoglycan inBacillussubtilis[J].Molecular Genetics and Genomics,2007,278(4):371-383.
[20] Wang S,Gu J,Lv M,et al.The antibacterial activity ofE.colibacteriophage lysin lysep3 is enhanced by fusing theBacillusamyloliquefaciensbacteriophage endolysin binding domain D8 to the C-terminal region[J].Journal of Microbiology,2017,55(5):403-408.
[21] Ma Q,Guo Z,Gao C,et al.Enhancement of the direct antimicrobial activity of Lysep3 againstEscherichiacoliby inserting cationic peptides into its C terminus[J].Antonie Van Leeuwenhoek,2017,110(3):347-355.
[22] Djurkovic S,Loeffler J M,Fischetti V A.Synergistic killing ofStreptococcuspneumoniaewith the bacteriophage lytic enzyme Cpl-1 and penicillin or gentamicin depends on the level of penicillin resistance[J].Antimicrobial Agents and Chemotherapy,2005,49(3):1225-1228.

