玉米ZmMGT0基因过表达载体的构建及拟南芥遗传转化研究
李洪有,张素芝,陈庆富
(1.贵州师范大学 荞麦产业技术研究中心,贵州 贵阳 550001;2.四川农业大学 玉米所,农业部西南玉米生物学与遗传育种重点实验室,四川 成都 611130)
镁是叶绿素的重要组成成分和超过300种酶的激活剂,参与了植物光合作用、呼吸作用、N代谢等众多重要的生理代谢过程[1-2]。镁缺乏将会抑制植物光合作用,同化物由“源”器官向“库”器官的分配,进而影响植物的正常生长发育,并最终影响农产品的产量与品质[3-4]。研究表明,CorA/MRS2/MGT-型镁离子转运蛋白在生物体镁离子平衡中起着重要作用[5-9]。
在植物中,CorA/MRS2/MGT-型镁离子转运蛋白基因已在拟南芥、水稻、玉米、铁皮石斛、巴西橡胶树中克隆[10-14],但有关该类蛋白的功能研究主要集中在拟南芥中。研究表明,几个拟南芥MRS2/MGT-型镁离子转运蛋白在拟南芥低镁胁迫抵抗中起着重要作用。Deng等[15]在烟草中的研究发现,过表达拟南芥AtMGT1基因增加了转基因烟草植株根对Mg2+的吸收,增强了转基因植株对低镁胁迫的抵抗。Gebert等[16]对拟南芥CorA/MRS2/MGT家族基因的T-DNA插入突变体进行分析时发现,mrs2-7植株不能在Mg2+浓度低于50 μmol/L 的培养条件下正常生长,表明AtMRS2-7/AtMGT7是拟南芥在低镁环境下正常生长发育所必需的。Mao等[17]研究发现,AtMRS2-4/AtMGT6在拟南芥根中的表达受低镁胁迫诱导,且在低镁环境下其RNAi植株的根和叶中的Mg2+积累量均低于野生型植株,其生长受到的抑制明显强于野生型植株,表明AtMRS2-4/AtMGT6介导的Mg2+吸收是拟南芥在低镁环境下正常生长发育所必需的。最近,Oda等[18]通过对低镁胁迫下EMS诱变的拟南芥M2群体筛选进一步证明AtMRS2-4/AtMGT6和AtMRS2-7/AtMGT7是拟南芥在低镁环境中正常生长发育所必需的。
虽然研究已经表明,拟南芥CorA/MRS2/MGT-型镁离子转运蛋白基因在抵抗拟南芥低镁胁迫中起着至关重要的作用,但该类基因在其他植物,尤其在作物中是否具有相关作用还不清楚。前面的研究发现,玉米基因组中有12个CorA/MRS2/MGT-型镁离子转运蛋白基因,其中ZmMGT10(基因ID:GRMZM2G018706)具有镁离子转运功能,其在根中特异性表达,且表达受缺镁胁迫诱导,暗示其可能在抵抗植物低镁胁迫中起作用[13]。本研究通过构建ZmMGT10的过表达载体,在拟南芥中过表达该基因来研究它是否具有抵抗低镁胁迫的功能。
1 材料和方法
1.1 试验材料
植物材料:野生型拟南芥(生态型为Col-0);菌株:大肠杆菌DH5α、根癌农杆菌EHA105;载体:克隆载体pMD19-T、植物表达载体PCMBIA2300-eGFP;质粒:pMD19-T∷ZmMGT10(农业部西南玉米生物学与遗传育种重点实验室保存)。
1.2 试验方法
1.2.1ZmMG10植物过表达载体构建 根据ZmMGT10基因cDNA序列和PCMBIA2300-eGFP载体多克隆位点特征,设计带有KpnⅠ酶切位点的上游引物ZmMGT10-FO(5′-ATGGTACCATGGGGAGGTTATCGGGAAG-3′)和带有PstⅠ酶切位点的下游引物ZmMGT10-RO(5′-ATCTGCAGTCAACTGCCAAGTAGCCTGTTC-3′),以pMD19-T∷ZmMGT10质粒为模板,扩增ZmMGT10基因完整的ORF,将完整的ORF克隆到PCMBIA2300-eGFP载体的KpnⅠ/PstⅠ酶切位点间,得到PCMBIA2300∷ZmMGT10重组植物表达载体。
1.2.2 拟南芥遗传转化 采用冻融法将PCMBIA2300∷ZmMGT10重组质粒转入根癌农杆菌EHA105中,待生长在22 ℃长日照(16 h光照/8 h黑暗)条件下的拟南芥长出花蕾时,利用蘸花法侵染拟南芥(中途多次侵染)[19]。转化完毕后将拟南芥平放并用黑塑料袋盖住,暗培养24 h后重新垂直放置小盆,在22 ℃长日照(16 h光照/8 h黑暗)条件下培养,收获T0种子。
1.2.3 转基因拟南芥阳性苗鉴定 将T0种子用70%的酒精消毒2 min,再用2%的次氯酸钠消毒15 min。消毒后的种子用无菌水冲洗干净,随后将种子用胶头滴管均匀地点在含50 mg/L的卡那霉素MS固体培养基上,并在4 ℃黑暗春化处理3 d,随后移入22 ℃光照培养箱培养。培养14 d后能在平板上正常生长的幼苗鉴定为初步鉴定的转基因阳性苗,并将其移入土壤中,置于人工气候室培养。取1个月大初步鉴定的转基因阳性苗叶片,利用CTAB法提取DNA,利用上游引物35SF:5′-AAGGAAGGTGGCTCCTACAA-3′(CaMV35S启动子序列)和下游引物ZmMGT10R:5′-CGTTAGTCATGAACACCTCG-3′(ZmMGT10序列)对初步鉴定的阳性苗进行基因组PCR检测。单株收获经基因组PCR证实的转基因拟南芥植株的T1种子。播种T1转基因种子,提取T1转基因植株RNA,利用实时荧光定量PCR检测ZmMGT10基因在T1转基因植株中的表达。

1.2.5 转基因拟南芥Mg2+吸收分析 将14 d的野生型和转基因株系#1的T1幼苗转移至含2 mmol/L MgSO4·7H2O全营养液中培养10 d,随后转移到含0 mmol/L MgSO4·7H2O培养10 d。对于时间依赖的Mg2+摄取分析,经Mg2+饥饿处理的野生型和转基因植株移至含0.01,2.00 mmol/L MgSO4·7H2O营养液中培养10,30,60,120,180,240 min,收获根用于Mg2+含量测定。对于浓度依赖的Mg2+摄取分析,经Mg饥饿处理的野生型和转基因植株在含0.00,0.01,0.05,0.10,0.50,1.00,2.00,3.00 mmol/L MgSO4·7H2O营养液中培养2 h,收获各浓度处理下拟南芥的根用于Mg2+含量测定。Mg2+含量测定参照Mao等[17]的方法进行。
2 结果与分析
2.1 ZmMGT10植物过表达载体构建
用KpnⅠ和PstⅠ限制性内切酶分别对ZmMGT10 PCR扩增产物和PCMBIA2300-eGFP(切掉eGFP)进行双酶切,回收目的片段。将回收的ZmMGT10片段和PCMBIA2300-eGFP大片段用T4连接酶进行连接,转化大肠杆菌DH5α,转化子经PCR检测后摇菌提取质粒。质粒用KpnⅠ和PstⅠ进行双酶切,得到了2条预期大小的条带(图1-A)。将阳性克隆送测序公司进行测序,测序结果与ZmMGT10参照序列完全一致,说明ZmMGT10基因的植物过表达载体构建成功,将其命名为PCMBIA2300∷ZmMGT10(图1-B)。
2.2 转基因拟南芥的鉴定
利用冻融法将PCMBIA2300∷ZmMGT10重组质粒转入根癌农杆菌EHA105中,阳性转化子采用花絮侵染法转化野生型拟南芥(Col-0),收获T0转基因种子。T0转基因种子经50 mg/L卡那霉素抗性筛选和基因组PCR鉴定,得到15株转基因阳性植株(图2-A、B),单株收获T1转基因种子。提取T1植株的总RNA,以拟南芥Actin基因为内参基因,对ZmMGT10在转基因植株中的表达进行实时荧光定量PCR检测。结果表明,ZmMGT10在15个转基因株系中均有表达,其中株系#1、#6、#12具有较高表达,选用于后继试验(图3)。

M.DL10000分子标记;1.PCMBIA2300载体酶切回收产物;2.PCMBIA2300∷ZmMGT10重组质粒;3.PCMBIA2300∷ZmMGT10重组质粒酶切产物;4.ZmMGT10酶切回收产物。
M.DL10000 Marker;1.Enzyme digestion product of PCMBIA2300 vector;2.PCMBIA2300∷ZmMGT10 recombinant plasmids;3.Enzyme digestion product of PCMBIA2300∷ZmMGT10 recombinant plasmids;4.Enzyme digestion product ofZmMGT10.
图1PCMBIA2300∷ZmMGT10重组质粒酶切验证(A)及结构(B)
Fig.1Enzymedigestion(A)andstructure(B)ofPCMBIA2300∷ZmMGT10recombinantplasmids
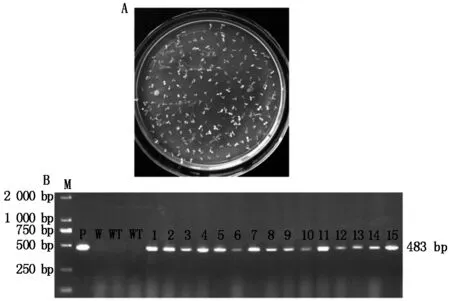
M.DL2000分子标记;P.质粒;W.水;WT.野生型植株;
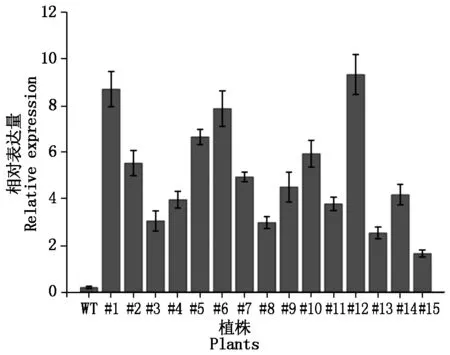
图3 ZmMGT10在转基因拟南芥株系中的表达Fig.3 Expression level of ZmMGT10 in transgenic Arabidopsis lines
2.3 转ZmMGT10基因拟南芥在低镁生长条件下的表型观察及生理指标分析
将14 d的野生型和转基因株系#1、#6、#12的T1拟南芥幼苗转移到全营养液培养3 d,随后2种材料各分为2组,分别在含2 mmol/L MgSO4·7H2O (+Mg)和0.01 mmol/L MgSO4·7H2O (-Mg)的营养液中培养21 d后观察表型。结果如图4-A所示,在Mg充足条件下野生型拟南芥植株和转基因拟南芥植株间没有明显的表型差异,而在低镁条件下,野生型植株的生长略弱于转基因植物,且野生型植株的中龄叶出现缺镁黄化症状。此外,在Mg充足条件下的野生型和转基因植株大小略大于低镁条件下植株的大小,叶色也略绿于低镁条件植株的叶色。根长分析显示,在Mg充足条件下,野生型植株和转基因植株的主根长无明显差异;而在低镁条件下,野生型和转基因拟南芥的根生长明显受到抑制,但转基因植株受到的抑制明显弱于野生型植株(图4-B)。生物量(以鲜质量计)分析显示,在Mg充足条件下,野生型植株和转基因植株的生物量无明显差异;而在低镁条件下,野生型植株和转基因植株的生物量明显降低,但转基因植株的生物量要显著高于野生型植株的生物量(图4-C)。叶片叶绿素浓度(以鲜质量计)分析显示,在Mg充足条件下,野生型植株和转基因植株叶片的叶绿素浓度无明显差异;而低镁生长条件明显减少了野生型和转基因植株叶片的叶绿素浓度,但转基因植株叶片的叶绿素浓度显著高于野生型(图4-D)。这些结果表明,低镁影响了植物的正常生长,过表达ZmMGT10基因增强了转基因拟南芥植株对低镁胁迫的抵抗。

WT.野生型植株;#1、#6、#12.转基因株系1、6、12。不同字母代表差异显著(P<0.05)。图5同。WT.Wild type plants;#1,#6,#12.Transgenic 1,6 and 12 lines.Different letters indicate statistic significant difference at P<0.05.The same as Fig.5.
2.4 转ZmMGT10基因拟南芥在低镁生长条件下Mg2+积累分析
为了探索过表达ZmMGT10增强了转基因拟南芥植株对低镁胁迫的抵抗是否与转基因植株在低镁条件下有更多Mg2+积累有关,检测了Mg充足和低镁生长条件下野生型和转基因植株的根和梢中的Mg2+含量。结果如图5所示,在Mg充足生长条件下,野生型和转基因植株的根和梢中的Mg2+含量(以干质量计)无明显差异;而在低镁生长条件下,2种材料的根和梢中的Mg2+含量均明显低于Mg充足条件下2种材料根和梢中的Mg2+含量,但转基因植株根和梢中的Mg2+含量均显著高于野生型植株。这些结果表明,过表达ZmMGT10增强了转基因拟南芥植株对低镁胁迫的抵抗与转基因植株在低镁条件下有更多的Mg2+积累有关,暗示ZmMGT10可能介导了低镁条件下根对Mg2+的吸收。
2.5 转ZmMGT10基因拟南芥对Mg2+的吸收分析
为了进一步探索转基因拟南芥在低镁条件下比野生型拟南芥积累更多的Mg2+是否与其在低镁条件下有更强的Mg2+吸收有关,野生型和转基因株系#1的T1幼苗被用于时间依赖的和浓度依赖的Mg2+吸收试验。时间依赖的Mg2+吸收分析结果显示,在2.00 mmol/L Mg2+生长条件下,野生型植株和转基因植株具有相似的Mg2+积累模式,而在0.01 mmol/L Mg2+条件下,野生型和转基因植株Mg2+积累量(以干质量计)均明显低于2.00 mmol/L条件下植株的Mg2+积累量,但转基因植株的Mg2+积累量明显高于野生型植株,表明过表达ZmMGT10增强了低镁条件下拟南芥根对Mg2+的吸收(图6-A)。浓度依赖的Mg2+吸收分析结果显示,在高镁浓度条件下,2种材料的Mg2+吸收率(以干质量计)无明显差异,但在低镁条件下,转基因植株的Mg2+吸收率明显高于野生型植株,表明ZmMGT10是在低镁浓度下介导植物根对Mg2+的吸收(图6-B)。这些结果表明,过表达ZmMGT10增强了转基因拟南芥植株对低镁胁迫的抵抗是由于ZmMGT10介导了低镁条件下转基因植株根对Mg2+的吸收。

图5 不同Mg2+浓度处理下野生型和转基因植株根(A)和梢(B)中的Mg2+含量Fig.5 Mg2+ contents in roots (A) or shoots (B) of the wild type and transgenic plants under different concentration Mg2+ treatments

图6 野生型和转基因拟南芥植株时间依赖和Mg2+浓度依赖的Mg2+吸收Fig.6 Time-dependent and concentration-dependent Mg2+ uptake in the roots of wild-type and transgenic plants
3 讨论
镁除了作为叶绿素的重要组成成分外,还是众多酶的激活剂,参与了植株多个重要的生理代谢过程。植物镁缺乏将会影响其正常生长发育,并最终影响产量和品质。因此,提高植物对低镁环境中镁的充分吸收利用,将会增强植物对低镁胁迫的抵抗。
研究已经表明,植物中存在着高亲和和低亲和2种镁离子吸收系统[13,22-27]。在水稻和玉米中利用MRS2/MGT蛋白活性抑制剂三氯化六氨合钴(Co-Hex)发现,MRS2/MGT-型镁离子转运蛋白介导了水稻和玉米根对Mg2+高亲和和低亲和吸收[13,27]。在拟南芥中的研究已证明,2个CorA/MRS2/MGT家族基因AtMGT6和AtMGT7具有抵抗低镁胁迫的能力,是拟南芥在低镁环境下正常生长所必需的[16-18]。AtMGT6编码蛋白定位于质膜上,其主要是通过介导低镁胁迫下根对Mg2+的吸收来增强拟南芥植株对低镁胁迫的抵抗[17]。AtMGT7编码蛋白定位于内膜系统上,其可能是通过调控低镁条件下镁离子在根细胞中的分布来抵抗低镁胁迫[16]。前面的研究发现,玉米ZmMGT10基因是拟南芥AtMGT6基因的同源基因,其在根中特异性表达且表达受缺镁胁迫诱导,暗示其可能也具有抵抗低镁胁迫的能力[13]。为了探讨ZmMGT10是否具有增强植物对低镁胁迫抵抗能力,笔者在拟南芥中对其进行了过表达分析。在Mg充足条件下,野生型植株和转基因植株生长均受到明显抑制,但野生型植物受到的抑制强于转基因植株且野生型植株出现了中龄叶缺镁黄化症状,这与烟草中镁缺乏表型相似[15];进一步分析发现,低镁条件下转基因植株的根长、生物量、叶绿素浓度、根和梢中的Mg2+积累量均明显高于野生型植株,表明在拟南芥中过表达ZmMGT10增强了转基因植株对低镁胁迫的抵抗力。前面在鼠寒沙门氏菌Mg2+转运缺陷突变体MM281中的研究表明,ZmMGT10具有Mg2+转运能力[13],暗示过表达ZmMGT10增强了转基因拟南芥植株对低镁胁迫的抵抗可能与转基因植株具有更强的Mg2+吸收能力有关。时间依赖的和浓度依赖的Mg2+吸收分析发现,在低镁条件下,转基因拟南芥植株的确比野生型植株具有更高的Mg2+吸收率。这些结果表明,ZmMGT10基因与拟南芥同AtMGT6基因一样,是通过介导低镁条件下根对Mg2+的吸收来增强植物对低镁胁迫的抵抗。
综上所述,过表达玉米ZmMGT10基因增强了低镁条件下转基因拟南芥植株根对Mg2+的吸收,进而增强了转基因植株对低镁胁迫的抵抗。
[1] Cowan J A.Structural and catalytic chemistry of magnesium-dependent enzymes[J].Biometals:an International Journal on the Role of Metal Ions in Biology,Biochemistry,and Medicine,2002,15(3):225-235.
[2] Hörtensteiner S.Stay-green regulates chlorophyll and chlorophyll-binding protein degradation during senescence[J].Trends in Plant Science,2009,14(3):155-162.
[3] 靳晓琳,马翠兰,陈立松.植物缺镁研究进展[J].亚热带农业研究,2012,8(2):118-122.
[4] 盛翊佳,丁亚文,傅媛烨,等.植物应答镁营养胁迫机理的研究进展[J].植物学研究,2015,4(5):97-106.
[5] Bui D M,Gregan J,Jarosch E,et al.The bacterial magnesium transporter CorA can functionally substitute for its putative homologue Mrs2p in the yeast inner mitochondrial membrane[J].The Journal of Biological Chemistry,1999,274(29):20438-20443.
[6] Szegedy M A,Maguire M E.The CorA Mg2+transport protein ofSalmonellatyphimurium:mutagenesis of conserved residues in the second membrane domain [J].Journal of Biological Chemistry,1999,274(44):36973-36979.
[7] Graschopf A,Stadler J A,Hoellerer M K,et al.The yeast plasma membrane protein Alr1 controls Mg2+homeostasis and is subject to Mg2+-dependent control of its synthesis and degradation[J].Journal of Biological Chemistry,2001,276(19):16216-16222.
[8] Lee J M,Gardner R C.Residues of the yeast ALR1 protein that are critical for magnesium uptake[J].Current Genetics,2006,49(1):7-20.
[9] Pisat N P,Pandey A,Macdiarmid C W.MNR2 regulates intracellular magnesium storage inSaccharomycescerevisiae[J].Genetics,2009,183(3):873-884.
[10] Li L,Tutone A F,Drummond R S,et al.A novel family of magnesium transport genes inArabidopsis[J].The Plant Cell,2001,13(12):2761-2775.
[11] Saito T,Kobayashi N I,Tanoi K,et al.Expression and functional analysis of the CorA-MRS2-ALR-type magnesium transporter family in rice[J].Plant & Cell Physiology,2013,54(10):1673-1683.
[12] 张 岗,翟清华,张大为,等.铁皮石斛镁离子转运蛋白基因的克隆及表达分析[J].中草药,2014,45(23):3443-3448.
[13] Li H,Du H,Huang K,et al.Identification,and functional and expression analyses of the CorA/MRS2/MGT-Type magnesium transporter family in maize[J].Plant & Cell Physiology,2016,57(6):1153-1168.
[14] 阳江华,秦云霞,方永军,等.巴西橡胶树镁离子转运蛋白基因HbMGT10的克隆及表达分析[J].热带作物学报,2016,37(12):2353-2358.
[15] Deng W,Luo K,Li D,et al.Overexpression of anArabidopsismagnesium transport gene,AtMGT1,inNicotianabenthamianaconfers Al tolerance[J].Journal of Experimental Botany,2006,57(15):4235-4243.
[16] Gebert M,Meschenmoser K,Svidová S,et al.A root-expressed magnesium transporter of theMRS2/MGTgene family inArabidopsisthalianaallows for growth in low-Mg2+environments[J].The Plant Cell,2009,21(12):4018-4030.
[17] Mao D,Chen J,Tian L,et al.Arabidopsistransporter MGT6 mediates magnesium uptake and is required for growth under magnesium limitation[J].The Plant Cell,2014,26(5):2234-2248.
[18] Oda K,Kamiya T,Shikanai Y,et al.TheArabidopsisMg transporter,MRS2-4,is essential for Mg homeostasis under both low and high Mg conditions[J].Plant & Cell Physiology,2016,57(4):754-763.
[19] Clough S J,Bent A F.Floral Dip:a simplified method for agrobacterium-mediated transformation ofArabidopsisthaliana[J].Plant Journal,1998,16(6):735-743.
[20] Tocquin P,Corbesier L,Havelange A,et al.A novel high efficiency,low maintenance,hydroponic system for synchronous growth and flowering ofArabidopsisthaliana[J].BMC Plant Biology,2003,3:2.
[22] Leggett J E,Gilbert W A.Magnesium uptake by soybeans[J].Plant Physiology,1969,44(8):1182-1186.
[23] Maas E V,Ogata G.Absorption of magnesium and chloride by excised corn root[J].Plant Physiology,1971,47(3):357-360.
[24] Joseph R A,Vanhai T.Kinetics of potassium and magnesium uptake by intact soybean roots[J].Physiologia Plantarum,1976,36(3):233-235.
[25] Rengel Z,Robinson D L.Competitive Al3+inhibition of net Mg2+uptake by intactLoliummultiflorumroots[J].Plant Physiology,1989,91:1407-1413.
[26] Tanoi K,Kobayashi N I,Saito T,et al.Application of Mg-28 to the kinetic study of Mg uptake by rice plants[J].Journal of Radioanalytical and Nuclear Chemistry,2013,296(2):749-751.
[27] Tanoi K,Kobayashi N I,Saito T,et al.Effects of magnesium deficiency on magnesium uptake activity of rice root,evaluated using (28) Mg as a tracer[J].Plant and Soil,2014,384(1/2):69-77.

