自体乳糜脂肪治疗增生性瘢痕的临床探究
王 斐,陈敏亮,赖琳瑛,梁黎明,周桂文,周运超
(1.解放军医学院 北京 100853;2.解放军总医院第一附属医院烧伤整形第四病区 北京 100037)
瘢痕的形成多由外伤及感染引起,是皮肤创伤后组织自然修复的产物。其产生机制较为复杂,瘢痕形成过程中成纤维细胞表达的胶原蛋白代谢机能失去正常的调控机制[1]。目前常用的瘢痕治疗方法包括:手术疗法、物理治疗、激光疗法、药物治疗、压迫疗法、放射疗法、基因疗法等[2]。然而这些治疗方式均有其限制因素如手术疗法可形成新的瘢痕需行二次修复,激光疗法有形成色素沉着的风险,压迫疗法可造成身体不适,放射疗法有造成局部坏死的可能。脂肪组织因其组织相容性好、取材方便、来源丰富、继发损伤小等优势越来越受到医学界各个领域的关注[3]。术后病理学、影像学研究表明,脂肪细胞可改善损伤组织局部微循环进而优化瘢痕重塑微环境[4]。但脂肪移植对增生性瘢痕的临床研究国内鲜有报道。基于此本次研究将制备好的乳糜脂肪注射移植到增生性瘢痕内,观察并研究自体乳糜脂肪移植注射对增生性瘢痕的临床治疗效果及其可能机制。
1 材料和方法
1.1 一般资料:选取2015年8月至2017年9月门诊及住院的瘢痕患者80例为研究对象,共122处病损。其中男性37例,女性43例;年龄20~55岁,平均(35.32±10.11)岁;病史11个月~20年;瘢痕面积1.5~50cm2;瘢痕部位:颜面部34例,躯干部20例,四肢26例;致病原因:外伤24例,烧伤56例。本研究按照赫尔辛基宣言的伦理原则实行,经伦理委员会许可,所有患者均自愿签署知情同意书。
1.2 诊断标准[5]:①瘢痕遍及全身各处,损伤累及真皮层,致病因素为外伤或烧伤等;②早期色鲜红,可伴痛、痒,也可发生破溃或挛缩,后期趋于稳定,不再增生。
1.3 纳入标准及排除标准:纳入标准:①稳定期瘢痕者;②自愿接受治疗并配合长期随访者;③年龄20~55岁,性别不限,病程均大于1年者。排除标准:①瘢痕疙瘩或不稳定瘢痕(破溃、感染等)者;②存在功能障碍需手术治疗者;③曾接受激光、磨削等物理治疗者,或行维A酸、激素注射等化学治疗者;④患者或家族中存在瘢痕体质或色素沉着倾向者;⑤妊娠或哺乳期妇女;⑥内科疾病活动期者。
1.4 器材和药物:20ml注射器5支;2ml注射器5支;1ml注射器5支;三通;吸脂针;脂肪注射用针头。林格氏液(规格:500ml/袋,杭州民生药业有限公司,国药准字号:H33020035);利多卡因注射液(规格:3g/支,晋城海斯制药有限公司,国药准字号:155402H93);肾上腺素(规格:3mg,遂城药业股份有限公司,国药准字号:1H1040425)。
1.5 术前准备:治疗前向患者及家属告知自体乳糜脂肪治疗瘢痕的适应证、治疗流程、持续时间、可能不良反应以及治疗后产生不良结局的可能,即治疗效果不明显甚至发生继发性瘢痕的可能性。术前标记瘢痕脂肪填充范围,抽脂部位为小腹和大腿等脂肪丰富部位。
1.6 乳糜脂肪获取:患者取仰卧位,治疗部位常规碘酒,酒精消毒,铺无菌单。配置肿胀液(林格氏液500ml+利多卡因注射液15ml+肾上腺素1.3ml),依术前站立位标记的预抽脂范围,沿皮纹方向切开,长约0.5cm,将肿胀液注入标记区的皮下脂肪层,再用20ml注射器回抽10ml(注射器内负压值约为-60kPa),抽吸术区,将获取的脂肪用林格氏液过滤、清洗、纯化,将粗大的结缔组织剔除,通过孔径为0.8mm纳米转换头连接两个注射器,以来回推挤30次的方式行脂肪乳糜化处理,将乳糜化的脂肪装入2ml的注射器内,静置备用。见图1~4。术后挤出供区皮下部分肿胀液,6-0尼龙线缝合封闭切口,无菌纱布加压包扎。
1.7 乳糜脂肪培养:将获取的乳糜脂肪用胰蛋白酶消化后,离心,沉淀弃除上清液,在沉淀物中取约1mm×1mm×1mm大小组织块置于含小牛血清的培养液进行培养。
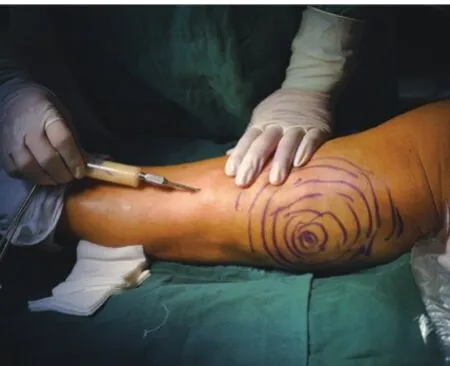
图1 脂肪抽吸

图2 清洗过滤
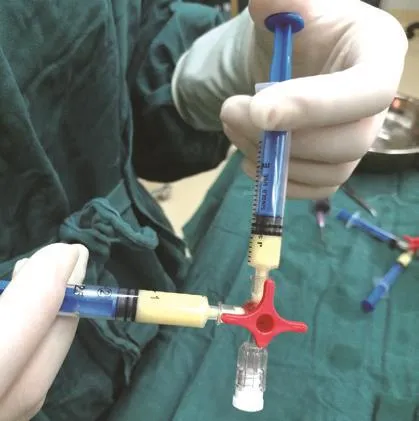
图3 脂肪乳糜化处理
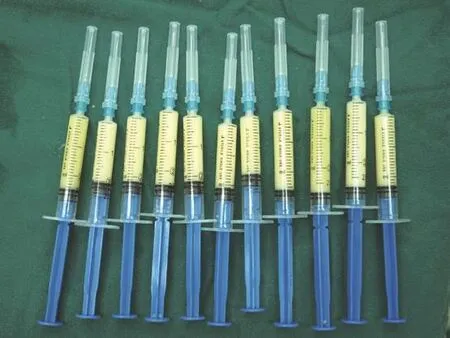
图4 乳糜化脂肪
1.8 乳糜脂肪移植:实验组根据术前标记填充部位给予局部麻醉,于瘢痕一端切开0.5cm长切口,将制备好的乳糜脂肪用2ml注射器采用边退针边注射的方式注入瘢痕内,每次注射量为0.5ml/cm2,检查无明显出血,无局部血运障碍,用6-0尼龙线缝合封闭切口,无菌纱布包扎。治疗疗程为3次,间隔时间均为2个月。
对照组选取治疗瘢痕附近的瘢痕,预先标记注射范围,在标记的瘢痕范围内用同样的方式注射等量生理盐水。
1.9 疗效判定:复诊时由同一医生为患者留取影像资料,采用相同焦距等相机设置参数,相同光照条件下留取影像资料,记录患者瘢痕厚度、质地、颜色、粗糙程度等指标。
观察并记录患者乳糜脂肪注射部位瘢痕的临床表现、患者的自觉症状、取治疗部位瘢痕组织进行病理学检查。
分别于治疗后2个月、4个月、6个月、1年由2名皮肤科专科医师按照3级评价标准独立对治疗效果进行评价。1级(显效):瘢痕体积缩小65%以上,质地柔软,弹性增加,色泽趋于正常皮肤,对外观影响轻微,患者自觉满意且1年后无复发;2级(有效):瘢痕体积缩小30%以上,但小于65%,瘢痕变薄、变软,有较明显色素改变,1年以上无复发,患者对治疗效果不完全满意;3级(无效):瘢痕体积缩小小于30%,质地、颜色无变化或轻微改善,治疗结束后1年内复发,患者对治疗结果不满意。有效率=(显效+有效)例数/总例数×100%。
分别于第1次治疗前(T0)、第1次治疗后2个月(T1)及第2次治疗后2个月(T2)对患者采用温哥华瘢痕量表(Vancouver scar scale, VSS)由2名未参与治疗的皮肤科医师独立双盲评分,分别从色泽、厚度、质地和血管分布等方面,总分为15分,分数越低则表示瘢痕越接近正常皮肤。
1.10 统计学分析:所有数据应用SPSS16.0收录原始数据进行统计分析,计量资料以表示,计数资料以率(%)表示,以重复测量资料的方差分析进行比较分析。P<0.05认为差异具有统计学意义。
2 结果
2.1 乳糜脂肪镜下检测结果:乳糜化的脂肪组织高倍镜下未见到成活的脂肪细胞,见图5~6;体外培养5d后可看到条索状成簇状生长的细胞群(脂肪干细胞、脂肪前体细胞、细胞外基质),见图7~8。

图5 乳糜化的脂肪细胞(200×)

图6 培养5d后脂肪组织(200×)
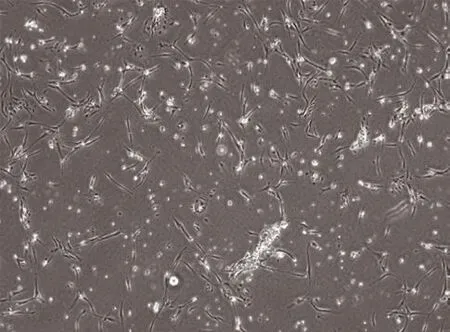
图7 培养5d后脂肪组织(200×)

图8 培养5d后脂肪组织(200×)
2.2 患者一般情况:本研究中所有患者经过3次治疗后,67例显效,8例有效,5例无效,总有效率为93.75%。1次治疗后,患者瘢痕颜色略淡,硬度减低,自觉症状减轻。疗程结束,随访半年以上,瘢痕明显软化、变平,无明显凸起部位,疗效稳定未见复发。
治疗术中采取供皮区注射膨胀液可引起局部胀痛、麻木、感觉减退,数天后可自行缓解;可出现血肿、瘙痒、局部皮肤瘀斑,但均可自行缓解;少数患者会出现局部皮下结节,极少数患者脂肪瘤形成。
2.3 两组VSS评分比较结果:实验组治疗后VSS评分均低于治疗前,差异有统计学意义(P<0.05);对照组治疗后VSS评分与治疗前比较,差异无统计学意义(P>0.05)。见表1。

表1 两组VSS评分比较 (分,x¯±s)
3 典型病例
3.1 病例1,女,24岁,车祸伤,于2年前行双上肢植皮。现患者左手背移植皮片皱缩,第四掌骨近端皮片与肌腱粘连,左手伸直时该处皮片凹陷明显,植皮皮片缝合处瘢痕色红、质硬。本次共接受3次自体乳糜脂肪填充治疗,治疗间隔时间为2个月,治疗剂量为0.5ml/cm2。3次治疗后患者瘢痕色泽趋于正常肤色,弹性增加,柔韧度增加。1年后复诊,疗效稳定,瘢痕未复发。见图9。

图9 病例1,左手背瘢痕治疗前后
3.2 病例2,女,40岁,全身多处酒精烧伤后3年余,面颈部及双上肢大面积增生性瘢痕,呈淡红色,质地硬,高出皮肤表面,脂肪移植注射部位为下颌缘,3次治疗后瘢痕变薄,色泽接近于正常肤色,瘢痕弹性增加,间隔时间为2个月,治疗完成半年后患者临床症状消失,瘢痕红色减退,厚度减低,趋于平坦、软化。见图10。

图10 病例2,烧伤后面部增生性瘢痕治疗前后
3.3 病例3,女,42岁,于6年前被黑火药烧伤全身各处,
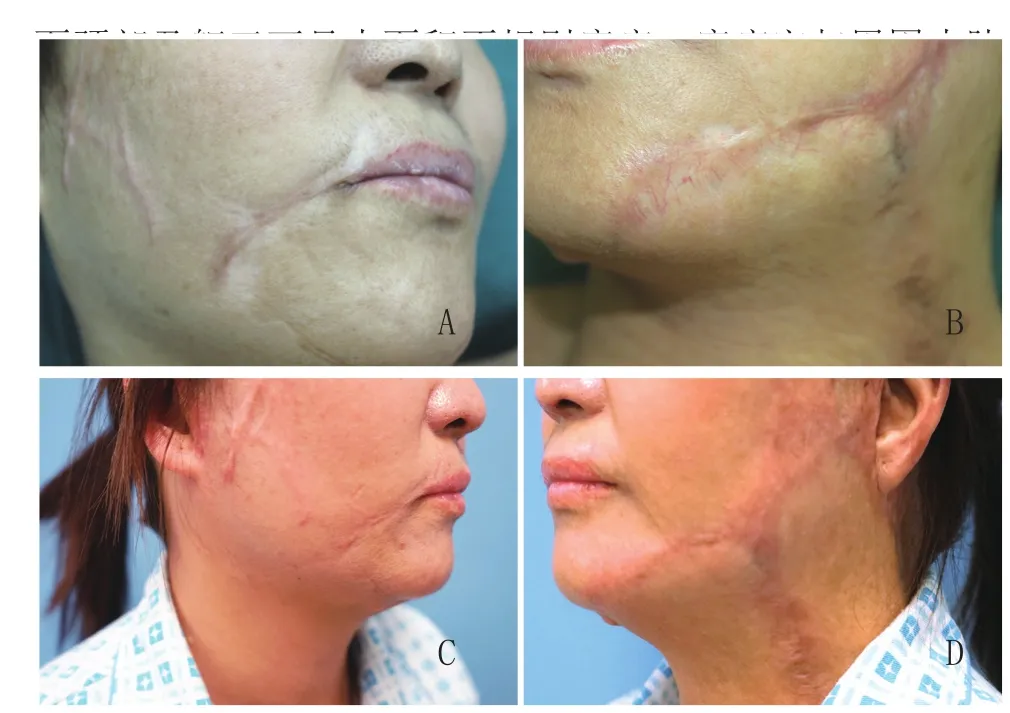
图11 病例3,烧伤后面部增生性瘢痕治疗前后
4 讨论
脂肪组织具有易获取、来源丰富、创伤小、无免疫反应及异物反应、良好的生物相容性、手术时间短、机械损伤小、成活率高、可控性强等优势[6],近年来做为软组织填充物已广泛应用于临床。翻阅文献发现脂肪组织中除含有大量脂肪细胞(50%~60%)外还有细胞外基质、间充质干细胞(10%)等。脂肪细胞生长过程如下:间充质干细胞-脂肪母细胞-前脂肪细胞-不成熟脂肪细胞-成熟脂肪细胞[7]。人脂肪中首次分离出脂肪源性干细胞便受到研究者们关注[8],脂肪干细胞不仅具有多项分化功能即能向脂肪细胞、软骨细胞、成骨细胞、内皮细胞等定向分化[9],还可分泌血管内皮生长因子(vascular endothelial growth factor,VEGF)、碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF)、肝细胞生长因子(hepatocyte growth factor, HGF)等进而调节组织再生及修复[10],其还具有抗氧化作用,可以抵抗在任何状态下自由基形成的皮肤损伤[11]。间充质干细胞通过旁分泌作用主要分泌三类物质:细胞外基质(extracellular matrixc, ECM)类、生长因子类、炎性因子及趋化因子等。这些物质在面部年轻化、创伤修复中起到很好的治疗效果。生长因子(TGF-β1)可抑制肥大细胞活性,促进基基质金属蛋白酶(MMPs)表达,使瘢痕重构进而得到一定程度的缓解,当脂肪组织受到机械损伤后,间充质干细胞能够更好地暴露进而发挥其作用;细胞外基质ECM,是组成间质和上皮血管中基质的不溶性结构,是细胞、组织和器官赖以生存的“微环境”,以保证细胞、组织和器官的正常功能以应对各种生理性和病理性刺激[12]。既往研究发现脂肪细胞外基质中含有瘦素、脂联素、抵抗素、白介素-6,肿瘤坏死因子等,还有转化生长因子-β(transforming growth factor-β,TGF-β)、白细胞介素(IL)、IFG、VEGF、PAI、LPL、TNF[13]等。一方面,可促进血管内皮细胞增殖,使血管增生,改善瘢痕内成纤维细胞、胶原蛋白的微环境,改善局部微循环;另一方面,脂肪移植后瘢痕内纤维母细胞增殖加快,其分泌胶原复合物,可促进真皮组织的修复,增加真皮组织弹性[14]。多种因素共同作用可有效改善皮肤质地,且其组成成分是随微环境变化动态调整的,以适应细胞间信号传导、通讯及迁移等不同需求。这种动态精确调控ECM,在人体组织修复中起到十分关键的作用。有研究者在动物模型上已经证实了ECM在组织修复过程中对瘢痕形成的调控作用。
本次研究发现乳糜脂肪内已无成活的脂肪细胞。这也从某种程度上证明了乳糜脂肪移植治疗增生性瘢痕起主要治疗效果的物质并非成熟脂肪细胞,可能与脂肪间充质干细胞、细胞外基质和脂肪前体细胞有关。脂肪细胞不仅仅是人们通常认识的储存脂质的场地,还具有分泌功能[15]。成熟的脂肪细胞可特异性或非特异性分泌大量细胞因子如瘦素(Leptin)、脂联素(Adiponectin)、肿瘤坏死因子(tumour necrosis factor-al-pha, TNF)、白细胞介素6(Interleukin-6)、抵抗素、干扰素等[16],这些物质对创伤愈合、皮肤质地的改善可起到一定的治疗效果,对瘢痕的生长起到一定的抑制作用。瘦素可与特异性受体结合,活化复杂的细胞内信号途径[17],参与皮肤、黏膜等创面修复过程[18];抵抗素水平在烧伤患者体内明显升高,反应了全身和局部炎症反应的开始,也预示着创面愈合开始启动[19];肿瘤坏死因子可诱导成纤维细胞的的凋亡[20],还可抑制增生性瘢痕内成纤维细胞的过度分泌[21];白细胞介素6中和抗体处理后可抑制成纤维细胞分泌胶原蛋白[22];r-干扰素在瘢痕的治疗中应用较为成熟,实验证明r-干扰素能抑制瘢痕中成纤维细胞的增殖,下调Ⅰ、Ⅲ型胶原蛋白的表达,拮抗TGF-β的作用,是瘢痕形成过程中的负性调控因子[23]。
既往无创注射治疗瘢痕主要是调控瘢痕内成纤维细胞和胶原蛋白的分泌及合成[24],可使增生性瘢痕厚度变薄,质地柔软,弹性增加,色泽趋于正常化。本次研究结果显示乳糜脂肪对增生性瘢痕的治疗效果是肯定的,为瘢痕的治疗提供了新思路,但治疗增生性瘢痕的过程中究竟是由哪种物质在起主导作用仍需进一步研究。
自体脂肪移植操作相对简单,但仍存在各种各样的不足,注射时有损伤神经、肌肉、腺体及血管的可能;面部自体脂肪移植时,颗粒脂肪可进入血管导致患者失明、休克、偏瘫,严重者甚至死亡;自体脂肪抽取、处理或移植过程中处理不当可能引起感染甚至局部坏死,可导致局部硬结、疼痛[25]等不良反应。因此,脂肪移植注射过程中,要规范化、严格无菌操作、熟练基本解剖结构。
[1]García AM,Vila TO,Ferrándiz L,et al.Hypertrophic and Keloid Scars After the Application of 5% Imiquimod Cream:A Report of 2 Cases[J].Actas Dermosif i liogr,2014,105(8):795-797.
[2]刘晓燕.瘢痕治疗的策略回顾及进展[J].中国美容整形外科杂志,2016,27(11):641-644.
[3]谢芸,郑丹宁,刘凯,等.自体脂肪移植综合技术在面部轮廓整形中的应用[J].中华整形外科杂志,2010,26(3):178-181.
[4]Luiz Charles-de-Sá,Natale Ferreira Gontijo-de-Amorim,Christina Maeda Takiya,et al.Antiaging Treatment of the Facial Skin by Fat Graft and Adipose-Derived Stem Cells[J].Plast Reconstr Surg,2015,135(4):999-1009.
[5]王炜.整形外科学[M].杭州:浙江科学技术出版社,2007:428.
[6]李劼.基质血管成分细胞(SVF)辅助自体脂肪移植的临床应用与实验研究[D].广州:南方医科大学,2012.
[7]张绪生,刘毅,宋玫.自体脂肪移植的临床应用[J].中国美容整形外科杂志,2010,21(2):88-90.
[8]Harrop AR,Ghahary A,Scott PG,et al.Regulation of collagen synthesis and mRNA expression in normal and hypertrophic scar fi broblasts in vitro by interferon-gamma [J].J Surg Res,1995,58(5):471-477.
[9]陈犹白,陈聪慧,Qixu Zhang,等.脂肪干细胞分离、纯化和保存:研究进展与未来方向[J].中国组织工程研究,2016,20(10):1508-1520.
[10]Shore EM,Ahn J,Jan de Beur S,et al.Patemally inherited inactivating mutations of the GNAS1 gene in progressive osseous heteroplasia[J].N Engl J Med,2002,346(2):99-106.
[11]傅士博,王雪,温从吉,等.脂肪干细胞在皮肤创伤修复中的研究进展与应用前景[J].中华损伤与修复杂志,2012,7(1):63-66.
[12]Oedayrajsingh-Varma MJ,Van Ham SM,Knippenberg M,et al.Adipose tissuederived mesenchymal stem cellyield and growth characteristics are affected by the tissue-harvesting procedure[J].Cytotherapy,2006,8(2):166-177.
[13]原博,陆树良.脂肪组织中血管基质部分(SVF)的细胞成分及应用[J].组织工程与重建外科杂志,2007,3(1):55-56
[14]徐晓霞,雷泽源.细胞外基质在无瘢痕修复和再生中的研究进展[J].重庆医学,2015,44(24):3445-3447.
[15]周业松,何传果,李栋梁.应用sRGB色彩标准对不同周期染料激光治疗兔耳瘢痕中胶原纤维含量的对比观察[J].激光杂志,2011,32(5):59-60.
[16]张高娜,梁正翠.动物脂肪细胞的研究进展[J].饲料工业,2009,30(2):42-44.
[17]武艳伟,张进进,范力星,等,脂肪干细胞的旁分泌功能及其对皮肤损伤修复的作[J].临床皮肤科杂志,2015,44(6):80-83.
[18]江佳伟,高士争,李冰,等.脂肪细胞分泌因子的研究进展[J].安徽农业科学,2012,40(24):12105-12107.
[19]Frank S,Stallmeyer B,Kampfer H,et al.Leptin enhances wound reepithelialization and constitutes a direct function of leptin in skin repair[J].J Clin Invest,2000,106(4):501-509.
[20]李培兵,金宏.瘦素与创伤愈合[J].生理科学进展,2005,36(3):256-259.
[21]Dasu MR,LaGrone L,Mileski WJ.Alterations in resistin expression after thermal injury[J].J Trauma,2004,56(1):118-122.
[22]Messadi DV,Doung HS,Zhang Q,et al.Activation of NFkappaB signal pathwaysin keloid fibroblasts[J].Arch Dermatol Res,2004,296(3):125-133.
[23]唐悦玲,李小静,李钊.TSG-6对病理性瘢痕成纤维细胞凋亡的影响因素[J].中国美容整形外科杂志,2014,25(3):157-159.
[24]Aurelia Trisliana Perdanasari,张铮,章一新.病理性瘢痕注射治疗的最新进展[J].组织工程与重建外科杂志,2015,11(3):216-220.
[25]万锦麟,鲁峰.颗粒脂肪移植后严重并发症的文献分析[J].中华整形外科杂志,2015,31(3):237-238.

