急性缺血性卒中血管内治疗影像评估中国专家共识
中国卒中学会,中国卒中学会神经介入分会,中华预防医学会卒中预防与控制专业委员会介入学组
卒中是严重威胁我国人口健康和阻碍社会经济发展的重大疾病。其中急性缺血性卒中(acute ischemic stroke,AIS)占所有卒中的70%,我国每年新发AIS患者超过200万。AIS治疗的关键是急性期,静脉溶栓可以改善患者预后,但是对大血管闭塞效果欠佳。随着血管内治疗技术及材料的发展,阳性试验证实了血管内治疗能显著改善颅内大血管闭塞患者预后,降低致残率和死亡率,由此,各国指南相继更新,将机械取栓作为急性前循环大血管闭塞患者的首要治疗方式,并给予最高级别推荐。各国政府以及医疗体系都在致力于改善AIS急救流程,确立相关技术指标,促进此项革命性技术的临床推广。我国也亟需开展AIS血管内治疗研究,实现“量身定制”的卒中急救流程,掌握血管内治疗的关键技术及评估方案。
进行AIS血管内治疗病例选择时,除时间窗外,通过影像评估选择适合的患者是获得良好预后的关键。因此,有必要建立适合的影像评估方案,为AIS血管内治疗患者的术前筛选及术后评估提供指导。
针对当前AIS血管内治疗指南中尚未明确的推荐,以及有待解决的技术方案与影像评估问题,中国卒中学会通过组织本领域专家查阅文献、征求意见并讨论,形成了本次专家共识,旨在结合目前AIS血管内治疗影像评估的最新证据,提出适合中国AIS血管内治疗病例选择及技术操作的影像评估专家指导意见。
1 概述
近年来的5项血管内治疗大型随机对照研究(randomized controlled trial,RCT)最终证实支架取栓可以有效改善发病6~8 h内前循环大血管闭塞导致的AIS患者的临床预后[1-5]。毫无疑问,脑缺血发病至成功再灌注的时间是治疗有效性的基石[6]。然而仅依靠时间窗来评估患者和制定治疗策略是远远不够的。研究之所以取得阳性结果,除了选用了新一代取栓装置外,还应用了影像学技术对患者进行了严格的筛选,主要包括平扫计算机断层扫描(noncontrast computed tomography,NCCT),多模式计算机断层扫描(computed tomography,CT),如CT血管成像(CT angiography,CTA)、CT灌注成像(CT perfusion,CTP),多模式磁共振成像(magnetic resonance imaging,MRI),如弥散加权成像(diffusion weighted image,DWI)、灌注加权成像(perfusion weighted image,PWI)、磁共振血管成像(magnetic resonance angiography,MRA)。这些影像学技术可以排除出血性病变、识别闭塞血管部位以及通过直接或间接征象评估梗死核心灶、缺血半暗带及侧支循环,以此识别通过取栓可能获得良好预后的患者(表1)[7]。
血管内治疗AIS的多中心随机临床试验(Multicenter Randomized CLinical trial of Endovascular treatment for Acuteischemic stroke in the Netherlands,MR CLEAN)[1]、应用动脉内治疗延长AIS溶栓时间(EXtending the time for Thrombolysis in Emergency Neurological Deficits with Intra-Arterial therapy,EXTEND-IA)[2]、前循环近端闭塞小核心梗死灶血管内治疗试验(Endovascular treatment for Small Core and Anterior circulation Proximal occlusion with Emphasis on minimizing CT to recanalization times,ESCAPE)[3]、8 h内前循环卒中应用Solitaire取栓vs最佳药物治疗实现血管内再通比较(Endovascular Revascularization with Solitaire Device Versus Best Medical Therapy in Anterior Circulation Stroke Within 8 Hours,REVASCAT)[4]及Solitaire支架取栓治疗AIS试验(Solitaire™ with the Intention for Thrombectomy as Primary Endovascular Treatment for Acute Ischemic Stroke,SWIFT-PRIME)[5],以上5项阳性试验行血管内治疗前的影像评估主要涉及以下几方面:组织学评价,包括核心梗死区、缺血半暗带;血管影像学评价,包括大血管病变情况、侧支循环。
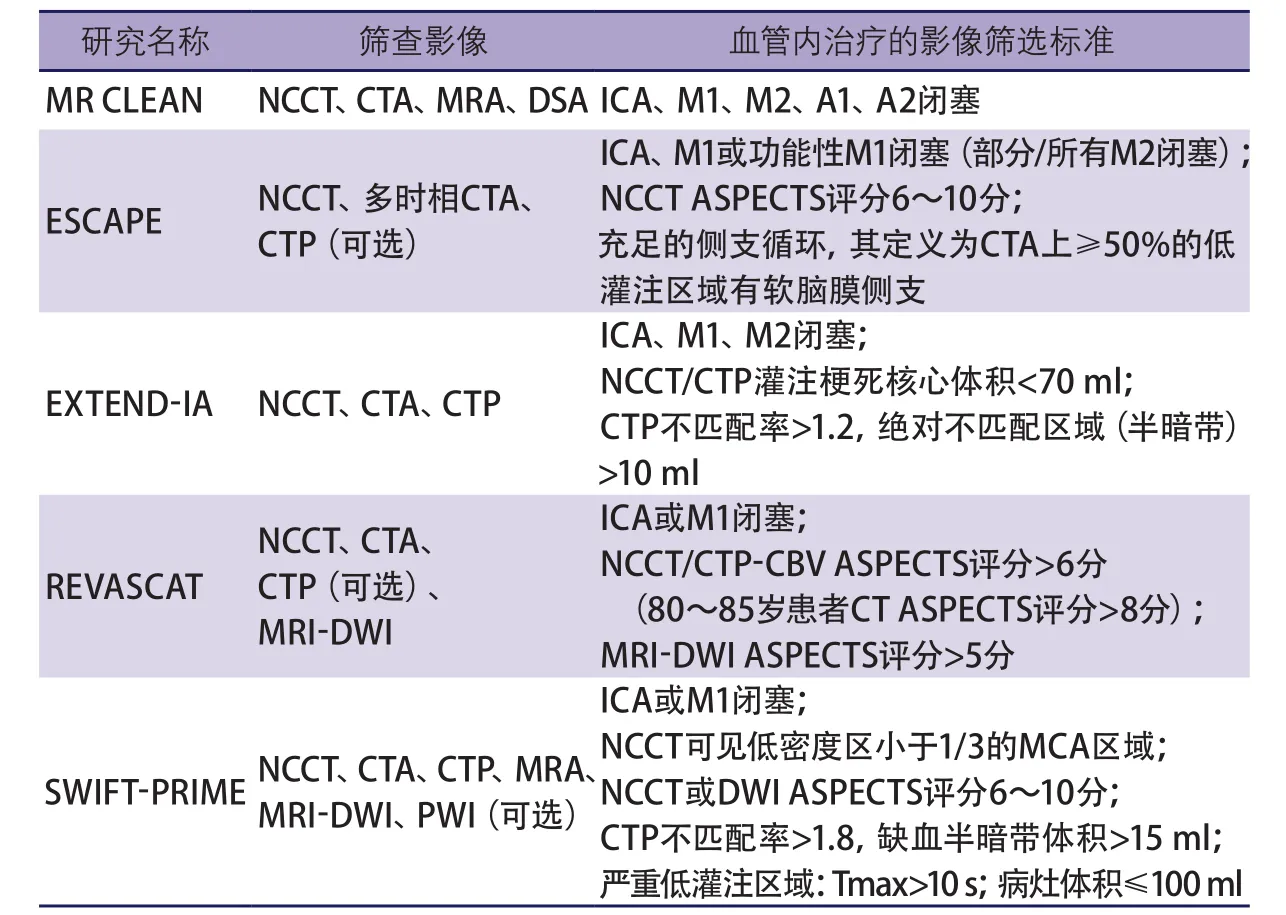
表1 5项急性缺血性卒中血管内治疗试验的影像评估
1.1 脑组织学评价
影像学技术对脑组织学的评价主要包括核心梗死区和缺血半暗区的评价两部分。对于筛选血管内介入治疗的适应证,首要是利用核心梗死区的范围来评估血管内介入治疗的风险,其次是通过缺血半暗带的范围来预测患者的获益。多项临床试验[急性卒中机械取栓术(Mechanical Retrieval and Recanalization of Stroke Clots Using Embolectomy,MR RESCUE)[8],EXTEND-IA[2]和SWIFTPRIME[5]]采用了最小绝对错配比作为血管内治疗的入组标准,以帮助临床决策是否进行血管内治疗。尤其对于发病时间较长的患者,相对小梗死核心、大缺血半暗带者更可能从血管内治疗中获益而出血风险较小。
1.2 脑血管影像学评价
一旦明确有大血管闭塞的存在,就应评估可挽救脑组织的范围。缺血脑组织在闭塞动脉开通前依赖侧支循环而生存,因此侧支循环的好坏一定程度上反映了可挽救脑组织的多少。侧支循环在不同个体之间具有明显的差异,并且能够显著影响梗死进展的速度。既往研究表明侧支循环状态能够显著影响AIS患者血管内治疗后的临床结局[9]。一项系统评价结果提示,AIS侧支循环状态与血管内治疗成功开通有相关性[10]。因此,评价有效的侧支循环能够识别可能从早期血管开通中获益的患者。
本共识将从影像学角度对如何评估大血管闭塞、判定核心梗死区域、评价侧支循环代偿以及缺血半暗带提出相应的推荐意见。
2 大血管闭塞
2.1 概述
近期所有发表的血管内治疗RCT试验都使用无创动脉影像(脑或颈部动脉的CTA或MRA)筛选颈内动脉(intracranial artery,ICA)远端和(或)大脑中动脉(middle cerebral artery,MCA)M1或M2段主干闭塞的患者。这可能是这些试验与前期取栓试验相比获得阳性结果的原因之一。如果无法进行无创动脉影像,在症状发生最初3 h内美国国立卫生研究院卒中量表(National Institutes of Health stroke scale,NIHSS)评分≥9分或者在3~6 h内NIHSS评分≥7分,则提示颅内大动脉闭塞[9-10]。急诊无创动脉影像检查在确定适合急性机械取栓患者时有显著的优势,并且没有额外的禁忌证。
早期识别由大血管闭塞引起的AIS患者,对临床有效进行血管内治疗尤为必要。通常将内径在2 mm及以上的血管划分为大血管,结合血管内治疗情况以及可以通过急性血管内治疗实现血运重建的血管分段,认为将包括颅外段及颅内段在内的ICA、椎动脉(vertebral artery,VA)V1-V4段、基底动脉(basilar artery,BA)、大脑后动脉(posterior cerebral artery,PCA)P1段、大脑前动脉(anterior cerebral artery,ACA)A1段、MCA M1、M2段列为大血管是合理的[11]。闭塞,指血管成像检查中首次造影剂填充时未见造影剂通过或血管显像中断[12]。一项纳入2209例急性AIS患者的回顾性研究通过采集发病24 h内CTA影像数据,将脑血管分为21个动脉片段,研究血管闭塞部位分布与AIS发病的关系,结果显示:前循环血管闭塞更常见(76.1%),颅内段闭塞多于颅外段(30.9%vs 24.6%),近端MCA闭塞发生率高(24.7%),其后依次为ICA颅外段(20.2%)、远端MCA(14.5%)[11]。
基于5大研究的荟萃分析HERMES研究结果汇总1287例前循环急诊血管内治疗的AIS患者(颅内段ICA闭塞274例、MCA M1段闭塞887例、M2段闭塞94例),其中46%的患者90 d功能预后良好[改良Rankin量表(modified Rankin Scale,mRS)评分0~2];亚组分析结果表明机械取栓能够使ICA[比值比(odds ratio,OR)3.96,95%可信区间(confidence interval,CI)1.65~9.48]及MCA M1段(OR2.29,95%CI1.73~3.04)闭塞患者获益;而针对MCA M2段,机械取栓和内科治疗预后无显著差异(OR1.28,95%CI0.51~3.21)[13]。
目前已经明确证实前循环近端大血管闭塞患者可从血管内治疗中获益,但是“近段”与“中段”(非近段)的分界很大程度上取决于血管内治疗的技术[14]。美国心脏学会/美国卒中学会(American Heart Association/American Stroke Association,AHA/ASA)将近端大血管定义为ICA或近端MCA M1段,欧洲卒中组织(European Stroke Organization,ESO)和中国指南中未明确指出前循环大血管范围。
近期发表的一项MCA M2段血管内治疗的荟萃分析纳入8项临床研究,630例AIS患者接受了机械取栓或血栓抽吸在内的血管内治疗,成功再通率[脑梗死溶栓评分(thrombolysis in cerebral infarction,TICI)2b/3级]为78%,3个月mRS评分0~1分的比例为40%、mRS 0~2分的比例为62%;死亡率为11%,术后颅内出血发生率为14%,其中5%为症状性颅内出血[15]。目前,缺少MCA远端闭塞的自然病史,且无内科治疗对照组,证据强度不足,尚不能明确M2段血管内治疗的真实获益。
后循环血管内治疗尚缺乏大型RCT证据支持。2009年的一项前瞻性注册登记研究结果未能显示出血管内治疗的有效性及安全性,68%的患者预后不良[16]。此外,2016年GORY等[17]发表的一项系统综述共纳入16项研究334例患者,均为在发病4.5 h内接受静脉溶栓基础上行血管内治疗的急性后循环AIS患者,血管再通率(TICI 2b/3级)81%、90 d良好功能预后(mRS 0~2分)率为42%、死亡率为30%、症状性颅内出血率为4%。目前,两项针对后循环基底动脉闭塞取栓的RCT研究——基底动脉国际协作研究(Basilar Artery International Cooperation Study,BASICS)(NCT01717755)和中国急性基底动脉闭塞血管内治疗临床试验(Basilar Artery Occlusion Chinese Endovascular Trial,BAOCHE)(NCT02737189)正在进行中。
2.2 大血管闭塞的影像学评估
2.2.1 平扫计算机断层扫描
通过NCCT发现的动脉高密度征是提示大血管闭塞的影像评估方法之一。由于急性血栓形成,血流减慢、停滞,进而在NCCT上可见血管走行区域内密度升高(77~89HU),即所谓的动脉高密度征,介于正常血管(35~60HU)与钙化斑之间(114~321HU),是动脉阻塞的早期征象[2]。
2.2.2 血管成像
血管成像研究显示,相当一部分(19%~39%)AIS患者并没有明确可见的颅内动脉闭塞,而明确的大动脉闭塞是进行血管内治疗的前提。最近的这5项阳性结果的RCT研究均采用了CTA或MRA作为识别前循环近段大动脉闭塞的影像工具,这也是其与过去阴性结果研究的主要区别之一。即使在整体结果阴性的卒中血管内介入治疗研究Ⅲ(Interventional Management of Stroke Ⅲ,IMS-Ⅲ)中[18],使用CTA选择的患者亚组也能够从血管内治疗中显著获益。
CTA影像评估
CTA能够快速无创地评价颅内外血管形态,明确是否存在大血管狭窄或闭塞。CTA评价颅内大动脉狭窄或闭塞的准确性很高,在部分研究中甚至超过数字减影血管造影(digital subtraction angiography,DSA)。CTA识别颅内动脉闭塞的敏感性和准确性分别为92%~100%和82%~100%。CTA除了能够快速明确血管闭塞位置外,还能够确定血管是否合并血管狭窄、钙化斑块以及弓上血管的入路路径是否迂曲,为血管内治疗选择适合的材料和技术方案提供参考依据。
MRA影像评估
MRA是MRI常用的血管检查技术,常用的方法包括时间飞跃法(time of flight,TOF)、相位对比法(phase contrast,PC)和对比增强MRA(contrast enhancement MRA,CEMRA)。超早期AIS患者采用三维时间飞跃法(three dimensions time of flight,3D-TOF),不需要对比剂即可清晰显示颅内大血管及分支。与DSA及CTA相比,MRA无创、简便且更为安全,避免了肾毒性造影剂和电离辐射。MRA能够显示Willis环及其邻近颈动脉和各主要分支,可显示AIS的责任血管,评测血管有无狭窄、闭塞以及病变的程度。但是,MRA容易将次全闭塞诊断成完全闭塞,容易对血管狭窄程度过度评估。此外,因为检查设备的限制,幽闭恐惧、心律失常、体内金属物置入(除颤器、关节置换等)的患者无法行MRA检查。
DSA影像评估
全脑血管造影能够清晰直观地判断闭塞血管及侧支循环情况,指导血管内治疗的操作。但其为有创检查,有一定的风险和禁忌证,不作为常规评估大血管闭塞的操作。当客观条件受限,无法快速有效实施无创血管影像检查,而进行DSA检查较为迅速时,可在行NCCT排除颅内出血后,直接进行DSA判断大血管情况。转运到院的患者有CT及无创血管影像,符合血管内治疗标准及时间窗,预行血管内治疗时,可直接送往导管室行血管影像评估及治疗。
专家共识性意见
·NCCT应作为可疑急性缺血性卒中患者首选的影像筛查方法,以除外出血性脑血管病。
·实施血管内治疗前,尽量使用无创影像检查明确有无颅内大血管闭塞;对可疑大血管闭塞患者,推荐使用一站式CTA+CTP影像检查方案,快速实施术前影像评估,指导血管内治疗。
·发病3 h内、NIHSS评分≥9分或发病6 h内、NIHSS评分≥7分时,提示存在大血管闭塞;无条件实施无创影像评估时,建议NCCT排除颅内出血后,快速进行全脑血管DSA评估血管闭塞情况及侧支循环代偿,选择适合的患者实施血管内治疗。
3 核心梗死
3.1 概述
核心梗死即发生不可逆性损伤的脑组织,指的是与正常脑组织相比,脑血流量下降超过30%的区域,在NCCT上显示为低密度区[19]。梗死核心的大小与患者的临床预后密切相关。梗死核心越小,患者预后良好的可能性越大。有文献报道,与AIS患者良好预后相关的预测指标是梗死核心体积,而不是缺血半暗带[20-21]。同时,评估梗死核心也可预测血管内治疗出现并发症的风险,因此,准确评价梗死核心有助于筛选出适合血管内治疗的卒中患者。
3.2 评估方法
评估核心梗死的影像学指标主要为Alberta卒中项目早期CT评分(Alberta Stroke Program Early CT Score,ASPECTS),其次是梗死核心体积[22]。近期发表的这5项阳性结果临床试验,除了MR CLEAN研究[1]外,其余4项研究[2-5]均对核心梗死有明确纳入标准(表1)。可分为两种:一种应用NCCT/MRI DWI评估,ASPECTS评分≥7分或6分;另一种应用CTP评估的核心梗死体积<70 ml。FEDERAU等[23]纳入109例前循环大血管闭塞行机械取栓术患者,研究早期(发病18 h~5 d)MRI DWI与液体衰减反转恢复序列(fluid attenuated inversion recovery,FLAIR)成像上梗死体积变化,发现对于术后5 d内梗死体积的演变,MRI DWI成像较FLAIR成像更准确。因此评估ASPECTS评分可通过NCCT、CTP及MRI DWI,评估核心梗死体积可通过CTP、MRI DWI及PWI等。有研究显示,ASPECTS评分≥7分对应于梗死体积<70 ml,ASPECTS评分≤3分对应于梗死体积>100 ml[24]。
3.2.1 ASPECTS评分
ASPECTS评分是基于NCCT评估MCA区域早期缺血改变简单而系统的一种方法[22]。将MCA供血区各主要功能区分别赋分(4个皮层下区:尾状核C、豆状核L、内囊IC、岛叶I;6个皮层区,标志为M1-M6)(图1),共计10分,每累及一个区域减去1分,即正常脑CT为10分,MCA供血区广泛梗死则为0分。
为评估后循环梗死患者早期梗死情况,PUETZ等[25]建立了评估后循环的AIS预后早期CT评分(posterior circulation Acute Stroke Prognosis Early CT score,pc-ASPECTS)。pc-ASPECTS总分也是10分:双侧丘脑和小脑各1分,双侧大脑后动脉供血区各1分,中脑和脑桥为2分(图2)。
为了提高组织结构细节的显示,使CT值差别小的两种组织能分辨,可采用不同的窗宽与窗位进行调整。窗宽的宽窄直接影响图像的对比度;窄窗宽显示的CT值范围小,每级灰阶代表的CT值幅度小,因而对比度强,可分辨密度较接近的组织或结构,因此检查脑组织选用窄的窗宽,能够增加不同改变的脑组织之间的辨识度。
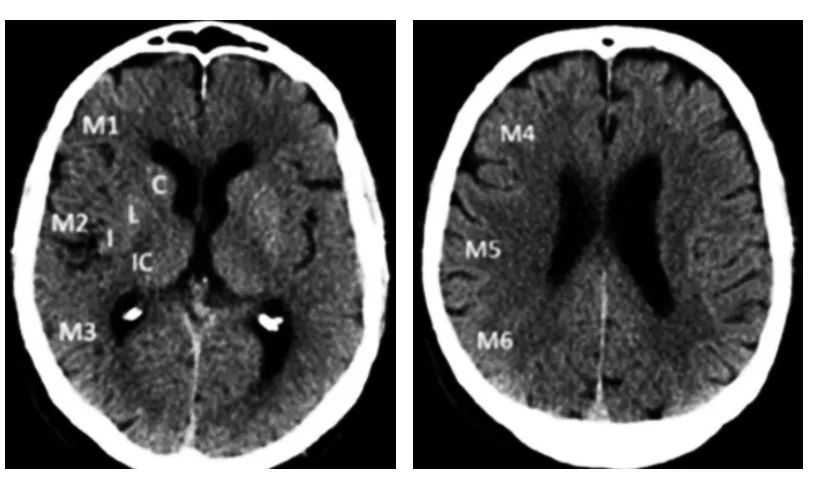
图1 ASPECTS评分中大脑中动脉供血区功能分区
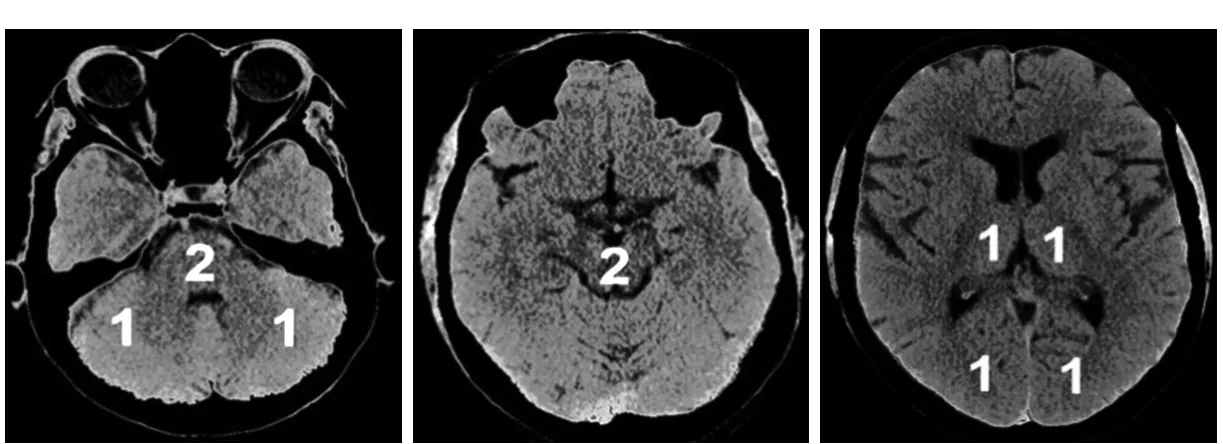
图2 pc-ASPECTS评分中后循环供血区功能分区
3.2.2 血管内治疗相关研究
2015年5大研究发表,证明机械取栓较标准内科治疗有明显的优势。其中,最先发表的MR CLEAN研究中,虽然没有使用ASPECTS限定入组患者,但是亚组分析显示,随着ASPECTS分值的增加,患者获益持续扩大[1]。并且,ASPECTS 0~4分的20例患者中,仅有1例患者的mRS≤2分[6]。
SWIFT-PRIME研究将发病6 h内ASPECTS评分≤5分作为排除标准,ASPECTS评分6~7分和8~10分的患者在预后方面没有显著差异[7]。ESCAPE研究也除外了发病12 h内ASPECTS评分≤5分的患者,结果显示ASPECTS评分6~7分和8~10分的患者行血管内治疗获益无显著差异[23]。而REVASCAT研究的排除标准是基于两种不同影像学方法的ASPECTS评分标准,即CT-ASPECTS评分<7分和DWI-ASPECTS评分<6分,研究结果也同样显示,中等ASPECTS评分(4~6分)患者与高ASPECTS评分(7~10分)患者在良好预后、颅内出血及死亡率方面均无显著差异[26]。
最近一项基于5大研究的所有入组患者术前影像分析的荟萃分析显示,ASPECTS评分>5分患者行机械取栓能够显著获益[27]。
区别于CTA和MRI需要数据后处理过程,ASPECTS评价方法具有简便快捷的优势,然而使用NCCT进行评价的评价者间信度很低,甚至在专家中也是如此[28]。超早期(起病90 min内)影像的信度则更低[29]。并且评价者间信度不仅受CT扫描质量的影响,还取决于ASPECTS评分是按照具体分值还是从是否可治疗(如仅二分类为<6分和≥6分)的层面分析。通过标准化NCCT的影像质量,严格培训评价者,以及将该评价转变为决定治疗的基础影像模式,评价者间信度有可能会得到改善。
3.3 核心梗死与临床预后的相关性
近年来,多项临床试验结果显示,核心梗死体积与患者短期及长期临床预后显著相关。
MR CLEAN亚组分析[30]以及HAUSSEN等[31]的研究结果均表明,CTP评估下的核心梗死体积和ASPECTS评分是功能预后的独立预测因子,ASPECTS评分≥6分及梗死核心体积≤50 ml与良好预后(mRS≤2分)显著相关。YOO等[32]纳入107例前循环近端血管闭塞并行血管内治疗的患者,完成3个月随访,发现最终梗死体积(final infarct volume,FIV)也是功能预后的独立预测指标,梗死体积<50 ml及>90 ml分别与预后良好(mRS≤2分)及预后不良高度相关。
针对发病8 h以内,因ICA末端或MCA闭塞所致的AIS患者,LESLIE-MAZWI等[7]发现经MRI DWI筛选的小核心梗死灶(梗死体积<100 ml)患者,机械取栓后脑组织若成功再灌注,则获得良好预后的可能性更大。因此,对于ASPECTS评分≥6分或核心梗死体积<50 ml的AIS患者,血管内治疗可明显获益,推荐行血管内治疗。
3.4 大面积核心梗死
随着AIS血管内治疗的技术不断改进,很多研究在探讨急性大面积核心梗死患者行血管内治疗的安全性及有效性。按Adama标准,梗死灶直径超过3 cm,或者梗死面积达到20 cm2,并累及2个以上解剖部位即为大面积脑梗死[33]。但对于大面积核心梗死的体积及ASPECTS评分,目前仍无明确界定。
相关研究发现,大面积核心梗死患者行血管内治疗预后不佳,出血概率高。MR CLEAN亚组分析发现,梗死核心体积超过70 ml的患者,血管内治疗组的死亡率(39%)高于内科治疗组(33%)[30]。PROTTO等[34]的研究结果也显示,预后不佳的患者ASPECTS评分显著低于预后良好患者。HAN等[35]也在研究结果中证实,无论是DWI-ASPECTS评分还是梗死核心体积,大面积梗死与不良预后显著相关,并且梗死核心体积的界值为86.2 ml。来自中国的急性前循环缺血性卒中血管内治疗注册研究(Endovascular Treatment for Acute Anterior Circulation Ischemic Stroke Registry,ACTUAL)结果表明,ASPECTS评分<6分是血管内治疗后症状性颅内出血的危险因素,并与不良预后显著相关[36]。
很多研究结果也提示,部分大面积梗死患者可从血管内治疗中获益。REBELLO等[37]研究发现,梗死核心体积大于50 ml的患者行血管内治疗组90 d良好功能预后(mRS≤2)比例显著高于内科治疗组(25%vs0%,P=0.04)。KIM等[26]应用MRI DWI筛选纳入171例患者,将DWI-ASPECTS评分分为中分组(4~6分)与高分组(7~10分)两组,结果提示中分组与高分组在良好预后、症状性颅内出血及死亡率方面无显著差异。中分组中血管成功开通的患者良好预后达到46.5%,未开通的患者中无一例获得良好预后。故作者认为经DWI-ASPECT评分的中分组患者如果符合血管内治疗条件,在行支架取栓时或许不应该被排除。MR CLEAN亚组分析也验证了这一结论,ASPECTS评分5~7分的人群也可从血管内治疗中获益[38]。缺血性卒中血管内治疗研究(Endovascular Treatment in Ischemic Stroke,ETIS)结果也发现,DWI-ASPECTS评分≤6分的患者成功再灌注组的良好预后比例显著高于无再灌注组(38.7%vs17.4%,P=0.002),并且3个月死亡率更低(22.5%vs39.1%,P=0.013)。但同时也发现DWI-ASPECTS评分<5分的患者,无论有无再灌注,均有很低的良好预后率(13.0%vs9.5%,P=0.68)及较高的死亡率(45.7%vs57.1%,P=0.38)[39]。而另一项探讨DWI-ASPECTS评分≤5分的患者机械取栓是否获益的研究显示DWI-ASPECTS评分>2分即为良好功能预后的预测指标[40]。
因此,对于大面积梗死核心患者是否行血管内治疗,目前尚无明确证据,还需要随机临床试验数据来证实。
专家共识性意见
·核心梗死体积与血管内治疗功能预后密切相关,推荐使用NCCT/CTP/MRI DWI评估患者核心梗死体积或计算ASPECTS评分。
·对于ASPECTS评分≥6分或核心梗死体积<50 ml的急性缺血性卒中患者,推荐尽早行血管内治疗。
·对于ASPECTS评分<6分的急性缺血性卒中患者,建议完善更多的影像学检查,评估侧支循环及缺血半暗带情况,指导血管内治疗方案选择。
4 侧支循环
4.1 概述
脑侧支循环是指当大脑的供血动脉严重狭窄或闭塞时,血流通过其他血管(侧支或新形成的血管吻合)到达缺血区,从而使缺血组织得到不同程度的灌注代偿。
按照不同的血流代偿途径,脑侧支循环可以分为三级:一级侧支循环是指通过Willis环的血流代偿;二级侧支循环是指通过眼动脉、软脑膜吻合支及其他相对较小的吻合支之间的血流代偿;三级侧支循环属于新生血管,通常在缺血一定时间后才会形成。
缺血脑组织在闭塞的动脉开通前依赖侧支循环而生存,因此侧支循环的好坏一定程度上反映了可挽救脑组织的多少。侧支循环在不同个体之间具有明显的差异,并且能够显著影响梗死进展的速度。既往研究表明侧支循环状态能够显著影响AIS患者接受血管内治疗后的临床结局,有效的侧支循环评价能够识别可能从早期血管开通中获益的患者。
MR CLEAN研究[1]中,研究者根据CTA显示的基线侧支循环状态将患者分为4级:无(0级)、差(1级)、中等(2级)和好(3级),对每一级患者分为血管内治疗组与对照组,比较两组的90 d预后,结果显示侧支循环对血管内治疗疗效有显著性影响,侧支循环好(3级)的患者从血管内治疗中获益最大(校正后OR3.2,95%CI1.7~6.2);侧支循环差(1级)或无(0级)的患者获益最少,甚至不获益。
针对接受血管内治疗的患者,LENG X等进行了两项系统评价[10,41],分别评价基线侧支循环状态对良好功能预后、症状性颅内出血和血管开通率的影响,两者分别纳入了58项和27项队列研究、病例对照研究或RCT研究的后分析,结果显示好的侧支循环能显著增加AIS患者血管内治疗的成功再灌注率[相对危险度(relative risk,RR)1.28,95%CI1.17~1.40,P<0.001]和血管开通率(RR1.23,95%CI1.06~1.42,P=0.006);同时,好的基线侧支循环与较高的良好功能预后比例、较低的症状性颅内出血率和死亡率相关。
4.2 侧支循环评价
AIS患者临床常用的侧支循环评价方法包括基于CT的多模式影像评估,如传统CTA(单时相)、多时相CTA/动态CTA、CT灌注;及基于MRA和DSA的血管评估方法。
4.2.1 基于计算机断层扫描的多模式影像评估
传统(单时相)CTA已被广泛应用于缺血性卒中的侧支循环评价[42-43]。比较常用的是源图像和最大密度投影重建(maximum intensity projection,MIP)图像,而MIP图像相对用的更多[44]。应用单时相CTA评价侧支循环的量化方法评分系统很多,目前的评分系统主要是针对前循环单侧大动脉闭塞(主要是MCA)所致的缺血性卒中设计的[45]。这些评分系统的思路基本一致,都是将病变侧缺血区域内软膜支与正常侧同一区域进行对比,从而估计其侧支代偿状态。
前期的评分系统一般比较简单,将缺血区域作为一个整体或指定某一个区域为对比区,将软膜支对比剂充盈状态相对于对侧的分为2~5级。比如:根据缺血区域周围血管充盈程度分为好(good)和差(poor)2级;或0~3级;或无(none)、中等(moderate)、好(good)、很好(excellent)4级。根据侧裂处血管充盈状态分为好(good)、中等(moderate)、缺失(absent)3级;或缺失(absent)、少于(less)、等于(equal to)、多于(greater than)、明显多于(exuberant)对侧半球5级。这些评分系统简单易操作,也具备中等程度以上的评价者间一致性。许多研究表明利用这类评分系统获得的侧支循环状态结果能够预测AIS患者的临床和影像预后。
为了能够更加客观和详细地进行侧支循环评价,MENON等[42]提出了分区软膜(regional leptomeningeal,rLMC)评分系统。该评分系统参照ASPECTS分区方法,将MCA供血区分为M1~M6共6个区域,加上ACA供血区和基底节区共8个区域,每个区域的软膜支(或基底节区的豆纹动脉)与对侧同一区域进行比较,评分0~2分(0:无;1:少于;2:等于或多于);另外侧裂区的软膜支则根据与对侧对比的结果,评分0、2或4分。所有区域最高合计20分。与以往的简易评分系统相比,该评分系统具有更好的评价者间一致性,对临床预后的预测能力也更强。
由于单时相CTA仅能提供某一时间点的血管充盈状态,因而扫描时间就至关重要。如果扫描时间过早,正常侧血管尚未完全充盈,可能导致高估侧支代偿水平;如果扫描时间过晚,静脉的显影则会严重影响软膜支的识别[46]。尽管现在自动追踪等技术已被广泛应用,在临床实践中,仍然很难做到准确抓取每个患者的最佳扫描时机。
与单时相CTA相比,多时相CTA能够更好地动态评估侧支循环状态。多时相CTA对AIS的侧支评估与脑血管造影的一致性好[47],被用来预测最终梗死体积、脑水肿和对溶栓治疗的临床反应[48]。ESCAPE研究就应用了这一检查进行患者筛选[3],该研究利用多时相CTA评价侧支循环的量化方法为一个6分的评分系统[49],评分标准如下:
0分:与对侧半球相比,缺血区域任何时相均无可见血管。
1分:与对侧半球相比,缺血区域任何一个时相有血管可见。
2分:与对侧半球相比,软膜血管的充盈有2个时相的延迟且充盈血管数减少,或有1个时相的延迟且部分区域无血管充盈。
3分:与对侧半球相比,软膜血管的充盈有2个时相的延迟,或有1个时相的延迟,但充盈血管数显著减少。
4分:与对侧半球相比,软膜血管的充盈程度正常,有1个时相的延迟。
5分:与对侧半球相比,软膜血管的充盈程度正常,没有延迟。
该评分将侧支血管对比剂充盈状态与充盈时间延迟相结合,显示出比单时相CTA更好的临床结局预测能力。
动态CTA能提供侧支血流的动态信息。利用动态CTA的原始图像或初步处理后的图像,可以直接进行侧支评价,其优势在于,通过比较各个时间点的软膜支充盈情况,可以分别找到两侧半球最佳充盈的时间点,从而准确判断评价血管的充盈程度。MR CLEAN研究中采用基线动态CTA的原始图像对侧支循环进行评价,发现侧支循环水平能够影响血管内治疗效果[1]。他们采用的量化方法是一个4分量表:0分:无侧支血管(闭塞区域无对比剂充盈);1分:侧支血管差(闭塞区域血管充盈与对侧相比>0但≤50%);2分:侧支血管中等(闭塞区域血管充盈与对侧相比>50%但<100%);3分:侧支循环好(闭塞区域100%血管充盈)。
通过动态CTA还能够获得准确的软膜支充盈延迟时间。MENON等[46]提出了利用动态CTA评价软膜侧支不同方面特征的评分系统,将逆向充盈时间、侧支充盈水平和侧支充盈程度相结合,其中逆向充盈时间分为小于5 s、5~10 s和大于10 s;侧支充盈水平分为到矢状沟旁、到半球凸面和到侧裂;侧支充盈程度分为少或无、中等和多。多个研究用不同的标准化方法证明了动态CTA在侧支评价方面优于传统的单时相CTA。通过tMIP技术后处理的动态CTA可以直接显示整个脑血流循环过程中的最佳侧支循环状态。除了侧支血管充盈程度,侧支充盈时间延迟(或充盈速度)也可以通过动态CTA进行评价,但其与临床结局的相关性相对较小[50-53]。一项研究比较了4个常用的基于单时相CTA或动态CTA的侧支评价系统与早期梗死核心和错配比的相关性,结果表明,将侧支循环程度和充盈时间同时纳入评价的ASPECTS和美国介入和治疗神经放射学学会/美国介入放射学学会(American Society of Interventional and Therapeutic Neuroradiology/Society of Interventional Radiology,ASITN/SIR)评分系统比仅评价侧支充盈程度的评分具有更好的临床结局相关性[54]。然而,大部分研究都是对小样本病例的回顾性分析,部分结果并没有统计学意义。而基于动态CTA的血流支配区域图可以用来明确侧支血管的来源和分布,尤其是对仍存在前向血流的慢性狭窄患者更有意义。未来需要更多的研究来探讨如何更好地应用这些新技术评价侧支循环。
此外,CT灌注也可以用来评估侧支代偿状态。CT灌注通过各种参数显示血管充盈程度或时间延迟,从而反映脑组织毛细血管水平的血流动力学状态。在大动脉闭塞导致的AIS中,CT灌注能够反映侧支循环状态,严重的脑灌注缺失提示侧支循环差,中等程度的灌注缺失可能与侧支充盈缓慢相对应。此外,CT灌注也可用于预测组织预后。梗死核心通常表现为脑血流量(cerebral blood flow,CBF)和脑血容量(cerebral blood volume,CBV)成比例地降低,造影剂平均通过时间(mean transit time,MTT)延长,而缺血半暗带表现为CBV正常而MTT延长。但是,在慢性动脉狭窄的供血区域,CT灌注不容易区分前向血流和侧支血流。CT灌注主要的缺点是缺少侧支循环评估的统一标准[55]。
4.2.2 基于磁共振成像的血管评估
MRA是探测Willis环解剖结构敏感性较高的技术。在MRA原始图像上,最小显示血管直径为1 mm,而MIP方法较原始图像特异性更高。研究显示,MRA评估前交通动脉的敏感性为89.2%,评估后交通动脉的敏感性为81.3%[56]。然而,MRA无法清晰显示远端软膜支,对二级以上侧支循环难以评价,且目前缺少基于MRA的侧支循环评价量化标准。
4.2.3 基于数字减影血管造影的全脑血管造影
侧支循环评价的金标准是基于DSA的全脑血管造影,该检查方法既能显示血管形态,又能反映血流动力学,既有时间分辨率,又有极高的空间分辨率[57]。然而,DSA全脑血管造影是有创检查,存在一定的风险,操作者需要经过规范的培训和长期的实践方可进行,而且该检查需要患者住院完成,在临床实践中难以普遍应用。除了计划进行血管内治疗的患者,全脑血管造影不适合作为常规检查。
目前应用最为广泛的侧支循环评估方法是2003年提出的基于DSA检查的ASITN/SIR侧支循环评估系统[58],标准如下:
0级:没有侧支血流到缺血区域;
1级:缓慢的侧支血流到达缺血周边区域,伴持续的灌注缺损。
2级:快速的侧支血流到达缺血周边区域,伴持续的灌注缺损,仅有部分到达缺血区域。
3级:静脉晚期可见缓慢但是完全的血流到达缺血区域。
4级:通过逆行灌注,血流快速而完全地灌注到整个缺血区域。
1级为侧支循环较差,2级为侧支循环中等,3~4级为侧支循环较好。此分级系统已在多个大型多中心临床对照研究中应用,具有较好的一致性和可靠性。
专家共识性意见
·拟行血管内治疗的急性缺血性卒中患者,推荐完成代偿相关血管的脑血管造影,评估基线侧支循环状态,可应用ASITN/SIR侧支分级系统,协助预测血管内治疗的风险和获益;也可在治疗前对患者进行多时相CTA检查评估侧支循环的代偿程度,以进行危险度分层。
·对于侧支循环分级量表,目前尚无统一的评估体系,各种评估量表的预测价值、信度和效度仍需进一步验证。
·尽管目前有多种无创性影像学方法可在血管再通治疗前完成侧支循环的评价,但目前关于是否应将侧支循环评价作为急性期血管再通治疗前的常规影像学评价指标仍未明确;在治疗前进行侧支循环评价是否会延迟治疗,以及是否可以通过基线侧支循环状态指导临床决策,仍需前瞻性临床研究证实。
5 缺血半暗带
5.1 缺血半暗带与不匹配区
缺血半暗带为脑梗死核心灶周围由于脑血流灌注不足而导致神经功能受损的脑组织,但其细胞正常电活动仍可维持正常[59]。缺血半暗带的缺血区从外向内依次包括:①良性缺血区:可自行恢复功能的区域;②缺血半暗带区:除非积极有效的治疗,否则进展为不可逆损伤的区域,是临床治疗及研究的焦点;③核心梗死区。缺血半暗带进展为梗死的速度取决于责任血管侧支代偿的程度、缺血持续时间、细胞的功能和代谢状态,因此快速有效地识别核心梗死灶与周围潜在的可挽救脑组织对于选择适合治疗的患者非常重要[60-61]。伴随影像检查技术的日新月异,如DWI、PWI及CTP等技术有助于快速准确识别缺血半暗带区,进而筛选合适的患者行再灌注治疗。2015年5项大型血管内治疗研究之所以取得阳性结果,主要在于其对入组患者的影像学检查进行了严格筛选并进行了及时治疗。ESCAPE[3]、SWIFT PRIME[5]、REVASCAT研究[4]患者入选标准——ASPECTS评分分别为≥6分,≥6分和≥7分。MR CLEAN研究未对术前的ASPECTS评分做要求,但MR CLEAN后期的亚组分析发现:ASPECTS评分5~7分与8~10分疗效相当且能够从血管内再通治疗中获益,而0~4分患者获益不明显[1,3-5]。EXTEND-IA研究是唯一一个血管内治疗前应用多模CT或多模MRI影像学来评估梗死核心灶、缺血半暗带及不匹配区的研究,经多模影像学评估后将不匹配比例>1.2或不匹配体积>10 ml及核心梗死灶体积小于70 ml的患者纳入研究[2]。正因为EXTEND-IA研究术前对入组患者进行了更为全面的影像学评估,因此其90 d的良好预后(mRS 0~2分)比例在5项研究中最高,达71%。对于5项研究的荟萃分析同样显示,经过影像筛选的患者,与对照组比较,死亡率及出血率均较低[13]。虽然5项研究使用不同的标准筛选进行血管内治疗的患者(CTvsMRI),但研究结果均显示经影像学筛选的具有“小核心梗死灶及大缺血半暗带区域”或中等至良好侧支循环的患者,良好预后的比例更高。
5.2 缺血半暗带与不匹配区的影像学评估
5.2.1 CT灌注成像
CT灌注成像是用来识别AIS后缺血半暗带的另一种成像技术,通过对各循环参数的判定来识别缺血半暗带。CTP常见的参数有:CBF、CBV、相对脑血容量(relative cerebral blood volume,rCBV)、MTT、达峰时间(time to peak,TTP)、相对平均通过时间(relative mean transit time,rMTT)、相对延迟时间(relative delay time,rDT)。随着CT对团注造影剂的扫描形成信号清除曲线,继而生成半定量CBV和CBV图。当缺血更为严重时,则CBV萎陷。
CT灌注成像对于梗死核心灶标记为CBV降低的区域,CBF与MTT以低于界定的阈值(CBV<2 ml/100 g、CBF<20 ml/100 g/min及MTT>8 s)来显示脑的异常灌注区。缺血半暗带为脑梗死核心区与异常灌注区域之间的差异区域(图3)[62-63]。
5.2.2 CT灌注成像评估缺血半暗带的特点及研究进展
CT灌注技术与MRI比较,最明显的优势在于CTP容易普及与实现,此外还可以提供很多强有力的生理学数值,扫描后可产生CBF、CBV、TTP及MTT等图像[64]。然而其也有一些不足之处,典型的CT扫描是20 mm扫描3~4层,因此对非大血管闭塞导致的卒中敏感性较低。此外,与MRI相比,CTP对急性小脑病变缺乏直接可视化的组织学改变[65]。目前CBF或者CBV图像上的病变程度与MTT比较,还没有形成统一共识[66-67]。未成功再通或再灌注患者中,MTT与TTP图像上病变体积与最终梗死体积有强相关性[62]。发病在3~6 h内的大血管闭塞患者,MTT与TTP图像上的病变显示范围比CBF或CBV都要大[67]。WINTERMARK等[68]基于正电子发射断层成像(positron emission tomography,PET)数据与动物研究认为,如果CBV低于阈值(2.5 ml/100 mg)则提示为梗死核心,rCBF低于64%界定为处于高危状态的脑组织;两者之间的差别区域即代表缺血半暗带区域。另外一项研究提示CBV阈值所界定的梗死核心灶与MRI DWI的病灶体积吻合度很高,CT灌注上的缺血半暗带与梗死核心灶与MRI PWI上MTT病变有较好的匹配度[66]。不进展为梗死的缺血半暗带的比例可以预测患者的临床结局[68-69]。KAMEDA[70]通过对其中心156例经机械取栓治疗患者的CT灌注成像研究发现,CT灌注成像或许可以预测经机械取栓的AIS患者可治疗的缺血半暗带和出血转化风险。
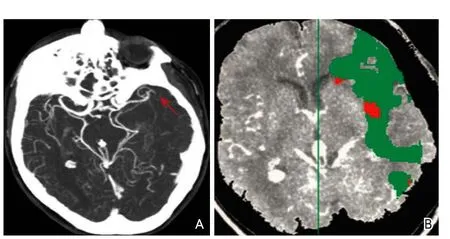
图3 CT血管造影(A)及CT灌注成像(B)
5.2.3 磁共振成像DWI-PWI不匹配区
MRI PWI常采用动态磁敏感对比增强技术,通过对比剂团注追踪技术进行动态增强扫描,依靠对比剂磁化率改变引起信号变化的原理成像。经处理后可得出相应灌注成像的参数如CBF、CBV、MTT及TTP等。研究表明,CBF下降和MTT延长是组织缺血的相对敏感指标,但存在过分估计最终梗死体积的可能性;TTP图像上脑灰质、白质之间无明显区别,可以清楚显示病变的范围和边界。虽然目前识别缺血半暗带的方法有多种,但MRI DWI与PWI不匹配区是急诊过程中判断缺血半暗带较切合实际的方法(图4)。一项回顾性研究认为,PWI的病灶面积是DWI病灶面积的2.6倍时早期再灌注的治疗效果最好[71]。
5.2.4 磁共振成像评估不匹配区的研究进展
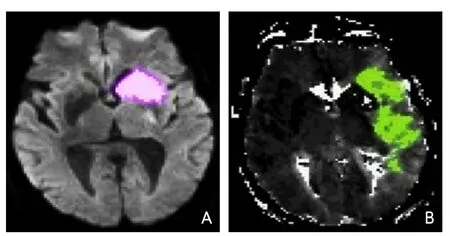
图4 磁共振成像DWI-PWI不匹配区影像
近期多项早期基于MRI筛选缺血半暗带进行治疗的研究均提示MRI在筛选适合治疗患者中的重要性,同时也指出亟需界定合适的阈值来快速判定缺血半暗带区域以最大程度提高干预的效率[72]。KAESEMANN等[73]用MRI评估了伴有ICA颅外段狭窄对MCA闭塞患者缺血半暗带的影响,结果提示在该类患者中,ICA颅外段狭窄对梗死体积、MTT、Tmax或者缺血半暗带没有影响,但对CBV有小的影响。WOUTERS及其团队[74]探讨了对醒后卒中与发病时间不明确患者的影像学筛选标准,包括DWI-FLAIR不匹配区,指出:目前对于该类患者仍没有统一的标准,但是用影像学识别缺血半暗带可指导临床筛选出很多适合血管内治疗的患者。两项大型血管内研究[MR RESCUE和磁共振弥散加权成像评估卒中演变研究2(Diffusion Weighted Imaging Evaluation for Understanding Stroke Evolution Study-2,DEFUSE-2)][8,75]得出相悖结论的原因在于MRI筛选患者时用不同标准定义了梗死核心区及缺血半暗带。也有研究提示MRA-DWI不匹配区同样可作为除PWIDWI不匹配区之外的筛选适合行血管内治疗患者的有效措施[76]。LEGRAND等[77]通过对164例MCA近端闭塞导致的AIS患者的MRI FLAIR血管高信号与DWI成像观察研究发现,FLAIR相血管高信号与DWI不匹配区可以快速识别可能从血管内治疗获益的近端大血管闭塞导致的AIS患者。
总结临床常用的这些影像学技术:CTP具备便捷、高效的特征,但MRI的各个模式却更有专业性,且似乎更准确。
专家共识推荐意见
·对于经筛选发病6 h以内、ASPECTS评分<6分、拟接受紧急再灌注治疗的患者,或发病超过6 h、拟接受紧急再灌注治疗的患者,建议完成CT灌注检查以明确梗死核心区和缺血半暗带体积。
·推荐使用一站式CTA+CTP检查方案缩短多模式CT的检查时间;对于无法完成CT灌注的卒中中心,可根据CTA源图像进行梗死核心和缺血半暗带的判断,也可以通过磁共振DWI+MRA+PWI进行术前评估。
共识撰写小组(按姓氏首字拼音顺序):
霍晓川,贾白雪,罗岗,彭光格,王正阳,杨俊,
张净瑜,张雪蕾
共识讨论编审组专家名单(按姓氏首字拼音顺序):
曹亦宾河北医科大学附属唐山工人医院
陈康宁第三军医大学附属西南医院
董强复旦大学附属华山医院
David Wang美国伊利诺伊州立大学Peoria医学中心
范一木天津市环湖医院
高峰首都医科大学附属北京天坛医院
高连波中国医科大学附属第四医院
韩巨山东省千佛山医院
何俐四川大学华西临床医学院华西医院
胡波华中科技大学同济医学院附属协和医院
吉训明首都医科大学宣武医院
李宝民中国人民解放军总医院
李天晓河南省人民医院
李铁林南方医科大学附属珠江医院
刘建民第二军医大学附属长海医院
刘丽萍首都医科大学附属北京天坛医院
刘新峰南京军区总医院
刘亚杰南方医科大学附属珠江医院
陆正齐中山大学附属第三医院
缪中荣首都医科大学附属北京天坛医院
彭亚常州市第一人民医院
秦超广西医科大学第一附属医院
帅杰第三军医大学新桥医院
石进空军总医院
王少石上海市第一人民医院分院
王文志北京神经外科研究所
王伊龙首都医科大学附属北京天坛医院
王拥军首都医科大学附属北京天坛医院
吴伟山东大学齐鲁医院
徐安定暨南大学附属第一医院
徐运南京鼓楼医院
许予明郑州大学附属第一医院
杨弋吉林大学附属第一医院
杨华贵阳医学院附属医院
于加省华中科技大学同济医学院附属同济医院
曾进胜中山大学附属第一医院
张鸿祺首都医科大学宣武医院
赵钢第四军医大学第一附属医院(西京医院)
赵性泉首都医科大学附属北京天坛医院
赵振伟第四军医大学第二附属医院(唐都医院)
郑洪波四川大学华西临床医学院华西医院
周盛年山东大学附属齐鲁医院
朱其义山东临沂人民医院
[1]BERKHEMER O A,FRANSEN P S,BEUMER D,et al. A randomized trial of intraarterial treatment for acute ischemic stroke[J]. N Engl J Med,2015,372(1):11-20.
[2]CAMPBELL B C,MITCHELL P J,KLEINIG T J,et al. Endovascular therapy for ischemic stroke with perfusion-imaging selection[J]. N Engl J Med,2015,372(11):1009-1018.
[3]GOYAL M,DEMCHUK A M,MENON B K,et al. Randomized assessment of rapid endovascular treatment of ischemic stroke[J]. N Engl J Med,2015,372(11):1019-1030.
[4]JOVIN T G,CHAMORRO A,COBO E,et al. Thrombectomy within 8 hours after symptom onset in ischemic stroke[J]. N Engl J Med,2015,372(24):2296-2306.
[5]SAVER J L,GOYAL M,BONAFE A,et al. Stentretriever thrombectomy after intravenous t-PAvs. t-PA alone in stroke[J]. N Engl J Med,2015,372(24):2285-2295.
[6]EILAGHI A,BROOKS J,D'ESTERRE C,et al. Reperfusion is a stronger predictor of good clinical outcome than recanalization in ischemic stroke[J]. Radiology,2013,269(1):240-248.
[7]LESLIE-MAZWI T M,HIRSCH J A,FALCONE G J,et al. Endovascular stroke treatment outcomes after patient selection based on magnetic resonance imaging and clinical criteria[J]. JAMA Neurol,2016,73(1):43-49.
[8]KIDWELL C S,JAHAN R,GORNBEIN J,et al. A trial of imaging selection and endovascular treatment for ischemic stroke[J]. N Engl J Med,2013,368(10):914-923.
[9]BERKHEMER O A,JANSEN I G,BEUMER D,et al. Collateral status on baseline computed tomographic angiography and intra-arterial treatment effect in patients with proximal anterior circulation stroke[J]. Stroke,2016,47(3):768-776.
[10]LENG X,FANG H,LEUNG T W,et al. Impact of collaterals on the efficacy and safety of endovascular treatment in acute ischaemic stroke:a systematic review and meta-analysis[J]. J Neurol Neurosurg Psychiatry,2016,87(5):537-544.
[11]ROTZINGER D C,MOSIMANN P J,MEULI R A,et al. Site and rate of occlusive disease in cervicocerebral arteries:a CT angiography study of 2209 patients with acute ischemic stroke[J]. AJNR Am J Neuroradiol,2017,38(5):868-874.
[12]VANACKER P,LAMBROU D,ESKANDARI A,et al. Improving prediction of recanalization in acute large-vessel occlusive stroke[J]. J Thromb Haemost,2014,12(6):814-821.
[13]GOYAL M,MENON B K,VAN ZWAM W H,et al. Endovascular thrombectomy after large-vessel ischaemic stroke:a meta-analysis of individual patient data from five randomised trials[J]. Lancet,2016,387(10029):1723.
[14]VAN GAAL S C,KAMAL N,BETZNER M J,et al. Approaches to the field recognition of potential thrombectomy candidates[J]. Int J Stroke,2017,12(7):698-707.
[15]CHEN C J,WANG C,BUELL T J,et al. Endovascular mechanical thrombectomy for acute middle cerebral artery M2 segment occlusion:a systematic review[J/OL]. World Neurosurg,2017,107:684-691. http://dx.doi.org/10.1016/j.wneu.2017.08.108.
[16]SCHONEWILLE W J,WIJMAN C A,MICHEL P,et al. Treatment and outcomes of acute basilar artery occlusion in the Basilar Artery International Cooperation Study(BASICS):a prospective registry study[J]. Lancet Neurology,2009,8(8):724.
[17]GORY B,ELDESOUKY I,SIVAN-HOFFMANN R,et al. Outcomes of stent retriever thrombectomy in basilar artery occlusion:an observational study and systematic review[J]. J Neurol Neurosurg Psychiatry,2016,87(5):520-525.
[18]BRODERICK J P,PALESCH Y Y,DEMCHUK A M,et al. Interventional Management of Stroke(IMS)III Investigators. Endovascular therapy after intravenous t-PA versus t-PA alone for stroke[J]. N Engl J Med,2013,368(10):893-903.
[19]CAMPBELL B C,CHRISTENSEN S,LEVI C R,et al. Cerebral blood flow is the optimal CT perfusion parameter for assessing infarct core[J]. Stroke,2011,42(12):3435-3440.
[20]JOVIN T G,YONAS H,GEBEL J M,et al. The cortical ischemic core and not the consistently present penumbra is a determinant of clinical outcome in acute middle cerebral artery occlusion[J]. Stroke,2003,34(10):2426-2433.
[21]PADRONI M,BERNARDONI A,TAMBORINO C,et al. Cerebral blood volume aspects is the best predictor of clinical outcome in acute ischemic stroke:A retrospective,combined semi-quantitative and quantitative assessment[J]. PLoS One,2016,11(1):e0147910.
[22]BARBER P A,DEMCHUK A M,ZHANG J,et al. Validity and reliability of a quantitative computed tomography score in predicting outcome of hyperacute stroke before thrombolytic therapy. ASPECTS Study Group. Alberta Stroke Programme Early CT Score[J]. Lancet,2000,355(9216):1670-1674.
[23]FEDERAU C,CHRISTENSEN S,MLYNASH M,et al. Comparison of stroke volume evolution on diffusion-weighted imaging and fluid-attenuated inversion recovery following endovascular thrombectomy[J]. Int J Stroke,2017,12(5):510-518.
[24]DE MARGERIE-MELLON C,TURC G,TISSERAND M,et al. Can DWI-ASPECTS substitute for lesion volume in acute stroke[J]? Stroke,2013,44(12):3565-3567.
[25]PUETZ V,SYLAJA P N,COUTTS S B,et al. Extent of hypo attenuation on CT angiography source images predicts functional outcome in patients with basilar artery occlusion[J]. Stroke,2008,39(9):2485-2490.
[26]KIM S K,YOON W,PARK M S,et al. Outcomes are not different between patients with intermediate and high DWI-ASPECTS after stent-retriever embolectomy for acute anterior circulation stroke[J]. AJNR Am J Neuroradiol,2016,37(6):1080-1085.
[27]LEES K R,BLUHMKI E,VON KUMMER R,et al. Time to treatment with intravenous alteplase and outcome in stroke:an updated pooled analysis of ECASS,ATLANTIS,NINDS,and EPITHET trials[J]. Lancet,2010,375(9727):1695-1703.
[28]ABOU-CHEBL A. Endovascular treatment of acute ischemic stroke may be safely performed with no time window limit in appropriately selected patients[J]. Stroke,2010,41(9):1996-2000.
[29]GONZALEZ R G. Clinical MRI of acute ischemic stroke[J]. J Magn Reson Imaging,2012,36(2):259-271.
[30]BORST J,BERKHEMER O A,ROOS Y B,et al. Value of computed tomographic perfusion-based patient selection for intra-arterial acute ischemic stroke treatment[J]. Stroke,2015,46(12):3375-3382.
[31]HAUSSEN D C,DEHKHARGHANI S,RANGARAJU S,et al. Automated CT perfusion ischemic core volume and noncontrast CT ASPECTS(Alberta Stroke Program Early CT Score)[J]. Stroke,2016,47(9):2318-2322.
[32]YOO A J,CHAUDHRY Z A,NOGUEIRA R G,et al. Infarct volume is a pivotal biomarker after intraarterial stroke therapy[J]. Stroke,2012,43(5):1323-1330.
[33]ADAMS H P,BENDIXEN B H,KAPPELLE L J,et al. Classification of subtype of acute ischemic stroke. Definitions for use in a multicenter clinical trial. TOAST. Trial of Org 10172 in acute stroke treatment[J]. Stroke,1993,24(1):35-41.
[34]PROTTO S,PIENIMÉKI J P,SEPPÉNEN J,et al. Low cerebral blood volume identifies poor outcome in stent retriever thrombectomy[J]. Cardiovasc Intervent Radiol,2017,40(4):502-509.
[35]HAN M,CHOI J. W,RIM N-J,et al. Cerebral infarct volume measurements to improve patient selection for endovascular treatment[J]. Medicine,2016,95(35):e4702.
[36]HAO Y H,YANG D,WANG H,et al. Predictors for symptomatic intracranial hemorrhage after endovascular treatment of acute ischemic stroke[J]. Stroke,2017,48(5):1203-1209.
[37]REBELLO L C,BOUSLAMA M,HAUSSEN D C,et al. Endovascular treatment for patients with acute stroke who have a large ischemic core and large mismatch imaging profile[J]. JAMA Neurol,2017,74(1):34-40.
[38]YOO A J,BERKHEMER O A,FRANSEN P S S,et al. Effect of baseline Alberta Stroke Program Early CT Score on safety and efficacy of intra-arterial treatment:a subgroup analysis of a randomised phase 3 trial(MR CLEAN)[J]. Lancet Neurol,2016,15(7):685-694.
[39]DESILLES J P,CONSOLI A,REDJEM H,et al. Successful reperfusion with mechanical thrombectomy is associated with reduced disability and mortality in patients with pretreatment diffusion-weighted imaging-Alberta stroke program early computed tomography score ≤6[J]. Stroke,2017,48(4):963-969.
[40]MANCEAU P F,SOIZE S,GAWLITZA M,et al. Is there a benefit of mechanical thrombectomy in patients with large stroke(DWI-ASPECTS≤5)?[J/OL]. Eur J Neurol,(2017-9-14). http://dx.doi.org/10.1111/ene.13460.
[41]LENG X,FANG H,LEUNG T W,et al. Impact of collateral status on successful revascularization in endovascular treatment: a systematic review and metaanalysis[J]. Cerebrovasc Dis,2016,41(1-2):27-34.
[42]MENON B K,SMITH E E,MODI J,et al. Regional leptomeningeal score on CT angiography predicts clinical and imaging outcomes in patients with acute anterior circulation occlusions[J]. AJNR Am J Neuroradiol,2011,32(9):1640-1645.
[43]LIU L P,XU A D,WONG L K,et al. Chinese consensus statement on the evaluation and intervention of collateral circulation for ischemic stroke[J]. CNS Neurosci Ther,2014,20(3):202-208.
[44]POWER S,MCEVOY S H,CUNNINGHAM J,et al. Value of CT angiography in anterior circulation large vessel occlusive stroke:imaging findings,pearls,and pitfalls[J]. Eur J Radiol,2015,84(7):1333-1344.
[45]MCVERRY F,LIEBESKIND D S,MUIR K W. Systematic review of methods for assessing leptomeningeal collateral flow[J]. AJNR Am J Neuroradiol,2012,33(3):576-582.
[46]MENON B K,O'BRIEN B,BIVARD A,et al. Assessment of leptomeningeal collaterals using dynamic CT angiography in patients with acute ischemic stroke[J]. J Cereb Blood Flow Metab,2013,33(3):365-371.
[47]KIM S J,NOH H J,YOON C W,et al. Multiphasic perfusion computed tomography as a predictor of collateral flow in acute ischemic stroke:comparison with digital subtraction angiography[J]. Eur Neurol,2012,67(4):252-255.
[48]BANG O Y,GOYAL M,LIEBESKIND D S. Collateral circulation in ischemic stroke:assessment tools and therapeutic strategies[J]. Stroke,2015,46(11):3302-3309.
[49]MENON B K,D'ESTERRE C D,QAZI E M,et al. Multiphase CT angiography:a new tool for the imaging triage of patients with acute ischemic stroke[J]. Radiology,2015,275(2):510-520.
[50]BRUNNER F,TOMANDL B,HANKEN K,et al. Impact of collateral circulation on early outcome and risk of hemorrhagic complications after systemic thrombolysis[J]. Int J Stroke,2014,9(8):992-998.
[51]BEYER S E,THIERFELDER K M,VON BAUMGARTEN L,et al. Strategies of collateral blood flow assessment in ischemic stroke:prediction of the follow-up infarct volume in conventional and dynamic CTA[J]. AJNR Am J Neuroradiol,2015,36(3):488-494.
[52]FROLICH A M,WOLFF S L,PSYCHOGIOS M N,et al. Time-resolved assessment of collateral flow using 4D CT angiography in large-vessel occlusion stroke[J]. Eur Radiol,2014,24(2):390-396.
[53]SMIT E J,VONKEN E J,VAN SEETERS T,et al. Timing-invariant imaging of collateral vessels in acute ischemic stroke[J]. Stroke,2013,44(8):2194-2199.
[54]SEKER F,POTRECK A,MÉHLENBRUCH M,et al. Comparison of four different collateral scores in acute ischemic stroke by CT angiography[J]. J Neurointerv Surg,2016,8(11):1116-1118.
[55]BIVARD A,LEVI C,SPRATT N,et al. Perfusion CT in acute stroke:a comprehensive analysis of infarct and penumbra[J]. Radiology,2013,267(2):543-550.
[56]STOLZ E,MENDES I,GERRIETS T,et al. Assessment of intracranial collateral flow by transcranial color-coded duplex sonography using a temporal and frontal axial insonation plane[J]. J Neuroimaging,2002,12(2):136-143.
[57]KORTMAN H G,SMIT E J,OEI M T,et al. 4D-CTA in neurovascular disease:a review[J]. AJNR Am J Neuroradiol,2015,36(6):1026-1033.
[58]HIGASHIDA R T,FURLAN A J,ROBERTS H,et al. Trial design and reporting standards for intra-arterial cerebral thrombolysis for acute ischemic stroke[J]. Stroke,2003,34(8):e109-e137.
[59]ASTRUP J,SIESJO B K,SYMON L. Thresholds in cerebral ischemia - the ischemic penumbra[J]. Stroke,1981,12(6):723-725.
[60]ROTHER J. Imaging-guided extension of the time window:ready for application in experienced stroke centers?[J]. Stroke,2003,34(2):582-583.
[61]SCHELLINGER P D,FIEBACH J B,HACKE W. Imaging-based decision making in thrombolytic therapy for ischemic stroke:present status[J]. Stroke,2003,34(2):575-582.
[62]WINTERMARK M,FLANDERS A E,VELTHUIS B,et al. Perfusion-CT assessment of infarct core and penumbra:receiver operating characteristic curve analysis in 130 patients suspected of acute hemispheric stroke[J]. Stroke,2006,37(4):979-985.
[63]SASAKI M,KUDO K,OGASAWARA K,et al. Tracer delay-insensitive algorithm can improve reliability of CT perfusion imaging for cerebrovascular steno-occlusive disease:comparison with quantitative single-photon emission CT[J]. AJNR Am J Neuroradiol,2009,30(1):188-193.
[64]KLOTZ E,KONIG M. Perfusion measurements of the brain:using dynamic ct for the quantitative assessment of cerebral ischemia in acute stroke[J]. Eur J Radiol,1999,30(3):170-184.
[65]KOENIG M,KLOTZ E,LUKA B,et al. Perfusion CT of the brain:diagnostic approach for early detection of ischemic stroke[J]. Radiology,1998,209(1):85-93.
[66]EASTWOOD J D,LEV M H,WINTERMARK M,et al. Correlation of early dynamic CT perfusion imaging with whole-brain MR diffusion and perfusion imaging in acute hemispheric stroke[J]. AJNR Am J Neuroradiol,2003,24(9):1869-1875.
[67]WINTERMARK M,FISCHBEIN N J,SMITH W S,et al. Accuracy of dynamic perfusion CT with deconvolution in detecting acute hemispheric stroke[J]. AJNR Am J Neuroradiol,2005,26(1):104-112.
[68]WINTERMARK M,REICHHART M,THIRAN J P,et al. Prognostic accuracy of cerebral blood flow measurement by perfusion computed tomography,at the time of emergency room admission,in acute stroke patients[J]. Ann Neurol,2002,51(4):417-432.
[69]MUIR K W,HALBERT H M,BAIRD T A,et al. Visual evaluation of perfusion computed tomography in acute stroke accurately estimates infarct volume and tissue viability[J]. J Neurol Neurosurg Psychiatry,2006,77(3):334-339.
[70]KAMEDAK,UNO J,OTSUJI R,et al. Optimal thresholds for ischemic penumbra predicted by computed tomography perfusion in patients with acute ischemic stroke treated with mechanical thrombectomy[J/OL]. J Neurointerv Surg,(2017-6-9). http://dx.doi.org/10.1136/neurintsurg-2017-013083.
[71]PACIARONI M,CASO V,AGNELLI G. The concept of ischemic penumbra in acute stroke and therapeutic opportunities[J]. Eur Neurol,2009,61(6):321-330.
[72]PARSONS M,SPRATT N,BIVARD A,et al. A randomized trial of tenecteplase versus alteplase for acute ischemic stroke[J]. N Engl J Med,2012,366(12):1099-1107.
[73]KAESEMANN P,THOMALLA G,CHENG B,et al. Impact of severe extracranial ica stenosis on mri perfusion and diffusion parameters in acute ischemic stroke[J/OL]. Front Neurol,(2014-12-05). https://doi.org/10.3389/fneur.2014.00254.
[74]WOUTERS A,LEMMENS R,DUPONT P,et al. Wake-up stroke and stroke of unknown onset:a critical review[J/OL]. Front Neurol,(2014-8-12). https://doi.org/10.3389/fneur.2014.00153.
[75]HACKE W,FURLAN A J,AL-RAWI Y,et al. Intravenous desmoteplase in patients with acute ischaemic stroke selected by MRI perfusion-diffusion weighted imaging or perfusion CT(DIAS-2):a prospective,randomised,double-blind,placebocontrolled study[J]. Lancet Neurol,2009,8(2):141-150.
[76]LANSBERG M G,THIJS V N,BAMMER R,et al. The MRA-DWI mismatch identifies patients with stroke who are likely to benefit from reperfusion[J]. Stroke,2008,39(9):2491-2496.
[77]LEGRAND L,TISSERAND M,TURC G,et al. Fluid-Attenuated inversion recovery vascular hyperintensities-diffusion-weighted imaging mismatch identifies acute stroke patients most likely to benefit from recanalization[J]. Stroke,2016,47(2):424-427.

