视网膜中央静脉阻塞伴发黄斑水肿患者房水中sCD200、VEGF表达
视网膜中央静脉阻塞(central retinal vein occlusion,CRVO)是一种常见的眼底病,常常引起黄斑水肿,而黄斑水肿是CRVO影响患者视力的主要原因[1,2]。因此,了解CRVO合并黄斑水肿发病机制非常重要。CRVO患者视网膜由于缺血缺氧,视网膜细胞分泌血管内皮生长因子(VEGF)增加,继而VEGF破坏血视网膜屏障,引起血管通透性增加。而在此过程当中,VEGF的分泌由很多细胞因子所调控,同时VEGF分泌增加亦可影响其他细胞因子分泌。
CD200属于白细胞分化抗原,一种与免疫反应及炎症反应相关的蛋白。在体内以两种形式存在:一种跨膜糖蛋白的形式,一种溶解于血浆中存在(sCD200)。它广泛表达于髓系细胞,T以及B淋巴细胞中[3]。CD200通过与CD200受体结合调节炎症以及免疫反应[3]。它在视网膜的血管内皮细胞以及视网膜的小胶质细胞均有表达[4]。研究发现sCD200在糖尿病视网膜病变的患者的玻璃体中表达明显上调,并可能参与了调节炎症反应[5]。那么sCD200在CRVO伴发黄斑水肿患者眼球内表达如何?为了解答该问题,本研究旨在了解CRVO伴发黄斑水肿患者房水中sCD200浓度以及与VEGF的关系。
资料与方法
一、对象
本研究纳入2015年11月至2017年1月在我院连续就诊的33例(33只眼)CRVO伴发黄斑水肿患者,同时选取30例(30只眼)无眼部及全身疾病的年龄相关性白内障患者作为对照。本研究经本院伦理委员会批准,遵循赫尔辛基宣言的原则,所有患者均签署了知情同意书。
CRVO伴发黄斑水肿患者入选与排除标准:入选标准:(1)眼底彩照以及荧光素眼底造影(FFA)检查明确的弥漫性或者囊样黄斑水肿的CRVO患者;(2)病程超过1个月;(3)需要玻璃体腔内注射抗VEGF药物;(4)最佳矫正视力低于0.5;(5)黄斑水肿没有接受其他治疗。排除标准:(1)全身存在可能影响房水中细胞因子含量的系统性疾病(高血压除外);(2)孕妇或者哺乳期患者;(3)不能签署知情同意书者;(4)除了CRVO之外,伴有其它眼局部疾病者;(5)有眼部手术史者;(6)糖尿病患者。
二、方法
1.一般检查:所有患者在我院均接受全面的眼科检查。CRVO患者接受间接检眼镜、眼底彩照,FFA以及相干光断层扫描仪(OCT)(RTVue-XR; Optovue, Inc)检查确诊。其它检查包括:裂隙灯检查,验光,最佳矫正视力,眼内压(IOP)测量,眼部B型超声检查等。同时所有研究对象均接受全身的基本检查包括心率、血压以及询问患者的疾病病史。
2.黄斑中央凹厚度测量:采用OCT测量黄斑中央凹厚度,OCT检查在玻璃体腔内注射抗VEGF药物前1~2 d进行。采用线性扫描方式,根据患者瞳孔大小、合作程度和屈光间质等情况对眼底后极部行最大范围扫描,选用扫描图像最清晰、扫描位置正且扫描质量髙的一次来进行检测分析,并利用软件分析程序来测量观测眼黄斑中心凹处视网膜的厚度。黄斑中央凹厚度定义为黄斑中央凹处内界膜与视网膜色素上皮之间的距离(图1)。
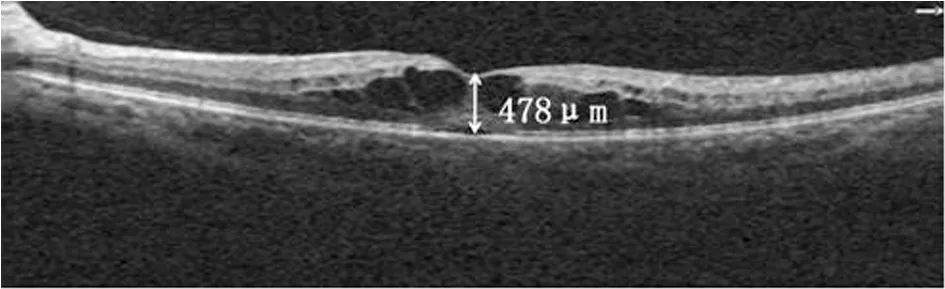
图1 CRVO伴有黄斑水肿患者黄斑中央凹厚度
3.手术方法:玻璃体腔内注射抗VEGF药物。玻璃体腔注射标准操作流程为:所有患者表面麻醉后,聚维碘酮结膜囊内清洁消毒,开睑器开睑后用30号注射器针头,距离角巩膜缘处3.5~4 mm进针颞下方,玻璃体腔内注射雷珠单抗0.05 ml/0.5 mg。
4.房水标本采集:CRVO患者:玻璃体体腔内注射雷珠单抗前,表面麻醉以及结膜囊内清洁消毒后,采用30G注射器针头前房穿刺缓缓抽出房水约100 μl。取出房水后转移至微量离心管中,避光保存在-80 ℃超低温冰箱中。白内障患者:在行白内障超声乳化手术+人工晶状体植入术前,表面麻醉以及结膜囊内清洁消毒后,抽取年龄相关性白内障患者房水约100 μl作为正常对照。
5.血液标本采集:CRVO患者在行玻璃体腔内注射抗VEGF药物以及白内障患者手术前取清晨空腹状态下肘静脉血5 ml,4 ℃下1000 r/min 离心15 min,取上清液至无菌Eppendof管内,放入-80 ℃超低温冰箱中避光保存直至检测。
6.细胞因子分析:所有患者的房水以及血清标本采用酶联免疫吸附试验(ELISA)分析sCD200以及VEGF的表达水平。实验方法按照试剂盒说明书进行。ELISA 试剂盒购自美国 BD公司。简言之:取50 μl房水或血清用移液管移入预包被单克隆抗体的96孔板,混匀后编号,用封板胶纸封住反应孔,室温育3 h,再用稀释好的洗涤液洗板5次,甩干。再在各孔中加入酶标试剂50 μl,用封板胶纸封住反应孔,37 ℃温育30 min,再用稀释好的洗涤液洗板5次,甩干。加入四甲基联苯胺(TMB)50 μl,37 ℃恒温箱内避光反应15 min后加入终止液50 μl。采用酶标仪在450 nm处测定吸光度(OD值),即VEGF水平或者sCD200水平。
三、统计学分析
结 果
一、基本临床资料
最终,本研究共纳入符合入选标准的CRVO患者33例(33只眼),同时纳入白内障患者房水作为对照30例(30只眼)。其中CRVO组男性15只眼,女性18只眼,对照组男性13只眼,女性17只眼。平均年龄分别为CRVO组(69.66±12.16)岁,对照组(68.40±5.85)岁。
两组之间的高血压患者比例相当。CRVO组与对照组相比,两组之间眼压、差异有统计学意义(P<0.05)。而两组之间年龄、性别差异均无统计学意义(P>0.05)。两组患者基本临床资料见表1。
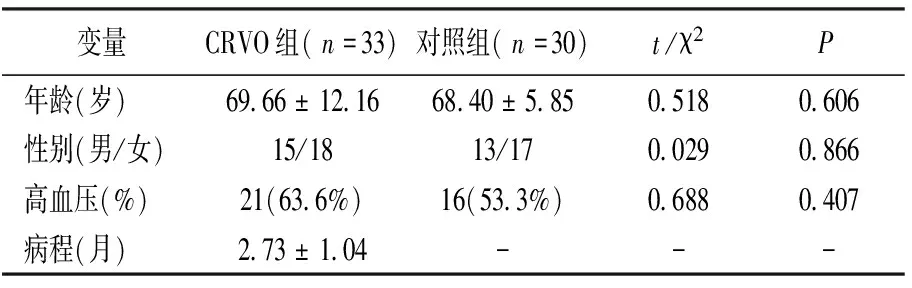
表1 纳入研究对象的基本特征
二、房水中sCD200与VEGF浓度
房水中sCD200与VEGF浓度 CRVO患者房水中sCD200浓度为(109.64 ± 33.18)pg/ml,而对照组患者房水中sCD200浓度为(42.55±28.27)pg/ml,CRVO患者房水中sCD200浓度明显高于对照组,差异有统计学意义(t=8.596,P<0.001)。CRVO组房水中VEGF浓度为(323.30±245.40)pg/ml,而对照组房水中VEGF浓度为(151.43±68.40)pg/ml,两组比较,差异有统计学意义(t=3.705,P< 0.001)(图2,3)。
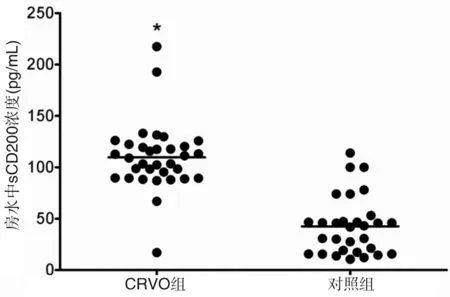
图2 CRVO与年龄相关性白内障房水中sCD200浓度比较
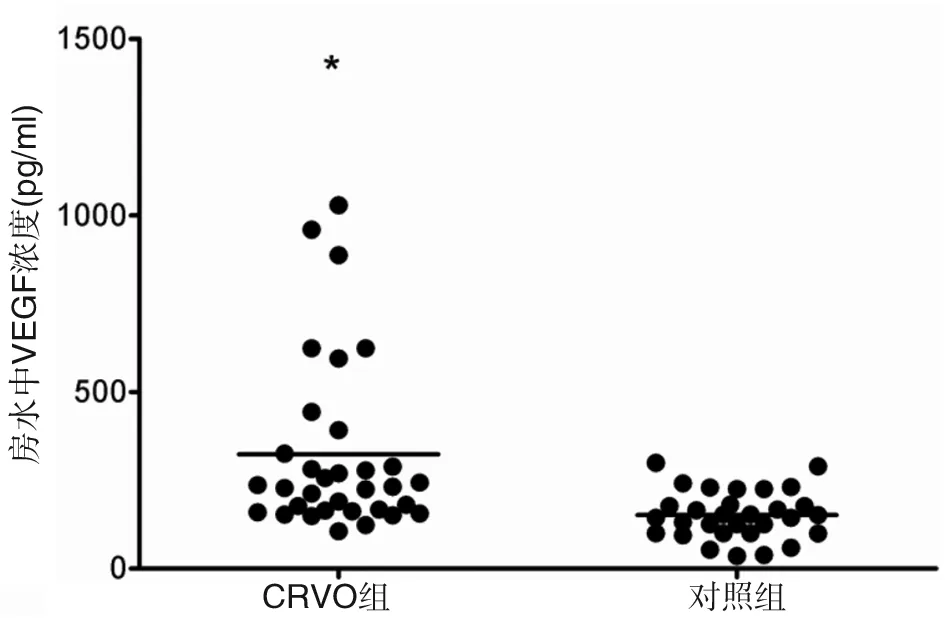
图3 CRVO伴发黄斑水肿患者与年龄相关性白内障患者房水中VEGF浓度比较
三、血浆中sCD200与VEGF浓度
CRVO血浆中sCD200浓度为(16.89±6.33)pg/ml,而对照组中sCD200浓度为(15.34±376)pg/ml,两组之间比较,差异无统计学意义(t=1.113,P=0.270)。同样CRVO患者血浆中sCD200浓度为(14.76±7.32)pg/ml与白内障患者血浆中(15.40±4.77)pg/ml VEGF浓度亦相当,差异无统计学意义(t=-0.404,P=0.688)。
四、CRVO伴发黄斑水肿患者房水中sCD200与VEGF相关性
对CRVO伴发黄斑水肿患者房水中sCD200与VEGF做相关性分析,结果显示房水中两个因子浓度呈现显著相关性(ρ=0.426 ,P=0.014 )(图4)。
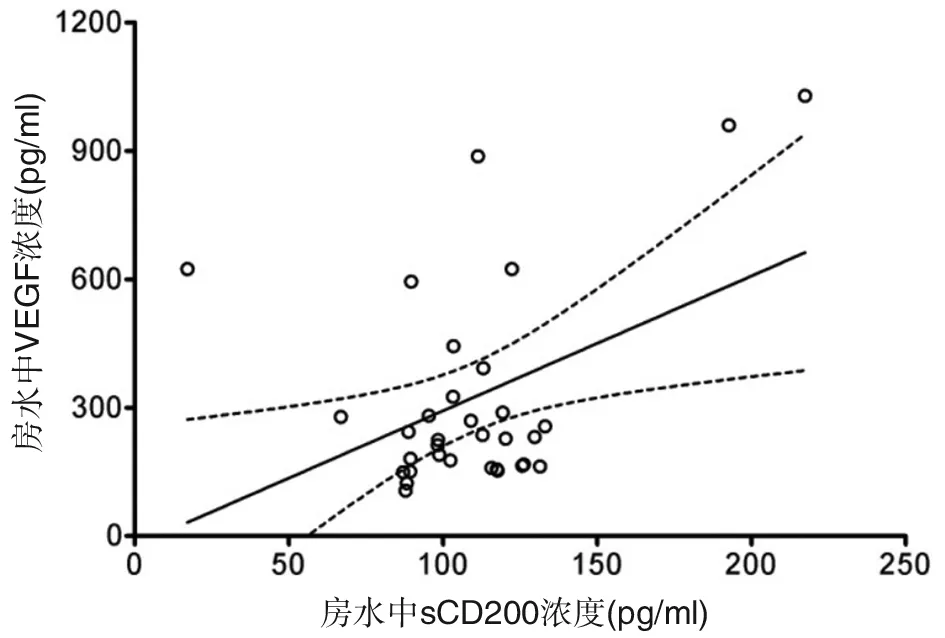
图4 CRVO伴发黄斑水肿房水中sCD200与VEGF呈显著相关性
五、CRVO伴发黄斑水肿患者房水中sCD200与黄斑中央凹厚度相关性
对CRVO伴发黄斑水肿患者房水中sCD200浓度与视网膜黄斑中央凹厚度做相关性分析,结果显示房水中sCD200与黄斑中央凹厚度呈显著正相关(ρ=0.468 ,P=0.006 )(图5)。
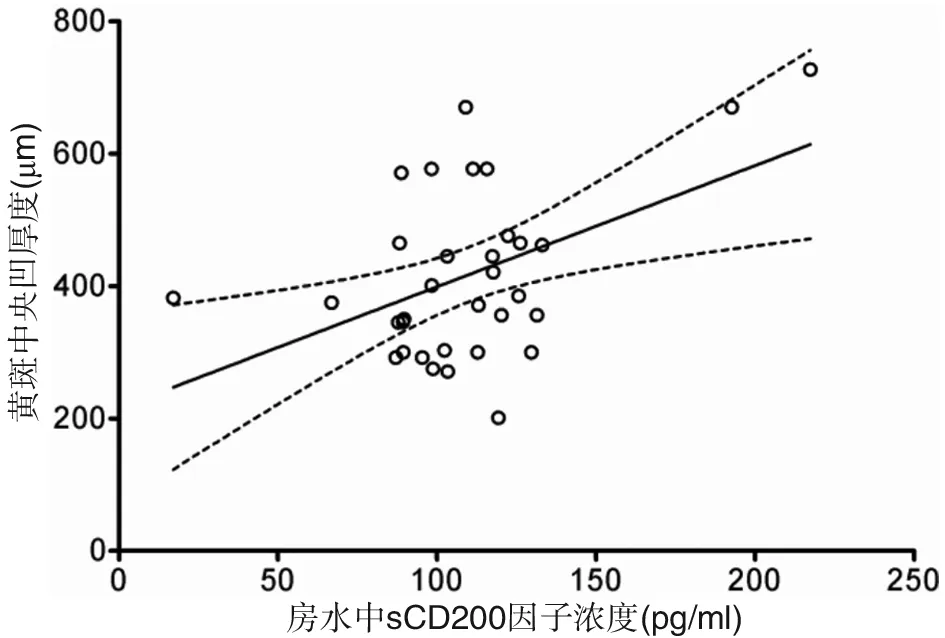
图5 CRVO伴发黄斑水肿患者房水中sCD200与黄斑中央凹厚度呈显著正相关
六、CRVO伴发黄斑水肿患者房水中VEGF与黄斑中央凹厚度相关性
对CRVO伴发黄斑水肿患者房水中VEGF浓度与黄斑中央凹厚度做相关性分析,结果显示房水中VEGF浓度与黄斑中央凹厚度亦呈显著正相关(ρ=0.494 ,P=0.003 )(图6)。
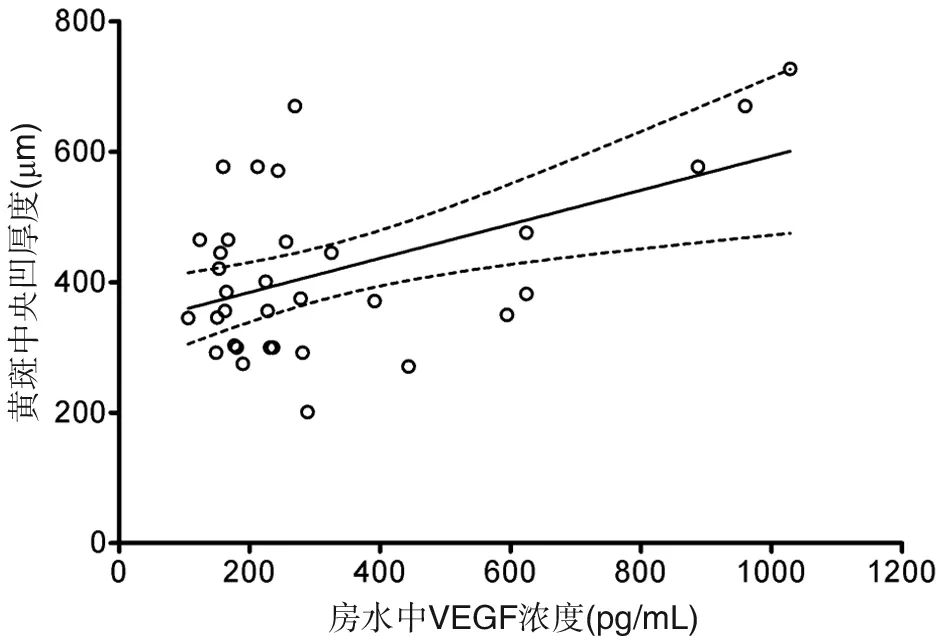
图6 CRVO伴发黄斑水肿患者房水中VEGF与黄斑中央凹厚度呈显著正相关
七、患者房水中sCD200、VEGF与血浆中sCD200、VEGF相关性

表2 患者房水中sCD200、VEGF与血浆中
CRVO伴发黄斑水肿的患者房水中sCD200与血浆中sCD200含量无显著相关性,同样房水中VEGF与血浆中VEGF含量亦无显著相关性。在对照组中,两个细胞因子在血浆中的含量与房水中的含量均未发现显著相关性(表2)。
讨 论
CRVO可导致严重的黄斑水肿,从而引起患者视力下降甚至丧失[6],而黄斑水肿一旦长时间得不到缓解,可造成视网膜组织的不可逆性损伤[2]。它的病理状态表现为:当静脉阻塞形成后,导致视网膜的广泛出血及缺血缺氧。继而引起VEGF表达异常增高。由于VEGF增加引起视网膜血管通透性增加,继而引起黄斑水肿[7]。
CD200是一种新型的与免疫抑制有关的蛋白,在自身免疫反应中发挥了举足轻重的作用。最近的研究表明,CD200跨膜糖蛋白主要表达于神经元上,与表达于小胶质细胞/巨噬细胞上的受体相结合后,产生抑制炎症反应的作用[8]。研究发现,IL-4和IL-10可以上调CD200表达,进而与小胶质细胞上的CD200受体结合,激活小胶质细胞,进而分泌IL-6以及IL-1β的炎症因子增加[9,10]。一些初步的临床研究表明CD200可能是一些自身免疫和炎症性疾病的重要生物标志物,并且可能成为治疗这些疾病的靶向药物[11]。比如在大疱性类天疱疮患者的血浆以及水泡液中,研究发现sCD200表达明显上调,而且通过抗IgE单克隆抗体治疗后,sCD200的表达明显降低[11,12]。同样,在类风湿关节炎患者外周辅助T细胞中,发现CD200表达明显上调,而且表达的量与疾病的严重程度呈正相关[13]。以上均说明,CD200在免疫及炎症性疾病中发挥了重要作用。视网膜组织是中枢神经系统的一部分,CD200在视网膜组织中也参与了调节神经炎症的过程。在葡萄膜炎的动物模型中发现CD200 发挥了重要的作用[4],进一步研究发现在敲除了CD200基因的小鼠中,视网膜小胶质细胞虽然形态仍然保持正常,但是相对于未敲除CD200基因的小鼠,它表达的炎症因子明显下调[14]。由此在眼部疾病中,CD200主要参与调控神经炎症的过程。
通过检测CRVO患者房水细胞因子的含量,本研究发现:相对正常对照组,CRVO患者房水中,sCD200与VEGF表达均明显增加,而且在CRVO患者房水中,sCD200与VEGF含量呈正相关的趋势。事实上,Xu[5]等也检测了糖尿病视网膜病变患者玻璃体腔内sCD200的浓度并与对照组(非糖尿病患者,非新生血管患者)比较,发现糖尿病视网膜病变患者玻璃体腔内sCD200因子浓度较对照组明显升高。同样作为视网膜缺血性疾病,与我们的研究取得相似的结论。因此我们推测,sCD200也参与了CRVO患者发生黄斑水肿的病理过程。
我们同时将sCD200以及VEGF的含量分别与CRVO黄斑中央凹厚度做相关性分析,发现黄斑水肿的程度与sCD200以及VEGF的含量有关,浓度越高,水肿程度越高。VEGF与黄斑水肿的关系已经得到广泛证实,VEGF可增加血管通透性继而引起黄斑水肿,基于这一点,目前抗VEGF治疗已经成为治疗各种类型的黄斑水肿的重要治疗方法。CRVO患者房水中sCD200因子浓度与黄斑水肿程度的关系,我们第一次阐述,但是具体机制尚不明确,期待基础研究进一步证实这个问题。
本研究还检测了两组患者血浆中sCD200与VEGF的浓度。结果发现:无论是sCD200还是VEGF血浆中的浓度,CRVO患者与白内障患者血浆中的含量均相当,差异无统计学意义。我们进一步对CRVO组与对照组患者房水中因子浓度与血浆中因子浓度做相关性分析:sCD200与VEGF在房水中的浓度与在血浆中的浓度均无显著相关性。更重要的是房水中的sCD200与VEGF的浓度均远高于血浆中的浓度。以上研究结果提示:黄斑水肿的CRVO患者房水中sCD200浓度升高,是由于眼局部分泌增多,由视网膜内血管内皮细胞、色素上皮细胞、小胶质细胞或者移行入视网膜的淋巴细胞等分泌后,通过玻璃体腔弥散入前房,而不是血浆中含量增加渗透入眼内所致。
本研究检测并比较了伴有黄斑水肿的CRVO患者以及年龄相关性白内障患者房水中一些sCD200与VEGF的浓度,本研究设计严谨,具有一定的优势:(1)本研究第一次检测了sCD200在伴有黄斑水肿CRVO患者房水中的浓度,并且第一次分析了sCD200与黄斑中央凹厚度的关系。(2)本研究同时还检测了血浆中sCD200的浓度,证实sCD200浓度升高是局部因素所致。本研究亦存在一定不足:首先,样本量偏少,但是所检测的细胞因子浓度两组之间差异非常明显,CRVO患者房水中检测到的浓度是对照组的数倍因而结果仍然可靠。其次,由于选择的都是伴有黄斑水肿的CRVO患者,因而存在选择性偏倚的可能。再次,由于CRVO患者发病病程不尽相同,病程是影响黄斑水肿的重要因素,而我们分析sCD200以及VEGF与黄斑水肿的相关性时,未能矫正病程以及其他混杂因素。最后,我们仅仅检测的是房水中sCD200以及VEGF的含量,它尚且不能代表玻璃体腔中细胞因子的浓度,更不能代表视网膜组织中的浓度。因而进一步的基础实验有待证实本研究命题。
综上所述,伴有黄斑水肿的CRVO患者房水中sCD200与VEGF表达明显上调,而且sCD200与VEGF含量与黄斑水肿的程度相关,sCD200与VEGF的含量越高,黄斑水肿程度越明显。而且sCD200与VEGF之间呈正相关。由于本研究尚存在一定的局限性,期待大样本量的、设计更严谨的研究进一步证实本结论。
[1] Zegarra H, Gutman FA, Conforto J. The natural course of central retinal vein occlusion. Ophthalmology,1979,86:1931-1942.
[2] Gutman FA, Zegarra H. Macular edema secondary to occlusion of the retinal veins. Surv Ophthalmol,1984,28:462-470.
[3] Rijkers ES, de Ruiter T, Baridi A, et al.Meyaard L. The inhibitory CD200R is differentially expressed on human and mouse T and B lymphocytes.Mol Immunol,2008,45:1126-1135.
[4] Taylor N, McConachie K, Calder C,et al.Liversidge J. Enhanced tolerance to autoimmune uveitis in CD200-deficient mice correlates with a pronounced Th2 switch in response to antigen challenge. J Immunol,2005,174:143-154.
[5] Xu Y, Cheng Q, Yang B,et al. Increased sCD200 levels in vitreous of patients with proliferative diabetic retinopathy and its correlation with VEGF and proinflammatory cytokines. Invest Ophthalmol Vis Sci,2015,56:6565-6572.
[6] Spaide RF, Klancnik JJ, Gross NE. Retinal choroidal collateral circulation after radial optic neurotomy correlated with the lessening of macular edema. Retina,2004,24:356-359.
[7] Dvorak HF, Brown LF, Detmar M,et al. Vascular permeability factor/vascular endothelial growth factor, microvascular hyperpermeability, and angiogenesis. J Pathol,1995,146:1029-1039.
[8] Lyons A, McQuillan K, Deighan BF,et al. Decreased neuronal CD200 expression in IL-4-deficient mice results in increased neuroinflammation in response to lipopolysaccharide. Brain Behav Immun,2009,23:1020-1027.
[9] Hernangomez M, Mestre L, Correa FG,et al. CD200-CD200R1 interaction contributes to neuroprotective effects of anandamide on experimentally induced inflammation. Glia,2012,60:1437-1450.
[10] Lyons A, McQuillan K, Deighan BF, et al. Decreased neuronal CD200 expression in IL-4-deficient mice results in increased neuroinflammation in response to lipopolysaccharide. Brain Behav Immun,2009,23:1020-1027.
[11] Akman-Karakas A, Yalcin AD, Koc S,et al. There might be a role for CD200 in the pathogenesis of autoimmune and inflammatory skin disorders. Med Sci Monit,2013,19:888-891.
[12] Yalcin AD, Genc GE, Celik B,et alS. Anti-IgE monoclonal antibody (omalizumab) is effective in treating bullous pemphigoid and its effects on soluble CD200. Clin Lab,2014,60:523-524.
[13] Chakera A, Bennett SC, Morteau O,et al. The phenotype of circulating follicular-helper T cells in patients with rheumatoid arthritis defines CD200 as a potential therapeutic target. Clin Dev Immunol,2012,2012:948218.
[14] Dick AD, Carter D, Robertson M,et al. Control of myeloid activity during retinal inflammation. J Leukoc Biol,2003,74:161-166.

