太子参通过MAPK信号转导通路促进人脐静脉内皮细胞增殖
林少兵 ,蒋宗胜 ,阮君山 ,2,王少明 ,2
(1.福建医科大学省立临床医学院,福建 福州350001;2.福建省立医院中医药分子生物学实验室,福建 福州350001;3.福建医科大学药学院,福建 福州350122)
太子参通过MAPK信号转导通路促进人脐静脉内皮细胞增殖
林少兵1,蒋宗胜3,阮君山1,2,王少明1,2
(1.福建医科大学省立临床医学院,福建 福州350001;2.福建省立医院中医药分子生物学实验室,福建 福州350001;3.福建医科大学药学院,福建 福州350122)
目的 通过太子参及主要成分环肽B(HB)对人脐静脉内皮细胞(HUVEC)增殖的影响,研究其相关作用机制。 方法 CAM鸡胚绒毛尿囊膜实验测定太子参对血管生成的影响;CCK8检测法检测HB对HUVEC的增殖和毒性;划痕实验检测HB对HUVEC增殖和迁移的影响;ELISA检测HB通过影响哪种细胞生长因子影响HUVEC的生长发育;Western Blot测定MAPK信号转导通路中各蛋白的表达,分析其相关作用机制。结果 太子参具有促进血管生成的作用;0~100 μg/mL HB可促进HUVEC增殖;随着时间推移,HUVEC快速地向划痕中间迁移,并且随着HB浓度的增加,HUVEC迁移的速度和强度也随着增强;HB通过影响VEGF的表达促进HUVEC细胞的增殖;HB通过激活MAPK信号转导通路促进HUVEC细胞的增殖。 结论 太子参具有促进血管生成的作用,作用机制与激活MAPK信号转导通路,促进细胞的增殖有关。
太子参;环肽B;人脐静脉内皮细胞;血管生成
血管生成是指从已有毛细血管或毛细血管后静脉发展而形成新血管[1],主要包括:血管基底膜降解;血管内皮细胞的激活、增殖、迁移;重建形成新血管和血管网,是一个涉及多种细胞的复杂过程。血管生成是目前研究热点,涵盖几乎所有临床学科,尤其是心血管和肿瘤领域的研究较为突出[2]。
太子参为石竹科太子参属植物,主要成分为太子参多糖、多种氨基酸和微量元素。有研究表明:太子参具有抗氧化的特性[3],且对心肌细胞具有一定的保护作用[4],但当前作用机制尚未明朗。本研究以环肽B(HB)促进人脐静脉内皮细胞(HUVEC)增殖为切入点,进一步研究太子参促进血管生成的作用机制,为太子参在血管生成领域提供更合理的用药依据。
1 材 料
1.1 试剂 SPF种鸡蛋(福建省大北农生物技术有限公司);重组人血管内皮抑制素(商品名:恩度,山东先声麦得津生物制药有限公司);重组牛碱性成纤维细胞生长因子(商品名:贝复舒,珠海亿胜生物制药有限公司);HUVEC(上海汉博生物科技有限公司);HB(成都普瑞法科技开发有限公司);DMEM基础培养基、血清、双抗(青霉素-链霉素溶液,美国通用医疗生命科学有限公司);CCKB试剂、Westem Blot试剂盒(碧云天生物技术有限公司);VEGF165试剂盒(武汉云克隆有限公司);FGF2试剂盒(武汉云克隆有限公司);Erk1/2、Mek1 /2、Raf-1(上海斯信生物科技有限公司);β-actin、IgG(H+L)(北京麦尔泰克科技有限公司)。太子参水提物由福建省立医院制剂室自制。
1.2 培养条件 HUVEC于36.9℃、5%CO2的培养箱中培养,培养基为DMEM基础培养基加15%血清和1%双抗。
2 方 法
2.1 CAM鸡胚绒毛尿囊膜实验测定太子参对血管增殖的影响 配制浓度为2、5、10 mg/mL的太子参水提物。选择表面清洁,蛋壳均质的SPF种鸡蛋,孵育于5%CO2、36.9℃恒温箱。孵蛋至第 8天,酒精消毒蛋壳表面,去除蛋壳,剪除卵壳膜(大概1.5 cm×1.5 cm),制备假气室[5]。将灭菌后的滤纸以1 cm×1 cm的规格剪取,作为载体置于CAM中。制作成功的 CAM 模型分成空白组、低(2 mg/mL)、中(5 mg/mL)、高(10 mg/mL)剂量组,每组 8 个 CAM 模型,做好标记。用微量加样器将0.06 mL药物滴到各组载体中,加完药后用透明胶封闭加药窗,放入5%CO2、36.9℃恒温箱中继续孵育,连续加药3 d。3 d后,由加药窗滴入甲醛∶丙酮=1∶1的固定液预固定 15 min,待CAM的血管完全凝固后,用眼科镊完整剪下CAM中心待观察区域,置于蒸馏水中,吸管吹打CAM,使其舒展开来,立即拍照保存。使用相关软件分析图像,根据管径将血管分类:管径≥0.1 mm为大血管;0.1 mm>管径≥0.05 mm为中血管;管径<0.05 mm为小血管。
在确定最适合细胞生长药物浓度后,用同样的方法将制作成功的CAM模型分成空白组、最适合细胞生长药物浓度组、贝复舒组、恩度组,每组8个CAM模型,观察各组药物对血管增殖的影响。
2.2 CCK8检测法检测细胞增殖和毒性 制备HUVEC细胞悬液并计数,稀释细胞悬液,以每孔2 000个HUVEC接种到96孔板中,5%CO2、36.9℃恒温箱培养 24 h 后,以 8 浓度梯度(0、20、30、50、60、80、100、150、200 μg/mL) 6 个复孔的形式加入 HB。 细胞培养48 h后,每个孔加20 μL CCK8试剂,CCK8作用1.5、3、4 h时,在波长450 nm下测各孔吸光度,实验结果取平均值[6]。
2.3 划痕实验检测HB对HUVEC增殖和迁移的影响 用marker笔在6孔板背后划横线,大约每隔0.5~1 cm一道。在6孔板中选4个孔,每孔加入70 μL(约含 5×105个 HUVEC)细胞悬液,放入 5%CO2、36.9℃恒温箱。待细胞铺满板孔,用枪头比着直尺,垂直于背后的横线划痕,用PBS洗去划下的细胞,加入 0、30、60、90 μg/mL HB 组的培养基,放入5%CO2、36.9℃恒温箱。 在 0、6、12、24 h 时拍照,记下划痕的间距。做3次实验,算平均值。
2.4 ELISA检测 VEGF、FGF2的表达情况 将HUVEC 分为 4 组,每组含 0、30、60、90 μg/mL HB,设5个孔,培养24 h。24 h后,用0.25%胰酶消化,离心收集细胞,将收集到的细胞用冷 PBS洗3次,制备PBS细胞悬液。取适量 PBS重悬细胞,用一定功率的超声波处理细胞悬液,使细胞急剧震荡破裂,反复冻融3次,使细胞溶胀破碎。于 2~8℃ 500 g离心10 min,收集上清备用。根据ELISA试剂盒说明书的操作检测VEGF、FGF2的表达情况。
2.5 Western Blot检测MAPK信号转导通路中蛋白表达情况 取一个培养瓶的细胞,用预冷过的PBS 洗 3 遍,加裂解液 300 μL(RIPA 裂解液∶PMSF=100∶1),30 min 后,用枪头刮下细胞(此操作在冰上进行),12 000 rpm,冷冻离心 10 min,取上清液200 μL,加入 SDS-PAGE 蛋白上样缓冲液 40 μL,98℃高温变性10 min,BCA法检测蛋白含量。SDSPAGE电泳,转膜,加一抗,4℃过夜,TBST洗5次,加二抗,孵育2 h,TBST洗5次,加发光剂ECL化学发光。将胶片扫描存档,凝胶图像分析目标带的光密度值。
2.6 统计学方法 以上实验均重复3次,采用SPSS22.0版本软件进行统计分析。计量资料属正态分布以(x±s)表示,采用 t检验。
3 结 果
3.1 CAM鸡胚绒毛尿囊膜实验 鸡胚在5%CO2、36.9℃恒温箱正常发育,孵育40个,成功37个,制作成功率为92.5%。空白组CAM膜与载体融合,部分中、小血管贯穿;低剂量组的中、小血管较多,没有大血管,血管呈点状分布,血管增生的范围主要集中在载体边缘0.2 cm内;中剂量组的血管增生最多,平均每个鸡胚有2.1根大血管,中、小血管的密集,血管呈树突状分布,血管增生的范围主要集中在载体边缘0.5 cm内;高剂量组的鸡胚在加药后死亡2个,基本没有大、中血管,有大量细小血管围绕,细小血管以载体为中心呈包绕或放射状分布。因此最适合细胞生长药物浓度组为中剂量组。
贝复舒组血管增生最多,大、中血管比较多,每个鸡胚有2~4根大血管,呈树突状分布,血管增生的范围主要集中在载体边缘0.8 cm内;恩度组抑制作用非常明显,鸡胚只存活2个,且存活鸡胚的血管多为零星分布的细小血管。如表1所示,中剂量组与空白组比较,血管数有显著性差异(P<0.05),说明太子参有促进血管生成的作用。

表1 各药物组与空白组血管数比较(x±s) 根
3.2 CCK8检测法检测HB对HUVEC的增殖和毒性 实验显示HB影响HUVEC的增殖,如图1所示:0~100 μg/mL HB 促进 HUVEC 增殖,150、200 μg/mL HB抑制细胞的生长。
3.3 HB促进HUVEC增殖和迁移 如图2、表2所示,随着时间的推移,HUVEC快速地向划痕中间迁移,并且随着HB浓度增加,HUVEC迁移的速度和强度也随着增强,与空白组比较,愈合程度有显著性差异(P<0.05)。
3.4 HB通过增加VEGF的表达促进HUVEC细胞增殖 如图3所示:随着HB浓度的增加,VEGF的表达随着增加,不同浓度间VEGF的表达有显著性差异(P<0.05),FGF2的表达不受环肽 B浓度影响。

图1 不同浓度HB作用后测得的HUVEC吸光度值
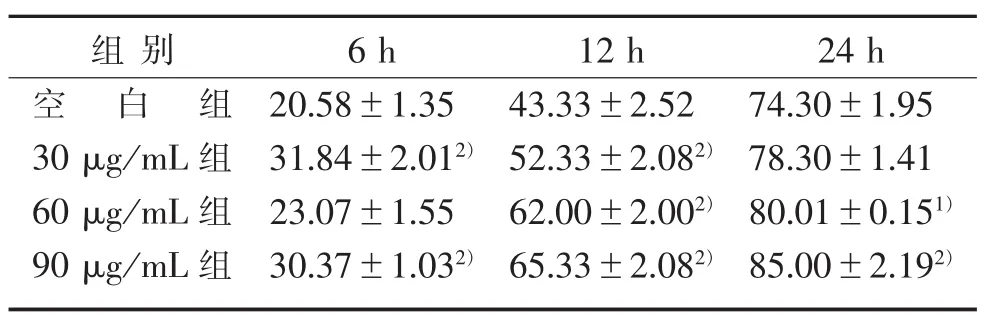
表2 不同浓度HB在不同时间划痕的愈合程度(x±s)%

图2 不同浓度HB在不同时间划痕的愈合程度
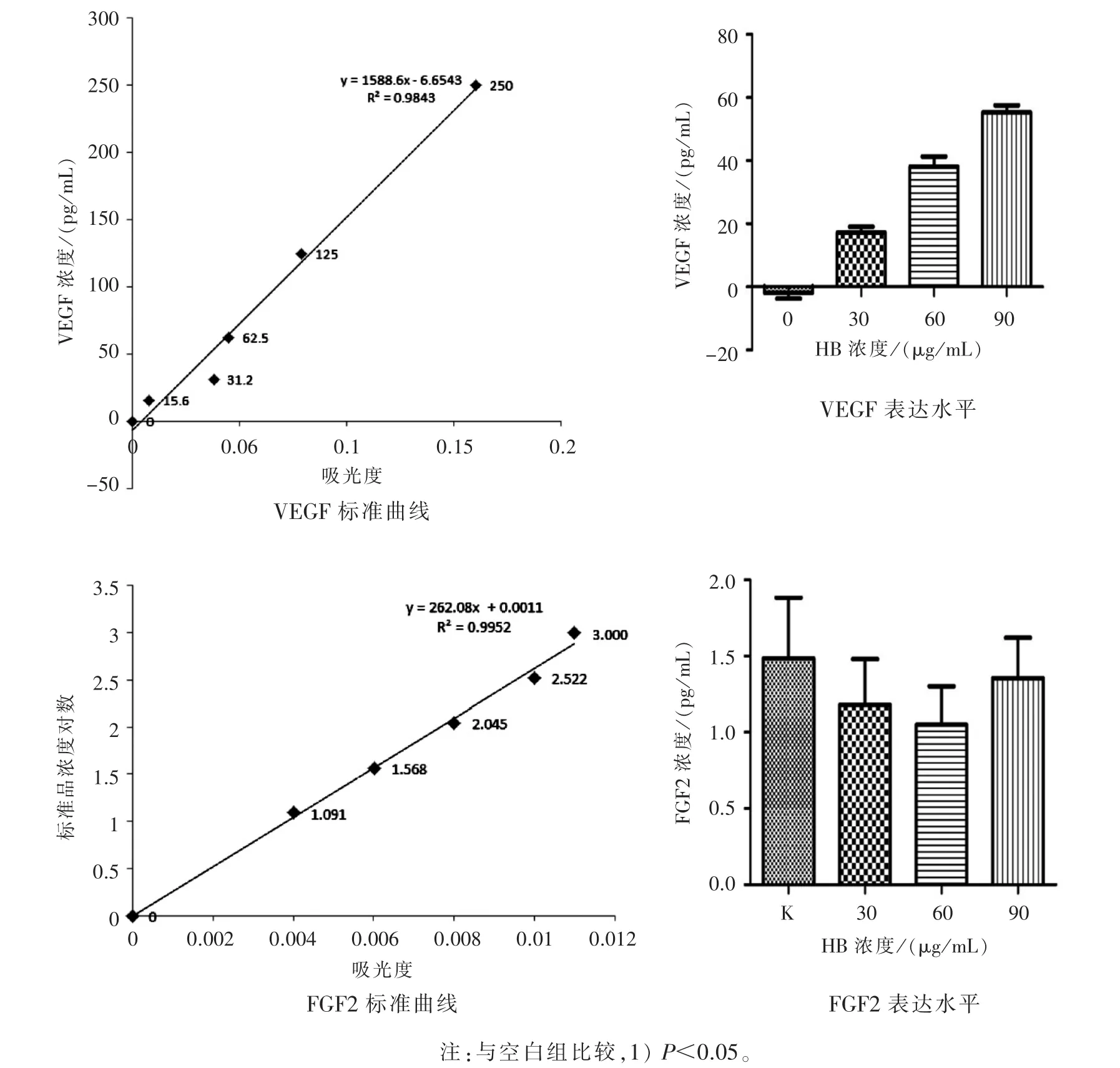
图3 ELISA检测VEGF、FGF2的表达情况
3.5 HB 激活 MAPK(Ras/Raf/Mek/Erk)信号转导通路促进 HUVEC细胞增殖 Ras/Raf/Mek/Erk信号转导通路作为MAPK众多信号通路中的一个,是细胞生长发育最重要的信号转导通路之一,参与HUVEC细胞生长、转移等过程。本实验检测了HUVEC 细 胞 中 Kras、Raf-1、Mek1 /2、Erk1/2 的 表达水平,结果如图4所示:随着HB浓度的增加,HUVEC 细胞中 Kras、Raf-1、Mek1/2、Erk1/2 蛋白的表达水平显著增加,与空白组比较,有显著性差异(P<0.05)。

图 4 HUVEC 细胞中 Kras、Raf-1、Mek1/2、Erk1/2 蛋白的表达情况
4 讨 论
应用药物刺激小血管生长,促进血管生成,已成为目前心血管领域的研究热点之一。CAM是鸡胚外的一层膜,主要功能是提供气体交换的表面,其功能依赖于致密的血管网支撑,正是由于鸡胚发育过程中大量尿囊膜血管的形成,为研究血管发生和形成提供了良好的模型[7]。本研究表明:太子参能促进血管内皮细胞的增殖、迁移,且作用比较缓和,此结果为太子参治疗相关疾病提供新的依据。
血管生成过程复杂,与多种细胞因子有关。目前,对促进血管生成的血管生成因子研究最多的为FGF和VEGF。本研究利用ELISA的敏感性、高特异性检测HB对HUVEC中FGF和VEGF的影响情况,证明HB是通过影响VEGF的表达促进HUVEC细胞的生长发育。
目前已知,所有真核细胞中均存在Ras/Raf/Mek/Erk这一信号转导通路,VEGF、源生长因子(PDGF)等与其受体结合后,可通过刺激 Ras-二磷酸鸟苷(GDP)转换为 Ras-三磷酸鸟苷(GTP),从而导致Ras激酶过度活化,进而以这种自体磷酸化方式激活 Ras/Raf/Mek /Erk 信号通路[8],启动相应转录子的转录,进而导致细胞的增殖分化。本文通过测定 Ras/Raf/Mek/Erk 这一信号转导通路中各蛋白的表达水平,结果显示:随着HB浓度的增加,各蛋白的表达水平也随着增加,说明HB通过Ras/Raf/Mek/Erk这一信号转导通路促进HUVEC细胞的增殖。但各蛋白的表达水平并不呈规则的趋势上升,考虑其不只是影响 Ras/Raf/Mek/Erk 这一信号转导通路,还通过其他信号转导途径促进HUVEC细胞的增殖,这需要更多的研究予以证实。
[1] 殷沈华,唐德才.益气活血类中药对血管生成影响的研究[J].时珍国医国药,2013,24(1):43-44.
[2] KERBEI R S.Tumor angiogenesis:past,present and the near future[J].Carcinogensis,2000,21(3):505-515.
[3] 晏春耕.药用植物太子参的研究及其应用[J].现代中药研究与实践,2008,22(2):61-65.
[4] 沈祥春,彭佼,喻斌,等.太子参对急性心肌梗死心力衰竭大鼠心肌重构的作用[J].贵阳医学院学报,2008,33(6):12.
[5] ZHANG S C,WU Z K,WANG L,et al.A pplication of chicken chorioallantoic membrane as a model for study of effects of Chinese medicine on angiogensis[J].China J Basic Med Tradit Chin Med,1999,5(5):16-18.
[6] 刘艳秋,张可华,王运良,等.CCK-8和MTS法检测人羊膜上皮细胞增殖的比较[J].中国康复理论与实践,2012,18(9):827-830.
[7] ZHU CUI-LING,ZHU YUAN-YUAN.Effects of Leeches on Angiogenesis of CAM[J].China Journal of Chinese Medicine,2011,155(4):64-66.
[8] ZHAO X,TIAN C,PUSZYK W M,et al.OPA1 downregulation is involved in sorafenib-induced apoptosis inhepatocellular carcinoma[J].Lab Invest,2013,9(3):8-19.
R285.5
A
1000-338X(2017)06-0016-04
2017-09-18
国家自然科学基金面上项目(81273647);福建省自然科学基金项目(2013J01365);福建省卫生系统中青年骨干人才重点项目(2015-ZQN-ZD-2);国家卫计委共建科学研究基金项目(WKJ-FJ-19)
林少兵(1983—),男,主管药师,主要从事药学工作。
王少明(1958—),男,主任药师,硕士研究生导师。E-mail:cnfjwsm@163.com

