表没食子儿茶素没食子酸酯通过NF-κB通路抑制脂多糖诱导的巨噬细胞向M1表型极化
吴 琼,王乐锋,张妍淞,汤小芳,张贤益,李 露,舒 瑶,黄 成,廖金珠,王富龙,李文娟,*
(1.南昌大学第二附属医院,江西 南昌 330006;2.南昌大学 食品科学与技术国家重点实验室,江西 南昌 330047)
表没食子儿茶素没食子酸酯通过NF-κB通路抑制脂多糖诱导的巨噬细胞向M1表型极化
吴 琼1,王乐锋1,张妍淞2,汤小芳2,张贤益2,李 露2,舒 瑶2,黄 成2,廖金珠2,王富龙2,李文娟2,*
(1.南昌大学第二附属医院,江西 南昌 330006;2.南昌大学 食品科学与技术国家重点实验室,江西 南昌 330047)
目的:研究表没食子儿茶素没食子酸酯((-)-epigallocatechin gallate,EGCG)的抗炎作用及其对巨噬细胞极化的影响。方法:原代培养小鼠腹腔巨噬细胞,通过对细胞培养基进行不同的处理,将实验分为对照组、脂多糖(lipopolysaccharides,LPS,1 μg/mL)组、EGCG(25 µmol/L)组和EGCG+LPS(25 µmol/L+1 μg/mL)组;流式细胞仪检测吞噬活性、活性氧(reactive oxygen species,ROS)含量和细胞凋亡情况,噻唑蓝法检测细胞增殖情况;Griess法测定NO的含量;酶联免疫吸附法测定肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)和白细胞介素-1β(interleukin-1β,IL-1β)含量,Western blot检测Toll-样受体4(Toll like receptor 4,TLR4)和核转录因子-κB(nuclear transcription factor-κB,NF-κB)p65蛋白表达量。结果:EGCG和/或LPS对小鼠腹腔巨噬细胞增殖和凋亡无显著影响;与LPS组相比,EGCG可以极显著抑制LPS刺激腹腔巨噬细胞中ROS、NO、TNF-α、IL-1β增加(P<0.01),提示EGCG可抑制巨噬细胞向M1表型极化,具有抗炎作用;与LPS组相比,EGCG+LPS组中巨噬细胞TLR4和细胞核蛋白中NF-κB p65表达量明显下降(P<0.01)。结论:EGCG对LPS致炎的小鼠腹腔巨噬细胞具有抗炎作用,其作用机制可能与其阻断TLR4受体介导的NF-κB通路活化,抑制巨噬细胞向M1表型极化有关。
表没食子儿茶素没食子酸酯;抗炎作用;细胞表型;NF-κB通路;巨噬细胞极化
炎症是机体重要的免疫学反应:一方面炎症反应是宿主防御的主要过程,是人体健康必不可少的生理反应;另一方面炎症反应持久、异常可引起多种疾病,包括促进肿瘤的形成[1-3]。表没食子儿茶素没食子酸酯((-)-epigallocatechin gallate,EGCG)是从茶叶中提取的多酚类物质,是茶叶的主要活性成分,实验证实EGCG能缓解巨噬细胞的炎症反应,具有抗炎作用[4-5]。Seong等[6]通过一次性大剂量注射脂多糖(lipopolysaccharides,LPS)建立小鼠炎症模型,证实EGCG可通过下调Toll样受体4(Toll like receptor 4,TLR4)发挥抗炎作用。巨噬细胞是机体重要的固有免疫细胞,在炎症反应中起着举足轻重的作用。在炎症反应的进程中,巨噬细胞极化表现出不同的细胞表型,从而发挥不同的免疫功能。根据细胞极化方式的不同,可将巨噬细胞表型分为M1型和M2型[7-8]。生理条件下,巨噬细胞的功能状态是连续的,M1和M2型巨噬细胞是这一系列连续状态的两个极端,分别发挥不同的促炎和抗炎作用[9-10]。近年来,巨噬细胞极化在抗炎作用研究中越来越受到关注,但在EGCG对巨噬细胞极化调控的研究颇少,尤其在信号通路机制研究中鲜见报道。本实验拟在前期的研究基础上,原代培养腹腔巨噬细胞,通过LPS刺激巨噬细胞模拟炎症模型,检测EGCG对小鼠腹腔巨噬细胞活性功能(M1型炎症相关参数,包括小鼠肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素-1β(interleukin-1β,IL-1β)、NO、活性氧(reactive oxygen species,ROS)含量和吞噬活性)及细胞表面受体TLR4和核转录因子-κB(nuclear transcription factor-κB,NF-κB)信号通路的影响,研究EGCG的抗炎作用,继而确定EGCG对的巨噬细胞极化的调控作用,为研究EGCG抗炎分子机制提供一定参考。
1 材料与方法
1.1 动物、材料与试剂
ALB/c小鼠雌雄不限(生产许可证:SCXK(湘)2013-0004),7~8 周龄,体质量(22±2)g,购自湖南斯莱克景达实验动物有限公司,饲养于南昌大学医学院实验动科部(使用许可证:SCXK(赣)2015-0001)。
DMEM培养基 美国Thermo公司;EGCG、噻唑蓝(3-(4,5-dimethyl-2-thiazolyl)-2,5-diphenyl-2-H-tetrazolium bromide,MTT)、胎牛血清、LPS 美国Sigma公司;2’,7’-二氯荧光黄双乙酸盐(2’,7’-dichlorodi-hydrofluorescein diacetate,DCFH-DA) 美国Molecular Probes公司;细胞凋亡试剂盒 美国BD公司;线粒体琥珀酸脱氢酶试剂盒 南京建成生物工程研究所;BCA蛋白质量浓度测定试剂、NO试剂盒碧云天生物技术研究所;细胞因子(TNF-α和IL-1β)酶联免疫吸附测定(enzyme linked immunosorbent assay,ELISA)试剂盒 中国武汉博士德生物工程有限公司;兔单克隆NF-κB抗体 美国Cell Signaling公司;小鼠单克隆TLR4抗体 美国Abcam公司。
1.2 仪器与设备
Varioskan Flash E33全波长多功能酶标仪 美国Thermo Electron公司;TDL-5-A大容量低速台式离心机上海安亭科学仪器厂;SHP-150生化培养箱 上海森信实验仪器有限公司;FACSCaliburTM流式细胞仪美国Becton Dickinson公司;MS 3 basic旋涡混匀器德国IKA公司。
1.3 方法
1.3.1 原代培养小鼠腹腔巨噬细胞
[11]原代培养小鼠腹腔巨噬细胞。颈椎脱臼处死小鼠,碘伏浸泡5 min,医用酒精脱碘3 min,置于弯盘中,腹腔注射磷酸盐缓冲液(phosphate buffered saline,PBS),腹部轻揉2 min,收集腹腔液置于离心管中,1 000×g离心8 min,收集细胞沉淀并重悬,台盼蓝拒染法计数活细胞大于95%,用完全培养基调整细胞浓度,分别接种于96 孔培养板和6 孔培养板中,置细胞培养箱中培养4 h后,差速贴壁去除未贴壁细胞,最后收集得到纯化的小鼠腹腔巨噬细胞。
1.3.2 小鼠腹腔巨噬细胞炎症模型的建立与分组
将原代培养腹腔巨细胞随机分为4 组,每个处理组设置3 个复孔。对照组:腹腔巨噬细胞中给予相同体积的培养基;LPS组:腹腔巨噬细胞中给予1 μg/mL LPS刺激24 h;EGCG+LPS组:结合文献[12-13],EGCG剂量选择25 µmol/L预处理腹腔巨噬细胞24 h后,加入1 μg/mL LPS刺激24 h,全程给予EGCG;EGCG组:25 µmol/L EGCG预处理腹腔巨噬细胞48 h。
1.3.3 细胞增殖情况的测定
将小鼠腹腔巨噬细胞(1.5×104个/孔)180 μL接种于96 孔培养板中。细胞培养48 h后,每孔加入20 μL MTT(5 g/L),继续培养4 h后,轻轻倾净96 孔培养板中微孔内的液体,然后每孔加入150 μL二甲基亚砜,终止反应,用振荡仪振荡10 min后,待MTT的紫色还原产物完全溶解。最后应用多功能酶标仪在570 nm波长处测定吸光度(A),细胞增殖情况以A表示,A越大代表其增殖越多。
1.3.4 流式细胞仪检测细胞凋亡情况
收集小鼠腹腔巨噬细胞,将细胞悬液(约2×106个/mL)于3 000 r/min离心10 min,PBS洗2 次,500 μL Binding Buffer重悬细胞,加入Annexin-V和PI各5 μL,避光反应5 min后,立即用FACScan进行流式细胞术检测各组细胞染色情况(一般不超过1 h),早期凋亡细胞为Annexin(+)/P1(-),坏死或凋亡晚期的继发坏死细胞为Annexin(+)/P1(+),正常活细胞为Annexin(-)/P(-)。同时以不加AnnexinV-FITC及PI的一管作为裸细胞,用于设定流式检测条件。
1.3.5 流式细胞仪检测细胞内ROS含量
收集小鼠腹腔巨噬细胞,将细胞悬液(约2×106个/mL)于3 000 r/min离心10 min,PBS洗2次,将配好的DCFHDA溶液(20 µmol/L)0.5 mL重悬细胞,37 ℃孵育20 min,3 000 r/min离心3 min,弃上清液,PBS洗2 次,用流式细胞仪检测细胞内DCF的荧光强度,以DCF的荧光强度来表示细胞内ROS的含量,荧光强度越强表明ROS含量越高。
1.3.6 流式细胞仪检测巨噬细胞吞噬活性
收集腹腔巨噬细胞,将细胞悬液(约2×106个/mL)于3 000 r/min离心10 min,PBS洗2 次,加入荧光标记FITC-Dextran(5 mg/mL)2 μL,细胞培养箱中孵育1 h。3 000 r/min离心3 min,PBS洗涤细胞2 次。流式细胞仪检测巨噬细胞对FITC-Dextran的荧光强度,以此反映细胞的吞噬功能,荧光强度越强表明其吞噬活性越高。
1.3.7 NO含量的测定
实验结束后按组分别收集小鼠腹腔巨噬细胞培养上清液,根据Griess法测定实验样本中NO含量,具体操作方法参照NO试剂盒说明书。
1.3.8 细胞因子含量的测定
实验结束后按组分别收集小鼠腹腔巨噬细胞培养上清液,根据试剂盒说明书,采用ELISA检测细胞培养上清液中细胞因子(TNF-α和IL-1β)含量。最后采用多功能酶标仪在492 nm波长处测定吸光度,根据标准曲线(以标准品浓度为横坐标,A292nm为纵坐标)计算出实验样本中细胞因子含量。
1.3.9 TLR4和NF-κB蛋白表达量的测定
将2.5 mL小鼠腹腔巨噬细胞接种到6 孔培养板中(2×106个/孔)。细胞培养48 h后,PBS冲洗两遍,加入细胞裂解液,采用蛋白提取试剂盒提取细胞蛋白。收集细胞蛋白,BCA蛋白质量浓度测定试剂盒测定蛋白质量浓度,等量蛋白上样,进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electropheresis,SDS-PAGE)(50 V电压,30 min;100 V电压,55 min),半干转PVDF膜,封闭2 h、一抗过夜、HRP标记二抗2 h。ECL化学发光显色反应,应用全能型凝胶成像分析系统成像。
1.4 数据统计分析
实验数据均以 ±s表示,采用SPSS 22.0统计软件进行单因素方差分析和t检验,P<0.05为差异有显著性意义。
2 结果与分析
2.1 EGCG对巨噬细胞增殖的影响
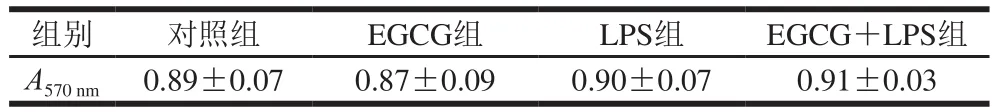
表1 EGCG对巨噬细胞增殖的影响Table 1 Effect of EGCG and/or LPS on the proliferation of mouse peritoneal macrophages
如表1显示,巨噬细胞经EGCG预处理后,EGCG组与对照组相比无显著差异。与对照组相比,LPS组和EGCG+LPS组中腹腔巨噬细胞有轻微的增殖,但统计学分析均无显著性差异(P>0.05)。这些结果提示,本实验中EGCG(25 µmol/L)、LPS(1 µg/mL)、EGCG+LPS对巨噬细胞增殖无明显影响。
2.2 EGCG对巨噬细胞细胞凋亡率的影响
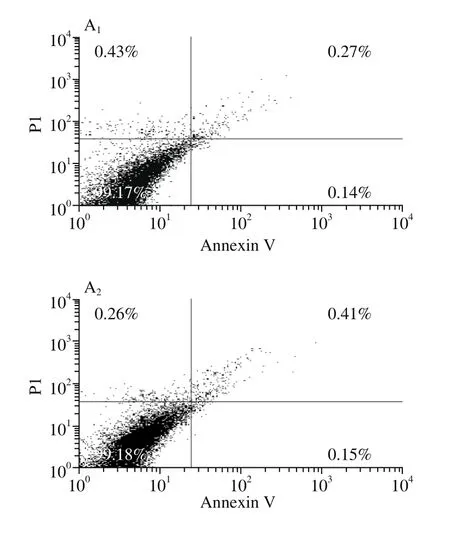

图1 EGCG和/或LPS对小鼠腹腔巨噬细胞凋亡的影响Fig. 1 Effect of EGCG and/or LPS on apoptosis in mouse peritoneal macrophages
细胞凋亡是细胞的正常生理现象,巨噬细胞凋亡具有自身的特点,既可调控自身的细胞功能,又可介导非己细胞的细胞凋亡[14]。由图1可知,在EGCG、LPS、EGCG+LPS给予巨噬细胞处理后,实验组中腹腔巨噬细胞的细胞凋亡率与对照组相比,均处于一个较低的水平,各组之间无显著性差异(P>0.05)。说明本实验中EGCG和/或LPS对巨噬细胞的正常凋亡无明显影响。
2.3 EGCG对小鼠腹腔巨噬细胞吞噬的影响
巨噬细胞通过荧光探针FITC-Dextran标记后,上样于流式细胞仪,检测Dextran的荧光强度。Dextran的荧光强度可反应巨噬细胞的吞噬活性,荧光强度越强,巨噬细胞吞噬活性越高。吞噬结果如图2所示,在LPS(1 μg/mL)的作用下,与对照组相比,腹腔巨噬细胞的平均荧光强度从40.58±8.53升高到215.80±38.28,腹腔巨噬细胞吞噬功能极显著增加(P<0.01)。在EGCG(25 µmol/L)预处理后加入LPS(1 μg/mL)刺激,与LPS(1 μg/mL)组相比,腹腔巨噬细胞的平均荧光强度从215.80±38.28下降到90.16±13.32,差异极显著(P<0.01),即EGCG能显著抑制LPS(1 μg/mL)激活的小鼠腹腔巨噬细胞的吞噬功能。
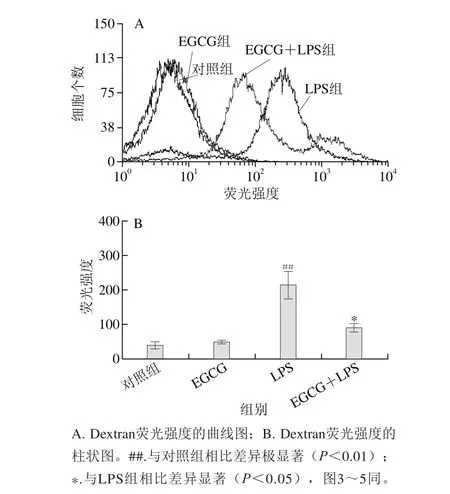
图2 EGCG对LPS处理的小鼠腹腔巨噬细胞吞噬的影响Fig. 2 Effect of EGCG on phagocytosis of mouse peritoneal macrophages
2.4 EGCG对小鼠腹腔巨噬细胞ROS含量的影响
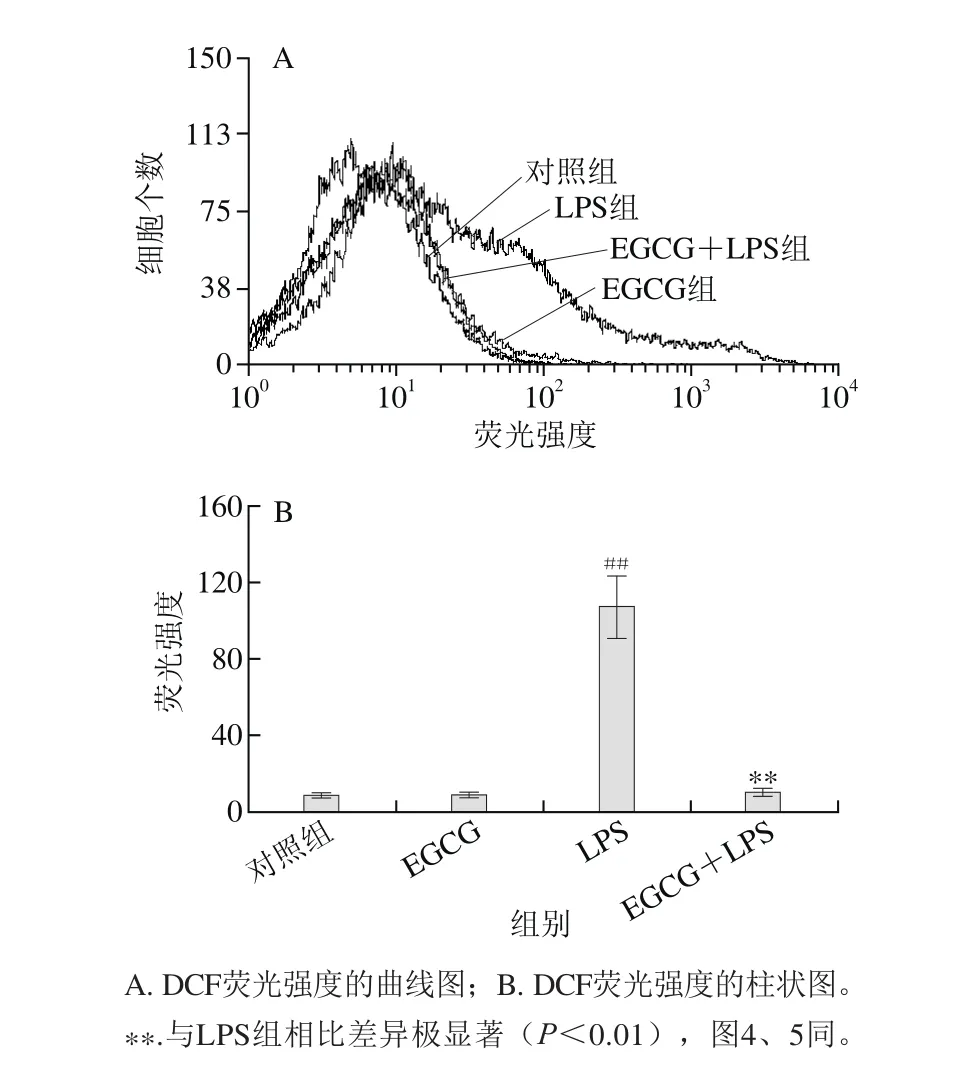
图3 EGCG对小鼠腹腔巨噬细胞ROS含量的影响Fig. 3 Effect of EGCG on the generation of ROS in mouse peritoneal macrophages
由图3可知,1 μg/mL LPS刺激小鼠腹腔巨噬细胞能使细胞内ROS含量显著上升,与对照组相比有明显差异(P<0.01)。对照组荧光强度为8.79±1.41,LPS(1 μg/mL)的刺激后明显升高到106.98±17.27。在EGCG(25 µmol/L)预处理后加入LPS(1 μg/mL)刺激,与LPS组相比,小鼠腹腔巨噬细胞内ROS含量明显降低(P<0.01),DCF荧光强度为10.68±2.59。实验结果表明,EGCG能极显著降低LPS刺激活化的小鼠腹腔巨噬细胞内产生的ROS。
2.5 EGCG对小鼠腹腔巨噬细胞中NO、细胞因子含量的影响

表2 EGCG对LPS处理的小鼠腹腔巨噬细胞中NO 、IL-1β和TNF-α含量的影响Table 2 Effect of EGCG on the production of NO, IL-1βand TNF-α in mouse peritoneal macrophages
由表2可以看出,对照组的小鼠腹腔巨噬细胞释放的NO含量很少;LPS(1 μg/mL)刺激24 h能促进巨噬细胞释放NO,与对照组相比具有极显著差异(P<0.01);若先用EGCG(25 µmol/L)预处理24 h,再加入LPS刺激24 h,则NO的产生量受到明显抑制,与LPS组相比具有极显著差异(P<0.01)。
实验采用ELISA法检测各组细胞中释放细胞因子TNF-α、1L-1β的量,结果如表2所示,与对照组相比,在LPS 组中,TNF-α由(513.53±68.97)ng/mL升高到(3 150.13±319.82)ng/mL,有极显著差异(P<0.01);IL-1β含量由(38.62±14.48)pg/mL升高到(292.77±58.14)pg/mL,有极显著差异(P<0.01),故LPS(1 μg/mL)能显著地促进小鼠腹腔巨噬细胞释放TNF-α、1L-1β。在EGCG(25 µmol/L)预处理后加入LPS(1 μg/mL)刺激,与LPS组相比,TNF-α由(3 150.13±319.82)ng/mL下降到(1 874.93±122.75) ng/mL,有极显著差异(P<0.01);IL-1β由(292.77±58.14)pg/mL下降到(225.58±34.07)pg/mL,有显著差异(P<0.01)。故EGCG能抑制经LPS激活巨噬细胞分泌TNF-α、IL-1β的水平。
2.6 EGCG对小鼠腹腔巨噬细胞中TLR4表达的影响
免疫的发生及其调控涉及复杂的免疫识别机制,依赖于种系编码的模式识别受体(pattern recognition receptors,PRRs)。TLR4是巨噬细胞表面重要PRRs,可识别并结合EGCG,触发细胞信号转导,调控免疫基因表达,执行免疫调控功能。此外,LPS是巨噬细胞TLR4中的主要配体,可与TLR4结合[15-16]。由图4的Western blot结果可知,在腹腔巨噬细胞未接受任何处理的对照组中,TLR4蛋白表达在一个较低的水平;与对照组相比,LPS组中小鼠腹腔巨噬细胞中TLR4的表达量极显著上调(P<0.01)。与LPS组相比,EGCG+LPS组中TLR4的蛋白表达极显著下降(P<0.01)。与此同时EGCG单独处理巨噬细胞后,与对照组比较,巨噬细胞中TLR4的表达无明显变化。这些结果表明EGCG的抗炎作用与细胞表面受体对TLR4的调节有关。
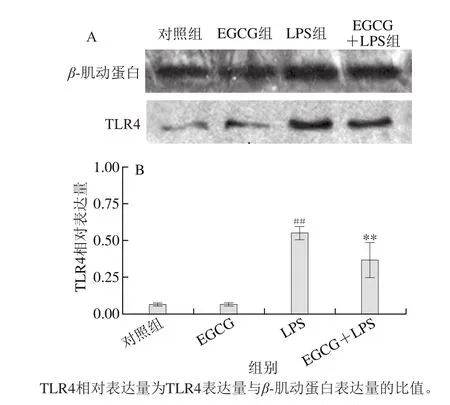
图4 EGCG对巨噬细胞表面TLR4表达的影响Fig. 4 Effect of EGCG on the expression of TLR4 in LPS-stimulated macrophages
2.7 EGCG对小鼠腹腔巨噬细胞中NF-κB p65表达的影响

图5 EGCG对巨噬细胞NF-κB p65表达的影响Fig. 5 Effect of EGCG on the expression of NF-κB p65 in LPS-stimulated macrophages
NF-κB信号转导通路,在巨噬细胞的炎症免疫反应中发挥重要的信号级联作用。LPS与TLR4结合后,激活NF-κB信号转导通路,促进炎症因子的释放,介导炎症反应[17]。Western blot实验结果如图5所示,与对照组相比,LPS组中小鼠腹腔巨噬细胞细胞核蛋白中NF-κB p65表达量显著增加;LPS处理巨噬细胞前,加入EGCG预处理24 h,极显著降低LPS介导的NF-κB p65蛋白表达的上调(P<0.01)。与此同时EGCG单独处理巨噬细胞后,与对照组比较,巨噬细胞中NF-κB p65蛋白的表达无显著变化。这说明EGCG抑制LPS介导的炎症,与可通过抑制NF-κB通路的激活有关。
3 讨 论
巨噬细胞作为机体重要的免疫细胞,具有很强的可塑性,在炎症反应和维持机体稳态过程中发挥着举足轻重的作用。M1型巨噬细胞主要通过分泌TNF-α、1L-1β和NO等,介导炎症反应的发生[18-19]。LPS炎症模型是最常见的炎症模型,其诱炎机理为LPS与细胞表面的CD14结合,然后再结合TLR4复合物,激活肿瘤坏死受体相关因子6,进一步激活转化生长因子激活激酶1,然后使NF-κB抑制性蛋白(NF-kappa B inhibitor,IκB)激酶磷酸化,导致IκB降解,使NF-κB信号通路激活,促进炎症因子释放,同时启动诱导型一氧化氮合酶转录,释放NO,促进巨噬细胞向M1型极化[20-21]。本实验通过原代培养小鼠腹腔巨噬细胞,应用LPS刺激巨噬细胞建立炎症实验模型。通过检测不同组别中巨噬细胞的NO、TNF-α、IL-1β含量及NF-κB p65蛋白表达量来说明EGCG对LPS致炎的巨噬细胞的抗炎作用。实验结果表明,与对照组相比,LPS组中小鼠腹腔巨噬细胞TNF-α、1L-1β和NO水平增加,NF-κB p65蛋白表达量增加,小鼠腹腔巨噬细胞呈现M1型。本实验结果还显示,与LPS组相比,小鼠腹腔巨噬细胞经EGCG预处理后,TNF-α、1L-1β、NO的水平显著下降。表明EGCG可抑制LPS诱导的巨噬细胞向M1表型极化。
研究证实,当巨噬细胞、嗜中性粒细胞等炎症细胞被激活后,细胞内的各种氧化酶的表达水平增加,释放大量的ROS来清除坏死的细胞。持久且异常的炎症过程中ROS可以在细胞间充当第二信使,能够通过趋化因子的表达,增加炎性细胞黏附,是炎症反应表现出级联效应,机体原有的抗氧化-氧化平衡被打破,生成过量的ROS作用于生物大分子造成细胞和组织损伤[22-23]。LPS作为一个革兰氏阴性细菌细胞壁的主要成分,是免疫反应中的促炎刺激物,在进入细胞后能在增强巨噬细胞的吞噬功能力和ROS的生成。本实验中,LPS刺激小鼠腹腔巨噬细胞能使细胞吞噬能力和ROS的水平与对照组相比显著上升。EGCG可抑制LPS诱导的巨噬细胞向M1表型极化的同时也抑制了巨噬细胞的吞噬活性和ROS的生成。
NF-κB是一种核转录因子,化学本质是由多肽亚单位组成的蛋白质家族,包括NF-κB2(p52)、p65(RelA)、NF-κB1(p50)、cRel、RelB 5 个成员,存在于真核生物中[24-26]。5 个家族成员的共同点是氨基末端有由近300 个氨基酸组成的保守区域(Rel同源区,RHD)。RHD里的功能区能够通过二聚化、与DNA结合等方式,调控靶基因的表达。抑制状态的NF-κB滞留在细胞质中。在哺乳动物中,IκB家族有8 个成员IκBa、IκBy、IκBP、BcL-3、IκBe、IicB-R、pl00、pl05[27-28]。NF-κB信号通路的激活有两条途径——经典途径和非经典途径。其中经典途径指的是NF-κB信号通路被大量的细胞因子等迅速激活,这种激活主要依赖由IκB激酶(IκB kinase,IKK)诱导的IκB的降解。当IKK激活后,可以使IκB特定位点发生降解,进而激活NF-κB信号通路。当NF-κB被激活后,NF-κB能和STAT1信号通路等共同作用,促进巨噬细胞向M1型极化,然后促进促炎因子的释放,出现炎症反应[29-30]。实验结果显示EGCG可通过抑制NF-κB信号通路的活化抑制LPS诱导的炎症。炎症的发生及其调控涉及复杂的免疫识别机制,依赖于种系编码的PRRs。TLR受体家族是生物致炎因素的主要受体,主要表达在固有免疫细胞表面,能与各种细菌或病毒的分解产物结合。TLR4是LPS的主要受体,LPS配体与TLR4受体结合后,可通过激活NF-κB促进细胞因子等的释放,从而发生炎症反应。本实验结果发现,LPS组中NF-κB信号通路活化的同时,TLR4的蛋白表达量增加。EGCG预处理后,可显著抑制LPS介导TLR4蛋白的增加和NF-κB信号通路的活化。
总之,本实验发现EGCG具有抗炎作用,EGCG预处理LPS刺激的小鼠腹腔巨噬细胞,可抑制小鼠巨噬细胞中M1型相关炎症参数的增加;提示EGCG的抗炎作用可通过竞争性的结合TLR4受体阻断NF-κB通路,继而抑制巨噬细胞向M1型极化。
参考文献:
[1] 张荧荧, 李渊越, 韩家淮. 炎症反应, 健康卫士还是癌症帮凶?[J]. 中国基础科学, 2012, 14(2): 11-14. DOI:10.3969/j.issn.1009-2412.2012.02.003.
[2] 刘远锦, 田媛媛, 刘博, 等. γ-谷维素对脂多糖诱导巨噬细胞RAW264.7炎症因子表达的影响[J]. 食品科学, 2015, 36(19): 238-243. DOI:10.7506/spkx1002-6630-201519043.
[3] 赵丹, 苏宁, 杨丽, 等. 蓝莓叶总黄酮的体外抗炎功效评价[J]. 食品科学, 2015, 36(17): 231-235. DOI:10.7506/spkx1002-6630-201517043.
[4] LU C C, YEN G C. Antioxidative and anti-inf l ammatory activity of functional foods[J]. Current Opinion in Food Science, 2015, 2: 1-8.DOI:10.1016/j.cofs.2014.11.002.
[5] GAO Z, HAN Y, HU Y H, et al. Targeting HO-1 by epigallocatechin-3-gallate reduces contrast-induced renal injury via anti-oxidative stress and anti-inflammation pathways[J]. PLoS ONE, 2016, 11(2): 1-17.DOI:10.1371/journal.pone.0149032.
[6] SEONG K J, LEE H G, KOOK M S, et al. Epigallocatechin-3-gallate rescues LPS-impaired adult hippocampal neurogenesis through suppressing the TLR4-NF-κB signaling pathway in mice[J]. The Korean Journal of Physiology & Pharmacology, 2016, 20(1): 41-51.DOI:10.4196/kjpp.2016.20.1.41.
[7] MOSSER D M, EDWARDS J P. Exploring the full spectrum of macrophage activation[J]. Nature Reviews Immunology, 2008, 8(12):958-969. DOI:10.1038/nri2448.
[8] WANG J H, MANNING B J, WU Q D, et al. Endotoxin/lipopolysaccharide activates NF-κB and enhances tumor cell adhesion and invasion through a β1 integrin-dependent mechanism[J]. The Journal of Immunology, 2003, 170(2): 795-804. DOI:10.4049/jimmunol.170.2.795.
[9] ORR M T, DUTHIE M S, WINDISH H P, et al. MyD88 and TRIF synergistic interaction is required for TH1-cell polarization with a synthetic TLR4 agonist adjuvant[J]. European Journal of Immunology,2013, 43(9): 2398-2408. DOI:10.1002/eji.201243124.
[10] 李红蓉, 孙颖, 常成成, 等. Notch信号通路调节巨噬细胞极化研究进展[J]. 医学研究生学报, 2015, 28(12): 1316-1321. DOI:10.16571/j.cnki.1008-8199.2015.12.019.
[11] 张莘莘, 李文娟, 聂少平, 等. 黑灵芝多糖对体外培养的小鼠腹腔巨噬细胞功能的影响[J]. 中国药理学通报, 2010, 26(9): 1139-1142.
[12] NAKAZATO T, ITO K, IKEDA Y, et al. Green tea component,catechin, induces apoptosis of human malignant B cells via production of reactive oxygen species[J]. Clinical Cancer Research, 2005, 11(16):6040-6049. DOI:10.1158/1078-0432.
[13] LI W J, NIE S P, YU Q, et al. (-)-Epigallocatechin-3-gallate induces apoptosis of human hepatoma cells by mitochondrial pathways related to reactive oxygen species[J]. Journal of Agricultural and Food Chemistry, 2009, 57(15): 6685-6691. DOI:10.1021/jf901396f.
[14] FADOK V A, BRATTON D L, KONOWAL A, et al. Macrophages that have ingested apoptotic cells in vitro inhibit proinflammatory cytokine production through autocrine/paracrine mechanisms involving TGF-beta, PGE2, and PAF[J]. Journal of Clinical Investigation, 1998,101(4): 890-898. DOI:10.1172/JCI1112.
[15] SAKHARWADE S C, MUKHOPADHAYA A. Vibrio cholerae porin OmpU induces LPS tolerance by attenuating TLR-mediated signaling[J]. Molecular Immunology, 2015, 68(2): 312-324.DOI:10.1016/j.molimm.2015.09.021.
[16] CUI J X, CHU Q, XU T J. miR-122 involved in the regulation of tolllike receptor signaling pathway after Vibrio anguillarum infection by targeting TLR14 in miiuy croaker[J]. Fish & Shellf i sh Immunology,2016, 58: 67-72. DOI:10.1016/j.fsi.2016.09.027.
[17] MURSHID A, GONG J, PRINCE T, et al. Scavenger receptor SREC-I mediated entry of TLR4 into lipid microdomains and triggered inf l ammatory cytokine release in RAW 264.7 cells upon LPS activation[J].PLoS ONE, 2015, 10(4): 1-24. DOI:10.1371/journal.pone.0122529.
[18] LEE W J, TATEYA S, CHENG A M, et al. M2 macrophage polarization mediates anti-inf l ammatory effects of endothelial nitric oxide signaling[J].Diabetes, 2015, 64(8): 2836-2846. DOI:10.2337/db14-1668.
[19] MAURO A, RUSSO V, DI MARCANTONIO L, et al. M1 and M2 macrophage recruitment during tendon regeneration induced by amniotic epithelial cell allotransplantation in ovine[J]. Research in Veterinary Science, 2016, 105: 92-102. DOI:10.1016/j.rvsc.2016.01.014.
[20] XING J, LI R, LI N, et al. Anti-inflammatory effect of procyanidin B1 on LPS-treated THP1 cells via interaction with the TLR4-MD-2 heterodimer and p38 MAPK and NF-κB signaling[J]. Molecular and Cellular Biochemistry, 2015, 407(1/2): 89-95. DOI:10.1007/s11010-015-2457-4.
[21] 肖鹏. 表没食子儿茶素没食子酸酯对脂多糖诱导的小鼠巨噬细胞炎症相关因子表达的影响[D]. 新乡: 河南师范大学, 2014: 1-65.
[22] MILLS E L, O’NEILL L A. Reprogramming mitochondrial metabolism in macrophages as an anti-inflammatory signal[J]. European Journal of Immunology, 2016, 46(1): 13-21. DOI:10.1002/eji.201445427.
[23] CHIOUU Y S, HUANG Q, HO C T, et al. Directly interact with Keap1 and LPS is involved in the anti-inflammatory mechanisms of (-)-epicatechin-3-gallate in LPS-induced macrophages and endotoxemia[J]. Free Radical Biology and Medicine, 2016, 94: 1-16.DOI:10.1016/j.freeradbiomed.2016.02.010.
[24] HÖRBER S, HILDEBRAND D G, LIEB W S, et al. The atypical inhibitor of NF-κB, IκBζ, controls macrophage interleukin-10 expression[J]. Journal of Biological Chemistry, 2016, 291(24): 12851-12861. DOI:10.1074/jbc.M116.718825.
[25] 赵宁. NF-κB信号通路介导的TNF-α抑制骨髓基质细胞成骨分化过程中的作用研究[D]. 济南: 山东大学, 2012: 1-101.
[26] 陈金龙, 张月巧, 袁娅, 等. 植物多糖通过NF-κB信号通路对巨噬细胞的免疫调节作用研究进展[J]. 食品科学, 2015, 36(23): 288-294.DOI:10.7506/spkx1002-6630-201523053.
[27] GHOSH S, MAY M J, KOPP E B. NF-κB and Rel proteins:evolutionarily conserved mediators of immune responses[J]. Annual Review of Immunology, 1998, 16(1): 225-260. DOI:10.1146/annurev.immunol.16.1.225.
[28] GHOSH S, KARIN M. Missing pieces in the NF-κB puzzle[J]. Cell,2002, 109(Suppl 2): 81-96. DOI:10.1016/S0092-8674(02)00703-1.
[29] LI H B, LI X, HUO C J, et al. TLR4/MyD88/NF-κB signaling and PPAR-γ within the paraventricular nucleus are involved in the effects of telmisartan in hypertension[J]. Toxicology and Applied Pharmacology, 2016, 305: 93-102. DOI:10.1016/j.taap.2016.06.014.
[30] PARK H S, NELSON D E, TAYLOR Z E, et al. Suppression of LPS-induced NF-κB activity in macrophages by the synthetic aurone,(Z)-2-((5-(hydroxymethyl) furan-2-yl) methylene) benzofuran-3(2H)-one[J]. International Immunopharmacology, 2017, 43: 116-128.DOI:10.1016/j.intimp.2016.12.004.
EGCG Inhibits LPS-Caused Polarization of Macrophages into M1 Phenotype via the NF-κB Pathway
WU Qiong1, WANG Lefeng1, ZHANG Yansong2, TANG Xiaofang2, ZHANG Xianyi2, LI Lu2, SHU Yao2, HUANG Cheng2,LIAO Jinzhu2, WANG Fulong2, LI Wenjuan2,*
(1. The Second Aff i liated Hospital of Nanchang University, Nanchang 330006, China;2. State Key Laboratory of Food Science and Technology, Nanchang University, Nanchang 330047, China)
Objective: The aim of this study was to explore the anti-inf l ammatory effect of (-)-epigallocatechin gallate (EGCG)and its effects on macrophage polarization. Methods: Primary cultures of mouse peritoneal macrophages were divided into 4 groups: control, 1 μg/mL lipopolysaccharides (LPS), 25 µmol/L EGCG, and 25 µmol/L EGCG + 1 μg/mL LPS groups. Flow cytometry analysis was used to determine phagocytosis, reactive oxygen species (ROS) and apoptosis. Cell proliferation was monitored by 3-(4,5-dimethyl-2-thiazolyl)-2,5-diphenyl-2-H-tetrazolium bromide (MTT) assay. NO generation was analyzed by Griess method. The levels of tumor necrosis factor-α (TNF-α) and interleukin-1β (IL-1β) were determined by enzyme linked immunosorbent assay (ELISA). The expression of Toll-like receptor 4 (TLR4) and NF-κB p65 proteins was detected by using Western blot analysis. Results: EGCG and/or LPS were no signif i cant effect on cell proliferation or apoptosis in mouse peritoneal macrophages. Compared with the LPS group, EGCG could significantly inhibit the LPS-induced increasing in ROS, NO, TNF-α and IL-1β in peritoneal macrophages (P < 0.01), thereby consequently suppress the polarization of macrophages into M1 phenotype and consequently exerting anti-inf l ammatory effects. Compared with the LPS group, the expression of TLR4 protein in macrophages and the expression of nuclear transcription factor-κB(NF-κB) p65 in nucleus were signif i cantly decreased in the EGCG + LPS group (P < 0.01). Conclusion: EGCG could inhibit LPS-induced inf l ammatory responses in mouse peritoneal macrophages, and the underlying mechanism may be related to the blocking of the polarization of macrophages into M1 phenotype via the TLR4-mediated NF-κB pathway.
(-)-epigallocatechin gallate; anti-inf l ammatory effects; cell phenotype; NF-κB pathway; macrophage polarization
2016-10-27
国家自然科学基金地区科学基金项目(31560460);江西省科技厅自然科学基金项目(20151512041185);“三区”人才支持计划科技特派人员专项(0210208651)
吴琼(1984—),女,主管技师,硕士,研究方向为免疫学相关性。E-mail:66077223@qq.com
*通信作者简介:李文娟(1982—),女,副教授,博士,研究方向为食品安全与营养。E-mail:wenjuanli@ncu.edu.cn
10.7506/spkx1002-6630-201801022
TS201.4
A
1002-6630(2018)01-0142-07
吴琼, 王乐锋, 张妍淞, 等. 表没食子儿茶素没食子酸酯通过NF-κB通路抑制脂多糖诱导的巨噬细胞向M1表型极化[J].食品科学, 2018, 39(1): 142-148.
10.7506/spkx1002-6630-201801022. http://www.spkx.net.cn
WU Qiong, WANG Lefeng, ZHANG Yansong, et al. EGCG inhibits LPS-caused polarization of macrophages into M1 phenotype via the NF-κB pathway[J]. Food Science, 2018, 39(1): 142-148. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201801022. http://www.spkx.net.cn

