低钠干腌肉加工过程中肌内结缔组织特性
刘成花,李 顺,张雅玮,刘世欣,黄孝闯,陈冬冬,彭增起*
(南京农业大学食品科技学院,食品安全与营养协同创新中心,江苏 南京 210095)
低钠干腌肉加工过程中肌内结缔组织特性
刘成花,李 顺,张雅玮,刘世欣,黄孝闯,陈冬冬,彭增起*
(南京农业大学食品科技学院,食品安全与营养协同创新中心,江苏 南京 210095)
以猪背最长肌为实验材料,食盐组为对照组,研究低钠盐对干腌肉加工过程中肌内结缔组织特性的影响。结果显示:陈香结束后,低钠组次级肌束膜厚度比食盐组低0.72 μm(P<0.05),胶原蛋白热溶解性比食盐组高0.91%(P<0.05),而低钠组胶原蛋白总含量、初级肌束膜厚度、成熟交联含量与食盐组相比差异不显著(P>0.05)。与食盐相比,低钠盐使α-螺旋、β-转角的相对含量分别减少了11.69%、13.41%(P<0.05),聚集片、无规卷曲的相对含量分别增加了46.88%、5.82%(P<0.05)。干腌猪肉加工中,低钠盐较食盐能进一步促进肌内结缔组织蛋白降解。
低钠盐;肌内结缔组织;胶原蛋白;成熟交联
传统干腌肉制品如干腌火腿的含盐量一般在6%~12%,咸肉、腊肉等也在8%左右,如此高的盐含量不仅影响产品品质,而且不利于消费者的健康[1]。研究表明,长期的高钠摄入不仅会增加肾脏负担、患肾结石的风险,更会引起高血压、心脏病、中风等心血管疾病[2]。因此,目前国内外学者积极探索低钠干腌肉制品。杨应笑等[3]研究显示,40% KCl替代NaCl的低钠腊肉可接受度最大,当KCl替代比例超过60%时,产品具有金属味、涩味等不良风味,不能被接受。在低钠干腌里脊中,Aliño等[4]用50% KCl+15% CaCl2+5% MgCl2+30% NaCl混合物替代NaCl可显著增加干腌里脊的硬度和咀嚼性,25% KCl+15% CaCl2+5% MgCl2+55% NaCl混合物替代NaCl时对产品质构没有显著影响。Armenteros等[5]选用50% KCl+50% NaCl、25% KCl+15% CaCl2+5% MgCl2+55% NaCl两种混合物研究低钠干腌火腿,结果显示,两组低钠干腌火腿的接受度低于食盐组,尤其是二价钙盐和镁盐的存在使火腿有金属味、辛辣味,50% KCl替代组有明显的苦涩味。
肉的食用品质包括滋味、气味、质地、多汁性等,其中以代表肉质地品质的质构最为重要,消费者常以肉的质构来评价肉品质的优劣[6-7]。肉的质构是指肌肉中各种蛋白质结构特性的总体概括,反映了舌头对肉感觉的柔软性,肉对牙齿压力的抵抗力以及咬断肌纤维、结缔组织的难易程度和嚼碎程度[8],金华火腿或其他干腌肉制品咀嚼起来,口腔内存留的渣感、咀嚼不碎的物质即是肌内结缔组织。肌内结缔组织对肌肉的质构、风味、多汁性有重要作用,胶原蛋白是肌内结缔组织的主要构成成分[9]。多年来,国内外学者通过研究宰前、宰后条件下结缔组织对质构的影响,指出肌内结缔组织特性(如胶原蛋白含量及其热溶解性、肌束膜厚度等)影响并决定肉的质构[10-14]。近年来,关于结缔组织特性的研究报道主要集中在不同动物种类、宰后成熟时间、不同部位肌肉中,原料肉或蒸煮肉的胶原蛋白含量及其热溶解性、共价交联等与质构相关性方面[9,15-17]。鲜见干腌肉制品及其加工过程中肌内结缔组织特性变化的研究报道,更鲜见低钠盐对肌内结缔组织特性的研究报道。
因此,本实验以食盐为对照,采用一种新型低钠盐加工低钠干腌肉。研究低钠干腌肉加工过程中肌内结缔组织特性变化规律,旨在揭示低钠盐对肌内结缔组织特性的影响,为后续调控干腌肉加工中肌内结缔组织特性的研究提供参考。
1 材料与方法
1.1 材料与试剂
取三元杂交猪背最长肌,三元杂交猪屠宰平均月龄为7 个月,体质量100 kg左右;无碘食用盐购于山东菜央子盐场。
低钠盐为本课题组自制(含氯化钠、氯化钾、葡萄糖酸钠、赖氨酸、甘氨酸、鸟氨酸-β-丙氨酸、氢氧化钾,其中NaCl质量分数约为50%);羟脯氨酸标准品美国Sigma公司;苦味酸-天狼星红染色液、PA饱和水溶液 南京森贝伽生物科技有限公司;成熟交联试剂盒上海蓝基生物有限公司;其他试剂均为国产分析级国药集团化学试剂有限公司。
1.2 仪器与设备
BY型恒温恒湿箱 东莞宝元通仪器设备公司;Adventurer®Pro先进型电子天平 美国OHAUS公司;DGG-9240A型电热恒温鼓风干燥箱 上海森信实验仪器有限公司;Allegra 64R型高速冷冻离心机、DU730型紫外-可见分光光度计 美国Beckman Coulter公司;CM1950冷冻切片机 德国Leica公司;DP72正置荧光相差显微镜 日本Olympus公司;SpectraMax M2酶标仪美国Molecular Devices公司;Heto PowerDry LL3000冷冻干燥机 德国SG公司;Nexus870型傅里叶变换红外光谱仪 美国Nicolet公司。
1.3 方法
1.3.1 低钠干腌猪肉加工流程
猪背最长肌去肌外膜→添加3%(质量分数,下同)低钠盐、3%食盐作对照→腌制→脱水→干燥→落架→陈香→成品
分别于主要工艺点随机抽取3 个样品,真空包装,-20 ℃冻藏备用。每个样品各指标测定均设3 个平行。具体取样工艺点及加工条件见表1。

表1 低钠干腌猪肉制品加工过程及工艺点选取Table 1 Selection of sampling points during the processing of low sodium dry-cured pork meat
1.3.2 测定方法
1.3.2.1 胶原蛋白总量及其热溶解性测定
胶原蛋白总量采用羟脯氨酸分光光度法测定,具体参考Xu Shuqin等[18]的方法:称取约300 mg冻干肉样品,充分研磨后添加10 mL 6 mol/L HCl溶液,于110 ℃下酸解16~18 h,待完全酸解后,4 ℃、16 000×g离心5 min,收集上清液待用。用1 mol/L NaOH溶液调整pH值至8.0±0.2,定容到10 mL后进行羟脯氨酸含量测定。于558 nm波长处测定吸光度。同时以羟脯氨酸为标准,绘制标准曲线,胶原蛋白总量由羟脯氨酸含量乘以7.25得出,各组设置3 个平行,结果表示为mg/g md。
胶原蛋白热溶解性测定参考Nishimura等[19]的方法操作,并稍作修改,具体操作如下:称取约300 mg冻干肉样充分研磨后于10 mL Ringer’s试剂中匀浆(冰浴,20 000 r/min,每次20 s,间隔30 s),混匀溶胀1 h后,77 ℃水浴65 min,室温冷却30 min;离心(2 ℃,6 000×g,10 min),收集上清液;用5 mL Ringer’s试剂溶解沉淀,再次离心,收集上清液,合并两次上清液,上清液即为可溶性胶原蛋白。上清液加25 mL浓盐酸,于110 ℃消化炉消化16~18 h;趁热过滤于25 mL容量瓶内,用10 mL 6 mol/L HCl溶液反复冲洗三角瓶和滤纸2 次,冷却,用蒸馏水定容至刻度,混匀。吸取10 mL滤液于烧瓶内,用1 mol/L NaOH溶液微调中和除酸,调节至pH(8.0±0.2),过滤于25 mL容量瓶中,水洗定容,用于羟脯氨酸含量测定;胶原蛋白的热溶解性按下式计算。

1.3.2.2 肌内结缔组织组织学观察
肌内结缔组织的组织学观察参考常海军[8]和李春保[20]的方法,略作修改。从每块肉样中心取一小块(0.5 cm×0.5 cm×0.5 cm)置于-80 ℃速冻,然后取出肉样,用冷冻超薄切片机垂直于肌纤维方向进行超薄切片,厚度约10 μm。染色基本步骤为:丙酮(浸泡5 h,去除脂肪),苦味酸-甲醛固定液(10 min),90%乙醇冲洗(1 min),温和流动水冲洗(10 min),苦味酸-天狼星红染色液滴染(1 h),0.01 mol/L HCl(5 min),蒸馏水(1 min),100%乙醇(1 min,3 次),二甲苯(3 min,2 次),封片观察。
切片于10 倍物镜下观察、拍照,每个样品在不同视野下拍摄图片10 张。用Image-pro plus 软件测定初/次级肌束膜厚度,每幅图选取8~10 个测量点(图1)。每个处理重复3 次。

图1 干腌肉组织切片(×100)Fig. 1 Section of muscle tissue in dry-cured meat (× 100)
1.3.2.3 成熟交联含量的测定
成熟交联含量测定参考Dubost等[16]的方法,前处理具体过程如下:称取300 mg冻干肉样充分研磨后用10 mL 6 mol/L HCl溶液于110 ℃下过夜进行酸消解,所得酸解物4 ℃、16 000×g离心5 min,收集上清液(即酸解液)待用。取上述酸解液1 mL,向其中加入1 mL 6 mol/L NaOH和1 mL 1 mol/L Tris溶液,再用6 mol/L HCl、6 mol/L NaOH溶液调整pH值至7.0~7.2后定容到10 mL,待后续测定。
结缔组织中成熟交联测定采用酶联免疫法,具体操作方法参照试剂盒使用说明书,由标准曲线计算样品含量。设3 个平行,结果表示为ng/g md。
1.3.2.4 肌内结缔组织二级结构测定
肌内结缔组织的提取参照Aktaş[21]和Badii[22]等的方法,并略作修改。取30 g肉样中心部分,用预冷的0.05 mol/L NaCl、0.02 mol/L 磷酸盐缓冲液(phosphate buffered saline,PBS)(pH 6.1)、1 mmol/L苯甲基磺酰氟(phenylmethanesulfonyl fluoride,PMSF)充分匀浆,过30 目滤网,重复此程序3~5 次。所得结缔组织于0.05 mol/L NaCl、0.02 mol/L PBS(pH 6.1)、1 mmol/L PMSF、0.05 mmol/L 乙二胺四乙酸(ethylenediaminetetraacetic acid,EDTA)中0~4 ℃低速搅拌12 h。4 ℃下3 000×g离心20 min,弃上清液,沉淀重新匀浆,所得沉淀于0.05 mol/L NaCl、0.02 mol/L PBS(pH 6.1)、1 mmol/L PMSF、0.05 mmol/L EDTA中0~4 ℃低速搅拌12 h,4 ℃下3 000×g离心20 min,弃上清液,所得沉淀即为肌内结缔组织,于-20℃预冷冻后进行真空冷冻干燥,真空包装,-80 ℃保存待用。各组设置3 个平行。
参照钟朝辉等[23]的方法,测定傅里叶变换红外光谱,具体操作如下:取结缔组织冻干品(约2 mg)与KBr压片,取出置于傅里叶变换红外光谱仪下进行测定。扫描范围400~4 000 cm-1,扫描分辨率4 cm-1,扫描次数40 次。所得红外图谱的1 600~1 700 cm-1波段指示酰胺Ⅰ带并用来分析结缔组织的二级结构变化。参照王复龙[24]和Chadefaux[25]等的方法,使用Peak fit软件进行去基线、平滑、二阶导定峰位以及分峰拟合。条带指认为聚集片:1 610~1 628 cm-1;β-折叠:1 625~1 640 cm-1;无规卷曲:1 640~1 648 cm-1;α-螺旋:1 648~1 660 cm-1;310-螺旋:1 660~1 675 cm-1;β-转角:1 680~1 696 cm-1[26],各组设置3 个平行。
1.4 数据统计分析
图表采用Origin 8.0软件绘制。通过SPSS 20.0软件对食盐组和低钠组间进行独立样本t检验,同一处理组加工过程中采用邓肯多重比较法进行差异显著性分析,显著性水平P<0.05。胶原蛋白总量及其热溶解性、肌束膜厚度等指标进行相关性分析。数据采用表示。
2 结果与分析
2.1 低钠干腌肉加工过程中胶原蛋白总量及其热溶解性变化
干腌肉制品所具有的独特风味和特殊口感,主要是干腌肉加工中内源酶对脂肪、蛋白质降解的结果[27-28]。胶原蛋白是肌内结缔组织的主要构成成分,对肌肉的质构、风味、多汁性有着重要影响[9]。图2显示,低钠组和食盐组的胶原蛋白总量变化趋势在整个加工过程中基本一致。随着加工时间的延长,胶原蛋白总量逐渐减少。食盐组胶原蛋白总量总是稍高于低钠组,但两组间差异不显著(P>0.05)。对于低钠组,从原料至落架结束,胶原蛋白总量由19.89 mg/g md显著降至17.96 mg/g md(P<0.05),降低了9.70%。这可能是由于组织蛋白酶L活力较高[29],能快速降解胶原蛋白[30]。但落架与陈香结束间差异不显著(P>0.05)。对于食盐组,从原料至干燥结束,胶原蛋白总量由19.89 mg/g md降低了5.83%(P<0.05),从干燥至陈香结束,胶原蛋白总量变化不显著(P>0.05)。

图2 干腌肉加工过程中胶原蛋白总量变化Fig. 2 Changes in total collagen content in dry-cured meat during processing
从原料至落架阶段,低钠组和食盐组的胶原蛋白总量减少迅速,而在落架至陈香结束阶段,两组胶原蛋白总量变化不显著,原因可能是后期食盐等抑制了酶活性[31],使胶原蛋白降解缓慢。干腌肉加工过程中,蛋白质降解由快至慢的现象在马志方等[32]的研究中也有类似发现,其研究低钠金华火腿加工过程中蛋白质降解情况表明,原料至落架,低钠组和食盐组的总氮含量出现显著性增加,而在落架至陈香结束阶段变化不显著。整个加工过程中,低钠组和食盐组胶原蛋白总量分别由原料的19.89、19.89 mg/g md降至终产品的17.70、17.83 mg/g md(P<0.05),分别降低了11.01%、10.36%。

图3 干腌肉加工过程中胶原蛋白热溶解性变化Fig. 3 Changes in heat solubility of collagen in dry-cured meat during processing
图3显示,低钠组和食盐组的胶原蛋白热溶解性变化趋势在整个加工过程中基本一致,随着加工时间的延长,胶原蛋白热溶解性逐渐增加。在落架和陈香结束阶段,两组的胶原蛋白热溶解性差异显著(P<0.05),这可能是由于低钠盐及其组分提高了胶原蛋白酶活力。Armenteros等[33]发现,当KCl替代NaCl比例越多时,组织蛋白酶L的活力就越强。对于低钠组,从原料至干燥结束,胶原蛋白热溶解性由原料组的9.09%显著升至12.69%(P<0.05),增加了39.60%;从干燥结束至陈香结束,胶原蛋白热溶解性变化不显著(P>0.05)。对于食盐组,与低钠组有着相似的变化规律。终产品时,低钠组的胶原蛋白热溶解性比食盐组高0.91%(P<0.05)。干腌肉加工是一个不断失水、水分活度不断降低、腌制剂等不断渗透的过程,加工中内源酶活性会出现不同形式的变化,对脂肪及蛋白质降解程度也会出现显著性变化[29,34]。Zhang等[34]在研究低钠干腌猪肉制品中发现,含有KCl、Lys、His等组分的低钠盐对酸性脂肪酶、中性脂肪酶、磷脂酶酶活性有明显的抑制作用;干腌肉加工过程中性脂质、游离脂肪酸含量不断增加,而磷脂含量不断减少。马志方[29]在研究低钠金华火腿加工过程中发现,组织蛋白酶L活力呈现先升高后降低的趋势,低钠组和食盐组无显著性差异;组织蛋白酶B活力呈现逐渐下降趋势,两组有显著性差异;蛋白质降解指数显著升高,且低钠组显著高于食盐组。所以,在干腌肉加工过程中,可能是因为降解胶原蛋白的相关酶活力的变化造成低钠组和食盐组的胶原蛋白总量及其热溶解性的差异。
2.2 低钠干腌肉加工过程结缔组织肌束膜厚度变化


图4 干腌肉加工中肌肉组织切片Fig. 4 Sections of muscle tissue in dry-cured meat during processing
肌肉组织结构在干腌肉加工过程中发生变化(图4)。肌内结缔组织被天狼星红-苦味酸染色液染成红色带状,较粗的为次级肌束膜,较细的为初级肌束膜,还有包裹在肌纤维外层的肌内膜。随着加工时间的延长,内源酶不断降解各类蛋白质,低钠组和食盐组的初级肌束膜和次级肌束膜厚度逐渐减小。对于低钠组,从原料至腌制结束,肌束膜仍保持完整结构。从脱水至陈香结束,肌束膜厚度逐渐减小,部分肌束膜断裂、肌内膜消失。对于食盐组,从原料至干燥结束,肌束膜厚度虽然逐渐减小,但仍可见完整的组织结构。从落架至陈香结束,部分肌束膜、肌内膜才逐渐消失。臧大存[35]通过研究2%~4% NaCl盐腌加热处理鸭肉时发现,盐腌降低了胶原蛋白的热稳定性,肌束膜出现非常明显的颗粒化,肌内膜结构也受到不同程度的破坏。王复龙[24]用0.5%苹果酸腌制牛背最长肌发现,随着腌制时间的延长,肌束膜结构逐渐弱化,初级肌束膜和次级肌束膜都呈现显著减小的趋势,弱酸处理降低了结缔组织的机械性能。以上研究与本研究有相同之处,因干腌肉是在弱酸性条件下,利用食盐或低钠盐腌制加工而成[36],所以食盐或低钠盐降低了胶原蛋白的热稳定性,弱化了肌内结缔组织,肌束膜厚度降低。

图5 干腌肉加工中初级肌束膜厚度变化Fig. 5 Changes in thickness of primary perimysium in dry-cured meat during processing
初级肌束膜厚度在加工过程中呈逐渐下降趋势。低钠组和食盐组的初级肌束膜厚度分别由原料的12.76、12.94 μm降至终产品的6.91、7.15 μm(P<0.05),分别降低了45.85%、44.74%。整个加工过程中,低钠组初级肌束膜厚度都稍低于食盐组,但两组间不存在显著性差异(P>0.05)。
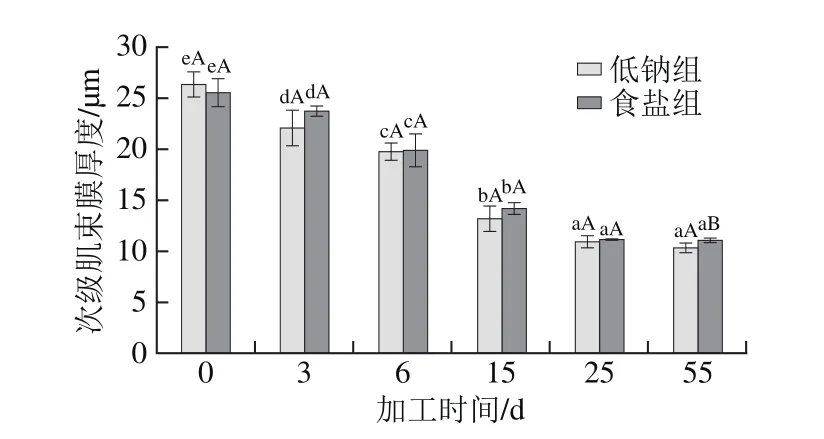
图6 干腌肉加工中次级肌束膜厚度变化Fig. 6 Changes in thickness of secondary perimysium in dry-cured meat during processing
随着加工时间的延长,低钠组和食盐组的次级肌束膜厚度也呈逐渐下降趋势,分别由原料的26.26、25.50 μm降至终产品的10.32、11.04 μm(P<0.05),分别降低了60.70%、56.71%。陈香结束后,低钠组的次级肌束膜厚度比食盐组低0.72 μm(P<0.05)。这可能是由于低钠组胶原蛋白降解程度大于食盐组的降解程度。
2.3 低钠干腌肉加工过程中成熟交联含量变化

图7 干腌肉加工中成熟交联变化Fig. 7 Changes in pyridinoline cross-linking in dry-cured meat during processing
成熟交联含量在干腌肉加工过程中呈逐渐下降趋势(图7)。成熟交联即非还原型的稳定交联,成熟交联含量越多,胶原蛋白热不溶解性越强[37]。非还原性的成熟交联是三共价键连接3 个胶原蛋白分子,使胶原纤维网状结构更加稳定[38-39]。卢桂松[40]和Wang Fulong[41]等研究证实,在肌内脂肪沉积较多的牛肉样本中,成熟交联的含量较少。成熟交联含量随着生理生熟度增加而逐渐升高[42]。然而鲜见关于干腌肉加工中成熟交联含量变化的研究报道。在整个加工过程中,低钠组和食盐组成熟交联含量都呈显著下降趋势,分别原料的12.88、12.88 ng/g md降至4.94、5.00 ng/g md(P<0.05),各降低了61.65%、61.18%。在整个加工过程中,食盐组成熟交联含量均稍高于低钠组,但两组间差异不显著(P>0.05)。整个加工过程中成熟交联含量的不断减少,说明胶原纤维网状结构稳定性逐渐减弱,胶原蛋白热溶解性逐渐增强[24]。
2.4 低钠干腌肉制品加工中肌内结缔组织特性相关性研究
肌内结缔组织特性之间的相关分析见表2。胶原蛋白总量、胶原蛋白热溶解性、次级及初级肌束膜厚度与成熟交联含量呈极显著相关(P<0.01),相关系数分别为0.853、-0.964、0.921、0.968。在干腌肉加工中,胶原蛋白分子间成熟交联含量逐渐降低,使胶原蛋白总量降低、胶原蛋白热溶解性升高、肌束膜厚度减小。这一结果符合McCormick的理论[43],即成熟交联含量的减少使3 个胶原蛋白分子间缺少足够的“桥梁”连接,这在一定程度上会减弱肌内结缔组织的机械强度,使胶原蛋白热溶解性升高、肌束膜厚度降低。胶原蛋白总量、次级及初级肌束膜厚度与胶原蛋白热溶解性呈极显著负相关(P<0.01),相关系数分别为-0.844、-0.932、-0.931。说明胶原蛋白热溶解性的升高,使胶原蛋白总量减少、次级及初级肌束膜厚度降低。
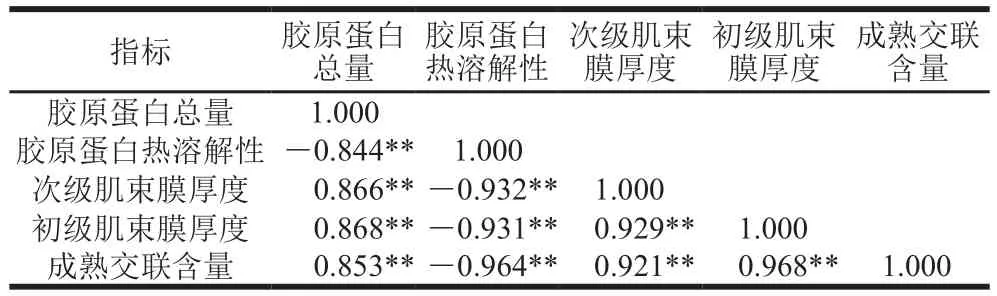
表2 肌内结缔组织特性相关性Table 2 Correlation among characteristics of intramuscular connective tissue
2.5 低钠干腌肉加工过程中肌内结缔组织二级结构变化

图8 低钠干腌肉加工过程中肌内结缔组织酰胺Ⅰ带分峰拟合图Fig. 8 Curve-f i tting analysis of amide I prof i le

表3 干腌肉加工过程中肌内结缔组织二级结构相对含量变化Table 3 Changes in secondary structure of IMCT in dry-cured meat during processing
图8和表3给出了干腌肉加工过程中肌内结缔组织的二级结构变化趋势。酰胺Ⅰ带可以反映多种蛋白质二级结构变化[44]。关于分峰拟合,是根据二阶求导和傅里叶去卷积方法来确定子峰数目及峰位置,最终得到6 个子峰,符合一般规律。经过7 次迭代,所有子峰拟合R2均达0.999 9以上,拟合效果理想[44]。干腌肉加工中肌内结缔组织主要有6 种形式(表3),分别为α-螺旋、310-螺旋、β-转角、聚集片、β-折叠、无规卷曲。低钠组和食盐组的肌内结缔组织二级结构主要存在两种形式的变化:一是α-螺旋、310-螺旋、β-转角相对含量总体呈降低趋势;二是聚集片、β-折叠、无规卷曲相对含量总体呈升高趋势。说明前者是向后者的转化,干腌肉加工过程中肌内结缔组织二级结构变化是一个解螺旋的过程。与之类似,Wang Rongrong等[45]利用牛肌肉组织提取物酶解牛肉肌束膜中胶原蛋白,观察胶原蛋白二级结构变化,结果表明,随组织提取物添加量增大,α-螺旋的相对含量逐渐降低,β-折叠的相对含量逐渐升高,β-转角、无规卷曲变化不明显,α-螺旋与β-折叠发生了一定程度的转化。
低钠组与食盐组α-螺旋、310-螺旋和β-转角这3 种结构的相对含量在加工过程中出现了不同程度的降低趋势。对于α-螺旋,低钠组由原料的27.82%降低至18.73%(P<0.05),减少了32.67%。食盐组由原料的27.84%降至21.21%(P<0.05),减少了23.81%。两组在腌制结束至陈香结束各加工阶段间均有显著性差异(P<0.05)。对于310-螺旋,终产品时,低钠组和食盐组分别降低了15.41%、14.22%,两组在陈香结束阶段不存在显著性差异(P>0.05)。对于β-转角,低钠组由原料的14.41%显著降低至12.07%(P<0.05),降低了16.24%。食盐组仅降低了3.33%。两组仅在腌制后、干燥结束及陈香结束阶段有显著性差异(P<0.05)。
聚集片、β-折叠、无规卷曲,在加工过程中相对含量出现了不同程度的升高趋势。对于聚集片,低钠组由原料的5.57%显著上升至终产品的10.12%(P<0.05),增加了81.69%。食盐组仅增加了23.48%。两组在腌制结束至陈香结束各加工阶段间均有显著性差异(P<0.05)。对于β-折叠,低钠组和食盐组在陈香结束无显著性差异(P>0.05),分别增加了30.03%、27.54%。对于无规卷曲,终产品低钠组增幅高于食盐组(P<0.05),分别增加了36.74%、29.39%。
干腌肉加工过程中,随着加工时间的延长,肌内结缔组织不断发生着解螺旋化,使得羟脯氨酸残基暴露出来[45],进而改变肌内结缔组性质。陈香结束后,与食盐相比,低钠盐使α-螺旋、β-转角相对含量分别减少11.69%、13.41%(P<0.05),聚集片、无规卷曲分别增加了46.88%、5.82%(P<0.05)。这表明低钠组肌内结缔组织二级结构的解螺旋程度大于食盐组。这可能是因为低钠组中胶原蛋白酶活力高于食盐组的酶活力。Burleigh等[46]研究由人体肝脏提取的组织蛋白酶B1和D对大鼠表皮的胶原蛋白的水解作用,结果发现,组织蛋白酶在pH 4.5~5.0时能够水解胶原蛋白,开始主要水解胶原蛋白的非螺旋结构的交联区域,之后逐步水解三螺旋结构区域。α链一旦遭到水解,就会迅速生产许多小分子质量的多肽。Etherington[47]在牛肉提取物中的组织蛋白酶B1时发现其中含有可以水解胶原蛋白的同工酶,该酶在28 ℃、pH 4.0~5.4时可有效降解牛皮中原胶原蛋白中心的交联,切断Lys衍生交联与三螺旋之间的末端区域,并进一步水解α链。以上研究表明,组织蛋白酶B能水解胶原蛋白α链,降解胶原蛋白。马志方[29]在研究低钠盐对金华火腿组织蛋白酶B活力的影响时发现,在低钠金华火腿加工过程中,组织蛋白酶B活力呈现逐渐下降趋势,低钠组酶活力显著高于食盐组的酶活力。所以,在干腌肉加工中,可能是低钠组的组织蛋白酶B活力高于食盐组,使组织蛋白酶B水解胶原蛋白α链能力更强,最终使低钠组肌内结缔组织二级结构的解螺旋程度高于食盐组。
3 结 论
猪肉在干腌加工过程中,胶原蛋白总量降低,胶原蛋白热溶解性升高,初级及次级肌束膜厚度减小,成熟交联含量降低,肌内结缔组织二级结构不断进行着解螺旋。与食盐组相比,低钠组产品具有较高的胶原蛋白热溶解性和较小的次级肌束膜厚度,肌内结缔组织二级结构解螺旋程度更大。所以,低钠盐能进一步促进肌内结缔组织蛋白降解。
[1] ALIŇO M, GRAU R, FUENTES A, et al. Influence of low-sodium mixtures of salts on the post-salting stage of dry-cured ham process[J].Journal of Food Engineering, 2010, 99(2): 198-205. DOI:10.1016/j.jfoodeng.2010.02.020.
[2] ALIŇO M, GRAU R, FUENTES A, et al. Characterisation of pile salting with sodium replaced mixtures of salts in dry-cured loin manufacture[J]. Journal of Food Engineering, 2010, 97(3): 434-439.DOI:10.1016/j.jfoodeng.2009.10.039.
[3] 杨应笑, 任发政. 氯化钾作为腊肉腌制剂中氯化钠替代物的研究[J]. 肉类研究, 2005, 19(9): 44-47. DOI:10.3969/j.issn.1001-8123.2005.09.015.
[4] ALIŇO M, GRAU R, TOLDRÁ F, et al. Physicochemical properties and microbiology of dry-cured loins obtained by partial sodium replacement with potassium, calcium and magnesium[J]. Meat Science, 2010, 85(3): 580-588. DOI:10.1016/j.meatsci.2010.03.009.
[5] ARMENTEROS M, ARISTOY M C, BARAT J M, et al. Biochemical and sensory changes in dry-cured ham salted with partial replacements of nacl by other chloride salts[J]. Meat Science, 2012, 90(2): 361-367.DOI:10.1016/j.meatsci.2011.07.023.
[6] 周光宏. 畜产品加工学[M]. 北京: 中国农业科技出版社, 2002: 63-71.
[7] BOLEMAN S J, BOLEMAN S L, MILLER R K, et al. Consumer evaluation of beef of known categories of tenderness[J].Journal of Animal Science, 1997, 75(6): 1521-1524.DOI:10.2527/1997.7561521x.
[8] 常海军. 不同加工条件下牛肉肌内胶原蛋白特性变化及其对品质影响研究[D]. 南京: 南京农业大学, 2010: 41-46.
[9] DUBOST A, MICOL D, PICARD B, et al. Structural and biochemical characteristics of bovine intramuscular connective tissue and beef quality[J]. Meat Science, 2013, 95(3): 555-561. DOI:10.1016/j.meatsci.2013.05.040.
[10] YOUNG O A, BRAGGINS T J. Tenderness of ovine semimembranosus: is collagen concentration or solubility the critical factor?[J]. Meat Science, 1993, 35(2): 213-222. DOI:10.1016/0309-1740(93)90051-I.
[11] LIU A, NISHIMURA T, TAKAHASHI K. Relationship between structural properties of intramuscular connective tissue and toughness of various chicken skeletal muscles[J]. Meat Science, 1996, 43(1): 43-49. DOI:10.1016/0309-1740(95)00065-8.
[12] 赵改名, 王艳玲, 田玮. 影响牛肉嫩度的因素及其机制[J]. 国外畜牧科技, 2000, 27(2): 35-40. DOI:10.3969/j.issn.1671-7236.2000.02.013.
[13] HOPKINS D L, THOMPSON J M. The relationship between tenderness, proteolysis, muscle contraction and dissociation of actomyosin[J]. Meat Science, 2001, 57(1): 1-12. DOI:10.1016/S0309-1740(00)00065-6.
[14] 刘寿春, 钟赛意, 葛长荣. 肉品嫩化理论及嫩化方法的研究进展[J]. 肉类工业, 2005(10): 19-21. DOI:10.3969/j.issn.1008-5467.2005.10.010.
[15] MODZELEWSKA-KAPITULA M, KWIATKOWSKA A,JANKOWSKA B, et al. Water holding capacity and collagen prof i le of bovine M. infraspinatus during postmortem ageing[J]. Meat Science,2015, 100: 209-216. DOI:10.1016/j.meatsci.2014.10.023.
[16] DUBOST A, MICOL D, MEUNIER B, et al. Relationships between structural characteristics of bovine intramuscular connective tissue assessed by image analysis and collagen and proteoglycan content[J]. Meat Science, 2013, 93(3): 378-386. DOI:10.1016/j.meatsci.2012.09.020.
[17] CHRISTENSEN L, ERTBJERG P, LØJE H, et al. Relationship between meat toughness and properties of connective tissue from cows and young bulls heat treated at low temperatures for prolonged times[J]. Meat Science, 2013, 93(4): 787-795. DOI:10.1016/j.meatsci.2012.12.001.
[18] XU Shuqin, ZHOU Guanghong, PENG Zengqi, et al. The influence of polyphosphate marination on simmental beef shear value and ultrastructure[J]. Journal of Muscle Foods, 2009, 20(1): 101-116.DOI:10.1111/j.1745-4573.2008.00136.x.
[19] NISHIMURA T, HATTORI A, TAKAHASHI K. Structural changes in intramuscular connective tissue during the fattening of Japanese black cattle: effect of marbling on beef tenderization[J]. Journal of Animal Science, 1999, 77(1): 93-104. DOI:10.2527/1999.77193x.
[20] 李春保. 牛肉肌内结缔组织变化对其嫩度影响的研究[D]. 南京: 南京农业大学, 2006: 58-60.
[21] AKTAŞ N. The effects of pH, NaCl and CaCl2on thermal denaturation characteristics of intramuscular connective tissue[J]. Thermochimica Acta, 2003, 407(1/2): 105-112. DOI:10.1016/S0040-6031(03)00306-X.
[22] BADII F, HOWELL N K. Elucidation of the effect of formaldehyde and lipids on frozen stored cod collagen by FT-Raman spectroscopy and differential scanning calorimetry[J]. Journal of Agricultural and Food Chemistry, 2003, 51(5): 1440-1446. DOI:10.1021/jf020492u.
[23] 钟朝辉, 李春美, 顾海峰, 等. 温度对鱼鳞胶原蛋白二级结构的影响[J].光谱学与光谱分析, 2007, 27(10): 1970-1976.
[24] 王复龙. 组织蛋白酶L与2-羟基丁二酸对牛眼肉肌内结缔组织特性与剪切力的影响[D]. 南京: 南京农业大学, 2015: 86-97.
[25] CHADEFAUX C, HŎ A S L, BELLOT-GURLET L, et al. Curvef i tting Micro-ATR-FTIR studies of the amideⅠ and Ⅱ bands of type Ⅰcollagen in archaeological bone materials[J]. e-Preservation Science,2009, 6: 129-137.
[26] AKTAŞ N, KAYA M. Influence of weak organic acids and salts on the denaturation characteristics of intramuscular connective tissue. A differential scanning calorimetry study[J]. Meat Science, 2001, 58(4):413-419. DOI:10.1016/S0309-1740(01)00044-4.
[27] COUTRON-GAMBOTTI C, GANDEMER G. Lipolysis and oxidation in subcutaneous adipose tissue during dry-cured ham processing[J].Food Chemistry, 1999, 64(1): 95-101. DOI:10.1016/S0308-8146(98)00079-X.
[28] 竺尚武. 火腿加工原理与技术[M]. 北京: 中国轻工业出版社, 2009:25-55.
[29] 马志方. 低钠传统金华火腿加工过程中脂质和蛋白质水解及氧化的研究[D]. 南京: 南京农业大学, 2016: 47-50.
[30] 王蓉蓉. 狭鳕和牛肌肉组织提取物在牛肉嫩化中的作用机理研究[D].南京: 南京农业大学, 2012: 93-118.
[31] RICO E, TOLDRÁ F, FLORES J. Effect of dry-curing process parameters on pork muscle cathepsin b, h and l activity[J]. Zeitschrift für Lebensmittel-Untersuchung und -Forschung, 1991, 193(6):541-544. DOI:10.1007/BF01190868.
[32] 马志方, 张雅玮, 惠腾, 等. 低钠传统金华火腿加工过程中理化特性的变化[J]. 食品工业科技, 2016, 37(14): 118-123; 127. DOI:10.13386/j.issn1002-0306.2016.14.015.
[33] ARMENTEROS M, ARISTOY M C, BARAT J M, et al. Biochemical changes in dry-cured loins salted with partial replacements of NaCl by KCl[J]. Food Chemistry, 2009, 117(4): 627-633. DOI:10.1016/j.foodchem.2009.04.056.
[34] ZHANG Y W, ZHANG L, HUI T, et al. Influence of partial replacement of NaCl by KCl, l -histidine and L-lysine on the lipase activity and lipid oxidation in dry-cured loin process[J]. LWTFood Science and Technology, 2015, 64(2): 966-973. DOI:10.1016/j.lwt.2015.06.073.
[35] 臧大存. 鸭肉嫩度影响因素及变化机制的研究[D]. 南京: 南京农业大学, 2007: 81-101.
[36] 张露, 张雅玮, 惠腾, 等. 低钠盐对干腌肉制品加工过程中理化特性的影响[J]. 食品科学, 2014, 35(17): 77-82. DOI:10.7506/spkx1002-6630-201417016.
[37] SLATTER D A, AVERY N C, BAILEY A J. Collagen in its fi brillar state is protected from glycation[J]. International Journal of Biochemistry & Cell Biology, 2008, 40(10): 2253-2263. DOI:10.1016/j.biocel.2008.03.006.
[38] EYRE D R, PAZ M A, GALLOP P M. Cross-linking in collagen and elastin[J]. Annual Review of Biochemistry, 1984, 53(1): 717-748.DOI:10.1146/annurev.bi.53.070184.003441.
[39] REISER K, MCCORMICK R J, RUCKER R B. Enzymatic and nonenzymatic cross-linking of collagen and elastin[J]. The FASEB Journal, 1992, 6(7): 2439-2449.
[40] 卢桂松, 王复龙, 朱易, 等. 秦川牛花纹肉剪切力值与胶原蛋白吡啶交联和热溶解性的关系[J]. 中国农业科学, 2013, 46(1): 130-135.DOI:10.3864/j.issn.0578-1752.2013.01.015.
[41] WANG Fulong, ZHANG Yawei, LI Junke, et al. Contribution of crosslinks and proteoglycans in intramuscular connective tissue to shear force in bovine muscle with different marbling levels and maturities[J].LWT-Food Science and Technology, 2015, 66: 413-419. DOI:10.1016/j.lwt.2015.10.059.
[42] SHIBA N, MATSUZAKI M, TSUNEISHI E, et al. Changes in the pyridinoline concentration of the gastrocnemius and soleus muscle in goats from 2 weeks prenatal to 24 weeks of age[J]. Small Ruminant Research, 2007, 71(1/2/3): 144-149. DOI:10.1016/j.smallrumres.2006.05.013.
[43] MCCORMICK R J. Extracellular modifications to muscle collagen:implications for meat quality[J]. Poultry Science, 1999, 78(5):785-791. DOI:10.1093/ps/78.5.785.
[44] 翁诗甫. 傅里叶变换红外光谱分析[M]. 北京: 化学工业出版社,2010: 254-261.
[45] WANG Rongrong, PENG Zengqi, HUI Teng, et al. Potential use of crude extracts from alaska pollock muscle as meat tenderizer[J].CyTA-Journal of Food, 2013, 11(1): 50-59. DOI:10.1080/19476337.20 12.684357.
[46] BURLEIGH M C, BARRETT A J, LAZARUS G S. Cathepsin B1.A lysosomal enzyme that degrades native collagen[J]. Biochemical Journal, 1974, 137(2): 387-398. DOI:10.1042/bj1370387.
[47] ETHERINGTON D J. The purification of bovine cathepsin B1 and its mode of action on bovine collagens[J]. Biochemical Journal, 1974,137(3): 547-557. DOI:10.1042/bj1370547.
Characteristics of Intramuscular Connective Tissue in Low Sodium Dry-Cured Meat during Processing
LIU Chenghua, LI Shun, ZHANG Yawei, LIU Shixin, HUANG Xiaochuang, CHEN Dongdong, PENG Zengqi*
(Synergetic Innovation Center of Food Safety and Nutrition, College of Food Science and Technology,Nanjing Agricultural University, Nanjing 210095, China)
The effect of low sodium salt on intramuscular connective tissue (IMCT) during the processing of dry-cured pork from M. longissimus dorsi was investigated. At the end of post-ripening, the thickness of secondary perimysium of low sodium-cured samples was 0.72 μm lower (P < 0.05), and the thermal solubility of collagen was 0.91% higher than that of normal salt-cured samples (P < 0.05). On the other hand, no signif i cant differences existed in total collagen, the thickness of primary perimysium or pyridinoline cross-linking between the two groups (P > 0.05). Compared with the normal salt group,the relative contents of α-helix and β-turn in the low sodium group were decreased by 11.69% and 13.41%, respectively(P < 0.05); in contrast, aggregated strands and random coil were increased by 46.88% and 5.82%, respectively (P < 0.05).In conclusion, low sodium salt can further promote the degradation of IMCT than normal salt during the processing of drycured pork.
low sodium salt; intramuscular connective tissue; collagen; pyridinoline cross-linking
10.7506/spkx1002-6630-201801014
TS251.5
A
1002-6630(2018)01-0091-08
刘成花, 李顺, 张雅玮, 等. 低钠干腌肉加工过程中肌内结缔组织特性[J]. 食品科学, 2018, 39(1): 91-98.
10.7506/spkx1002-6630-201801014. http://www.spkx.net.cn
LIU Chenghua, LI Shun, ZHANG Yawei, et al. Characteristics of intramuscular connective tissue in low sodium dry-cured meat during processing[J]. Food Science, 2018, 39(1): 91-98. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201801014. http://www.spkx.net.cn
2016-09-08
江苏省优势学科人才引进专项基金项目(080/80900234)
刘成花(1989—),女,硕士研究生,研究方向为畜产品加工与质量控制。E-mail:2014108048@njau.edu.cn
*通信作者简介:彭增起(1956—),男,教授,博士,研究方向为畜产品加工与质量控制。E-mail:zqpeng@njau.edu.cn

