乙草胺降解菌L3的促生物质
闫志宇+翟蓓蓓+李术娜+李红亚+王全

摘要: 为探明乙草胺降解菌枯草芽孢杆菌(Bacillus subtilis)菌株L3的促生功能。以嗜铁素、吲哚乙酸和小分子有机酸(包括甲酸、乙酸、乳酸等)为检测指标,应用平皿生化反应与薄层色谱法对供试菌株的发酵液进行促生物质的定性检测,并使用光度法对嗜铁素和吲哚乙酸进行定量测定,最后利用特异性颜色反应对菌株所产嗜铁素类型进行鉴定。结果表明,菌株L3可产生嗜铁素,其D680 nm/D680 nm(r)值为0.610,为羧酸型;菌株可产生吲哚乙酸,在LB液体培养基中培养36 h,其发酵液中吲哚乙酸浓度为75.6 mg/L;应用薄层色谱法检出菌株可产生小分子有机酸,但不能明确种类。研究结果明确了乙草胺降解菌L3的促生功能,证实L3菌株除了可用于修复乙草胺污染的土壤外,还具有多方面的应用价值。
关键词: 乙草胺降解菌;枯草芽孢杆菌;嗜铁素;吲哚乙酸;小分子有机酸;促生物质
中图分类号: X172 文献标志码: A
文章编号:1002-1302(2017)22-0295-04
近年来,土壤生态系统不断遭到破坏,一方面各种农药的过量或不恰当施用导致土壤中农药残留不断增多,进而引发粮食、蔬菜等安全问题;另一方面,化肥使用量逐年增加,造成土壤板结,肥力下降,农产品减产减质严重。面对日趋严峻的土壤恶化形势,科学家和政府职能部门均在采用各种措施减轻土壤所受的污染,并寻求新的增产措施。
乙草胺是一种广谱、高效的内吸性酰胺类除草剂,需在芽前施用于土壤中[1]。我国自1982年研制成功乙草胺并投入使用后,乙草胺一直是我国生产量和用量最大的三大除草剂之一,过量、频繁地施用乙草胺或施用不当已造成严重的土壤污染,加上乙草胺已被美国环保局定为B2类致癌物,其降解问题已倍受关注[2-3]。笔者所在研究室前期筛选到1株乙草胺降解菌株L3,在牛肉膏蛋白胨培养基中培养48 h后对乙草胺的降解率为52.0%,经鉴定为枯草芽孢杆菌(Bacillus subtilis)。据报道,枯草芽孢杆菌可通过分泌嗜铁素、吲哚乙酸、抗菌蛋白、抗生素等不同物质促进植物的生长,加上其在工业生产中的优势,对其促生应用功能的研究正成为当下的热点[4]。本研究在此基础上进一步考察降解菌株的促生功能,探明此菌株对解决土壤问题的综合潜力与可行性,以期为该菌株的实际应用奠定基础。
目前对乙草胺降解菌的研究大多集中于降解菌的筛选、降解特性研究及降解途径的分析方面,对降解菌的多功能发挥探究尚未见报道[5-11]。而在促生菌研究方面,目前研究较深入的是假单胞菌属和芽孢杆菌属,其中,枯草芽孢杆菌在促生方面的研究已有报道,但大多数研究集中于通过盆栽试验明确其对植物的增产增质效果[12-15]。在对枯草芽孢杆菌促生物质的种类及产量研究中,易有金等明确了枯草芽孢杆菌可产生或诱导产生吲哚乙酸、赤霉素和玉米素核苷等促生物质[16-17]。余贤美等筛选获得的枯草芽孢杆菌CAS15和 Bs-15 均可产生促生物质嗜铁素[18-19]。
對乙草胺降解菌枯草芽孢杆菌(Bacillus subtilis)菌株L3进行盆栽试验时发现,该菌株除对乙草胺具有较高的降解率(7 d后对土壤中乙草胺的降解率为34.93%)外,还对土壤中因乙草胺的施入而降低的一些酶和营养元素具有一定的修复作用,且对小麦的生长产生了积极的促进作用,推测乙草胺降解菌L3可能产生了某些促进植物生长的物质[20]。因此,本试验选取目前研究最为广泛的几种促生物质,即嗜铁素、吲哚乙酸和一些小分子有机酸作为检测对象,探讨菌株L3是否可以产生此类物质,进而明确其在土壤修复与农业增收增产中的作用。
1 材料与方法
1.1 材料
1.1.1 菌株
乙草胺降解菌菌株L3,由笔者所在实验室分离保存。
1.1.2 培养基和染液
NA培养基,用于L3的活化及保藏。
LB液体培养基,用于菌株发酵与产嗜铁素的定量检测。
铬天青(简称CAS)定性检测培养基:参考Schwyn等的检测方法[21-23],将CAS平板进行改进,改进处如下:
取0.023 g十六烷基三甲基溴化铵加入8 mL蒸馏水中,得液体a;取0.018 g CAS溶于10 mL双蒸水中,并与3 mL 1 mmol/L FeCl3溶液混匀,得溶液b;然后将溶液a和b混匀,即得染液c。向100 mL双蒸水中加入4.95 g磷酸氢二钠和5.10 g磷酸二氢钠,将配制好的磷酸缓冲液用蒸馏水稀释 8.5 倍,后取170 mL放入三角瓶中,然后滴入少量的 12 mol/L NaOH使pH值降到5.9,向上述三角瓶中添加3.2 g琼脂粉,为培养基d。其他操作参照文献[22]。该培养基用于菌株产嗜铁素的定性检测。
0.5%溴甲酚绿培养基,用于菌株产吲哚乙酸和小分子有机酸的定性检测。
CAS检测液的制备参照文献[22];以溴甲酚绿为指示剂,显色范围为3.8~5.4(黄~蓝);以对二甲氨基苯甲醛为显色剂。
1.2 方法
1.2.1 菌株L3产嗜铁素能力研究
在CAS定性检测培养基上打孔,将培养48 h的L3发酵液经φ0.45 μm滤膜除去菌体后,取上清液100 μL注入小孔内,另将未接菌的LB液体培养基经上述相同处理后注入孔内作为对照,在37 ℃培养箱中培养48 h后观察小孔周围颜色的变化情况,以确定菌株L3产嗜铁素的能力。
将培养48 h的L3发酵液于8 000 r/min离心10 min,取 3 mL 上清液加入3 mL CAS检测液中,充分混匀[23]。静置 1 h 后采用分光光度法测定其在波长680 nm下的吸光度,以蒸馏水调零,以未接菌、经相同处理的LB液体培养基的吸光度作为本试验的参比值[简称D680 nm(r)[23]。endprint
为确定菌株L3所产嗜铁素的结构类型,将培养48 h的L3发酵液作如下处理:儿茶酚型嗜铁素检测采用Arnows试验[24];异羟肟酸型嗜铁素检测采用FeCl3试验[25];羧酸型嗜铁素检测采用Shenkers试验[26]。
1.2.2 菌株L3产吲哚乙酸能力研究
在0.5%溴甲酚绿培养基上打孔,将培养48 h的L3发酵液经φ0.45 μm滤膜除去菌体后,取上清液100 μL注入小孔内,另将未接菌的LB液体培养基经上述相同处理后注入孔内,作为对照,在37 ℃培养箱中培养,48 h后观察小孔周围颜色的变化情况,初步判定菌株L3产吲哚乙酸的情况。
利用薄层层析法进一步鉴定菌株L3产吲哚乙酸的能力。制作浓度为30%的硅胶层析板,用等体积乙酸乙酯萃取菌株L3培养48 h的发酵液,将上层有机溶剂倒入圆底烧瓶中旋转蒸发浓缩样品,干燥后的粉末倒入烧杯中,加入5 mL甲醇溶解;设置未接L3菌株的对照组,与试验组进行相同处理。用0.5 mm毛细管蘸取吲哚乙酸标准品点样,并取试验样品和对照样品依次点样2个,以体积比5 ∶ 1的三氯甲烷、甲醇为展开剂,晾干后用对二甲氨基苯甲醛显色剂显色。
对吲哚乙酸进行定量测定,制作吲哚乙酸标准曲线:向 5 mL 甲醇中加入5.0 mg吲哚乙酸标准品,充分溶解后配成终浓度为1 mg/mL的吲哚乙酸母液。分别取0.05、0.10、0.20、0.40、0.80、1.60 mL上述母液,用甲醇定容至20 mL。摇匀后在280 nm波长处测定各自的吸光度,以甲醇为对照调零。取培养至24、36、48 h的发酵液,经乙酸乙酯萃取浓缩后置于4支1.5 mL的离心管中,8 000 r/min离心10 min,取上清液用甲醇溶液稀释200倍后加入比色皿中,分别测其在280 nm波长处的吸光度,以甲醇溶液为对照调零。根据吲哚乙酸的标准曲线计算样品的产物浓度。
1.2.3 菌株L3产小分子有机酸的能力研究
利用薄层层析法定性判定菌株是否能产小分子有机酸及其种类。制备菌株L3的发酵液,设置不接菌对照组,37 ℃、180 r/min培养48 h。用与吲哚乙酸同样的方法对试验组和对照组进行萃取浓缩。分别在5支1.5 mL离心管中加入0.2 mL甲酸、乙酸、乳酸、苹果酸、丙酸、正丁酸溶液,加入0.8 mL甲醇溶液摇匀以配制各小分子有机酸的标准液,并各取少量(等量)混匀。用 0.5 mm 毛细管蘸取标准酸混合液及浓缩样品液、对照液依次点样于薄层板,以体积比5 ∶ 4 ∶ 1的三氯甲烷、乙酸乙酯、甲酸为展开剂,将展开后的薄层板在通风处晾置12 h后,用溴甲酚绿显色剂显色。
2 结果与分析
2.1 菌株L3产嗜铁素的能力研究
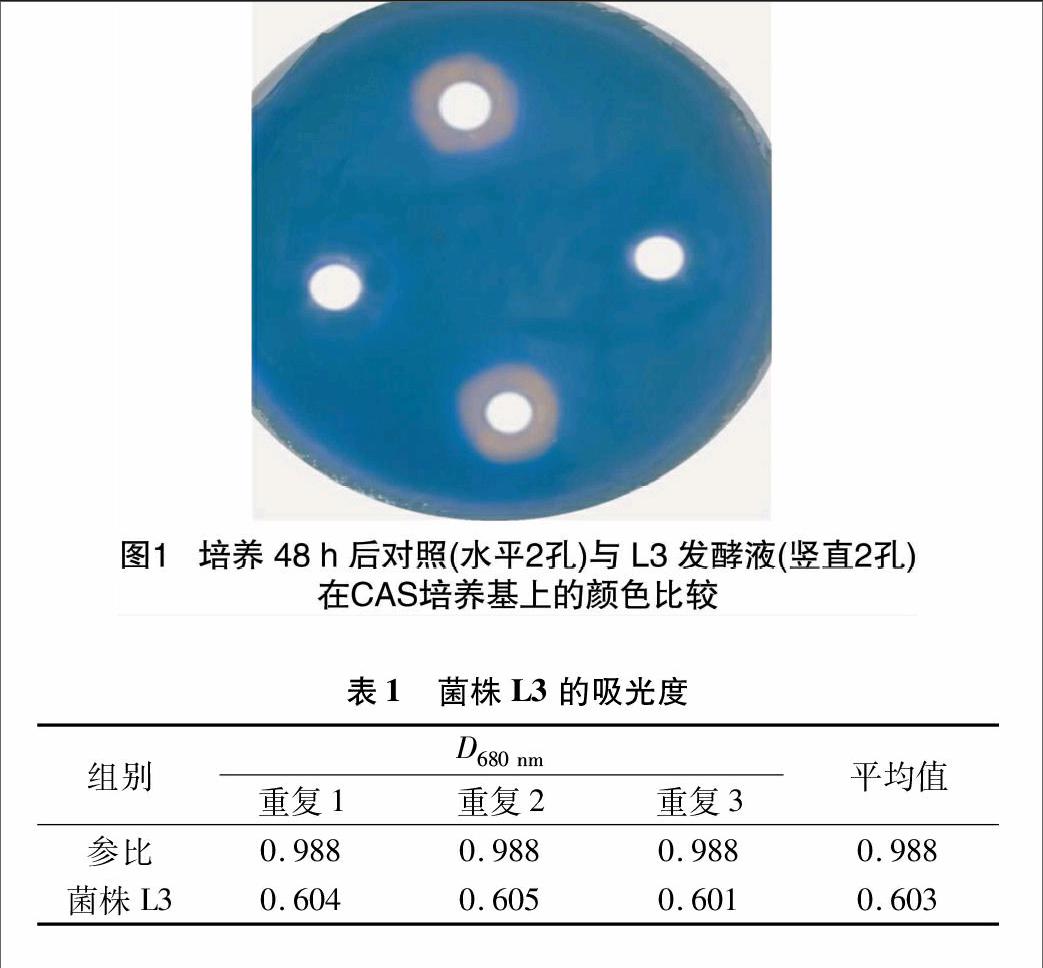
CAS定性检测培养基呈天蓝色固态,由于嗜铁素是强铁螯合剂,可竞争培养基中与乙二胺四乙酸(EDTA)螯合的铁离子,使培养基由蓝色变成黄色,因此菌落周围黄色晕圈的大小可代表嗜铁素的产量[12]。观察培养48 h后的培养基,与对照孔相比,注入L3发酵液小孔周围的橘黄色晕圈现象明显,见图1。因此可知菌株L3可以产生嗜铁素。
经测定,在波长680 nm下,各处理的吸光度見表1。菌株L3 D680 nm均值为0.603,参比组均值为0.988,D680 nm/D680 nm(r)比值为0.603/0.988=0.610。D680 nm/D680 nm(r)比值作为定量指标,比较各种微生物嗜铁素的产量,D680 nm/D680 nm(r)比值越小,反映嗜铁素的产量越大。
在嗜铁素类型检测反应中,菌株L3的发酵液在儿茶酚型嗜铁素检测和异羟肟酸型检测试验所规定的波长中均没有吸收峰;而在羧酸型嗜铁素检测中,其发酵液上清与检测液反应,在240~280 nm范围内有明显的吸收峰(图2),表明菌株L3产生的嗜铁素为羧酸型。
2.2 菌株L3产吲哚乙酸能力研究
溴甲酚绿的变色pH值范围为3.8~5.4,颜色变化为黄色~蓝色;本研究的溴甲酚绿培养基为偏中性,呈蓝色,如菌株发酵液中含有吲哚乙酸,则导致孔周围呈弱酸性,该范围培养基中的溴甲酚绿变为黄绿色。图3所示为菌株培养48 h后发酵液所造成的颜色变化情况。由图3可见,与对照孔相比,L3发酵液孔周围培养基趋近黄绿色,说明菌株L3可产生一定量的吲哚乙酸。
对该菌株发酵液用硅胶薄层色谱法进行进一步检测,根据吲哚类物质遇对二甲氨基苯甲醛显示玫瑰红色的特性来定性检测发酵液中的吲哚乙酸。48 h后发酵液的薄层色谱结果见图4,表明菌株L3发酵液含有吲哚乙酸。
通过紫外分光光度法测定不同浓度标准吲哚乙酸的吸光度,得出吲哚乙酸的标准曲线为y=0.019 8x+0.026 2,r2=0.997 6。经检测计算,不同发酵时间下菌株L3发酵液D280 nm及对应的吲哚乙酸含量见表2。
根据表2可知,培养36 h的发酵液中吲哚乙酸含量最高,而48 h时含量有所下降,推测可能是菌株所分泌的吲哚乙酸参与后期菌株代谢而被利用消耗了。
2.3 菌株L3产小分子有机酸能力研究
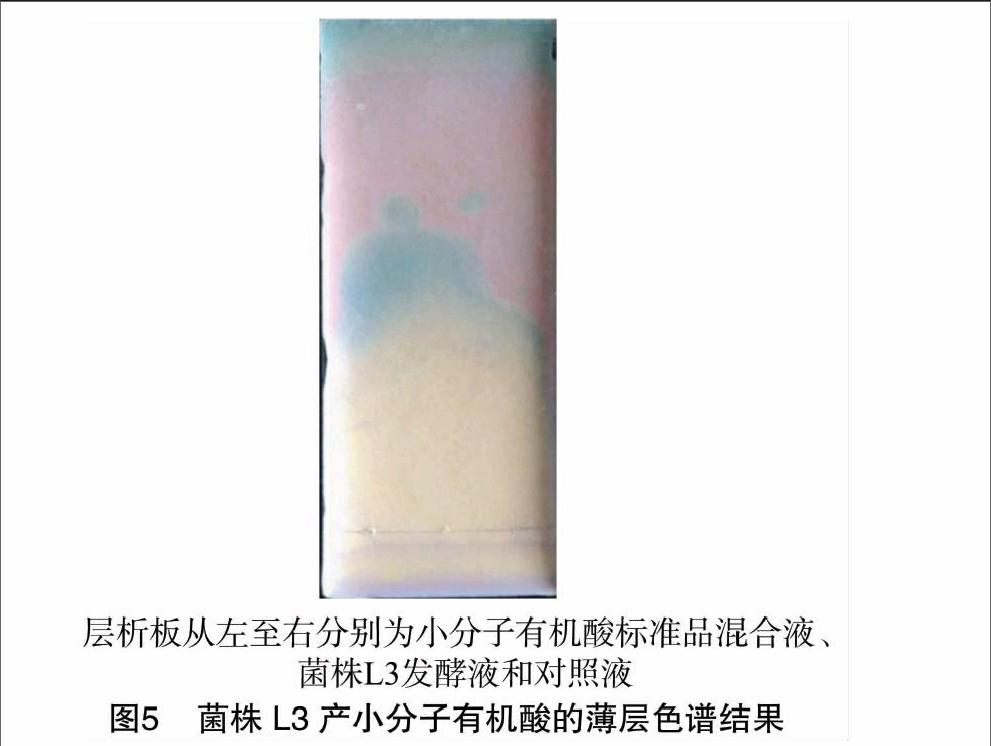
为明确发酵液中是否含有小分子有机酸及其类型,采用硅胶薄层色谱法进行进一步的定性检测,用酸碱指示剂溴甲酚绿为显色剂。经多次比较试验,考虑菌株在发酵过程中可能产生的一种或几种小分子有机酸较微量,不便于分别检出,故将各标准酸液混匀使用,并对发酵液进行充分浓缩,所得薄层色谱结果见图5。如图5所示,小分子有机酸标准品混合液在薄层板上形成绿色区域,菌株L3发酵液在相应水平面上同样出现该变色区域,而对照组中只出现略微斑迹,可能是受到展开剂影响。此结果虽未能确定所产有机酸的种类,但可说明菌株L3发酵液中的确有小分子有机酸产生。
3 结论与讨论
已报道的菌株嗜铁素产量各不相同,较高的如韩松等筛选的芽孢杆菌,样品D680 nm的D/Dr值约为0.2[27];梁建根等筛选出的杭州地区黄瓜猝倒病菌产嗜铁素拮抗菌HZX-25与HZD-8,其D/Dr值分别为0.62、0.61[28];余贤美分离获得的枯草芽孢杆菌CAS15,其D510 nm/D600 nm值为0.10~039。本试验中枯草芽孢杆菌L3所产嗜铁素其D/Dr值为0.61,产量比较理想[19]。endprint
前人所获菌株的吲哚乙酸产量从0.152~148.800 mg/L大小不等[29-31]。菌株L3培养至36 h时发酵液中吲哚乙酸浓度可达75.6 mg/L。据报道,吲哚乙酸对植物正常生长的作用通常是低浓度可促进生长,浓度稍高时即起抑制生长的作用,更高浓度即对植物有伤害作用[32]。不过不同作物对吲哚乙酸浓度的敏感性不同[33]。
有机酸不仅是植物碳代谢的中间体,而且在应对养分缺乏、金属胁迫以及根-土界面植物-微生物间交互作用方面都发挥着关键作用[34]。且低浓度有机酸对作物的生长有明显的调节,可提高作物的抗逆性[35]。新的活性有机酸和有机酸盐的发现会成为调节植物生长过程的重要研究课题。在本研究中,并没有确切检验出菌株L3产生小分子有机酸的类型,由于小分子有机酸在产生之后便迅速进入菌株的物质代谢循环,被微生物再利用,故须要采用其他更灵敏准确的定性定量检测方法如高效液相色谱法、气相色谱法和离子交换色谱法等。
本试验仅对菌株检测了少量促生物质,但具有促生长作用的物质还有很多,如植物细胞分裂素(简称CTK)[36]、氨基环丙烷羧酸(简称ACC)脱氨酶[29]、其他有机酸(包括腐殖酸、低分子酸)[37]和某些抗生素等。菌株L3也可能潜在地分泌其他类型的促生物质,有待试验的进一步加强和验证。
试验最终探明菌株L3可产生一定量的嗜铁素、吲哚乙酸、小分子有机酸,基本明确了菌株L3的促生作用。菌株L3所产嗜铁素其D/Dr值为0.610,全部为羧酸型;36 h时菌株L3发酵液中吲哚乙酸的浓度为75.6 mg/L;经与文献数据比对可知,菌株L3有较强的促生能力。
本试验证实菌株L3除可降解除草剂乙草胺外,兼有促进植物生长能力,且L3属枯草芽孢杆菌,由于芽孢杆菌具有利于实现工业化生产、仓储期长、活性不易衰退,且施用于土壤中更易适应环境、生存定值与功能发挥等特点,使其具有更广泛的应用前景和更大的应用价值。本研究为单一菌剂在受损土壤的多方修复应用方面提供了理论指导。
参考文献:
[1] 农业部农药检定所.新编农药手册(续集)[M]. 北京:中国农业出版社,1998.
[2]冯慧敏,何红波,俞 洁,等. 乙草胺的生态环境风险及其主要土壤行为综述[J]. 土壤通报,2009,40(1):203-208.
[3]Kolpin D W,Nations B K,Goolsby D A,et al. Acetochlor in the hydrologic system in the midwestern United States,1994[J]. Environmental Science & Technology,1996,30(5):1459-1464.
[4]石怀兴,尚玉珂,季 静,等. 培养条件对枯草芽孢杆菌G8抗菌蛋白含量的影响及蛋白液对黄瓜菌核病的生防效果[J]. 农药学学报,2009,11(2):244-249.
[5]董 濱,王凤花,林爱军,等. 乙草胺降解菌A-3的筛选及其降解特性[J]. 环境科学学报,2011,32(2):542-547.
[6]Xu J,Qiu X H,Dai J,et al. Isolation and characterization of a Pseudomonas oleovorans degrading the chloroacetamide herbicide acetochlor[J]. Biodegradation,2006,17(3):219-225.
[7]倪 俊,沈维亮,闫 新,等. 乙草胺降解菌Y-4的分离鉴定及降解特性研究[J]. 农业环境科学学报,2011,30(5):946-951.
[8]赵 野. 土壤中乙草胺降解菌的筛选与主要影响因子研究[D]. 重庆:西南大学,2008.
[9]周建娇,邹 芳,杨 汉,等. 乙草胺降解菌筛选及其初步鉴定[J]. 中国土壤与肥料,2013(6):93-96.
[10] 陈 青,姚 利,王成红,等. 乙草胺降解菌Sphingomonas sp. DC-6的分离鉴定及其代谢途径的初步研究[J]. 中国农业科技导报,2013,15(5):67-74.
[11]金 雷,郭远明,陈雪昌,等. 一株乙草胺降解菌株M-3的分离鉴定及其代谢途径的初步研究[J]. 农业生物技术学报,2013,21(7):863-869.
[12]钱兰娟,李 倩,张清霞,等. 生防细菌L5生防相关因子的初步分析及其种类鉴定[J]. 植物病理学报,2011,41(3):295-300.
[13]刘 勇,柯绍英,黄小琴,等. 枯草芽孢杆菌Bs2004菌株的防病促生效果[J]. 中国生物防治,2008,24(增刊1):46-49.
[14]辛中尧. 枯草芽孢杆菌B1、B2抗菌活性物质研究及其防病促生田间试验[D]. 兰州:甘肃农业大学,2005.
[15]居正英. 茄子内生枯草芽孢杆菌(Bacillus subtilis)29-12防病促生生理生化研究[D]. 福州:福建农林大学,2008.
[16]易有金,肖浪涛,王若仲,等. 内生枯草芽孢杆菌B-001对烟草幼苗的促生作用及其生长动态[J]. 植物保护学报,2007,34(6):619-623.
[17]蔡学清,何 红,胡方平. 内生菌BS-2对辣椒苗的促生作用及对内源激素的影响[J]. 亚热带农业研究,2005,1(4):49-52.
[18]余贤美,周广芳,辛 力. 枯草芽孢杆菌Bs-15产嗜铁素条件及其对甜椒的防病促生效应[J]. 农药学学报,2010,12(2):135-141.endprint
[19]余贤美. 海南岛橡胶根际嗜铁细菌B.subtilis CAS15筛选及嗜铁素基因dhbC克隆、表达与功能分析[D]. 泰安:山东农业大学,2009.
[20]荆瑞勇,王丽艳,王彦杰,等. 乙草胺对土壤微生物数量和酶活性的影响[J]. 中国生态农业学报,2010,18(6):1302-1305.
[21]Schwyn B,Neilands J B. Universal chemical assay for the detection and determination of siderophores[J]. Analytical Biochemistry,1987,160(1):47-56.
[22]王 平,董 飚,李阜棣,等. 小麥根圈细菌铁载体的检测[J]. 微生物学通报,1994,21(6):323-326.
[23]赵 翔,陈绍兴,谢志雄,等. 高产铁载体荧光假单胞菌Pseudomonas fluorescens sp-f的筛选鉴定及其铁载体特性研究[J]. 微生物学报,2006,46(5):691-695.
[24]Arnow L E. Colorimetric determination of the components of 3,4-dihydroxyphenylalanine-tyrosine mixtures[J]. Journal of Biologiacl Chemistry,1937,118(2):531-537.
[25]Neilands J B. Microbial iron compounds[J]. Annual Review of Biochemistry,1981,50(1):715-731.
[26]Shenker M,Oliver I,Helmann M,et al. Utilization by tomatoes of iron mediated by a siderophore produced by Rhizopus arrhizus[J]. Journal of Plant Nutrition,1992,15(10):2173-2182.
[27]韩 松,张守村,黄晓艳,等. 一株产铁载体内生细菌对尖孢镰刀菌的拮抗作用[J]. 西北植物学报,2011,31(5):1039-1044.
[28] 梁建根,吴吉安,竺利红,等. 杭州地区黄瓜猝倒病菌产嗜铁素拮抗菌的筛选与评价[J]. 中国农学通报,2006,22(11):318-322.
[29]刘静洋,崔松松,韩国民,等. 棉花根际细菌的生理活性和促生效果[J]. 中国土壤与肥料,2013(6):88-92.
[30]王西祥,徐 坤,张冬梅,等. 5株生姜促生菌的初步鉴定及产IAA和抑菌能力测定[J]. 山东农业科学,2015,47(1):36-40,46.
[31]张 振,李辉信,陈 雄,等. 一株具有荧蒽降解能力的产吲哚乙酸菌的筛选鉴定及其特性[J]. 环境工程学报,2014,8(11):5041-5047.
[32]魏爱丽,陈云昭. IAA对盐胁迫下大豆幼苗膜伤害及抗盐力的影响[J]. 西北植物学报,2000,20(3):410-414.
[33]宁 倩,吴金水,李宝珍,等. 水稻苗期生长特性对不同浓度IAA的响应[J]. 农业现代化研究,2013,34(2):235-238.
[34]汪建飞,沈其荣. 有机酸代谢在植物适应养分和铝毒胁迫中的作用[J]. 应用生态学报,2006,17(11):2210-2216.
[35]李忠岐,佘小平. 草酸对绿豆上胚轴插条生根和生长的影响[J]. 植物生理学通讯,2002,38(3):242-243.
[36]刘大林,谷文英,秦玉玲,等. 外源细胞分裂素对紫花苜蓿生长及品质的影响[J]. 草业科学,2005,22(10):36-40.
[37]刘 勤,张 新,赵言文,等. 土壤植物营养与农产品品质及人畜健康关系[J]. 应用生态学报,2001,12(4):623-626.endprint

