胡桃醌对前列腺癌细胞雄激素受体及PI3K/AKT通路蛋白表达的影响
方芳,马静,崔家博,王立国
(吉林医药学院检验学院,吉林吉林132013)
胡桃醌对前列腺癌细胞雄激素受体及PI3K/AKT通路蛋白表达的影响
方芳,马静,崔家博,王立国
(吉林医药学院检验学院,吉林吉林132013)
目的探讨胡桃醌对人前列腺癌LNCaP 细胞雄激素受体(AR)及磷脂酰肌醇3激酶/蛋白激酶B(PI3K/AKT)通路蛋白表达的影响。方法培养人前列腺癌LNCaP细胞,分为空白对照组、胡桃醌低剂量组、胡桃醌中剂量组及胡桃醌高剂量组。分别加入终浓度为12.5、25和50 μmol/L胡桃醌作用24 h,空白对照组不加入胡桃醌。采用Western blotting法检测磷酸化蛋白激酶B(p-AKT)、AR、β-catenin蛋白表达。为观察LY294002与胡桃醌对PI3K/AKT信号通路是否具有交互作用,将LNCaP细胞分为空白对照组、胡桃醌组、LY294002组、胡桃醌+LY294002组,胡桃醌组加入胡桃醌50 μmol/L,LY294002组加入LY294002 20 μmol/L,胡桃醌+LY294002组加入LY294002 20 μmol/L及胡桃醌50 μmol/L,空白对照组不加入LY294002及胡桃醌,各组干预24 h后,采用Western blotting法检测p-AKT、β-catenin、AR及AR下游分子前列腺特异性抗原(PSA)的表达变化。结果与空白对照组比较,胡桃醌低、中、高剂量组p-AKT、β-catenin及AR蛋白表达均降低(P均<0.05)。与胡桃醌组、LY294002组比较,胡桃醌+LY294002组p-AKT、β-catenin、AR及PSA蛋白表达均降低(P均<0.05)。结论胡桃醌能够抑制前列腺癌细胞AR的表达,其机制可能与抑制PI3K/AKT信号通路导致AR共刺激分子β-catenin表达下降有关。
胡桃醌;前列腺癌;雄激素受体;磷脂酰肌醇3激酶/蛋白激酶B
前列腺癌是男性最常见的恶性肿瘤之一。针对雄激素-雄激素受体(AR)的雄激素剥夺疗法(ADT)是治疗中晚期前列腺癌的主要手段。前列腺是雄激素依赖性器官,AR在去势抵抗性前列腺癌(CRPC)发生过程中起着核心作用,仍然是临床治疗CRPC的有效靶点[1,2]。因此,发掘新的药物和治疗方法,改善CRPC的疗效和预后,就成为目前前列腺癌领域的研究热点[3]。胡桃醌是从胡桃楸的外壳中提取的一种活性成分,具有促进肿瘤细胞凋亡、抑制肿瘤细胞生长的作用[4,5]。我们前期研究发现,胡桃醌具有抑制前列腺癌细胞生长、促进前列腺癌细胞凋亡作用[6]。然而,胡桃醌对前列腺癌细胞中AR的表达是否有影响及其机制尚不明确。2015年1月~2017年1月,本研究通过观察胡桃醌对人前列腺癌LNCaP细胞AR表达及其作用机制,探讨胡桃醌抑制前列腺癌细胞的作用。
1 材料与方法
1.1 主要试剂 前列腺癌LNCaP细胞(上海中国科学院细胞库);胡桃醌(美国Sigma公司);兔抗磷酸化蛋白激酶 B (p-AKT)、β-catenin、前列腺特异性抗原(PSA)、β-actin抗体和磷脂酰肌醇3激酶(PI3K)/AKT通路抑制剂LY294002(美国Cell Signaling Technology公司);AR(美国Santa Cruz公司)。
1.2 细胞培养、分组及干预方法 人前列腺癌LNCaP细胞于37 ℃、5%CO2培养箱中,用RPMI 1640+10% FCS培养,隔日换液。分为空白对照组、胡桃醌低剂量组、胡桃醌中剂量组及胡桃醌高剂量组。胡桃醌低、中、高剂量组分别加入终浓度为12.5、25和50 μmol/L胡桃醌作用细胞24 h,空白对照组不加入LY294002及胡桃醌。
1.3 p-AKT、p-AR及β-catenin蛋白表达检测 采用Western blotting法检测。提取细胞总蛋白,取30 μg蛋白进行SDS-PAGE凝胶电泳,将凝胶上蛋白移至醋酸纤维素膜,于50 g/L脱脂奶粉中4 ℃封闭过夜,加兔抗p-AKT、β-catenin、AR(1∶1 000)和β-actin抗体(1∶3 000),4 ℃过夜。次日TBST洗膜,分别加HRP标记的山羊抗兔抗体(1∶3 000),室温避光孵育2 h。TBST洗膜,加底物发光显影。使用Quantity One软件扫描并做灰度分析。
1.4 胡桃醌与LY294002交互作用观察 分为空白对照组、胡桃醌组、LY294002组、胡桃醌+LY294002组,胡桃醌组加入胡桃醌50 μmol/L,LY294002组加入LY294002 20 μmol/L,胡桃醌+LY294002组加入LY294002 20 μmol/L及胡桃醌50 μmol/L,空白对照组不加入LY294002及胡桃醌。各组干预24 h后,采用Western blotting法检测p-AKT、β-catenin、AR及AR下游分子PSA的表达变化,方法同1.3。
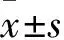
2 结果
2.1 各组p-AKT、AR、β-catenin蛋白表达比较 与空白对照组比较,胡桃醌低、中、高剂量组p-AKT、β-catenin及AR蛋白表达均降低(P均<0.05),详见表1、图1。
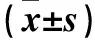
表1 各组p-AKT、AR及β-catenin蛋白表达比较
注:与空白对照组比较,*P<0.05,﹟P<0.01。
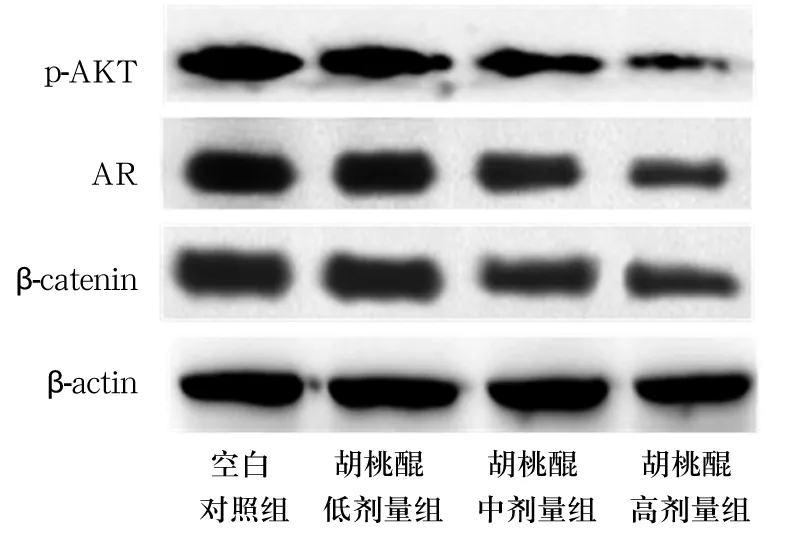
图1 各组p-AKT、AR及β-catenin蛋白表达情况(Western blotting法)
2.2 胡桃醌与LY294002交互作用结果 与胡桃醌组、LY294002组比较,胡桃醌+LY294002组p-AKT、β-catenin、AR及PSA蛋白表达均降低(P均<0.05)。详见表2、图2。
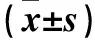
表2 胡桃醌与LY294002交互作用对p-AKT、β-catenin、AR、PSA蛋白表达的影响
注:与胡桃醌+LY294002组比较,*P<0.05。
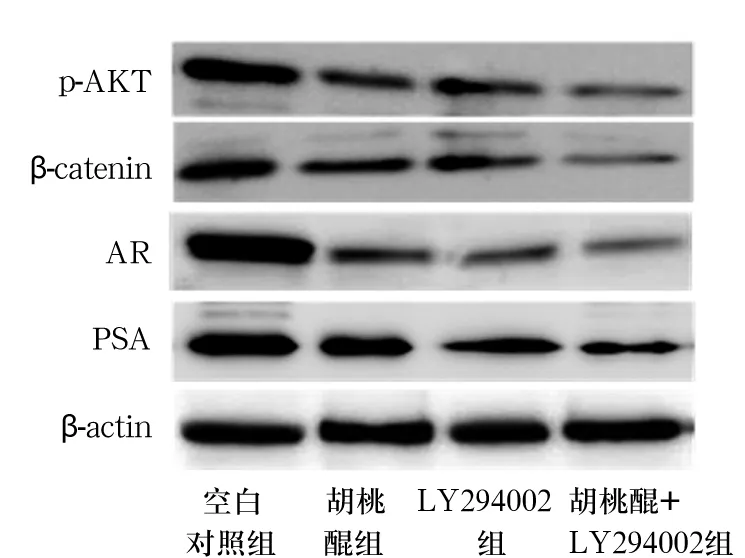
图2 胡桃醌与LY294002交互作用对p-AKT、β-catenin、AR、PSA蛋白表达的影响(Western blotting法)
3 讨论
近年来由于饮食结构改变和人口老龄化,我国前列腺癌发病率逐年增高[7]。患者在接受ADT治疗后2~3年内,往往由雄激素依赖性前列腺癌(ADPC)转化为CRPC。CRPC是前列腺癌病程中的致死性阶段,尽管采用新型ADT药物、化疗、核素与生物治疗等方法可使CRPC的预后有所改善,但是患者的平均存活期仍不足2年[8]。因此,发掘新的药物和治疗方法,改善CRPC的疗效和预后,就成为目前前列腺癌领域的研究热点。
CRPC是前列腺癌病程中的致死性阶段,AR在CRPC发生中起着核心作用。AR通过基因扩增、突变、剪接体、共激活因子和信号通路活化等途径导致其异常表达或(和)活化,使ADPC细胞增殖并最终导致CRPC[9,10]。AR通路是CRPC诸多形成机制中的共同点,在ADPC 进展为CRPC的过程中起着核心作用。AR引发CRPC的机制主要有AR点突变、AR过表达、AR共激活因子促进AR异常活化等[11]。因此,AR亦是CRPC 的治疗靶点。PSA是AR调节的下游靶分子,AR可以促进PSA基因的转录及其表达。PSA是前列腺癌的特异性标志物,PSA增高是诊断前列腺癌发生发展的标志物。
我国的药用植物资源丰富,已发现多种植物成分具有抗癌作用。人们很早就发现核桃楸树皮及果皮具有抗肿瘤、抗炎和杀虫的作用,在中国许多治疗癌症的验方中都含有核桃楸成分。研究发现,核桃楸中具有抗肿瘤、抗炎及杀虫作用的有效成分是胡桃醌。本研究表明,胡桃醌作用前列腺癌LNCaP细胞后p-AKT、AR及AR的共刺激分子β-catenin 蛋白表达逐渐下降。PI3K/AKT信号通路在肿瘤细胞中起着重要的调节作用,具有促进肿瘤细胞的增殖、分化、凋亡、血管生成等作用。研究表明,PI3K/AKT通路可以调节β-catenin的转录活性。β-catenin是AR的共激活因子,β-catenin能与AR结合,有效协助AR诱导AR调控基因的表达。本研究表明,胡桃醌低、中、高剂量组p-AKT、β-catenin及AR蛋白表达均降低,提示胡桃醌能够降低p-AKT、β-catenin及AR蛋白表达。
进一步证实胡桃醌、PI3K/AKT信号通路与AR之间的关系,本研究采用PI3K/AKT通路抑制剂LY294002与胡桃醌共同作用细胞24 h,观察LY294002与胡桃醌对于PI3K/AKT信号通路是否具有交互作用。本研究结果表明,LY294002与胡桃醌间具有交互效应,胡桃醌+LY294002组p-AKT、β-catenin、AR及PSA蛋白表达表达均降低,提示LY294002与胡桃醌间的交互效应可使p-AKT、β-catenin、AR和PSA蛋白表达表达明显降低,抑制PI3K/AKT信号通路。
综上所述,胡桃醌能够抑制前列腺癌细胞AR及其下游分子PSA的表达,其机制可能与抑制PI3K/AKT信号通路导致AR共刺激分子β-catenin表达下降有关。
[1] Eqan A, Dong Y, Zhang H, et al. Castration-resistant prostate cancer: adaptive response in the androgen axis[J]. Cancer Treat Rev, 2014,40(3):426-433.
[2] Henzler C, Li Y, Yang R, et al. Truncation and constitutive activation of the androgen receptor by diverse genomic rearrangements in prostate cancer[J]. Nat Commun, 2016,7(7):13668-13680.
[3] Wang J, Zou JX, Xue X, et al. ROR-γ drives androgen receptor expression and represents a therapeutic target in castration-resistant prostate cancer[J]. Nat Med, 2016,22(5):488-496.
[4] Xu HL, Yu XF, Qu SC, et al. Juglone, from Juglans mandshruica Maxim, inhibits growth and induces apoptosis in human leukemia cell HL-60 through a reactive oxygen species-dependent mechanism[J]. Food Chem Toxicol, 2012,50(3-4):590-596.
[5] 赵行宇,杨森,周丽霞,等.胡桃醌对肝癌HepG2 细胞的增殖抑制及诱导凋亡作用[J].吉林大学学报,2013,2(3):255-258.
[6] 方芳,王立国,孔德玉,等.胡桃醌对人前列腺癌PC-3细胞生长作用研究[J].时珍国医国药,2013,24(5):1120-1121.
[7] Chen W, Zheng R, Baade PD, et al. Cancer statistics in China, 2015[J]. CA Cancer J Clin, 2016,66(2):115-132.
[8] Lowrance WT, Roth BJ, Kirkby E, et al. Castration-resistant prostate cancer: AUA guideline amendment 2015[J]. J Urol, 2016,195(5):1444-1452.
[9] Henzler C, Li Y, Yang R, et al. Truncation and constitutive activation of the androgen receptorby diverse genomic rearrangements in prostate cancer[J]. Nat Commun, 2016,7(7):13668-13680.
[10] Watson PA, Arora VK, Sawyers CL, et al. Emerging mechanisms of resistance to androgen receptor inhibitors in prostate cancer[J]. Nat Rev Cancer, 2015,15(12):701-711.
[11] Ferraldeschi R, Welti J, Luo J, et al. Targeting the androgen receptor pathway in castration-resistant prostate cancer: progresses and prospects[J]. Oncogene, 2015,34(14):1745-1757.
JugloneinhibitsARexpressionthroughPI3K/AKTpathwayinhumanprostatecancercells
FANGFang,MAJing,CUIJiabo,WANGLiguo
(CollegeofLaboratory,JilinMedicalUniversity,Jilin132013,Chain)
ObjectiveTo investigate the effects of juglone on the androgen receptor (AR) and phosphatidylinositol 3-kinase (PI3K)/AKT pathway expression in the prostate cancer LNCaP cells.MethodsThe human prostate cancer LNCaP cells were divided into the blank control group (without juglone), the low-dose juglone group (12.5 μmol/L), medium-dose juglone group (25 μmol/L) and high-dose juglone group (50 μmol/L). After the cells in each group were treated for 24 h, Western blotting was used to detect the expression of p-AKT, AR and β-catenin. In order to observe whether LY294002 and juglon had interaction on PI3K/AKT signal pathway, LNCaP cells were divided into the blank control group (without juglone and LY294002), juglone group (50 μmol/L juglone), LY294002 group (20 μmol/L LY294002), juglone and LY294002 group (50 μmol/L Juglone and 20 μmol/L LY294002). Cells in each group were treated for 24 h and Western blotting was used to detect the expression of p-AKT, AR, β-catenin, and prostate-specific antigen (PSA).ResultsCompared with the blank control group, the p-AKT, β-catenin and AR expression levels of LNCaP cells decreased in the low-dose, medium-dose and high-dose juglone groups (allP<0.05). Compared with the juglone group and LY294002 group, the expression levels of p-AKT, β-catenin, AR, and PSA decreased in the juglone and LY294002 groups (allP<0.05).ConclusionJuglone can inhibit the expression of AR in the prostate cancer cells, and its mechanism may be that the inhibition of PI3K/AKT signaling pathways leads to the decrease of β-catenin expression.
juglone; prostate carcinoma; androgen receptor; phosphatidylinositol 3-kinase/protein kinase B
10.3969/j.issn.1002-266X.2017.46.006
R737.25
A
1002-266X(2017)46-0024-03
吉林省教育厅“十二五”科学技术研究[吉教科合字(2014)第360号]。
方芳(1973-),女,博士,副教授,研究方向为肿瘤的药物治疗。E-mail: jillmcfang@163.com
王立国(1971-),男,博士,主任医师,研究方向为肿瘤的药物治疗。E-mail: urolancet@sina.com
2017-08-13)

