PEG 4000/(NH4)2SO4双水相体系萃取欧李种仁蛋白研究
孙雁霞,罗 倩,时羽杰,李 杰,田计均,唐 媛,邬晓勇
(成都大学 药学与生物工程学院,四川 成都 610106)
PEG 4000/(NH4)2SO4双水相体系萃取欧李种仁蛋白研究
孙雁霞,罗 倩,时羽杰,李 杰,田计均,唐 媛,邬晓勇
(成都大学 药学与生物工程学院,四川 成都 610106)
利用聚乙二醇(PEG)4000/(NH4)2SO4双水相体系萃取欧李种仁蛋白.研究了PEG 4000/(NH4)2SO4双水相体系的体系组成对蛋白分配系数及回收率的影响,最后确定了最佳的双水相萃取体系.在18%的(NH4)2SO4与10%的聚乙二醇构成的双水相体系中,蛋白的分配系数最小为0.495,回收率为92.0%.对体系的最大萃取容量测定结果表明,双水相体系易于放大和进行连续性操作,适用于大规模生产活性蛋白.
双水相萃取;PEG 4000/(NH4)2SO4体系;欧李;种仁蛋白
0 引 言
欧李为蔷薇科樱桃属落叶小灌木,为我国特有的果实和药食兼用树种[1].欧李种仁也称郁李仁,其主要成分包括苦杏仁苷、欧李种仁油与欧李种仁蛋白,欧李种仁蛋白组成中谷氨酸含量很高,有改善神经系统的功效[2-3].一般蛋白的提取与分离通常采用硫酸铵盐析法,但蛋白的活性和构象在过高浓度的盐离子中容易遭到破坏.而双水相方法则是利用高聚物与无机盐体系的水溶液所形成的互不相容的两相,通过构建适宜的成相条件,使蛋白质等活性生物大分子在两互不相容的水相中具有不同的分配系数,从而使蛋白得到分离与纯化[4-7].该方法不仅避免了传统的有机溶剂萃取对蛋白造成的破坏,同时也为生物活性物质的纯化提供了温和的水相环境,而且具有分离高效、成本低廉、高回收率和工业上易于放大的特点.
目前,在蛋白质的分离与分析等方面,科研人员已做了大量的工作,蛋白质的分离纯化方法相对比较完善[4-6],但针对欧李种仁蛋白质的提取工艺研究相对较少.对此,本研究采用双水相萃取技术[7],通过筛选优化提取条件,建立了适宜欧李种仁蛋白的双水相萃取体系.
1 材料、仪器与方法
1.1 材 料
实验所用的欧李来自于山西农业大学园艺学院.
实验所用试剂包括:考马斯亮蓝G-250、标准牛血清白蛋白、PEG 4000、(NH4)2SO4、石油醚、乙醇、NaCl、95%乙醇等,购于成都科龙化工有限公司,均为分析纯.
1.2 仪 器
实验所用仪器包括:精密电子天平(上海速展机电公司),旋涡混合器(沃信仪器制造有限公司),Unico紫外可见分光光度计(上海光学仪器公司).
1.3 方 法
1.3.1 欧李种仁蛋白制备.
成熟的欧李种子,手工去壳后置干燥箱干燥备用.将干燥欧李种仁研磨成粉末,用2倍体积的石油醚脱脂,于通风处风干后用文献[4]中的碱提酸沉的方法获得种仁蛋白,经冷冻干燥后备用.
1.3.2 试剂配制.
1)考马斯亮蓝G-250溶液的配制.精确称取0.1 g考马斯亮蓝G-250,用50 mL 95%的乙醇溶解,之后加入100 mL 85%浓磷酸,然后转移至1 000 mL容量瓶并用水定容至刻度线,反复摇匀后静置24 h,之后过滤置棕色瓶中避光备用.
2)牛血清蛋白原液的配制.精确称取0.10g牛血清白蛋白,用生理盐水稀释并定容至100 mL容量瓶中,混匀,制得浓度为1 mg/mL的牛血清蛋白原液.
1.3.3 标准牛血清蛋白制定标准曲线.
将牛血清蛋白原液稀释10倍以后,在7支试管中(一支为空白对照),分别精确吸取稀释后的牛血清白蛋白原液0.00 mL(空白调零),0.10 mL、0.30 mL、0.50 mL、0.70 mL、0.90 mL、1.00 mL,用生理盐水全部稀释至1.0 mL,然后分别加入5.00 mL考马斯亮蓝G-250溶液,混合均匀,立即于波长595 nm条件下比色测定.以试管中标准蛋白的总含量为横坐标,相应的吸光度值(A)为纵坐标作标准曲线图,并作线性回归,求线性方程.
1.3.4 双水相体系相图制备.
配制质量分数30%的(NH4)2SO4溶液并测定其密度,将此溶液装入滴定管备用.
精确称取0.2 g PEG 4000溶解于0.8 g蒸馏水中,用滴定管缓慢滴加(NH4)2SO4溶液并不断振荡使其混合均匀,观察溶液的澄清程度,直至溶液开始出现浑浊为止.记录(NH4)2SO4溶液的加量(mL),并根据密度值求出质量(g).然后再加入固定体积(0.5 mL)的蒸馏水,溶液澄清,继续重复上述操作,直至再次达到浑浊.如此反复操作10次并计算每次达到浑浊时PEG 4000和(NH4)2SO4在系统中的质量分数(g/g).以PEG 4000的质量分数为纵坐标,(NH4)2SO4的质量分数为横坐标,即可得到一条PEG4000和(NH4)2SO4的双水相相图.
1.3.5 双水相体系制备.
1)(NH4)2SO4质量分数固定为18%,以不同质量分数的PEG 4000组成双水相体系,加入1 mL牛血清白蛋白原液,pH调至中性,置于4 ℃萃取,待完全分层后,测定各双水相体系蛋白质的上下相的分配系数、相比以及下相萃取率.加样情况见表1,选择分配系数最小的作为最适PEG 4000的质量分数.
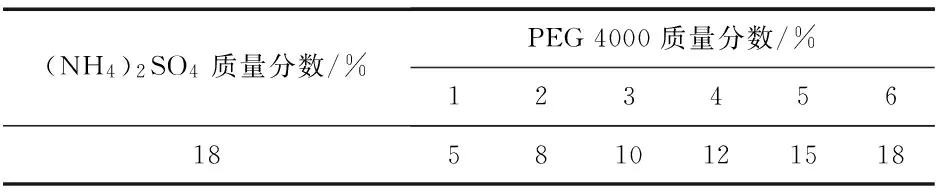
表1 PEG 4000/(NH4)2SO4双水相体系A组成
2)PEG4 000的质量分数固定为10%,以不同质量分数的(NH4)2SO4组成双水相体系,加入牛血清白蛋白原液,pH调至中性,置于4 ℃萃取,待完全分层后,测定各双水相体系蛋白质的上、下相的分配系数、相比以及下相萃取率.加样情况见表2,选择分配系数最小的组作为最适的(NH4)2SO4质量分数.
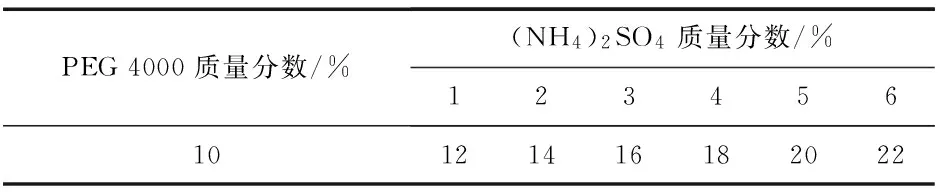
表2 PEG/(NH4)2SO4双水相体系B组成
3)双水相体系蛋白质的分配系数、回收率及相比计算公式为,
分配系数,K=C上/C下
相比,R=V上/V下
回收率(%),Y上=C上V上/(C上V上+C下V下)
Y下=C下V下/(C上V上+C下V下)
式中,C上、C下分别代表上、下相蛋白质浓度;V上、V下分别代表上、下相的体积.
1.3.6 双水相体系中蛋白质最大萃取容量测定.
分别以“1.3.5”项下确定的最佳的PEG 4000和(NH4)2SO4质量分数组成双水相体系,加入稀释后的欧李种仁蛋白溶液,不断反复操作,直至溶液由浑浊变澄清记录滴加蛋白溶液的量,并计算出下相中蛋白的含量.
2 结果与分析
2.1 蛋白标准曲线
按照“1.3.3”项下的方法,在波长595 nm条件下测得各梯度浓度标准蛋白溶液的吸光度值.据吸光度值制作出牛血清白蛋白标准曲线如图1所示.回归方程为,y=5.8767x+0.0992,R2=0.9991,表明蛋白浓度在0.01~0.12 mg/mL范围内,线性关系良好,可用于后续蛋白质的测定.
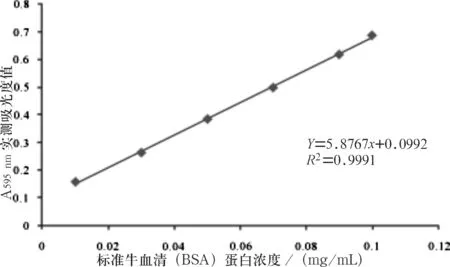
图1牛血清蛋白标准曲线
2.2 PEG/(NH4)2SO4双水相相图
精确称取(NH4)2SO4固体30 g加入70 g蒸馏水溶解,配制质量分数为30%的(NH4)2SO4溶液.测定其密度为1.1266 g/mL.通过反复操作,记录加入(NH4)2SO4溶液的体积(mL),计算出纯(NH4)2SO4的累计量(g),PEG和(NH4)2SO4的质量分数(%),结果如表3所示.
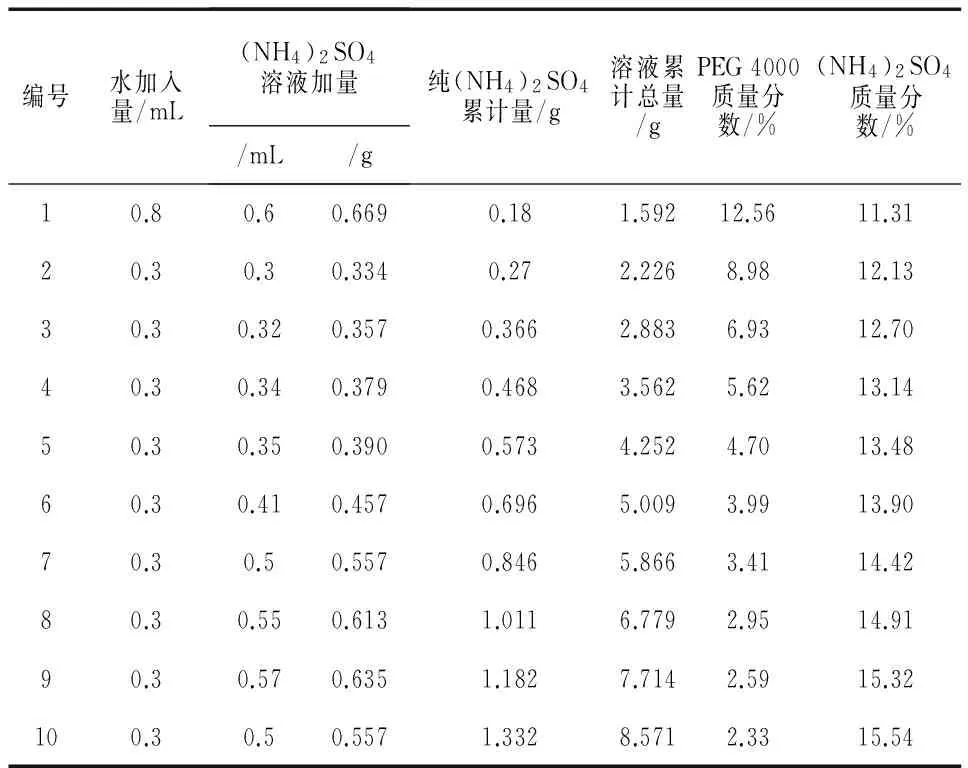
表3 双水相相图制作数据记录表
通过表3中PEG 4000和(NH4)2SO4的质量分数的数据制作出双水相相图如图2所示.
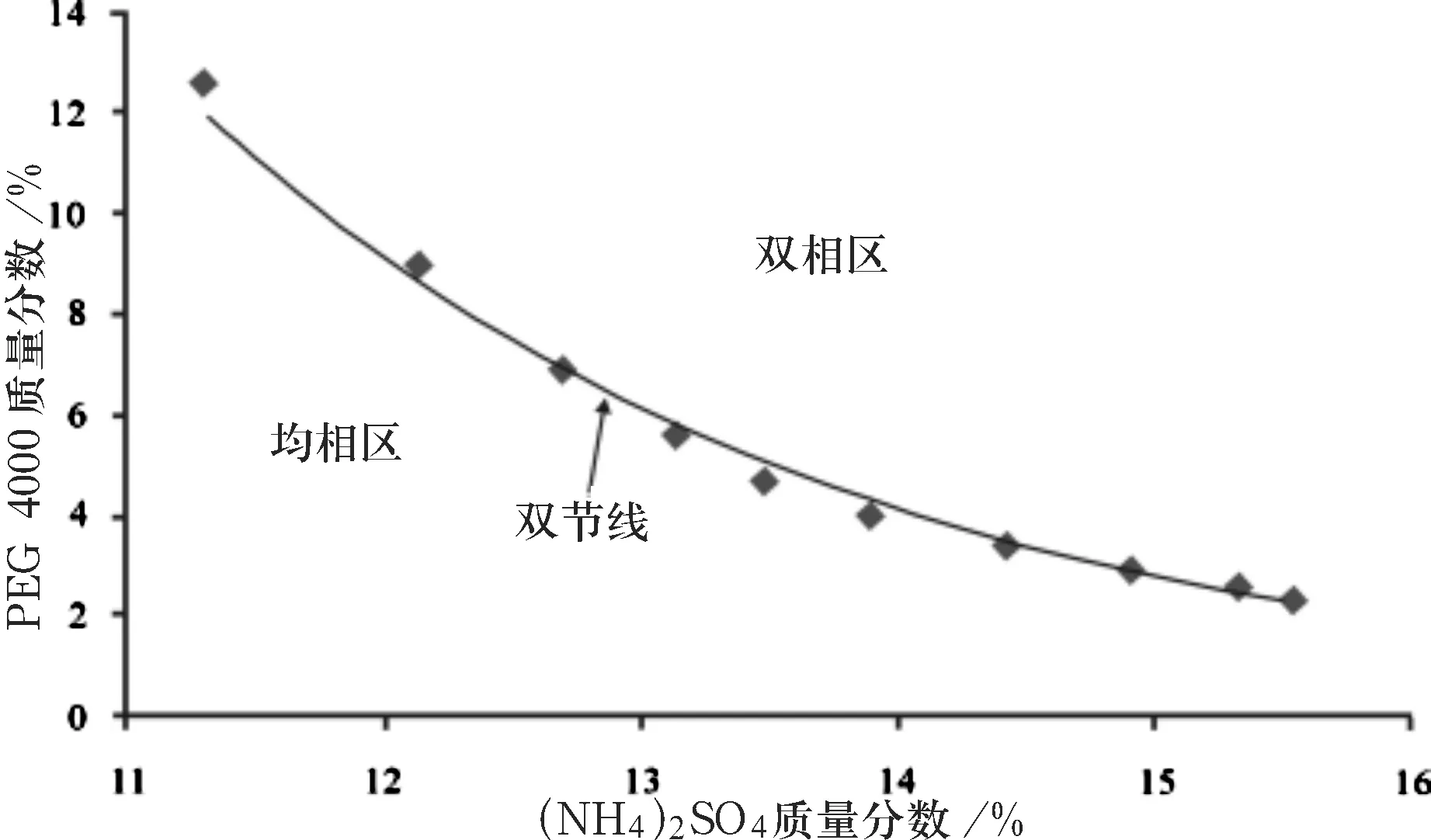
图2 PEG 4000/(NH4)2SO4双水相相图
2.3 水相中分配系数、相比计算及最佳条件确定
(NH4)2SO4质量分数固定为18%,以不同质量分数的PEG 4000组成双水相体系,在595 nm处测得溶液的吸光度,结果如表4所示.
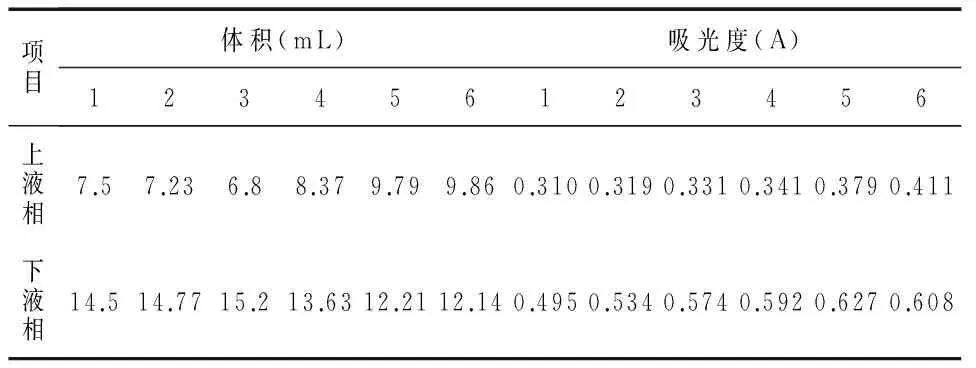
表4 PEG/(NH4)2SO4双水相体系A数据
PEG 4000质量分数固定为10%,以不同质量分数的(NH4)2SO4组成双水相体系,通过分光光度计在595 nm处测得溶液的吸光度值,结果如表5所示.
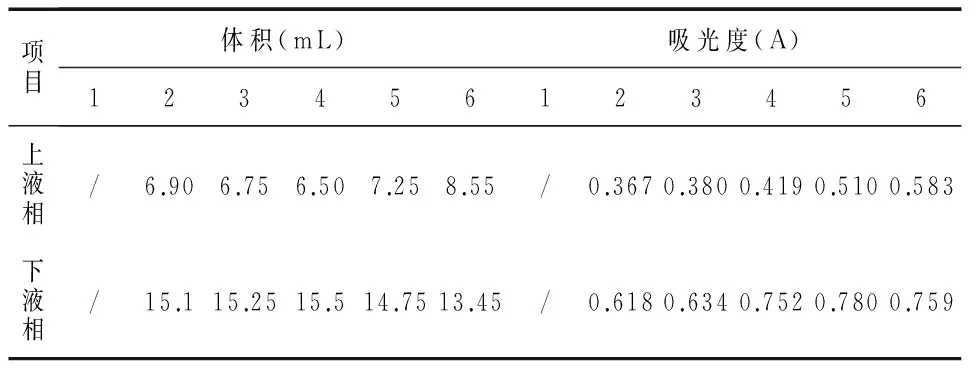
表5 PEG/(NH4)2SO4双水相体系B数据
注:项目1的“/"表示加入蛋白后破坏了双水相体系两相的组成使其无法分层,故未统计数据.
通过表4中溶液上、下相的体积(mL)和溶液的吸光度(A)计算出双水相体系A中蛋白在两相中的分配系数、相比、回收率的数据,结果如表6所示.
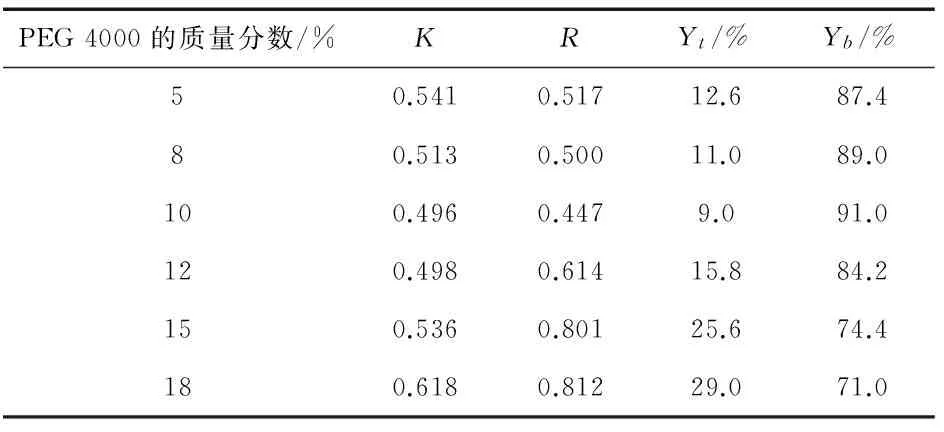
表6 双水相体系A中蛋白质K、R、Y的数据
通过表5中溶液上、下相的体积(mL)和吸光度(A)计算出双水相体系B中蛋白在两相中的的分配系数、相比、回收率的数据,结果如表7所示.
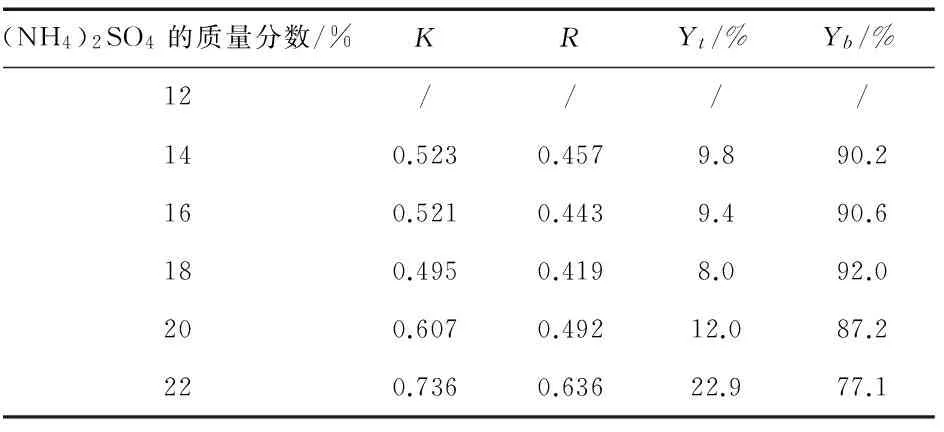
表7 双水相体系B蛋白质K、R、Y的数据
2.3.1 PEG 4000的质量分数对蛋白萃取的影响.
随着PEG 4000质量分数的增加(见表6),分配系数K先下降后上升且变化较大,Y下先增大后减小,并在PEG 4000质量分数为10%时,K和Y下均达到最佳值.在总体趋势中,相比R先下降后上升.由于在PEG 4000质量分数在10%时,K最小,为0.496,Y下为91.0%,因此,最佳提取条件的PEG 4000质量分数为10%.
2.3.2 (NH4)2SO4的质量分数对萃取的影响.
当固定PEG 4000的质量分数量时(见表7),分配系数K随着(NH4)2SO4质量分数的增加而下降,当(NH4)2SO4浓度超过18%时,分配系数K又逐渐上升.总趋势相比R先下降后上升,Y下先升高后降低.(NH4)2SO4的质量分数为18%时,分配系数K最小,为0.495,而Y下最大达92.0%,由此可知,最适萃取条件的(NH4)2SO4质量分数为18%.
2.3.3 双相体系最佳条件确定.
通过上述数据的分析,确定该双相体系下最佳条件为:(NH4)2SO4的质量分数为18%,PEG 4000的质量分数为10%.
2.4 双水相体系最大萃取容量确定
在确定了最佳双水相体系的组成后,利用(NH4)2SO4的质量分数为18%,PEG 4000的质量分数为10%组成双水相体系.测定体系的总体积为50 mL,通过滴加稀释的欧李蛋白溶液,记录滴加蛋白溶液的最大量为18.9 mL.通过标准曲线求得在本双水相体系下蛋白质的最大容量为1.739 mg.根据表6和表7中Y下的值估算出下相中蛋白的量为1.600 mg.因此,通过实验确定的最佳双水相萃取体系的蛋白萃取率为92.0%.
3 结 论
据双水相分配理论,(NH4)2SO4可影响体系上、下相的电位差,进而影响蛋白的分配系数和萃取率.而高浓度的(NH4)2SO4导致蛋白发生盐析,进而使蛋白萃取率下降,同时还会扰乱双水相系统,改变体系中成相物质的组成和相比[6-7].本实验利用聚乙二醇(PEG)4000/(NH4)2SO4双水相体系萃取欧李种仁蛋白,在18%的(NH4)2SO4与10%的聚乙二醇构成的双水相体系中,蛋白的分配系数最小为0.495,回收率为92.0%.对体系的最大萃取容量测定结果表明,双水相体系易于放大和进行连续性操作,适用于大规模生产活性蛋白.
[1]薛晓芳,杜俊杰.浅谈欧李的开发利用价值[J].落叶果树,2012,44(3):23-26.
[2]田金强,兰彦平,朱克瑞,等.欧李仁综合利用关键技术研究[J].中国油脂,2012,37(2):65-69.
[3]李佳,苟兰亭,陈俊,等.双水相体系提取欧李种仁蛋白的初步研究[J].种子,2014,33(3):82-85.
[4]周红航,王维香.聚乙二醇/硫酸铵双水相体系萃取猪胰蛋白酶[J].化工进展,2009,28(2):305-308.
[5]于群,朱新产.苦瓜种子蛋白的双水相提取及抑菌性研究[J].江西农业学报,2012,24(1):88-90.
[6]郑楠,刘杰.双水相萃取技术分离纯化蛋白质的研究[J].化学与生物工程,2006,23(10):7-9.
[7]马春宏,朱红,王良,等.双水相萃取技术的运用研究进展[J].光谱实验室,2010,27(5):1906-1913.
StudyonExtractionofSeedKernelProteinfromPrunusHumilisbyPEG4000/(NH4)2SO4AqueousTwo-phaseSystem
SUNYanxia,LUOQian,SHIYujie,LIJie,TIANJijun,TANGYuan,WUXiaoyong
(School of Pharmacy and Bioengineering, Chengdu University, Chengdu 610106, China)
The seed kernel protein was extracted from Prunus humilis PEG4000/(NH4)2SO4aqueous two-phase system.The paper studied the effects of composing mechanism the PEG4000/(NH4)2SO4aqueous two-phase system on the recovery rate and the protein distribution coefficients,and then the best aqueous two-phase extraction system was determined.The minimum protein distribution coefficient was 0.495 and the maximum protein recovery rate was 92.0% in the aqueous two-phase system which was constituted by 18%(NH4)2SO4and 10% PEG4000 constituted by polyethylene glycol.The results obtained from the test of the maximum extraction capacity of the system showed that the aqueous two-phase system was suitable for large-scale active protein extraction and easy to be zoomed and continuously operated.
aqueous two-phase extraction;PEG4000/(NH4)2SO4system;Cerasus humilis;seed kernel protein
TQ464.7
A
1004-5422(2017)04-0338-04
2017-09-26.
食品加工与应用四川省高校重点实验室科研基金(14-S03)、 成都大学药食同源植物资源开发四川省高校重点实验室开放基金(10Y201409)资助项目.
孙雁霞(1976 — ),女,博士,副教授,从事植物生物技术研究.

