湖南牡丹黑斑病的病原菌鉴定
肖婷婷,吕长平,钟丽凡,许文婷
(湖南农业大学园艺园林学院,湖南 长沙 410128)
湖南牡丹黑斑病的病原菌鉴定
肖婷婷,吕长平,钟丽凡,许文婷
(湖南农业大学园艺园林学院,湖南 长沙 410128)
牡丹黑斑病在湖南地区危害严重,且其病原菌种类尚不明确,本研究通过形态学鉴定结合分子鉴定对湖南牡丹黑斑病的致病菌进行鉴定,并通过 Blast 进行序列同源性比对,明确病原菌的种类。结果表明:形态学鉴定可推断病原菌为链格孢属(Alternaria)真菌,分子鉴定表明该病原菌的 ITS 序列与 Alternaria alternate和 Alternaria tenuissima 的 ITS 序列的同源性达 100%,因此,可以确定该病病原菌为 Alternaria alternate 和Alternaria tenuissima。致病性鉴定表明有伤口和无伤口都可导致黑斑病的发生。
牡丹黑斑病;形态学鉴定;分子鉴定
牡丹(Paeonia suffruticosa)为多年生落叶灌木,花色艳丽,品种繁多,深受人们的喜爱,是我国十大名花之一。近年来,随着牡丹产业的快速发展,湖南牡丹的栽培面积在不断扩大,品种也在逐步增加,与之相对的是病害的发生日益严重,黑斑病就是其中之一。该病在湖南发生普遍,危害严重,主要危害牡丹的叶片、叶柄和茎秆,牡丹感病后,感病部位会产生黑褐色的病斑,病斑中心位置颜色变浅为淡褐色或白色,严重时,病斑遍布整个叶片,造成叶片卷曲、穿孔,甚至整株枯死。目前,关于牡丹黑斑病的研究不多,主要是其病害症状的描述和防治措施,段春燕[1]等对牡丹黑斑病的危害症状进行了较详细的描述,段亚冰[2]发现黑斑病严重危害山东牡丹,并通过病原培养确定其病原菌为链格孢属的真菌,石良红[3]等通过形态学鉴定结合分子鉴定,并进行序列分析,明确了黑斑病的病原菌为Alternaria alternate,侯颖[4]和刘玉兰[5]则对牡丹黑斑病病原菌进行室内毒力试验。
湖南牡丹病害的研究十分缺乏,没有系统的文献资料,这对湖南牡丹病害研究工作的开展造成困难。本研究对危害湖南牡丹的黑斑病通过形态学鉴定和致病性鉴定来确定其致病菌,并利用分子生物学手段明确致病菌的种类,为以后的防治研究提供理论依据。
1 材料与方法
1.1 供试材料及菌株
病原分离的寄主材料采自长沙、邵阳、湘西基地和湖南农业大学花卉基地不同发病期的植株;菌株是由采集的样本组织进行分离纯化后培养所得的纯菌株,于 4 ℃ 冰箱内保存。
1.2 实验药品及试剂
PDA 培养基(土豆、葡萄糖、琼脂糖)、双蒸水、苯胺蓝染色剂、三羟甲基氨基甲烷(以下简称 Tris)、乙二胺四乙酸二钠(以下简称 Na2EDTA·2H2O)、NaCl、十六烷基三甲基溴化铵(以下简称 CTAB)、三水合醋酸钠(以下简称 NaOAc·3H2O)、浓 HCl、NaOH、冰醋酸、氯仿:异戊醇(V : V=24 : 1)、异丙醇、70% 乙醇、TE 缓冲液、RNase A、琼脂糖、6×Loading Buffer、GelStain、DNA Maeker D2000 和 2×Taq PCR MasterMix、通用引物 ITS1(5’-TCCGTAGGTGAACCTGCGCGG-3’)和通用引物 ITS4(5-TCCTCCGCTTATTGATATGC-3’)由英潍捷基(上海)贸易有限公司合成。
1.3 试验方法
1.3.1 病原菌的分离及纯化 采用常规组织分离法[6],将采取的病样组织在病健交界处剪成 5 mm 左右的小块,对其进行消毒处理后,接种到 PDA 平板上,每个培养皿放 4 - 5 块,置于恒温恒湿培养箱中 28 ℃ 培养,待平板长出菌落后对其进行纯化培养,将纯化后的菌株放入 4 ℃ 冰箱保存备用。
1.3.2 病原菌形态鉴定 对分离后的菌落进行形态观察,观察其菌落的颜色、形态特征及生长情况并拍照记录,然后用灭菌的挑针挑取少量菌丝制片,进行镜检,观察菌丝形态、分生孢子及分生孢子梗等特征,并用显微镜拍照。
1.3.3 致病性鉴定 将纯化培养后得到的病原菌菌丝配成菌丝悬浮液,采取新鲜无病叶片,用75% 的酒精进行消毒,然后用双蒸水冲洗,将其放入灭菌的培养皿中,培养皿中放置浸湿的已灭菌的滤纸,分为无伤口和有伤口两组,用已灭菌的枪头刺伤叶片,用移液枪吸取少量悬浮液喷洒叶片,以无菌水做对照,用保鲜膜包裹,室温保湿培养,3 天后观察并记录接种的发病症状及发病率。最后将接种后发病的叶片再次进行病原菌的分离纯化,检测分离的病原是否和接种的病原一致[7]。
1.3.4 分子鉴定 从黑斑病菌落上分离出 4 个菌株,命名为 H1、H2、H3、H4,将其培养 6 天后,刮取菌丝,采用 2×CTAB 法[8-9]提取菌丝的总 DNA,并将提取的 DNA 利用通用引物 ITS1和 ITS4 进行 PCR 扩增,采用 25 μL 反应体系,反应条件为:94 ℃ 的预变性 5 min;94℃的变性 45 s,55 ℃ 的退火 45 s,72 ℃ 的延伸105 s,总共 30 个循环;72 ℃ 的补平 10 min,4 ℃无限循环保温[2]。
将 PCR 扩增得到的产物进行琼脂糖凝胶电泳检测,并用凝胶成像系统观察并记录扩增产物的图谱,并将未纯化的 DNA 片段送到英潍捷基(上海)贸易有限公司进行测序。测序结果用 NCBI 中的 Blast 工具进行序列同源性比对,以确定菌株的种类。
2 结果与分析
2.1 形态学鉴定
病株在 PDA 培养基上长成的菌落早期为白色,随后颜色加深,菌落中间为深褐色,边缘为灰白色,菌落背面有同心轮纹,中间为深褐色或黑褐色,边缘颜色为灰褐色(见图 1 A、B)。在显微镜下可以观察到分生孢子梗为黄褐色,单生或丛生,有分枝,直立或弯曲;分生孢子梗顶生分生孢子,分生孢子为深褐色,单生或丛生,卵形、长椭圆形或倒棍棒状,分生孢子内生横隔膜和纵隔膜(见图 1 C、D)。根据以上形态特征,推断其为链格孢属(Alternaria)的真菌。
2.2 致病性鉴定
用病原菌对牡丹叶片进行有伤口和无伤口接种后的叶片的发病情况见图 2。接种 1 天后看到叶片上有圆形的黑色小点发生,随后扩大成病斑,发病迅速,而且无伤口接种的叶片在 2 天后也会出现圆形的灰黑色小点,且病斑不断扩大。从试验中可以看出有伤口和无伤口接种都会使叶片产生病斑,且病害发生的时间相差不多,这表明即使牡丹植株没有伤口,黑斑病的病原菌也可以侵染植株,而对照组不出现症状。根据科赫氏法则将发病的叶片组织再次进行分离纯化,得到的菌落和原分离的菌落一致,对其菌丝进行镜检,结果也一致,得出该分离的病菌就是牡丹黑斑病的致病菌。
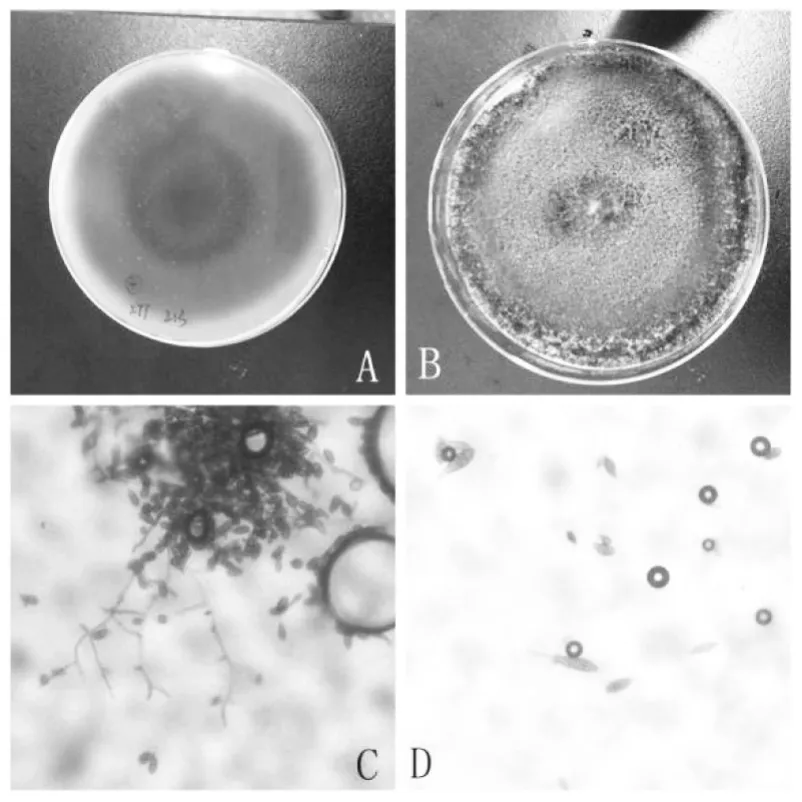
图1 黑斑病病原菌形态特征Fig.1 Colony morphology of black spot

图2 黑斑病接种试验Fig.2 The inoculation test of black spot
2.3 分子鉴定
2.3.1 菌株 DNA 序列扩增 将菌株所提取到的DNA,利用通用引物 ITS1 和 ITS4 对其进行 PCR 扩增,获得 530 bp 左右的 DNA 序列,经过琼脂糖凝胶电泳和凝胶成像系统检测,可看到清晰条带(见图 3)。

图3 PCR扩增产物图谱Fig.3 The map of PCR products
2.3.2 序列分析 将测序后得到序列提交到 NCBI网站上,用 Blast 工具进行序列同源性比对,序列比对的结果表明黑斑病的病原菌为 Alternaria alternata 和 Alternaria tenuissima。
菌株 H1 的序列用 Blast 比对后,在 GenBank数据库中查找到登录号为 JF835905.1 的 Alternaria alternate 的 ITS 序列和 H1 菌株的同源性为 100%(529/529),29~484 号碱基和所测序列的 1-456号碱基位置一致,其中两者间的 score 最大值为955 bits,E 值为 0(见图 4)。

图4 菌株H1和编号JF835905.1菌株的rDNA的ITS序列比对Fig.4 Comparison of ITS sequences of rDNA strains H1 and No.JF835905.1 strains
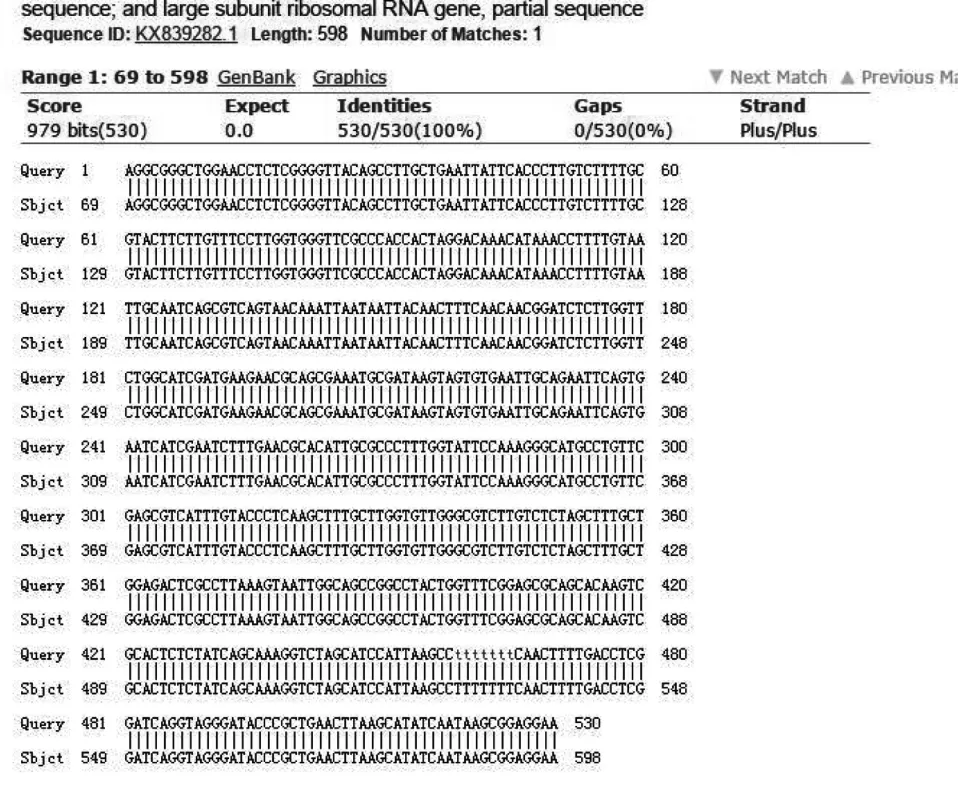
图5 菌株H2和编号KX839282.1菌株的rDNA的ITS序列比对Fig.5 Comparison of ITS sequences of rDNA strains H2 and No.KX839282.1 strains
登录号 JF835905.1 的菌株来源于:Polyphasic classification of Alternaria isolated from walnut fruit in China,作者为 Yang, K.Q.,Qu, W.W。
菌株 H2 的序列用 Blast 比对后,在 GenBank数据库中查找到登录号为 KX839282.1 的Alternaria sp.的 ITS 序列和 H2 菌株的同源性为100%(530/530),69~526 号碱基和所测序列的 1~458 号碱基位置相对应,其中两者间的 score 最大值为 979 bits,E 值为 0;菌株 H2 和编号为 KX664408.1 的Alternaria tenuissima 的 ITS 序列的同源性也为100%(530/530),41~498 号碱基和所测序列的 1~458 号碱基位置相对应,两者间的 score 最大值为 979 bits,E 值为 0(见图 5、图 6)。
登录号 KX839282.1 的菌株来源于:Microbial succession in an inflated lunar/Mars analog habitat during a 30-day human occupation,作者为Mayer, T.,Blachowicz, A.J.,Vaishampayan,P.,Checinska,A.,Swarmer, T.,de Leon, P and Venkateswaran, K。
登录号 KX664408.1 的菌株来源于:Microbial succession in an inflated lunar/Mars analog habitat during a 30-day human occupation,作者为 Mayer,T.,Blachowicz, A.J.,Vaishampayan, P.,Checinska,A.,Swarmer,T.,de Leon, P.and Venkateswaran, K。
菌株 H3 的序列用 Blast 比对后,在 GenBank数据库中查找到登录号为 LT799975.1 的 Alternaria tenuissima 的 ITS 序列和 H3 菌株的同源性为 100%(527/527),18~472 号碱基和所测序列的1~455 号碱基位置相对应,两者间的 score 最大值为 974 bits,E 值为 0(见图 7)。
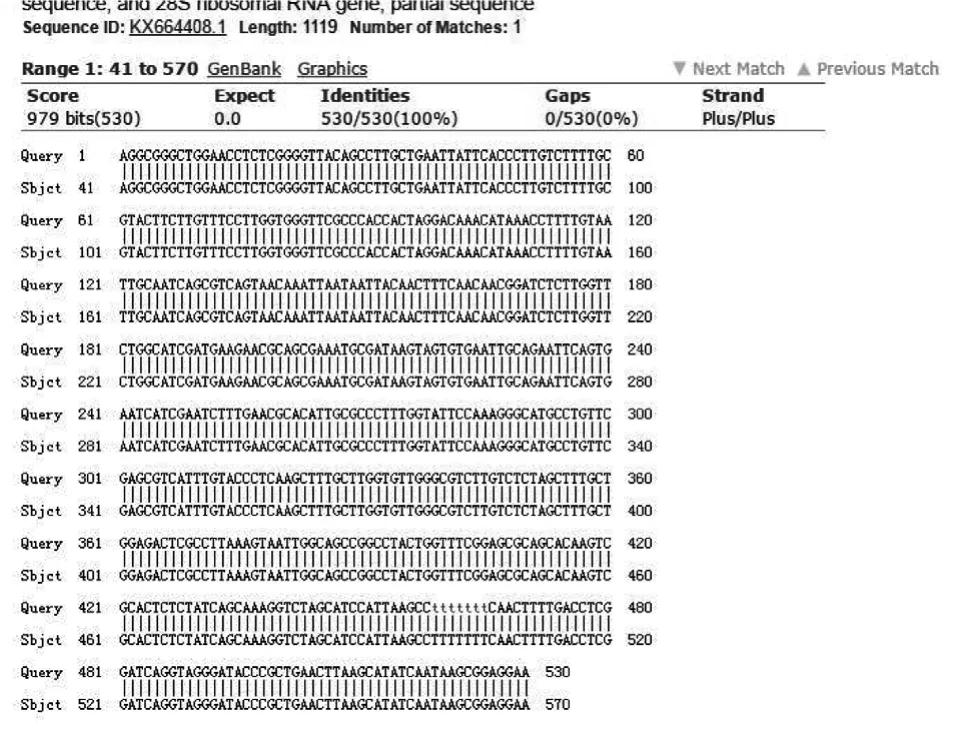
图6 菌株H2和编号KX664408.1菌株的rDNA的ITS序列比对Fig.6 Comparison of ITS sequences of rDNA strains H2 and No.KX664408.1 strains
登录号 LT799975.1 的菌株来源于:Isolation of Penicillium expansum from Kiwi fruit,作者为 Javed, S.and Javaid, A.
菌株 H4 的序列用 Blast 比对后,在 GenBank数据库中查找到登录号为 KY315929.1 的 Alternaria tenuissima 的 ITS 序列和 H4 菌株的同源性为 100%(530/530),41~498 号碱基所测序列的 1~458号碱基位置相对应,两者间的 score 最大值为979 bits,E 值为 0(见图 8)。
登录号为 KY315929.1 的菌株来源于:Isolating fungi from the environment,作者为 Bonito, G.

图7 菌株H3和编号LT799975.1菌株的rDNA的ITS序列比对Fig.7 Comparison of ITS sequences of rDNA strains H3 and No.LT799975.1 strains

图8 菌株H4和编号KY315929.1菌株的rDNA的ITS序列比对Fig.8 Comparison of ITS sequences of rDNA strains H4 and No.KY315929.1 strains
3 结论与讨论
牡丹黑斑病发病严重,且发病普遍,在对湖南牡丹病害调查中发现其主要危害牡丹叶片、叶柄和茎杆,该病的发病高峰期主要在 7 - 9 月,但对于黑斑病的研究主要集中在病症描述和防治措施上,对于其病原菌研究却很少,关于其病原菌种类尚不明确,段春燕[1]只是简单说明黑斑病的病原菌是由一种链格孢真菌所引起的,段亚冰[2]通过传统的形态鉴定得出其病原菌种类为链格孢属中的三个种,为 A.suffruticosae,A.suffruticosicola,A.tenuissima,而石良红[3]等通过分子手段首次明确了牡丹黑斑病病原菌的种类及其分类地位,其病原菌为 Alternaria alternata。
链格孢属真菌是分布最广的半知菌类真菌之一,也是植物病害的重要致病菌,其属级特征十分明显,但种级间却难以区分,尤其是小孢子种,其特异性相差很大,而且在人工培养基上的分生孢子形态有相同现象,传统的形态鉴定手段难以精准地鉴定其种类[10-11],只能借助分子生物学手段。王义勋[12]等利用 rDNA-ITS 序列对苍术黑斑病的病原菌进行分析时发现该病原菌和 5 种链格孢属真菌的 ITS 序列完全一致,这说明靠 ITS序列分析可以为其种类的确定提供依据,但不能区分小孢子种。本研究利用 ITS 序列分析对目的菌株的 ITS 序列进行准确鉴定,并对其 ITS 序列进行同源性比对,结果表明目的菌株的序列与链格孢(Alternaria alternata)和细极链格孢(Alternaria tenuissima)的序列同源性极高,达 100%。说明目的菌株中存在这两种病原菌,而通过 ITS 序列不能完全将链格孢属的小孢子种区分开来,这与王义勋的结论相同。此外,通过致病性鉴定发现,黑斑病病原菌在无伤口的情况下也可以侵染牡丹叶片,且与有伤口接种发病时间相差不多,这说明该病原菌并不是只通过伤口侵染植物,本次研究只进行了室内接种,还需进行室外接种以便进一步验证。
链格孢属真菌是多数植物病害的致病菌,如威灵仙黑斑病[13]、核桃黑斑病[14]、金叶女贞黑斑病[15]等,植株造成严重危害。本研究通过形态学鉴定结合分子生物学鉴定,明确了湖南牡丹黑斑病的病原菌种类,为今后进一步对其病原菌其它特性进行研究和开展病害防治提供了理论基础。
[1]段春燕,郑跃进,薛 娴.牡丹主要病害的识别[J].中国植保导刊,2007,27(8):29-31.
[2]段亚冰.牡丹叶斑病病原真菌鉴定及生物学特性研究[D].洛阳:河南科技大学,2009.
[3]石良红,赵兰勇,吴 迪,等.山东牡丹黑斑病的病原菌鉴定与 ITS 序列分析[J].园艺学报,2015,34(3):585-590.
[4]侯 颖,徐建强,宋宇州,等.三种杀菌剂对牡丹黑斑病菌菌丝生长及分生孢子萌发的影响[J].植物保护学报,2014,41(3):367-372.
[5]刘玉兰.七种杀菌剂对牡丹黑斑病室内毒力测定及田间药效试验[J].吉林农业科技学院学报,2016,25(3):1-3.
[6]方中达.植病研究方法[M].北京:中国农业出版社,1998.
[7]张 荣,王素芳,崔静秋,等.陕、豫两省苹果炭疽病病原鉴定[J].中国农业科学,2009,42(9):3224-3229.
[8]赵 丹.牡丹根部茎部真菌病害及病原鉴定[D].洛阳:河南科技大学,2012.
[9]李 丽.山东地区芍药病害调查及主要真菌性病害的病原鉴定[D].泰安:山东农业大学,2014.
[10]刘振亚,熊仁次,朱天生.链格孢属小孢子种 ISSR和 RAPD-PCR 最佳反应体系的建立[J].北方园艺,2015(14):105-110.
[11]王洪凯,张天宇.链格孢属小孢子种的 RAPD 分析[J].菌物学报,2003,22(1):35-41.
[12]王义勋,江 明,郑 露,等.苍术黑斑病病原鉴定[J].植物病理学报,2006,36(5):477-480.
[13]蒋 妮,黄永才,唐美琼,等.威灵仙黑斑病的病原鉴定及防治药剂的离体活性筛选[J].中国农学通报,2010, 26(24):221-225.
[14]曲文文,刘 霞,杨克强,等.山东省危害核桃的链格孢属真菌鉴定及其系统发育[J].植物保护学报,2012,39(2):121-128.
[15]王 坦.金叶女贞新病害—黑斑病的病原鉴定及其防治研究[D].南宁:广西大学,2012.
The pathogen identification on Peony black spot in Hunan Province
XIAO Tingting,LV Changping,ZHONG Lifan,XU Wenting
(College of Horticulture and Landscape,Hunan Agricultural University,Changsha 410128,China)
Peony black spot disease was serious in Hunan area,and the pathogen species remained unclear.In this study,the pathogen was identified based on morphology and molecular identification,and sequence homology compare was conducted by Blast to identify the type of pathogen.The results suggested that the pathogen was identified as Alternaria through the morphology identification,and the molecular identification indicated that the pathogen of peony black spot was Alternaria alternate and Alternaria tenuissima,the ITS sequence of the sample strain had 100% homology with Alternaria alternate and Alternaria tenuissima.Pathogenicity test showed that the wound and no wound ones were both lead to black spot.
Peony black spot;morphological identification;molecular identification
S 436.8
A
1003-5710(2017)05-0029 -06
10.3969 / j.issn. 1003-5710.2017.05.006
2017-07-11
湖南省教育厅重点研究项目(16A094);湖南农业大学优势特色重点学科开放基金项目(2014YYX005);长沙市花卉培育工程中心建设项目(20145911)
肖婷婷(1992-),女,湖南长沙市人,硕士研究生,研究方向为园林植物与观赏园艺
吕长平,副教授;E-mail:changpinglv@sina.com
(文字编校:张 珉)

