白背飞虱酵母双杂交cDNA文库的构建
薛 进,李 静,羊 健,唐 彦,梁 瑶,陈剑平,*,张恒木,*
(1.植物病虫害生物学与防控湖南省重点实验室 湖南农业大学 植物保护学院 病毒研究所,湖南 长沙 410128; 2.浙江省农业科学院 病毒学与生物技术研究所,浙江 杭州310021; 3.湖南农业大学 东方科技学院,湖南 长沙 410128)
白背飞虱酵母双杂交cDNA文库的构建
薛 进1,2,李 静2,羊 健2,唐 彦1,3,梁 瑶1,陈剑平2,*,张恒木2,*
(1.植物病虫害生物学与防控湖南省重点实验室 湖南农业大学 植物保护学院 病毒研究所,湖南 长沙 410128; 2.浙江省农业科学院 病毒学与生物技术研究所,浙江 杭州310021; 3.湖南农业大学 东方科技学院,湖南 长沙 410128)
白背飞虱(SogatellafurciferaHorvth)作为一种迁飞性害虫,不仅自身危害水稻,而且以持久性方式传播南方水稻黑条矮缩病毒(Southernriceblack-streakeddwarfvirus,SRBSDV)。为了研究白背飞虱与SRBSDV之间的相互作用,需要构建一个高质量的酵母筛选文库,试验利用Gateway技术构建了白背飞虱cDNA酵母表达文库,检测分析显示,白背飞虱初级文库库容量约为1.72×107CFU,cDNA插入片段主要分布在500~2 000 bp,重组率约为95.8%;次级文库库容量约为1.73×107CFU,cDNA插入片段主要分布在400~2 000 bp,重组率为100%;Y187酵母菌株的白背飞虱酵母双杂交cDNA文库库容量约5.09×107CFU,插入片段大小在750~2 000 bp,重组率100%,再随机挑选36个单克隆进行测序分析,所得结果与GenBank数据库比对显示36个克隆中含有22个不同的基因,长度在750~2 000 bp,这些分析表明,该文库可以用于酵母双杂交的后续筛选,为研究白背飞虱与SRBSDV之间的互作奠定了基础。
白背飞虱;南方水稻黑条矮缩病毒(SRBSDV);Gateway技术;酵母双杂交;cDNA文库
广泛分布在东亚地区的为害水稻的白背飞虱(SogatellafurciferaHorvth)属于半翅目(Hemiptera)同翅亚目飞虱科(Delphacidae)的迁飞性昆虫[1-3],是最常见的3种稻飞虱之一,每年春天随大气环流方向从中南半岛、东南亚和我国的海南岛等地不断地北上迁飞,直至我国东北,其初始迁入量与每年春夏暖湿气流北上程度相关[4-5],在南岭以北地区不能越冬。水稻是其最适宜的寄主,其他寄主只能勉强完成一个世代[6-7]。白背飞虱可通过口针汲取韧皮部汁液直接为害水稻,另外还可以持久方式传播南方水稻黑条矮缩病毒(Southernriceblack-streakeddwarfvirus,SRBSDV),且白背飞虱一旦获毒,将终生携毒和传毒,但不经卵垂直传播[8]。在热带气候地区如海南、福建、广西等地区,白背飞虱以卵在禾谷类作物或杂草上越冬,第二年春天孵化的若虫可先在禾本科植物上取食繁殖,然后侵害农作物,并向北方迁移,成为初始虫源,同时带毒的白背飞虱成为SRBSDV的初始毒源。之前,我们测定并比较分析了多个中国和越南SRBSDV分离物基因组全序列[9-12],构建了SRBSDV基因的酵母表达文库,探讨分析了SRBSDV部分基因之间的互作[13-15]。SRBSDV能特异性地在白背飞虱体内增殖并由其高效传播,反映二者基因之间存在广泛互作和适应性进化,但当前这方面的研究仍然很缺乏。研究昆虫基因功能通常要采用cDNA文库[16-20],为了利用酵母双杂交技术探索白背飞虱部分基因功能以及SRBSDV蛋白与白背飞虱间可能存在的互作关系,需要构建一个高质量的酵母筛选文库,在此前的工作中我们已经构建了SRBSDV越南分离物的诱饵文库,在这里需构建白背飞虱的cDNA文库作为靶标文库。但由于白背飞虱cDNA文库中包含的目的基因大都是未知的,因而不能采用传统的文库构建方法,因而采用了Gateway技术构建白背飞虱cDNA文库。
Gateway技术就是利用λ噬菌体的位点特异性重组系统[21]的特异性重组特性,借由λ噬菌体整合酶和整合宿主因子的催化作用,将两端含有重组位点的基因片段构建到含有相应重组位点的载体上,该技术可以同时将DNA序列构建到各种兼容的载体上。与传统的文库构建方法相比,Gateway技术构建重组载体时使用attBl和attB2接头进行位点特异性重组,能够定向重组进载体,而且无需进行PCR、限制性酶切、连接等过程,简单快捷;使用毒性基因ccdB筛选阳性克隆,因而阳性克隆率较高,重组成功载体上的ccdB基因被cDNA置换,重组产物转化到合适的宿主中后只有含重组子的菌株可以成活[22];同时加入3个不同的阅读框接头,使插入的基因片段能够包含3种不同的读码方式,从而确保了文库的完整性和可靠性。在RT-PCR中获得的cDNA两端接上接头5’-attBl及3’-attB2,它们在酶的催化下与含有attP1、attP2的入门载体pDONR222发生BP重组反应,cDNA位点特异性重组到pDONR222载体上,此时重组载体上的cDNA两边是attL1和attL2,在酶的作用下与含有attR1和attR2的酵母表达载体pGADT7-DEST发生LR重组反应,文库cDNA重组到pGADT7-DEST载体上得到相应的cDNA文库质粒重组子。肖冬来等[23]利用该技术完成了灰飞虱酵母双杂交cDNA文库的构建及分析,结果比较令人满意。本试验利用Gateway技术构建了白背飞虱cDNA酵母表达文库,旨在研究白背飞虱与SRBSDV之间的相互作用。
1 材料与方法
1.1 试验材料
1.1.1 白背飞虱
本试验所用的白背飞虱为实验室饲养种群,采用健康水稻饲养,用白背飞虱的卵、若虫、成虫等各个虫态的混合样品提取总RNA。
1.1.2 载体与菌株
载体构建时用到的入门载体为pDNOR222,其通用引物正向为M13F(5’-GTAAAACGACGGCCAG-3’),反向为M13R(5’-CAGGAAACAGCTATGAC-3’);酵母表达载体为pGADT7-DEST,其通用引物正向为T7(5’-TAATACGACTCACTATAG GGC-3’),反向为3-AD(5’-AGATGGTGCACGATGCACAG-3’);大肠埃希菌菌株DH10B,酵母菌株Y187。
1.1.3 attB1构库接头
根据构库需要而设计的构库流程,在合成cDNA第二链后需在cDNA两头连接上aTTB1接头,在此试验中用到3种attB1接头,分别是:
Reading Frame α 5’-TCGTCGGGGACAACTTTGTACAAAAAAGTTGG-3’,
(RFα)3’-CCCCTGTTGAAACATGTTTTTTCAACCp-5’;
Reading Frame β 5’-TCGTCGGGGACAACTTTGTACAAAAAAGTTGGA-3’ ,
(RFβ)3’-CCCCT GTTGAAACATGTTTTTTCAACCTp-5’;
Reading Frame γ 5’-TCGTCGGGGACAACTTTGTACAA AAAAGTTGGAA-3’,
(RFγ)3’-CCCCTGTTGAAACATGTTTTTTCAACCTTp-5’。
1.2 文库构建方法
本研究利用Gateway技术构建白背飞虱酵母双杂交cDNA文库的大致流程为:提取总 RNA→分离mRNA→合成cDNA第一条链→合成cDNA第二条链→连接attB1接头→cDNA分级→BP重组反应将cDNA构建到pDNOR222入门载体→转化感受态细胞→LB重组反应将cDNA重组到pGADT7-DEST表达载体→转化感受态细胞→鉴定文库质量。
1.2.1 Trizol法提取白背飞虱总RNA
总RNA提取主要参照Invitrogen公司说明书,采用Trizol法提取水稻叶片或白背飞虱总RNA, RNase free H2O中溶解,-80 ℃保存。
1.2.2 分离mRNA
参考Invitrogen公司说明书,利用FastTrack®2.0 Kit进行mRNA分离,溶于50 μL DEPC-H2O中,置于-80 ℃冰箱保存。
1.2.3 pDNOR222-cDNA 重组子构建
实验流程和实验方法参照CloneMiner说明书(Invitrogen)进行。合成cDNA第一链,然后合成cDNA的第二链,将合成得到的cDNA与attB1重组接头进行连接。
连接完成后分级分离收集cDNA(用Invitrogen公司产品FastTrack® 2.0 Kit分级分离收集cDNA,操作步骤参照其说明书)。所得含接头的cDNA进行BP重组反应。
BP重组所得产物电击转化大肠埃希菌DH10, 取10 μL转化后的菌液梯度稀释10倍、100倍、1 000倍后,从中取出50 μL涂布LB(含Kan+,50 mg·mL-1)平板,第2天计数(选择3个梯度平板中克隆生长清晰,分布均匀的平板准确计数),剩余培养物加入甘油至终浓度20%保存于-80 ℃冰箱。
白背飞虱cDNA初级文库文库质量鉴定,文库库容量计算公式:文库滴度(CFU·mL-1)=平板克隆数×稀释倍数/涂板体积(mL);
文库的总容量(Total CFU)=文库滴度(CFU·mL-1)×该文库总体积(mL);
重组率和插入片段长度鉴定:随机挑取48个克隆进行菌落PCR鉴定,PCR产物用1%琼脂糖凝胶电泳鉴定。
1.2.4 白背飞虱酵母双杂交cDNA文库的构建
抽提初级cDNA文库的质粒,将抽得的初级文库质粒用微量浓度测定仪测定浓度,然后用灭菌ddH2O按比例稀释至300 ng·μL-1。建立LR重组反应将白背飞虱cDNA重组到pGADT7-DEST载体上,参照上述BP重组反应步骤得到重组cDNA。
电转化大肠埃希菌DH10B,加入2 mL SOC 液体培养基,37 ℃复苏1 h,转化液用SOC 液体培养基稀释10 倍后全部涂于大量的LB 平板(含100 mg·mL-1Amp+),37 ℃倒置培养过夜,无菌操作刮下菌苔,悬浮于20%甘油保存液中,分装后-80 ℃保存,此即为次级文库。取10 μL菌液梯度稀释10倍、100倍、1 000倍,从中取出50 μL涂布LB(含Amp+,100 mg·mL-1)平板,第2天计数(选择3个梯度平板中克隆生长清晰,分布均匀的平板准确计数),用于库容量鉴定。然后鉴定次级文库质量,PCR引物使用酵母载体通用引物组合F/R∶5’-T7/3’-AD。
1.2.5 Y187酵母菌株的白背飞虱酵母双杂交cDNA文库制备
Y187酵母感受态细胞制备:用醋酸锂法制备酵母感受态细胞,然后用PEG/LiAc法将白背飞虱酵母双杂交次级文库质粒转化酵母菌株Y187,在SD/-Leu固体平板上,30 ℃倒置培养3~5 d,直至长出克隆;同时取10 μL菌液稀释10倍、100倍、1 000倍后取100 μL涂布SD/-Leu固体平板用于计算转化后文库克隆数。
将长有菌落的SD/-Leu固体平板于4 °C预冷3~4 h,然后用含25%甘油的YPD液体冷却培养基刮菌,调节菌液浓度至>1×107cell·mL-1,每管1 mL分装,保存于-80 ℃。
2 结果与分析
2.1 白背飞虱总RNA
RNA质量是文库构建质量关键因素之一,提取白背飞虱总RNA是构建其文库的第一步,本试验中采用了Trizol法提取白背飞虱总RNA,mRNA的分离使用了Invitrogen公司产品FastTrack®2.0 Kit。用1.0%琼脂糖电泳检测提取的白背飞虱总RNA可以看到清楚的3条带,即28S、18S 和5S RNA,说明提取的总RNA质量较好,纯化的mRNA大小主要集中在750~2 000 bp(图 1)。
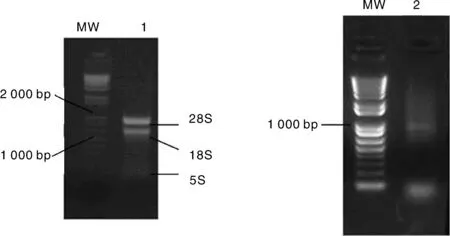
M,DNA ladder; 1,Total RNA; 2,mRNA图1 白背飞虱总RNA及mRNA电泳Fig.1 Electrophoresis of Sogatella furcifera total RNA
2.2 库容量鉴定
2.2.1 初级文库库容量及检测
本试验构建的初级文库库容量检测中,在稀释1 000倍的平板上生长了86个单克隆(图 2),根据库容量公式计算得出:文库滴度为1.72×106CFU·mL-1,文库库容量为1.72×107CFU,即初级文库库容量约为1.72×107CFU。从图3可以看出,白背飞虱初级文库cDNA插入片段主要分布在500~2 000 bp,平均插入片段大于1 000 bp,具有良好的多态性。在所检测的48个转化子中有2个为空载体,根据公式:文库重组率=(有插入片段的转化子/总转化子)×100%,计算出文库的重组率约为95.8%,所以插入片段长度和重组率均符合文库构建要求。
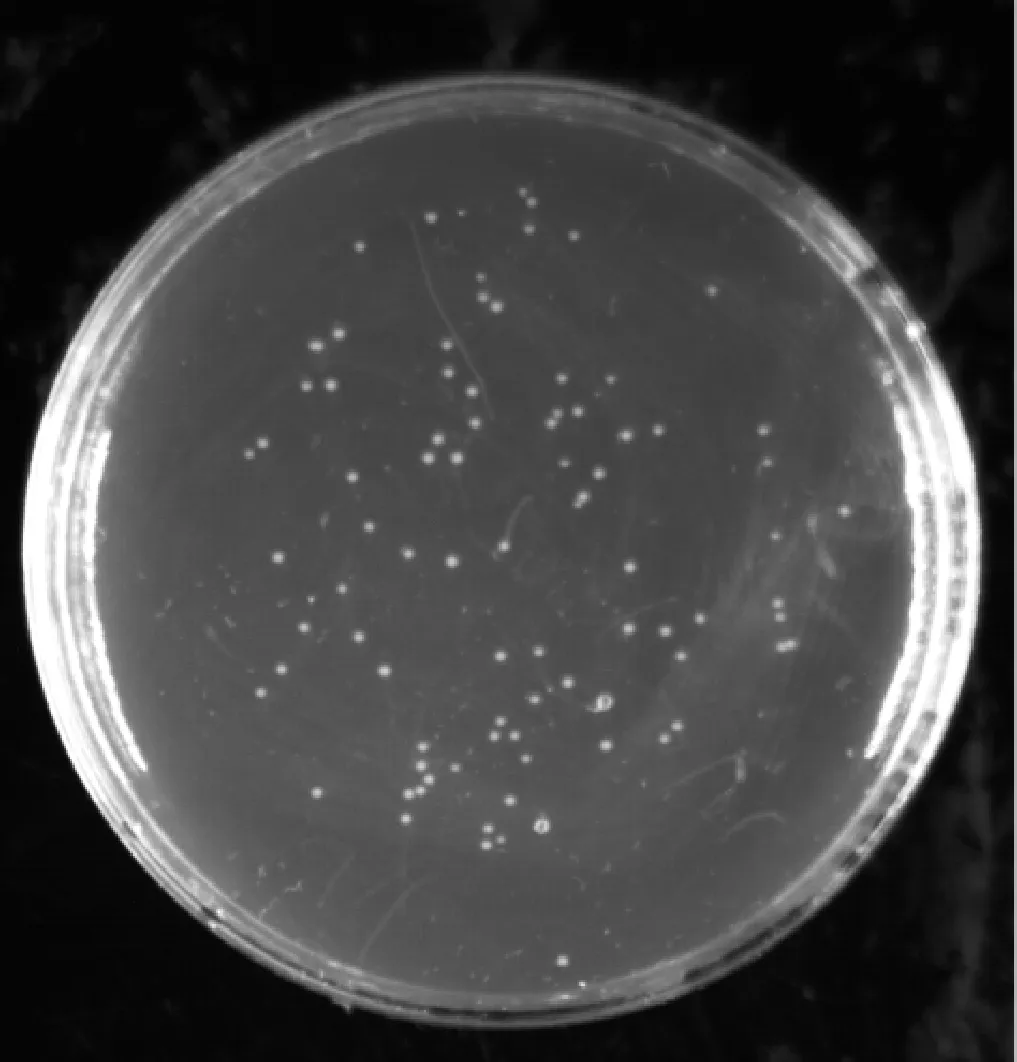
稀释倍数1∶1 000;涂布量50 μL;单克隆数86Dilution factor was 1∶1 000; Coating weight was 50 μL; Number of clones was 86图2 初级文库库容量检测Fig.2 Calculation of the primary library titer

M, Marker 10 kb Plus DNA ladder;泳道1~24为扩增产物M, Trans10K DNA ladder; Lane 1-24, Amplification products by PCR图3 初级文库PCR检测Fig.3 Detection of primary library by PCR
2.2.2 次级文库库容量及检测
本试验构建的初级文库库容量检测中,在稀释100倍的平板上生长了867个单克隆(图4),根据库容量公式计算得出:文库滴度为1.73×106CFU·mL-1,文库库容量为1.73×107CFU,即次级文库库容量约为1.73×107CFU。从图5可以看出,白背飞虱次级文库cDNA 插入片段主要分布在400~2 000 bp,平均插入片段大于900 bp,具有良好的多态性。在所检测的24个转化子中没有空载体,因而次级文库的重组率为100%,所以插入片段长度和重组率均符合文库构建要求。
2.2.3 Y187酵母菌株的白背飞虱酵母双杂交cDNA文库库容量及检测
一个合格的cDNA文库其库容量要求达到1×106CFU以上,本试验构建的Y187酵母菌株白背飞虱酵母双杂交cDNA文库库容量检测中,在稀释1 000倍的平板上生长了509个单克隆(图6),根据库容量公式计算得出:文库滴度为5.09×106CFU·mL-1,文库库容量为5.09×107CFU,即白背飞虱酵母双杂交文库库容量约为5.09×107CFU,符合酵母文库筛选试验的要求。
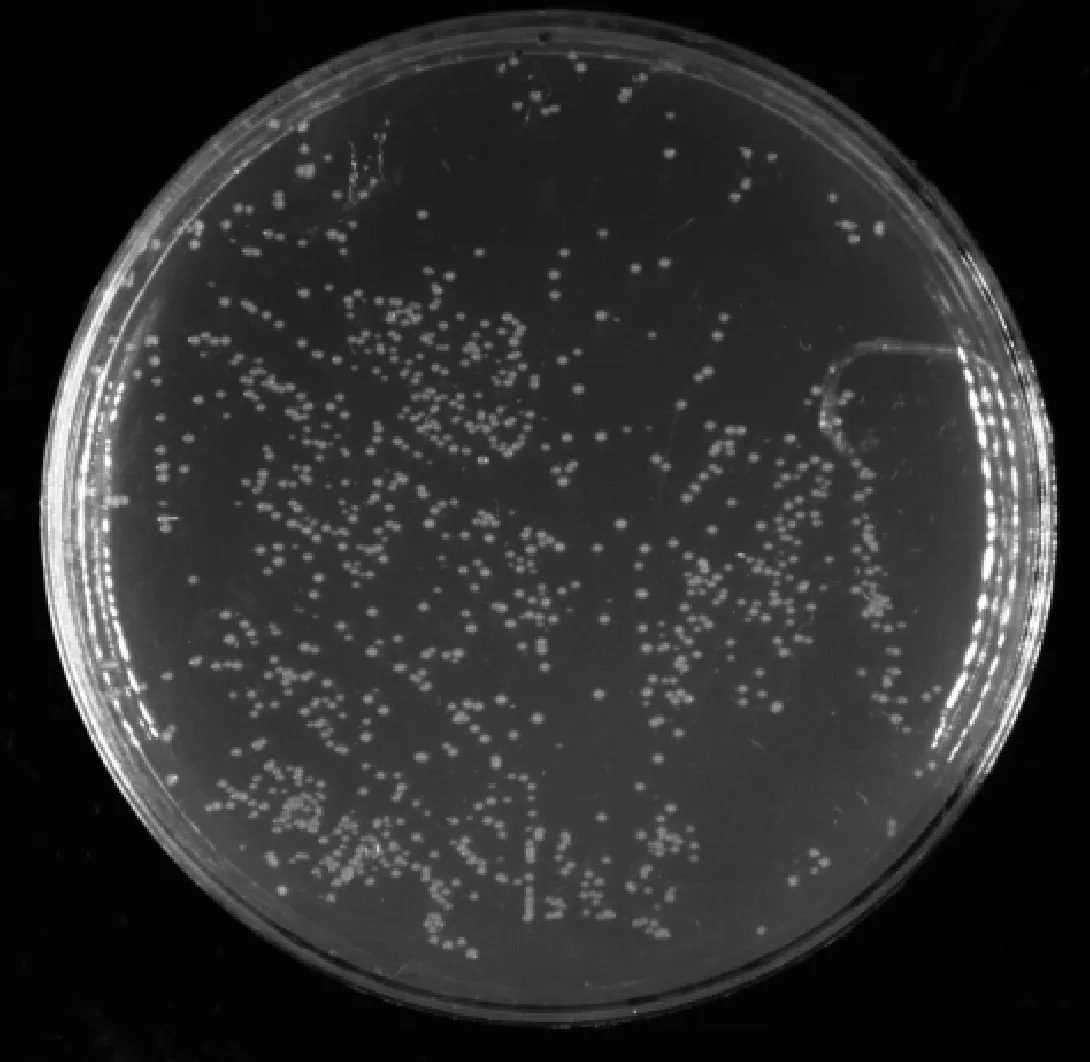
稀释倍数1∶100;涂布量50 μL;单克隆数867Dilution factor was 1∶100; Coating volumn was 50 μL; Number of clones was 867图4 酵母文库库容量检测Fig.4 Calculation of the secondary library titer
M, Marker 10 kb Plus DNA ladder; 泳道1~24为部分文库cDNA扩增产物M, Trans10K DNA ladder; Lane 1-24, Amplification products by PCR图5 次级文库PCR检测Fig.5 Detection of secondary library by PCR
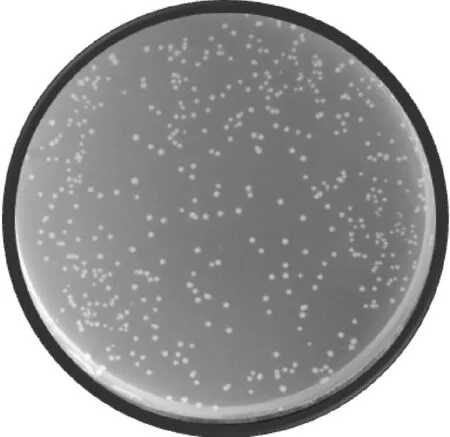
稀释倍数1∶1 000;涂布量100 μL;单克隆数509Dilution factor was 1∶1 000; Coating volumn was 100 μL; Number of clones was 509图6 Y187酵母文库库容量检测Fig.6 Calculation of the Y187 cDNA library titer
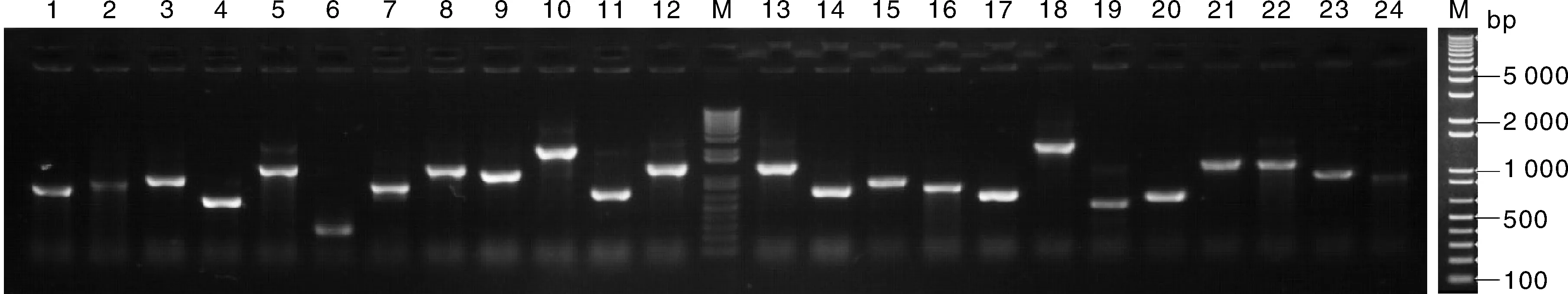
随机挑选72个单克隆分别用通用引物进行PCR分析,结果显示72个克隆均含有重组片段,重组率100%,达到文库构建要求,插入片段的大小平均约1 000 bp(图 7)。再随机挑选36个单克隆进行测序分析,测序所得结果用BLAST对比分析,结果表明36个克隆中含有22个不同的基因(表1),长度在750~2 000 bp,这些分析表明该文库可以用于酵母双杂交的后续筛选。
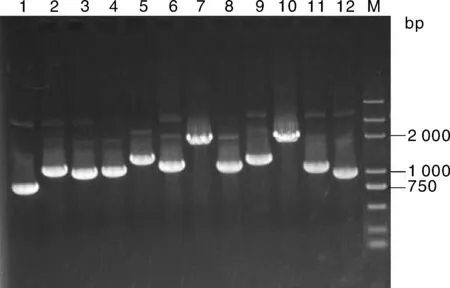
M, Marker 10 kb Plus DNA ladder; 泳道1~12为部分文库cDNA扩增产物M, Trans10K DNA ladder; Lane 1-12, Amplification products of cDNA clones by PCR图7 Y187酵母cDNA文库PCR检测Fig.7 Detection of Y187 cDNA library by PCR
表1二十二个基因测序分析结果
Table1The results of sequencing and analysis of 22 genes

编号No.同源基因序列号SerialnumberofHomologousgeneE值Evalue基因注释Geneannotation1HM60072310LaodelphaxstriatellusstrainYunnancloneLsCarE1carboxylesterase(LsCarE)2HM16012210Sogatellafurciferaisolatebb4cytochromeoxidasesubunitIgene3HM23375210Sogatellafurciferaisolate4116SribosomalRNAgene,partialsequence;mitochondrial4HF95118411e⁃83PantroglodytesBACcloneRP43⁃86L11fromchromosome75LT72725710001Xenopus(Silurana)tropicalisG⁃2andS⁃phaseexpressed1(gtse4),mRNA6FJ36069510Laodelphaxstriatellusmitochondrion,completegenome7KX67054410Laodelphaxstriatellusputativemucin⁃likeproteinmRNA,completecds8XM_01526911819e⁃75ChrysomelatremulaeribosomalproteinL21(RpL22)mRNA,complete9BT05849812e⁃12Arabidopsisthalianachromosome0,completesequence10KC51291510SogatellafurciferaisolateWBPHYNmitochondrion,completegenome11KX24592710Sogatellafurcifera16SribosomalRNAgene,partialsequence;mitochondrial12HM23374012e⁃130Arcofaciesmaculatipennisisolate816SribosomalRNAgene,partialsequence;mitochondrial13AY16696918e⁃179Oryzasativa(indicacultivar⁃group)resistance⁃relatednon⁃codingRNA(nc1),completesequence14XM_01526911819e⁃75PREDICTED:Diachasmaalloeum60SribosomalproteinL21(LOC107046495),mRNA15HM23380012e⁃179Sardiarostrataisolate23416SribosomalRNAgene,partialsequence;mitochondrial16KX24596810Matutinusmelichari16SribosomalRNAgene,partialsequence;mitochondrial17JX88006818e⁃179Laodelphaxstriatellusmitochondrion,completegenome18HM23375015e⁃156Nilaparvatamuiriisolate2716SribosomalRNAgene,partialsequence;mitochondrial19KX24594111e⁃162Himeunkatateyamaella16SribosomalRNAgene,partialsequence;mitochondrial20HM23376210Matutinusmelichariisolate6916SribosomalRNAgene,partialsequence;mitochondrial21KX24595512e⁃179Sardiarostrata16SribosomalRNAgene,partialsequence;mitochondrial22XM00113654220Unknown1
3 讨论
本试验构建了白背飞虱酵母双杂交cDNA文库。首先在总RNA提取中,电泳检测提取的白背飞虱总RNA可以看到清楚的28S、18S 和5S RNA条带,说明提取的总RNA质量较好,纯化的mRNA大小也主要集中在750~2 000 bp,完全满足了下游操作需要。在逆转录合成了双链cDNA后,巧妙地利用了Gateway技术中λ噬菌体的位点特异性重组系统,借由λ噬菌体整合酶和整合宿主因子的催化作用,将两端含有重组位点的基因片段构建到含有相应重组位点的载体上,这样充分地将cDNA中的未知基因连接到载体上,避免了需要设计特异引物进行特异性扩增,也保证所插入cDNA 片段的完整性,在对文库质量及库容量的检测中充分体现了这些优点,重组率和插入片段长度均符合文库构建的要求。当然,由于白背飞虱总RNA提取中没有去掉飞虱肠道中的取食物,可能会残留部分水稻等食物,构建的文库质粒中也许含有水稻等物种的其他基因,但在后期的筛选中可以通过测序等手段去除这些干扰。
目前,国内外曾报道过用各种不同方法构建白背飞虱[24]、灰飞虱(Laodelphaxstriatellus)[25]和褐飞虱(Nilaparvatalugens)[26]的酵母双杂交cDNA文库,用于研究昆虫基因功能、介体昆虫与植物病毒的互作[15,27]。本试验中利用Gateway技术构建了白背飞虱酵母双杂交cDNA文库,并对该文库进行了质量鉴定,结果显示白背飞虱cDNA初级文库库容量约为5.16×107CFU,次级文库库容量约为1.73×107CFU,白背飞虱酵母双杂交cDNA文库库容量约为5.09×107CFU,重组率和库容量均达到了文库构建要求,插入片段位于400~2 000 bp。在对含有的基因含量进行检测中发现基因丰富度较高,基本符合预期目标,说明此方法是方便快捷可行的,达到酵母文库筛选所要求的文库质量标准,可用于与已转入Y2H Gold菌株中的SRBSDV文库进行Mating杂交,筛选互作蛋白等工作。
[1] 丁建云, 王文瑶, 余盛华, 等. 高空捕虫网在稻白背飞虱监测中的应用[J]. 植物保护, 1997, 23(5): 28-30.
DING J Y, WANG W Y, YU S H, et al. Application of high altitude insect catching net in the monitoring ofSogatellafurcifera(Horvth)[J].PlantProtection, 1997, 23(5): 28-30.(in Chinese)
[2] 广东省农科院植保所. 飞机捕捉迁入稻虱试验初报[J]. 广东农业科学, 1978(5): 32-35.
Institute of plant protection of Guangdong Academy of Agricultural Sciences. The preliminary report on the capture of planthopper by plane[J].JournalofGuangdongAgriculturalSciences, 1978(5): 32-35. (in Chinese)
[3] 王万一. 白背飞虱诱集新法——稻虱诱测圃[J]. 贵州农业科学, 1982, 11(4): 27.
WANG W Y. A new method for capture ofSogatellafurcifera(Horvth)-Induced nursery forSogatellafurcifera(Horvth)[J].JournalofGuizhouAgriculturalSciences, 1982, 11(4): 27.
[4] 赵悦, 张孝羲, 翟保平. 江西上饶2009、2010年南方水稻黑条矮缩病的毒源地分析[J]. 应用昆虫学报, 2011, 48(5): 1321-1334.
ZHAO Y, ZHANG X X, ZHAI B P. Identifying the source regions ofSouthernriceblack-streakeddwarfvirustransmitted bySogatellafurcifera(Horvth) in Shangyou, Jiangxi Province[J].ChineseBulletinofEntomology, 2011, 48(5): 1321-1334. (in Chinese with English abstract)
[5] SYOBU S, OTUKA A, MATSUMURA M. Annual fluctuations in the immigrant density of rice planthoppers,SogatellafurciferaandNilaparvatalugens(Hemiptera: Delphacidae),in the Kyushu district of Japan, and associated meteorological conditions[J].AppliedEntomologyandZoology, 2012, 47: 399-412.
[6] 全国白背飞虱科研协作组. 白背飞虱迁飞规律的初步研究[J]. 中国农业科学, 1981,14(5): 25-31.
National scientific research cooperation group onSogatellafurcifera(Horvth). Preliminary study on migration ofSogatellafurcifera(Horvth)[J].ScientiaAgriculturaSinica, 1981,14(5): 25-31. (in Chinese)
[7] 洪晓月, 丁锦华. 农业昆虫学[M]. 2版. 北京: 中国农业出版社, 2007.
[8] 周国辉, 温锦君, 蔡德江, 等. 呼肠孤病毒科斐济病毒属一新种:南方水稻黑条矮缩病毒[J]. 科学通报, 2008, 53(20): 2500-2508.
ZHOU G H, WEN J J, CAI D J, et al. A new species of the genus Fiji reovirus:Southern rice black-streaked dwarf virus[J].ChineseScienceBulletin, 2008, 53(20): 2500-2508. (in Chinese)
[9] XUE J, LI J, TA H A, et al. Complete genomic sequence ofSouthernriceblacked-dwarfvirus, a novel Fijivirus, from Vietnam[J].GenomeAnnouncements, 2012, 1(3): 212-213
[10] XUE J, LI J, ZHANG H M, et al. Molecular characterization ofSouthernriceblacked-streakeddwarfvirus(SRBSDV) from Vietnam[J].JournalofPhytopathology, 2014, 162(6): 349-358
[11] ZHANG H M, YANG J, Chen J P, et al. A black-streaked dwarf disease on rice in China is caused by a novel Fijivirus[J].ArchivesofVirology, 2008, 153(10): 1893-1898 .
[12] ZHOU G H, WEN J J, CAI D J, et al.Southernriceblack-streakeddwarfvirus[J].ChineseScienceBulletin, 2008, 53(23): 3677-3685.
[13] LI J, XUE J, ZHANG H M, et al. Characterization of homologous and heterologous interactions between viroplasm proteins P6 and P9-1 of the FijivirusSouthernriceblack-streakeddwarfvirus[J].ArchivesofVirology, 2015, 160(2): 453-457.
[14] LI J, XUE J, ZHANG H M, et al. Interactions between the P6 and P5-1 proteins ofSouthernriceblack-streakeddwarfFijivirusin yeast and plant cells[J].ArchivesofVirology, 2013, 158(8): 1649-1659
[15] LI J, CAI N J, XUE J, et al. Interaction betweenSouthernriceblack-streakeddwarfvirusminor core protein P8 and a rice zinc finger transcription factor[J].ArchivesofVirology, 2017,162(5):1261-1273.
[16] 王日升, 张曼, 李猷, 等. 植物抗病虫SSH文库的EST分析[J]. 西北植物学报, 2012, 32(2): 425-430.
WANG R S, ZHANG M, LI Y, et al. ESTs analysis of suppression subtractive hybridization library from plant resistance to disease and insect pest[J].ActaBotanicaBoreali-OccidentaliaSinica, 2012, 32(2): 425-430. (in Chinese with English abstract)
[17] 黎万顺, 冯国忠, 陈斌,等. 葱蝇冬滞育蛹的全长cDNA文库的构建[J]. 昆虫知识, 2010, 47(1): 53-58.
LI W S, FENG G Z, CHEN B, et al. Construction of full-length cDNA library of winter-diapause pupae of the onion maggot, Delia antique[J].ChineseBulletinofEntomology, 2010, 47(1): 53-58. (in Chinese with English abstract)
[18] 王春苗, 钟雪萍, 刘攀峰, 等. 草地贪夜蛾细胞系IPLB-Sf-9酵母双杂交cDNA文库的构建[J]. 环境昆虫学报, 2009, 31(1): 41-45.
WANG C M, ZHONG X P, LIU P F, et al. Construction of a yeast GAL4 fusion cDNA library from Sf9 cells[J].JournalofEnvironmentalEntomology, 2009, 31(1): 41-45. (in Chinese with English abstract)
[19] 夏润玺, 李玉萍, 王欢, 等. 柞蚕蛹全长cDNA文库的构建和随机EST测序[J]. 蚕业科学, 2009, 35(3): 528-532.
XIA R X, LI Y P, WANG H, et al. Construction of a full-length cDNA library fromAntheraeapernyiPupae and random sequencing of expressed sequence tags[J].ScienceofSericulture, 2009, 35(3): 528-532. (in Chinese with English abstract)
[20] 袁红雨, 祝莉莉, 何光存. 褐飞虱取食水稻幼苗cDNA文库的构建及筛选[J]. 信阳师范学院学报(自然科学版), 2005, 18(1): 48-51.
YUAN H Y, ZHU L L, HE G C. Construction and screening of a cDNA library from rice seedlings exposed to brown planthopper[J].JournalofXinyangNormalUniversity(NaturalScienceEdition), 2005, 18(1): 48-51. (in Chinese with English abstract)
[21] MARUYAMA K, SUGANO S O. Oligo-capping: a simple method to replace the cap structure of eukaryotic mRNAs with oligoribonucleotides[J].Gene, 1994, 138(1/2): 171-174.
[22] BEMARD P, COUTURIER M. Cell killing by the F plasmid ccdB protein involves poisoning of DNA-topoisomerase Ⅱ complexes[J].JournalofMolecularBiology, 1992, 226(3): 735-745.
[23] 肖冬来, 邓慧颖, 谢荔岩, 等. 灰飞虱酵母双杂交cDNA文库的构建及分析[J]. 植物保护, 2011, 37(1): 19-23.
XIAO D L, DENG H Y, XIE L Y, et al. Construction of a yeast two-hybrid cDNA library ofLaodelphaxstriatellus[J].PlantProtection, 2011, 37(1): 19-23. (in Chinese with English abstract)
[24] 郑立敏,彭静,陈建斌,等.SRBSDV侵染的白背飞虱中肠酵母双杂交cDNA文库的构建和分析[J]. 农业生物技术学报,2016, 24(2): 245-251.
ZHENG L M, PENG J, CHEN J B, et al. Construction and analysis of yeast two-hybrid cDNA library of the SRBSDV-infected midgut of white backed planthopper (Sogatellafurcifera)[J].JournalofAgriculturalBiotechnology,2016, 24(2): 245-251. (in Chinese with English abstract)
[25] 李硕, 孙丽娟, 李醒, 等.灰飞虱高带毒(RSV) 群体酵母双杂交cDNA 文库的构建[J]. 昆虫学报, 2011, 54(11):1324-1328.
LI S, SUN L J, LI X, et al. Construction of yeast two-hybrid cDNA library of high-viruliferous (RSV-infected) populations of the small brown planthopper,Laodelphaxstriatellus(Hemiptera: Delphacidae)[J].ActaEntomologicaSinica, 2011, 54(11):1324-1328. (in Chinese with English abstract)
[26] 乌慧玲, 许晓凤, 王文兵.褐飞虱生物型Ⅰ和生物型Ⅱ cDNA 文库的构建[J]. 安徽农业大学学报, 2005,32(4):423-427.
WU H L, XU X F, WANG W B. Full-length cDNA library construction of a specific tobacco germplasm[J].JournalofAnhuiAgriculturalUniversity, 2005, 32(4):423-427. (in Chinese with English abstract)
[27] MAR T, LIU W, WANG X. Proteomic analysis of interaction between P7-1 ofSouthernriceblack-streakeddwarfvirusand the insect vector reveals diverse insect proteins involved in successful transmission[J].JournalofProteomics, 2014, 102(3): 83-97.
Constructionofyeasttwo-hybridcDNAlibraryofwhite-backedplanthopper(Sogatellafurcifera)
XUE Jin1,2, LI Jing2, YANG Jian2, TANG Yan1,3, LIANG Yao1, CHEN Jianping2,*, ZHANG Hengmu2,*
(1.HunanProvincialKeyLaboratoryforBiologyandControlofPlantDiseasesandInsectPests,InstituteofVirology,CollegeofPlantProtection,HunanAgriculturalUniversity,Changsha410128,China; 2.InstituteofVirologyandBiotechnology,ZhejiangAcademyofAgriculturalSciences,Hangzhou310021,China; 3.CollegeofOrientScience&Technology,HunanAgriculturalUniversity,Changsha410128,China)
White-backed planthopper (SogatellafurciferaHorvth) is a major migratory pest that feed on rice plants and transmitSouthernriceblack-streakeddwarfvirus(SRBSDV) in a persistent manner. In order to screen interactions between the genes of WBPH and SRBSDV, a cDNA expression library of WBPH was firstly constructed into the yeast plasmids using Gateway technique in this study. The results showed that the primary library consisted of 1.72×107CFU (colony-forming units), the sizes of most inserts were 500-1 500 bp in length, and the recombinant frequency was about 95.8%; the titer of secondary cDNA library was 1.73×107CFU, the sizes of most inserts were 400-2 000 bp in length, and the recombinant frequency was 100%; the titer assays showed that the cDNA library was approximately 5.09×107CFU for yeast two-hybrid cDNA library of Y187; PCR assays showed that the average length of insertions were 750-2 000 bp and the recombinant frequency of the cDNA library was high up to 100%, random sequence analysis of 36 clones showed that 22 of the clones were different in GenBank. These results consistently indicated that the cDNA library could be used for screening interactions in the yeast two hybrid experiments, which laid the foundation for studying on the interactions between white-backed planthopper and SRBSDV.
white-backed planthopper (SogatellafurciferaHorvth);Southernriceblack-streakeddwarfvirus(SRBSDV); Gateway technique; yeast two-hybrid; cDNA library
浙江农业学报ActaAgriculturaeZhejiangensis, 2017,29(12): 2060-2067
http://www.zjnyxb.cn
薛进,李静,羊健,等. 白背飞虱酵母双杂交cDNA文库的构建[J].浙江农业学报,2017,29(12): 2060-2067.
10.3969/j.issn.1004-1524.2017.12.14
2017-05-09
湖南省教育厅科学研究项目(16C0773)
薛进(1980—),男,湖南桃江人,博士,讲师,主要从事昆虫病毒学研究。E-mail: xuejin@hunau.edu.cn
*通信作者,陈剑平,E-mail: jpchen2001@126.com;张恒木,E-mail: zhhengmu@tsinghua.org.cn
S435.11
A
1004-1524(2017)12-2060-08
(责任编辑张 韵)

