病毒性脑炎及化脓性脑膜炎患儿脑脊液1-磷酸鞘氨醇水平的变化
杜开先 高丽佳 贾天明 李 林 霍爱香 李曼曼 张华玲
郑州大学第三附属医院小儿神经内科,河南 郑州 450052
·论著临床诊治·
病毒性脑炎及化脓性脑膜炎患儿脑脊液1-磷酸鞘氨醇水平的变化
杜开先 高丽佳 贾天明 李 林 霍爱香 李曼曼 张华玲
郑州大学第三附属医院小儿神经内科,河南 郑州 450052
目的探讨病毒性脑炎及化脓性脑膜炎患儿脑脊液(CSF)1-磷酸鞘氨醇(S1P)的变化。方法选取病毒性脑炎患儿30例,化脓性脑膜炎患儿30例以及非颅内感染患儿(对照组)20例,采用酶联免疫吸附试验定量测定CSF中S1P水平。结果化脑组CSF中S1P水平高于病脑组及对照组[(0.217±0.017)nmol/L vs (0.191±0.010)nmol/L、(0.172±0.015)nmol/L,P<0.05];病脑组CSF中S1P的水平高于对照组[(0.191±0.010)nmol/L vs (0.172±0.015)nmol/L,P<0.05]。结论S1P参与儿童颅内感染发病过程,在不同病原导致的颅内感染中作用程度可能不同。
1-磷酸鞘氨醇;脑脊液;病毒性脑炎;化脓性脑膜炎;颅内感染
病毒性脑炎(简称病脑)及化脓性脑膜炎(简称化脑)是儿童颅内感染中最常见的疾病,儿童本身中枢神经系统不完善,血脑屏障薄弱,病原体易通过血脑屏障进入大脑,引起颅内感染,易留后遗症,甚至死亡,严重威胁儿童的生命健康。研究表明,S1P(sphingosine-1-phosphate)在神经系统和炎症性疾病发生发展中起重要作用,但对儿童颅内感染的研究尚未见报道。本文观察病脑和化脑患儿CSF中S1P变化,探讨其作用机制。
1 资料与方法
1.1研究对象选取2016-04—2017-04入住郑州大学第三附属医院的病脑和化脑患儿(符合《诸福棠实用儿科学》第8版对病脑和化脑的诊断标准),并通过病史、CSF、血清学检测、影像学检查以及对治疗的反应加以明确。其中化脑组30例,男18例,女12例,年龄(3.7±1.6)岁;病脑组30例,男19例,女11例,年龄(4.2±2.2)岁;选取同期住院排除颅内感染、非中枢神经系统疾病患儿20例为对照组,男12 例,女8例,年龄(3.6±1.8)岁。化脑组、病脑组和对照组性别及年龄差异无统计学意义(P>0.05)。
1.2研究方法所选患儿均在入院48 h内行腰椎穿刺留取CSF 5 mL,其中3 mL立即送至我院实验室进行常规、生化、三染色检测,余2 mL立即经3 000 r/min,4 ℃下离心5 min后,取脑脊液上清液,于2.0 mL无菌EP管中-80 ℃冰箱保存待测。S1P的测定采用ELISA,试剂盒购自上海泸鼎生物科技有限公司,具体步骤严格按照说明书操作。

2 结果
2.1 3组CSF中S1P水平比较化脑组和病脑组CSF中S1P水平均高于对照组,且化脑组CSF中S1P水平高于病脑组。见表1。
2.2脑脊液中S1P水平与其他指标的相关性分析各组脑脊液中S1P与细胞数(N-XP)、糖(GLU)、腺苷脱氨酶(ADA)、脑脊液蛋白(CSF-P)、乳酸脱氢酶(LDL)、氯化物(CL)相关性分析中,CSF中S1P与细胞数呈正相关,与葡萄糖呈负相关性,与其他指标无相关性。见表2。
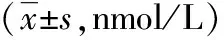
表1 3组CSF中S1P水平比较
注:与对照组比较,*P<0.01;与病脑组比较,**P<0.01
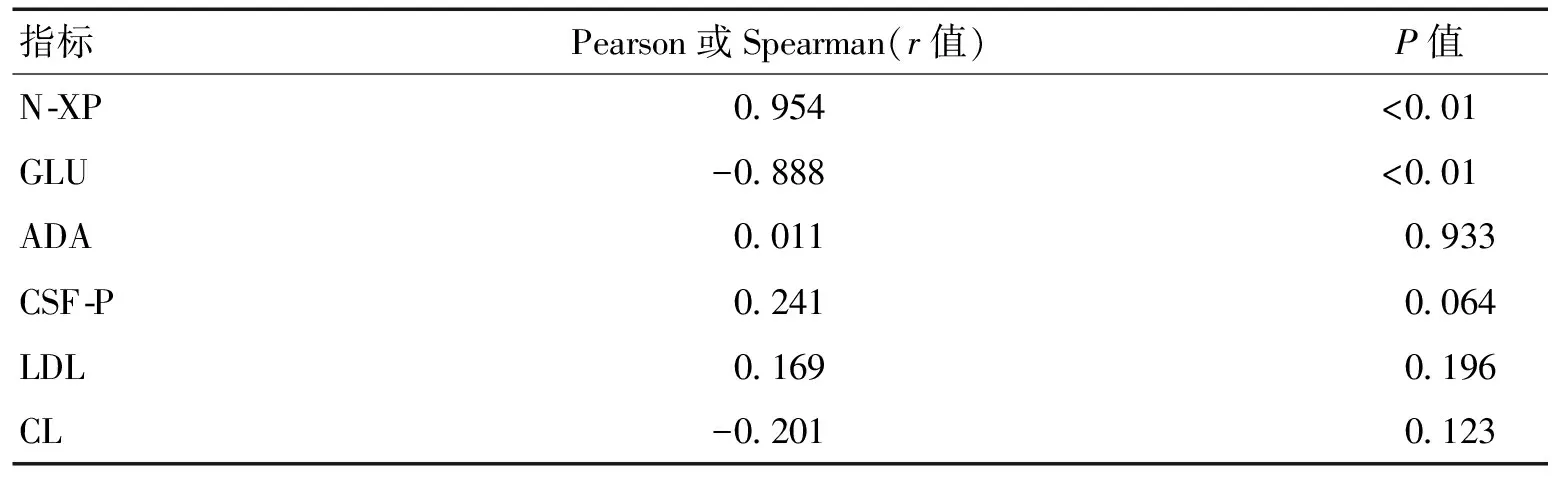
表2 脑脊液中S1P水平与其他指标的相关性分析
3 讨论
颅内感染是小儿神经内科常见病之一,随着临床上广谱抗感染药物的应用,病死率有所降低,但仍有较高的病死率和致残率[1]。同时,抗生素的不恰当应用导致脑脊液改变不典型,增加了病脑和化脑的鉴别难度,寻找新的两者间的鉴别方法,对于病脑和化脑的及时诊断和治疗、疾病的转归及预后意义重大。
S1P是生物体内存在的具有生物活性的细胞膜鞘类脂质的中间代谢产物。细胞中S1P的生成由鞘氨醇激酶(SphK1和SphK2)调节,S1P的分解通过S1P裂解酶的不可逆水解或S1P磷酸酶(SPP1和SPP2)可逆去磷酸化实现[2]。S1P受体(S1PR1~S1PR5)是G蛋白偶联受体(G protein-coupled receptor,GPCR)家族成员之一,主要与G蛋白亚型偶联,通过激活多条细胞内信号途径发挥不同的生物学功能[3]。S1P合成酶及S1P受体在在大脑中的各类细胞中具有不同程度的表达,且具有细胞类型的高度特异性;在脑中S1P主要参与大脑的发育、神经营养因子的生成和存活、血脑屏障的维持、神经递质释放以及神经元兴奋性的调节等多种活动。最近研究表明,一些神经系统疾病,如多发性硬化、阿尔茨海默病、帕金森病等均与S1P调节异常有关[4-5],且S1P/SPHK信号轴在炎症信号通路起始、传递及将免疫细胞募集至损伤部位等方面发挥重要作用[6]。基于此,推断S1P也可能参与病脑和化脑的疾病过程,实验发现,化脑组和病脑组CSF中S1P浓度均高于对照组,且化脑组CSF中S1P浓度高于病脑组,表明S1P参与了颅内感染的发病过程。Alina等[4]发现,应用HPLC方法检测婢传脑炎等CNS炎性疾病患者CSF中平均S1P浓度也显著高于对照组,与本实验一致。其可能作用机制:(1)S1P与血脑屏障渗透性的调控有关。S1P在血脑屏障中的作用是双向的,在生理浓度下,S1P主要激活S1P1,诱导屏障功能增强,而血浆中较高的S1P水平激活S1P2,引起细胞骨架重排,从而导致BBB破坏[7];同时S1P2通过激活Rho途径,诱导细胞骨架收缩、应激纤维形成和增加VE-钙黏蛋白的磷酸化,阻止其定位于细胞间连接并增强屏障通透性导致白细胞的进入。(2)炎症反应中,SphK1是LPS、TNF和IL-信号转导和促炎过程中所必需的介质,通过刺激SphK1产生的S1P与细胞表面G蛋白偶联受体的结合可以激活炎症和免疫反应所需的NF-κB,进而引起一系列的炎症变化。此外,S1P还可促进炎症细胞及趋化因子的释放,如IL-、IL-6、IL-8及MCP-1等,而IL-的增加可以增加细胞间黏附分子(ICAM-1)和血管细胞黏附分子1(VCAM-1)在内的白细胞黏附分子的表达[8]。动物实验表明,SPHK-1缺乏的小鼠在脂多糖(LPS)的刺激下加重了神经炎症反应[9]。(3)S1P2的拮抗剂JTE-013可降低炎性分子,如E-选择蛋白、VCAM-1和趋化配体2(CCL-2)的表达,促进免疫细胞通过内皮屏障[10],参与颅内感染中的免疫反应。此外,S1P参与神经炎症的过程可能与其他部位的炎症不同,而且更为复杂。其主要考虑到人脑血管化程度高,且具有不同类型的血管,这些不同的血管类型或脑区域可能存在S1P受体和生物合成和(或)降解酶的差异表达[9],仍需进一步研究,完整阐释S1P信号通路在大脑中的作用。
化脑组中的S1P浓度高于病脑组的可能原因:(1)化脑中BBB的损伤较病脑明显(通过比较化脑组与病脑组QALb反映BBB功能的完整性),血液中高浓度的S1P透过BBB进入大脑,引起脑脊液中S1P的水平升高;(2)研究发现,炎性细胞因子,如TNF-、IL-1、VEGH可以激活SphK1导致S1P增加,其可在多个水平调节炎症过程[11],化脑血清及脑脊液中TNF-、IL-1中明显高于病脑组,可能会更敏感地激活SphK1,产生更多的S1P,导致脑脊液中的S1P水平升高。Wang等[12]发现,大肠杆菌引起的脑膜炎可诱导SPHK2的活化导致S1P产生增加。
脑脊液中S1P与其他的常规、生化指标检测的相关性分析中,CSF中S1P与细胞数呈正相关(r=0.954,P<0.01),与葡萄糖呈负相关(r=-0.888,P<0.01),与乳酸(LDL)、蛋白(CSF-P)、腺苷脱氨酶(ADA)、氯化物(CL)无相关性。已知化脑中白细胞数较病脑中升高明显,且以中性粒细胞为主,化脑中升高的TNF-、IL-1均可增加包括ICAM-1和VCAM-1在内的白细胞黏附分子的表达。研究发现,S1P裂解酶的缺乏可增加炎症反应,同时调节中性粒细胞迁移到炎症区域[13],具体机制仍需进一步研究。化脑中脑脊液葡萄糖降低,主要因细菌的繁殖和代谢所需能量主要由大脑中的葡萄糖提供。有研究表明,S1P参与葡萄糖的代谢[14],脑脊液中葡萄糖与S1P呈负相关,提示S1P可能参与大脑中葡萄糖的代谢调节,但具体机制目前尚不清楚。
[1] 杜开先,范冬霞,贾天明,等.P物质IL-17与IL-6在颅内感染中的表达[J].中国实用神经疾病杂志,2017,20(5):36-38.
[2] Ksiazek M,Chacinska M,Chabowski M,et al.Sources,metabolism,and regulation of circulating sphingosine-1-phosphate[J].J Lipid Res,2015,56(7):1 271-1 281.
[3] Richard LP,Hla T.Emerging biology of sphingosine-1-phosphate:its role in pathogenesis and therapy[J].J Clin Invest,2015,125(4):1 379-1 387.
[4] Kulakowska A,Fitzroy JB,Malgorzata ZP,et al.Increa-sed levels of sphingos-ine-1-phosphate in cerebrospinal fluid of patients diagnosed with tick-borne encephalitis[J].Neuroinflammation,2014,11:193.
[5] Ghasemi R,Dargahi L,Ahmadiani A,et al.Integrated sphingosine-1-phosphate signaling in the central nervous system:From physiological equilibrium to pathological damage[J].Phamacologic Res,2016,104:156-164.
[6] Snider AJ.Sphingosine kinase and sphingosine-1-phosphate:regulators in au-toimmune and inflammatory disease[J].Int J Clin Rheumatol,2013,8(4):453-463.
[7] Simona FS,Obermeier B,Cotleur A,et al.Sphingosine 1 Phosphate at the Blood Brain Barrier:Can the Modulation of S1P Receptor 1 Influence the Response of Endothelial Cells and Astrocytes to Inflammatory Stimuli?[J].PLoS One,2015,10(7):e0133392.
[8] Rachael W,Nelson V,Kho DT,et al.Regulation of human cerebro-microvascular endothelial baso-lateral adhesion and barrier function by S1P through dual involvement of S1P1 and S1P2 receptors[J].Sci Rep,2016,6:19 814.
[9] Stephanie SD,Chun J,Rosen H,et al.Sphingosine 1-phosphate receptor 3 and RhoA signaling mediate inflammatory gene expression in astrocytes[J].Neuroinflammation,2017,14:111.
[10] Prager B,Spampinato SF,Ransohoff RM.Sphingosine-1-phosphate signaling at the blood-brain barrier[J].Trends Mol Med,2015,21(6):354-363.
[11] Tomasz W,Wtek M,Durnas B,et al.Sphingosine-1-Phosphate Metabolism and Its Role in the Development of Inflammatory Bowel Disease[J].Int J Mol Sci,2017,18(4):741.
[12] Wang XR,Maruvada R,Morris AJ.Sphingosine-1-Pho-sphate Activation of E-GFR As a Novel Target for meningitic Escherichia coli Penetration of the Blood Brain Barrier[J].PLos Pathog,2016,12(10):e1005926.
[13] Nussbaum C,Bannenberg S,Keul P,et al.Sphingosine-1-phosphate receptor3 p-romotes leukocyte rolling by mobilizing endothelial P-selectin[J].Nat Commun,2015,6:6 416.
[14] 赵艳丽,刘云峰.1-磷酸鞘氨醇对葡萄糖代谢的调节及其机制[J].中华临床医师杂志,2017,11(3):484-487.
Changesofsphingosine-1-phosphate(S1P)detectionincerebrospinalfluidinchildrenwithviralencephalitisandpurulentmeningitis
DUKaixian,GAOLijia,JIATianming,LILin,HUOAixiang,LIManman,ZHANGHualing
DepartmentofPediatricNeurology,theThirdAffiliatedHospitalofZhengzhouUniversity,Zhengzhou450052,China
ObjectiveTo investigate the change of cerebrospinal fluid sphingosine-1-phosphate(S1P)in children with viral encephalitis and purulent meningitis.MethodsThe diagnosis of 30 cases of purulent meningitis (PM),30 cases of viral meningitis and 20 children without intracranial infection (control group) was enrolled.The level of S1P in CSF was measured using ELISA.ResultsThe level of S1P in CSF in PM group was significantly higher than in the VM and control groups ((0.217±0.017) nmol/L vs.(0.191±0.010) nmol/L,(0.172±0.015) nmol/L,P<0.05).The level of S1P in CSF in VM group was significantly higher than the control group ((0.191±0.010) nmol/L vs.(0.172±0.015) nmol/L,P<0.05).ConclusionS1P involved in the pathogenesis of intracranial infection in children,in different pathogens caused by the degree of intracranial infection maybe different.
Sphingosine-1-phosphate;Cerebrospinal fluid;Viral meningitis;Purulent meningitis;Intracranial infection
10.3969/j.issn.1673-5110.2017.24.011
河南省教育厅科学技术研究重点项目(13A320662)
杜开先,主任医师,副教授,神经病学博士,硕士生导师。研究方向:小儿神经系统疾病及新生儿黄疸。Email:dukaixian@126.com
R512.3
A
1673-5110(2017)24-0048-03
(收稿2017-08-03)
夏保军
信息:杜开先,高丽佳,贾天明,等.病毒性脑炎及化脓性脑膜炎患儿脑脊液1-磷酸鞘氨醇水平的变化[J].中国实用神经疾病杂志,2017,20(24):48-50.

