慢性心衰大鼠心肌miRNA-1、miRNA-133/Caspases表达差异研究
刘蓉芳 ,谭 雄 ,张 辉 ,毛湘屏 ,杨 柳 ,陈志成 ,毛以林 *
(1.湖南中医药大学,湖南 长沙 410208;2.湖南中医药大学第二附属医院,湖南 长沙 410005)
·基础研究·
慢性心衰大鼠心肌miRNA-1、miRNA-133/Caspases表达差异研究
刘蓉芳1,谭 雄2,张 辉2,毛湘屏2,杨 柳2,陈志成2,毛以林2*
(1.湖南中医药大学,湖南 长沙 410208;2.湖南中医药大学第二附属医院,湖南 长沙 410005)
目的探讨慢性心衰大鼠心肌miRNA-1、miRNA-133/Caspases表达差异。方法30只SD大鼠随机分为正常组10只,模型组20只。正常组等容量生理盐水腹腔注射,模型组予阿霉素腹腔注射造模;采用心脏彩超检测心功能,采用生理记录仪记录血流动力学,心脏切片行Tunel染色检测细胞凋亡,采用Real-time PCR法检测miRNA-1、miRNA-133、Caspase-3mRNA、Caspase-9mRNA表达;采用Western blot及免疫组化法检测心肌组织Caspase-3、Caspase-9蛋白表达水平。结果与正常组比,模型组大鼠左室舒张期内径(LVIDd)、左室收缩末期内径(LVESD)、左心室终末舒张压(LVEDP)明显增大(P<0.05),而左心室短轴缩短率(LVFS)、左室射血分数(LVEF)、心输出量(CO)、左心室平均压(LVAP)、左心室内压最大上升速率(dp/dtmax)及左心室内压最大下降速率(-dp/dtmax)下降(P<0.01),Tunel染色示心肌凋亡明显。 miRNA-1、Caspase-3mRNA、Caspase-9mRNA、Caspase-3 蛋白、Caspase-9 蛋白表达增加(P<0.01),miRNA-133 表达下降(P<0.01)。结论miRNA-1、Caspase-3、Caspase-9 在心肌凋亡中表达增加,miRNA-133表达下降。
慢性心衰;心肌凋亡;miRNA-1;miRNA-133;Caspase-3;Caspase-9
心肌细胞凋亡是心力衰竭心脏重构主要表现形式之一,参与心肌梗死、心力衰竭、心房颤动及主动脉狭窄等心脏性疾病[1-3]的病理过程。微小RNA(microRNA,miRNA)是存在于真核生物中的非蛋白质编码RNA分子,主要通过与靶基因mRNAs3’非编码区结合,降低mRNA分子的稳定性,导致其降解,或抑制靶mRNA的转录后翻译过程来实现调控靶基因表达[4-5]。 微小 RNA-1(microRNA-1,miRNA-1)和微小 RNA-133 (microRNA-133,miRNA-133)是肌肉组织特异性表达miRNA,在肌肉及心脏中具有重要作用,并均可通过调控半胱胺酸天冬氨酸酶(Caspases)家族蛋白表达,从而调控心肌细胞调亡[6]。在Caspase家族蛋白中,Caspase-9处于凋亡级联反应上游,传递激活信号去下游,Caspase-3是凋亡级联反应下游最关键的凋亡蛋白酶,主要执行凋亡程序。但目前国内关于慢性心衰心肌凋亡中miRNA-1、miRNA-133、 Caspase-3、Caspase-9表达及调控的研究报道较少,因此本研究通过制作慢性心衰大鼠模型,观察心衰模型大鼠miRNA-1、miRNA-133/Caspase-3、Caspase-9差异表达,探讨心肌凋亡与 miRNA-1、miRNA-133/Caspase-3、Caspase-9 表达关系,为研究心衰的发生机制提供新思路。
1 材料与仪器
1.1 实验动物
5周龄SPF级SD大鼠30只购于湖南斯克达实验动物有限公司 (实验动物合格证号:43004700025 096)。 饲养温度20~25℃,湿度50%~70%,体质量(160±20) g,雌雄各半。
1.2 药品及主要仪器
注射用盐酸阿霉素(深圳万乐药业有限公司),引物(上海生工合成)。HRP goat anti-rabbit IgG(美国 Proteintech),miRNA引物 (上海生工合成),Western-blotting及免疫组化检测一抗Caspase-3(美国 CST,Rabbit),Caspase-9 (美国 proteintech,Rabbit),actin(美国 proteintech,Mouse),二抗 HRP-conjugated Affinipure Goat Anti-Mouse IgG(H+L)(美国 proteintech),HRP-conjugated Affinipure Goat Anti-Rabbit IgG(H+L)(美国 proteintech),免疫组化二抗通用型二步法检测试剂盒PV-9000(中杉金桥,北京),Tunel试剂盒(武汉博士德)。Motic B5显微摄像图像分析系统(麦克奥迪),BX43型双目生物摄像显微镜(日本OLYMPUS),便携式彩色多普勒超声仪 (DW-PF522,徐州市大为电子设备有限公司)。BL-420F生理记录仪,成都泰盟科技有限公司。
2 方法
2.1 动物分组及造模
动物适应饲养1周后随机取10只为正常组,余下20大鼠行阿霉素造模。造模方法参考文献[7]。注射用盐酸阿霉素按1.5 mg/kg注射,每周2次,共7周。超声心动图检测左心室短轴缩短率 (LVFS)<30%,即为心衰造模成功[8]。
2.2 指标及检测方法
2.2.1 大鼠行为学观察及死亡情况 8周后处死动物,处死前夜禁食。实验全程观察大鼠活动状态、饮食情况、毛色变化、大小便等,同时统计大鼠死亡情况。
2.2.2 心脏超声检测大鼠心功能 大鼠用10%水合氯醛溶液按3 mL/kg麻醉后固定,前胸备皮涂搽脱毛膏及耦合剂,彩色多谱勒超声诊断仪取大鼠左心室长轴切面后进行M超声检测,连续记录10个心动周期,测量左室舒张期内径(LVIDd mm)、左室收缩末期内径(LVESD mm)、左室射血分数(LVEF)、左心室短轴缩短率(LVFS)、心输出量(CO),所有数据均测量3次并取其平均值记录。
2.2.3 生理记录仪监测血流动力学指标 心脏彩超完毕后,分离出大鼠右侧颈总动脉1.5~2 cm,结扎远心端,夹闭近心端,动脉导管平行推进颈动脉后,以振幅高大、波宽较大心室内压力波为标志,记录心室压力曲线,计算左心室平均压(LVAP)、左心室终末舒张压(LVEDP)、左心室内压最大上升速率(dp/dtmax)、左心室内压最大下降速率(-dp/dtmax)。
2.2.4 Tunel染色法检测细胞凋亡 打开胸腔,剪下心脏,去掉心房及右室,余下左心室投入10%多聚甲醛溶液固定、石蜡包埋、切片,依次二甲苯透明、 梯度乙醇脱水、PBS漂洗,50 μL TdT+450 uL荧光素标记后反应l0 min。再加50 μL Tunel反应混合液,PBS漂洗、DAPI染色,封片。在荧光显微镜下计数凋亡细胞。随机计数5个不同视野的凋亡细胞及细胞总数,计算凋亡细胞平均灰度值。
2.2.5 Real-time PCR 法检测 miRNA-1、miRNA-133及 Caspase-3 mRNA、Caspase-9 mRNA 表达取大鼠左心室心尖部分适量,Trizol法提取大鼠心脏组织总RNA,行RNA琼脂糖凝胶电泳。取2 μg以组织总mRNA为模板,逆转录cDNA,42℃孵育15 min,85℃孵育5 min,冰上冷却,逆转录产物可直接用于荧光定量PCR反应。检测miRNA者行miRNA反转录,根据所用RNA的量,合成修饰后的miRNA cDNA第一链,向冰浴中预冷的无RNase反应管中加入 Poly(A)反应液 4 μL+超纯 dNTPs(10 mM each)1 μL+25 μM RT primer3 uL+5×RT Buffer 4 μL+SuperRT Reverse Transcriptase 0.5 μL+RNase-Free Water7.5 μL, 至终体积20 uL,反应终止后,合成的cDNA反应液可以直接进行荧光定量检测实验。以各检测基因引物(引物序列见表1)进行实时定量PCR。定量PCR扩增条件:95 ℃ 10 min,95 ℃ 15 s,60 ℃ 60 s,40 个循环。收集每循环第3个步骤荧光信号量,以2-ΔΔCt反映各样品相对于对照组样品目的基因的表达水平,-ΔΔCt=对照组 ΔCt-各样品 ΔCt,ΔCt=目的ΔCt-内参ΔCt。每个样本重复3次,然后进行统计分析。在网址http://www.mirbase.org/cgi-bin/query.pl?terms=214中搜索 miRNA-1、miRNA-133序列,在 NCBI上搜索 Caspase-3、Caspase-9基因的序列,primer5软件设计引物,由上海生工合成。引物资料见表1。

表1 引物名称序列及产物长度
2.2.6 Western blot检测心肌组织Caspase-3、Caspase-9蛋白含量 剪取0.25 g组织加入200 μLRIPA裂解液蛋白裂解,4℃,12 000 r/min离心15 min,取上清分装离心管中;照BCA蛋白定量试剂盒(Wellbio)使用说明操作,测定蛋白浓度。然后电泳、转膜、封闭、一抗孵育:用1×TBST将一抗按照一定比例稀释[Caspase-3(1∶1 000),Caspase-9(1:200),actin(1∶4 000)],将膜与一抗一起孵育,4℃过夜。孵育结束,1×TBST洗3次,每次15 min,然后二抗孵育:用1×TBST 稀释 HRP 标记的二抗(Proteintech),稀释比例鼠抗(M)1∶4 000,兔抗(R)1∶6 000,将稀释后的二抗与膜共同孵育45~60 min。孵育结束,1×TBST洗3次,每次15 min。最后显色、曝光,使用ECL化学发光液(Thermo)与膜孵育3 min,用吸水纸吸尽液体,用保鲜膜将膜包裹杂交膜,在暗盒内与X胶片曝光数秒至数分钟;显影冲洗。将曝光后的底片扫描,并用quantity one专业灰度分析软件进行分析。以目的蛋白与β-actin的光密度比值表示目的基因在蛋白水平的表达。
2.2.7 二步免疫组化法检测心肌组织Caspase-3、Caspase-9蛋白含量 心肌切片经脱蜡、脱水后,3%双氧水阻断内源性过氧化物酶,入微波炉修复,冷却,加 1∶100 一抗(Caspase-3、Caspase-9)4 ℃过夜;PBS洗3次;加二抗,PBS洗3次;每片滴二甲基联苯胺(DAB)显色液,水洗苏木精复染;脱水、透明、封片。MOTIC图像分析系统在×400倍光学显微镜下对Caspase-3、Caspase-9阳性结果进行半定量分析:每个标本随机观察6个视野,以阳性产物面积/视野面积表示该蛋白的相对含量,并取其平均值,重复3次。
2.3 统计学方法
所有数据应用SPSS 20.0统计软件进行处理。全部计量资料用“±s”表示,先进行正态性检验,满足正态性时,采用配对t检验,不满足正态性时选择秩和检验;以P<0.05为差异具有统计学意义。
3 结果
3.1 大鼠行为学观察及死亡情况
正常组大鼠鼠毛光泽、贴顺,眼睛有神,活泼,反应灵敏,饮食及二便正常,体质量增加明显,大鼠无死亡;模型组大鼠鼠毛无光泽、脱落,喜静倦怠,大鼠有腹水,体质量增长缓慢,多数大鼠大便稀,大鼠因严重腹水死亡5只。
3.2 两组大鼠心功能比较
与正常组比,模型组LVIDd、LVESD明显增大而 LVFS、LVEF 及 CO 下降(P<0.05,P<0.01),见表 2。
表2 两组大鼠心脏彩超数值比较 (±s)
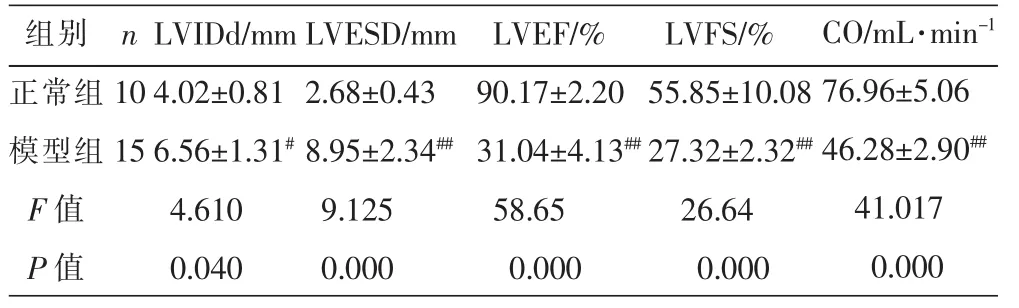
表2 两组大鼠心脏彩超数值比较 (±s)
注:与正常组相比,#P<0.05; ##P<0.01。
组别正常组模型组F值P值n 10 15 LVIDd/mm 4.02±0.81 6.56±1.31#4.610 0.040 LVESD/mm 2.68±0.43 8.95±2.34##9.125 0.000 LVEF/%90.17±2.20 31.04±4.13##58.65 0.000 LVFS/%55.85±10.08 27.32±2.32##26.64 0.000 CO/mL·min-1 76.96±5.06 46.28±2.90##41.017 0.000
3.3 两组大鼠血流动力学比较
与正常组相比,模型组LVAP、dp/dtmax、-dp/dtmax明显降低(P<0.01),LVEDP 明显增高(P<0.01),见表3。
表3 两组大鼠心脏血流动力学 (±s)
注:与正常组相比,##P<0.01。
组别 n正常组模型组F值P值10 15 LVAP/mmHg 133.9±11.56 86.55±9.80##79.85 0.000 LVEDP/mmHg 3.94±0.75 15.29±2.20##50.12 0.000 dp/dtmax/mmHg·s-1 6 610±841.4 4 126±925.9##109.1 0.000-dp/dtmax/mmHg·s-1 6 454±700.1 2 367±1216##121.06 0.000
3.4 Tunel法检测细胞凋亡
400×光镜下观察:Tunel染色示正常细胞核呈长梭形,蓝色,排列规整,凋亡心肌细胞呈棕褐色。模型组与正常组相比,棕褐色坏死颗粒物质明显增多,表明模型组心肌凋亡明显,棕褐色颗粒物质平均灰度值较正常组明显增高 (P<0.01);见表4,图1。
表4 两组大鼠心脏切片Tunel灰度值 (±s)

表4 两组大鼠心脏切片Tunel灰度值 (±s)
注:与正常组相比,##P<0.01。
组别正常组模型组F值P值n 10 15灰度值72.65±4.37 129.5±6.84##77.79 0.000
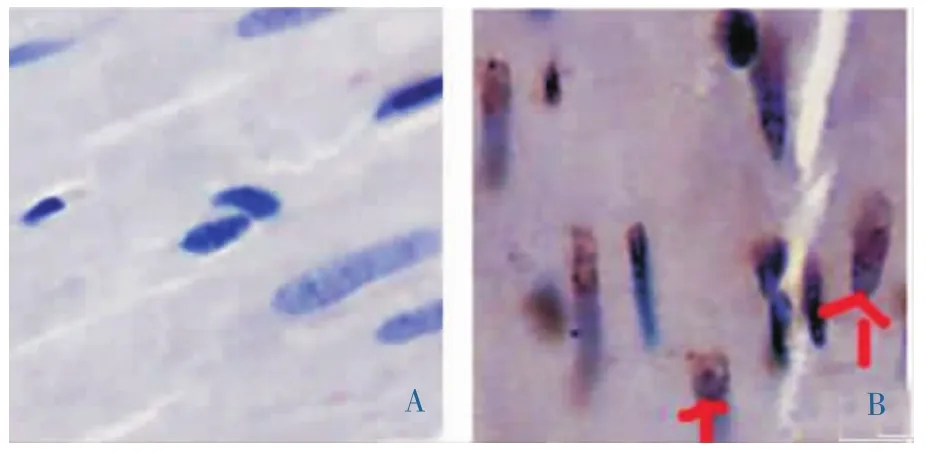
图1 两组大鼠心肌切片光镜图(Tunel染色,×400)
3.5 Real-time PCR 法检测 miRNA-1、miRNA-133、Caspase-3mRNA、Caspase-9mRNA 表达
与正常组相比,模型组miRNA-1、Caspase-3 mRNA、Caspase-9 mRNA 表达增加,miRNA-133表达下降(P<0.01),表明心肌凋亡组组织中,miRNA-1、Caspase-3 mRNA、Caspase-9 mRNA 表达增加 ;miRNA-133表达下降,见表5。
表5 两组大鼠基因表达量比较 (±s)

表5 两组大鼠基因表达量比较 (±s)
注:与正常组相比,##P<0.01。
组别正常组模型组F值P值n 10 15 miRNA-1 0.96±0.11 2.64±0.29##78.49 0.000 miRNA-133 1.11±0.12 0.25±0.09##109.9 0.000 Caspase-3 mRNA 1.00±0.05 1.49±0.13##9.618 0.000 Caspase-9 mRNA 0.99±0.55 2.79±0.20##142.6 0.000
3.6 Western blot法(WB法)及免疫组化法检测Caspase-3、Caspase-9 蛋白表达
免疫印迹法及免疫组化法显示,与正常组相比,模型组 Caspase-3、Caspase-9 蛋白表达增加(P<0.01),免疫组化染色显示心肌棕褐色颗粒阳性表达较多,表明在凋亡心肌组织中Caspase-3、Caspase-9蛋白表达亦升高,与Caspase-3、Caspase-9mRNA表达一致。 见表6、图 2、图3。
表6 两组大鼠Caspase-3、Caspase-9蛋白质表达 (±s)

表6 两组大鼠Caspase-3、Caspase-9蛋白质表达 (±s)
注:与正常组相比,##P<0.01。
组别 n Caspase-3 WB(15KD) WB(35KD) 免疫组化Caspase-9 WB 免疫组化正常组模型组F值P值10 15 0.21±0.03 0.37±0.05##10.69 0.000 0.17±0.03 0.40±0.07##5.508 0.000 86.1±6.77 163.2±15.80##14.85 0.000 0.18±0.038 0.49±0.12##48.82 0.000 35.6±6.75 132.8±10.52##30.98 0.000
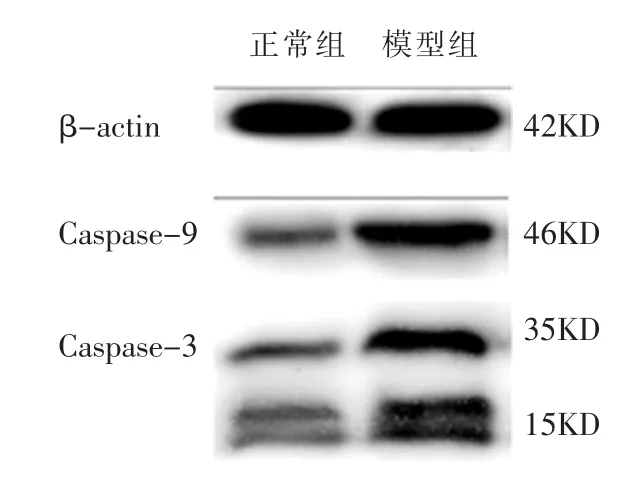
图2 两组大鼠Caspase-3、Caspase-9蛋白表达电泳图
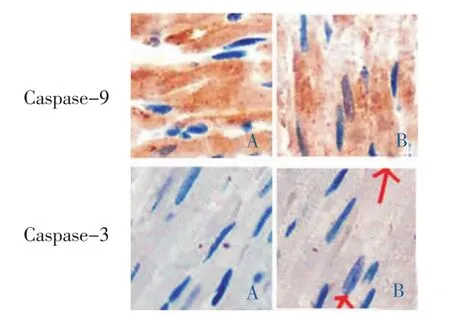
图3 两组大鼠心肌切片光镜图(免疫组化,×400)
4 讨论
心肌细胞调亡是受相关基因严格控制的主动过程,在慢性心力衰竭(CHF)发生、发展过程中,由于许多病理因素(如肾上腺素、血管紧张素Ⅱ、氧化应激、致炎细胞因子、缺血、压力或容量负荷过重、缺氧等)均可诱导心肌细胞凋亡[9]。心力衰竭心肌凋亡的途径由外源性途径(涉及细胞表面死亡受体)和内源性途径(涉及线粒体和内质网)两条通路介导。外源性途径中,死亡配体结合死亡受体,通过Caspase-8激活下游的Caspase,触发线粒体凋亡事件。内源性途径被多种生物、化学和物理刺激所激活,传递到线粒体和内质网,触发形成凋亡体,激活Caspase-9随后剪切并激活下游的Caspase,并导致细胞凋亡。由此可知,两条通路最终都要通过激活Caspases介导心肌细胞凋亡并参与慢性心衰的发生、发展,而其中Caspase-3,是Caspase家族中最重要的凋亡执行者之一,是凋亡级联反应下游最关键的凋亡蛋白酶,它的激活是细胞凋亡的标志[10],上游的Caspase-9在细胞凋亡过程中被各种促凋亡因子形成的凋亡体所激活,从而对Caspase-3产生作用,使其执行凋亡程序。Caspase-3是经典凋亡通路后期的共同途径。近年来的研究认为,在分子水平上,下调Caspase蛋白表达对于干预心室重构乃至心力衰竭具有重要意义。
微小RNA(microRNA)长约20~25个核苷酸,是存在于真核生物中的非蛋白质编码RNA分子,几乎参与调控人类生长发育的各个阶段。研究发现,心肌中存在着大量调节心血管疾病的相关miRNAs,但MiRNA-1、miRNA-133是横纹肌组织包括心肌中特异性表达的miRNA,广泛参与心脏发育、心肌肥厚、心肌损伤、凋亡和心律失常等心脏生理和病理生理过程。miRNA可通过调控半胱胺酸天冬氨酸酶(Caspases)家族蛋白表达,从而调控心肌细胞调亡[6]。
本实验研究结果表明,与正常组比,模型组大鼠出现死亡较多,LVIDd、LVESD、LVEDP 明显增大而 LVFS、LVEF、CO、LVAP、dp/dtmax及-dp/dtmax 下降,Tunel染色棕褐色坏死颗粒物质明显增多,表明模型组大鼠心衰心功能明显下降,同时心肌凋亡明显。进一步的基因表达研究表明凋亡心肌中miRNA-1、Caspase-3 mRNA、Caspase-9 mRNA 表达增加;miRNA-133表达下降;蛋白质表达方面,Caspase-3、Caspase-9蛋白表达亦升高,与 Caspase-3 mRNA、Caspase-9 mRNA表达一致。由此可知,miRNA-1与miRNA-133在心肌凋亡中作用可能相反,miRNA-1心肌凋亡中表达增加、miRNA-133表达下降;在miRNA与Caspase二者关系表达上,既往国外有研究报道miRNA-1通过正性调控Caspase-3促进细胞凋亡[11],miRNA-133可能是靶向抑制Caspase-9的表达从而抑制心肌细胞凋亡[12]。本研究中观察到 miRNA-1与 Caspase-3、Caspase-9呈正相关,miRNA-133 与 Caspase-3、Caspase-9 呈负相关,而是否存在miRNA-1正性调控Caspase-3、miRNA-133靶向抑制Caspase-9的关系需要进一步研究证实。
miRNA及其调控的靶基因在心血管疾病的病理过程中扮演着非常重要的角色[13]。明确miRNA及其对靶基因的调控,寻找心血管系统重大疾病的药物治疗新靶点,是今后心血管药物研发的新的发展方向。
[1]TAN AY,ZIMETBAUM P.Atrial fibrillation and atrial fibrosis[J].J Cardiovasc Pharmacol,2011,57(6):625-629.
[2]Babur GG,Karaahmet T,Tigen K.Myocardial fibrosis detected by cardiac magnetic resonance imaging in heart failure:inpact on remodeling.diastolic function and BNP levels[J].Anadolu Kardiyol Derg,2011,11(1):71-76.
[3]Kania G,Blyszczuk P,Eriksson U,Mechanisms of cardiac fibrosis in inflammatory heart disease[J].Trends Cardiovasc Med,2009,19(8):247-252.
[4]Zhi C,Huang Y,Qi W,et al.Expression of microRNAs differed in the omental adipose tissue of obese rats[J].Int J Clin Exp Med,2015,8(4):6601-6606.
[5]Yu L,Scherlag BJ,Sha Y,et al.Interactions between atrial electrical remodeling and autonomic remodeling:how to break the vicious cycle[J].Heart Rhythm 2012, 9(5):804-809.
[6]Hiroyuki Yaoita, Yukiomaruyama.Intervention for apoptosis in cardio-myopathy[J].Heart Failure Reviews,2008,13(2):181-191.
[7]徐建虎,张 琦,杨子庆,等.阿霉素诱导大鼠慢性心衰模型的制备[J].宁夏医科大学学报,2016,3(39):348-351.
[8]Xu K,George I,Klotz S,et a1.Erythropoietin derivate improvesleftventricularsystolic performanceand attenuatesleft ventricularremodeling in rats with myocardial infarct-induced heart failure[J].JCardiovasc Pharmacol,2010,56(5):506-512.
[9]Consili C,Gatta L,Iellamo F,et al.Severity of left ventricular dysfuction in heart failure patients affects the degree of serum-induced cardiomyocyte apoptosis.Importance of inflamma tory response and metabolism[J].Int J Cradiol,2013,167(6):2859-2866.
[10]Khan M,Zheng B,Yi F,et al.Pseudolaric acid B induces Caspase dependentand Caspase-independentapoptosis in u87 glioblastoma cells[J/OL].Evid Based Complementary Alterna tive Medicine,eCAM,2012,957568.http://dx.doi.org/10.1155.2012/957568.
[11]Nasser MW,Datta J,Nuovo G,et al.Down-regulation of MiR-1 in lung cancer.Suppression of tumorigenic property of lung cancer cells and their sensitization to doxorubicin-induced apoptosis by miR-1[J].J Biol Chem,2008,283(48):33394-33405.
[12]Castaldi A,Zaglia T,Di Mauro V,et al.MicroRNA-133 modulates the β1-adrenergic receptor transduction cascade[J].Circ Res,2014,115(2):273-283.
[13]彭 岭,郭宗耀,李 杰.循环microRNA在冠心病及其中医证候诊断中的作用[J].湖南中医药大学学报,2016,36(5):85-89.
Differential Expression of miRNA-1,miRNA133/Caspases in Rats with Chronic Heart Failure
LIU Rongfang1,TAN Xiong2,ZHANG Hui2,MAO Xiangping2,YANG Liu2,CHEN Zhicheng2,MAO Yilin2*
(1.Hunan University of Chinese Medicine,Changsha,Hunan 410208,China;2.The Second Affiliated Hospital of Hunan University of Chinese Medicine,Changsha,Hunan 410005,China)
ObjectiveTo investigate the different expression of miRNA1,miRNA133/Caspases in rats with chronic heart failure.Methods30 SD rats were randomly divided into the normal control group (n=10),the model group (n=20).The normal group was injected intraperitoneally with equal volume normal saline,the model group was injected with doxorubicin intraperitoneally for modeling.The cardiac function was examed by color doppler ultrasound and hemodynamics was recorded.The cell apoptosis was determined by Tunnel staining method.The expression of miRNA-1,miRNA-133,Caspase-3mRNA,Caspase-9mRNA was determined by Real-time PCR,and the expression level of Caspase-3 and Caspase-9 in myocardial tissue of rats was detected by Western blot and immunohistochemistry.ResultsCompared with the normal group,the LVIDd,LVESD and LVEDP of rats in the model group increased significantly(P<0.05),while LVFS,LVEF,CO,LVAP,dp/dtmax and-dp/dtmax decreased(P<0.01).The myocardial apoptosis was obvious.The expression of miRNA-1,Caspase-3mRNA,Caspase-9mRNA,protein of Caspase-3 and Caspase-9 increased(P<0.01),and miRNA-133 decreased (P<0.01).ConclusionThe expression of miRNA-1,Caspase-3 and Caspase-9 increased and miRNA-133 decreased in myocardial apoptosis.
chronic heart failure;myocardial apoptosis;miRNA-1;miRNA-133;Caspase-3;Caspase-9
R541.6
A
10.3969/j.issn.1674-070X.2017.12.008
本文引用:刘蓉芳,谭 雄,张 辉,毛湘屏,杨 柳,陈志成,毛以林.慢性心衰大鼠心肌miRNA-1、miRNA-133/caspases表达差异研究[J].湖南中医药大学学报,2017,37(12):1326-1330.
2017-07-28
湖南省自然科学基金(2016JJ4068);湖南省中医药科研计划(201610)。
刘蓉芳,女,在读读博士研究生,中医内科专业。
*毛以林,男,博士研究生导师,E-mail:maoyilin8518@126.com。
(本文编辑 杨 瑛)

