子宫腺肉瘤的诊治分析
苏家林,张 赟,吴海根,陈军女
(1.江西省妇幼保健院a.肿瘤科; b.妇产科,南昌 330006; 2.余干县妇幼保健院妇产科,江西 余干 335100)
子宫腺肉瘤的诊治分析
苏家林1a,张 赟1b,吴海根1a,陈军女2
(1.江西省妇幼保健院a.肿瘤科; b.妇产科,南昌 330006; 2.余干县妇幼保健院妇产科,江西 余干 335100)
目的分析子宫腺肉瘤的临床表现、病理特点及治疗方法,探讨可能影响其预后的相关因素。方法回顾性分析13例子宫腺肉瘤患者的临床资料。11例表现为阴道异常出血,巨检:肿瘤均为息肉样肿块,可带蒂或伴坏死,病理检查通过免疫组织化学确诊。其中子宫腺肉瘤伴肉瘤过度生长者2例、伴骨化1例、宫颈腺肉瘤1例。按FIGO分期(2009)标准:宫体腺肉瘤ⅠA期2例、ⅠB期3例、ⅠC期5例、ⅡB期1例、ⅢB期1例、宫颈腺肉瘤ⅠB1期1例。6例血清CA125高于正常,最高者达3248 U·mL-1。均采取手术治疗辅助放化疗。结果术后随访率为92.3%(12/13),随访1~94.2个月,中位随访52.2个月。6例未发现复发及转移,现已健康存活平均55.8个月(20~85个月),且在继续随访中。复发转移3例经对应治疗生存良好;死亡3例;失访1例。结论子宫腺肉瘤恶性程度低,预后良好,治疗以手术为主,放、化疗为辅,早期患者行术后辅助放化疗的毒副反应大于可能的收益。预后不仅与手术病理分期、病理类型、年龄有关,还可能和血清CA125有关,与肿瘤大小的关系不密切。
子宫腺肉瘤; 病理; CA125; 治疗; 预后
腺肉瘤为一种罕见的混合性肿瘤,最早是Clement等[1]于1974年报道,由良性上皮成分与恶性的间质成分(肉瘤)构成,在女性生殖系统主要发生在宫体(71%),宫颈部位很少见(2%)[2],随着人们健康意识的提高和诊疗方法的进步,越来越多的子宫腺肉瘤被早期发现,及时有效的手术是该病治疗的重点,是否辅助放、化疗仍存在争议。本文对13例子宫腺肉瘤的临床资料进行回顾性分析,探讨可能影响其预后的危险因素。
1 临床资料
1.1 一般资料
收集2008年11月至2015年11月江西省妇幼保健院收治的13例子宫腺肉瘤患者的病例资料,平均年龄52.15(40~69)岁。6例已绝经;11例临床表现为阴道异常出血,2例以彩超发现子宫内容物、肌瘤为主诉;巨检:肿瘤均为息肉样肿块,可带蒂或伴坏死,肿瘤最大径线1~8 cm,平均4.7 cm;病理检查:均通过免疫组织化学确诊,其中子宫腺肉瘤伴肉瘤过度生长者2例、伴骨化1例、宫颈腺肉瘤1例;血清CA125高于正常者6例(有1例异常升高达3248 U·mL-1,其他5例为轻度升高39.7~73.7 U·mL-1)。按FIGO分期(2009)标准:宫体腺肉瘤ⅠA期2例、ⅠB期3例、ⅠC期5例、ⅡB期1例、ⅢB期1例、宫颈腺肉瘤ⅠB1期1例。
1.2 治疗方案
本组13例患者首先采取手术治疗,其中宫体腺肉瘤基于筋膜外全子宫+双附件切除+盆腔淋巴结清扫的基本术式,对早期患者尝试保留卵巢、不行淋巴清扫,甚至仅行单纯病灶切除的不同术式,对于术中探查可疑有转移的患者,扩大手术范围,加行腹主动脉旁淋巴结活检、切除大网膜。术后病理无一例出现淋巴结转移。1例宫颈腺肉瘤ⅠB1期患者行Ⅲ型宫颈癌根治术。术后放化疗情况:1例(宫颈腺肉瘤)ⅠB1期、2例ⅠA期患者均未行辅助放化疗;3例ⅠB期患者中有2例未行放化疗、1例术后接受同步放化疗;5例ⅠC期患者中2例未行放化疗、2例术后行化疗、1例术后行同步放化疗;ⅡB、ⅢB期患者均行术后放化疗。放疗采用全盆外照射,化疗采用TP(多西他赛+顺铂/奈达铂)或IAP(异环磷酰胺+表柔比星+顺铂)方案。
1.3 观察项目
观察治疗后患者临床缓解情况,随访其生存状态,分析死亡、复发转移患者的病例特点,分析可能影响子宫腺肉瘤预后的危险因素。
1.4 结果
1.4.1 术后随访、复发及死亡
术后随访率92.3%(12/13),随访1~94.2个月,中位随访52.2个月,平均随访50.1个月。6例未发现复发及转移,现已健康存活平均55.8个月(20~85个月),且在继续随访中。复发转移3例,死亡3例,其病例资料见表1。失访1例。复发转移3例中 1例ⅠA期患者行宫腔镜下病灶切除术后24个月复发,再次行宫腔镜下病灶切除术保守治疗,现生存良好;1例ⅠC期患者在术后22个月出现盆腔复发,行病灶切除术+放化疗(放化疗过程中出现Ⅳ度骨髓抑制,无法坚持而放弃继续放化疗),现术后74个月生存良好;1例宫体腺肉瘤ⅠC期患者术后化疗后45个月出现骨转移,予放化疗,现术后94.2个月尚生存。死亡3例中1例ⅠC期患者于术后1月,化疗过程中出现肺栓塞死亡、1例ⅢB期患者于术后4.5个月放化疗过程中出现Ⅳ度骨髓抑制 电解质紊乱 多脏器功能衰竭死亡、1例ⅡB期患者于术后放化疗后18个月出现肺转移,予姑息性放化疗,于术后36个月死亡。
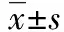

预后分期病理年龄/岁CA125/(U·mL-1)肿瘤大小/cm术后放化疗情况死亡例1ⅠC腺肉瘤侵犯深肌层4558.144.0×3.0化疗例2ⅡB腺肉瘤伴肉瘤过度生长、侵犯深肌层、脉管见瘤栓4122.44.0×4.0放化疗例3ⅢB腺肉瘤伴肉瘤过度生长、侵犯深肌层、脉管见瘤栓4073.77.0×5.0放化疗复发例1ⅠA腺肉瘤4439.73.0×3.0无例2ⅠC腺肉瘤侵犯深肌层5548.95.0×1.5无例3ⅠC腺肉瘤侵犯深肌层48-1.0×0.8化疗
-:未查。
1.4.2 术后辅助放、化疗与预后情况
是否行术后辅助放、化疗及随访结果见表2。2例未行术后放化疗复发者:1例复发考虑手术不彻底,再次行保守手术治疗;1例ⅠC期盆腔复发行手术切除+放化疗,出现Ⅳ度骨髓抑制而终止治疗。
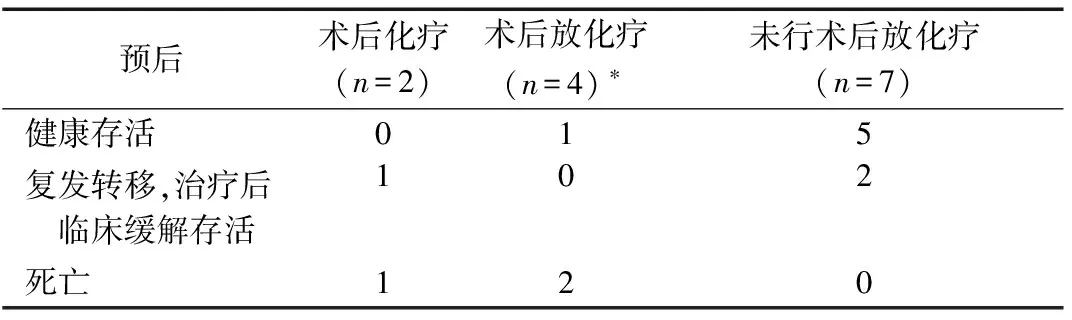
表2 13例患者术后辅助放、化疗与预后情况 例
*:失访1例。
2 讨论
2.1 临床表现
子宫腺肉瘤多发生在中老年妇女,中位年龄58岁[3],症状典型,常有阴道异常流血、肿瘤从子宫颈外口突出、子宫增大等,大体标本可见来自子宫的实性、息肉样或乳头样肿瘤,直径1~17 cm,平均5 cm,质地有软有硬,可伴出血、坏死,有时可见蒂与子宫壁相连[4],宫颈腺肉瘤极少见。本文13例患者平均年龄52.15岁,只有1例原发于宫颈,11例症状表现为阴道异常出血,肿瘤均为息肉样肿块,可带蒂或伴坏死,最大径线1~8 cm,平均4.7 cm。
2.2 治疗方法
手术是治疗子宫腺肉瘤的主要方法,一般主张,Ⅰ期患者以行全子宫+双附件切除为宜,术后根据肌层浸润和肉瘤增生情况决定是否辅以化学治疗;Ⅱ期行次广泛子宫+双附件切除+盆腔淋巴结清扫,术后可给予辅助治疗;Ⅲ期行次广泛子宫+双附件切除+盆腔淋巴结清扫+大网膜转移灶切除,术前或术后辅助治疗[5]。国外学者[6]鉴于腺肉瘤恶性程度低,且首次手术即发生转移的比例很少,仅约2%,提倡对年轻患者采取局部病灶切除及随访。国内学者[7]也认为年轻患者可行保留卵巢的手术,但需严格掌握指征:病灶应局限于子宫,且应行卵巢楔形活检排除转移。本文13例子宫腺肉瘤患者,除一例ⅠA期患者对保留子宫意愿强烈,行病灶切除术外,其他手术范围都偏广。原因可能是对子宫腺肉瘤的预后良好存在疑问和出于对肿瘤行根治性切除的理念考虑。对于辅助放、化疗必要性目前没有达成共识,其价值存在争议。Arend等[8]认为放射治疗可能能够改善对盆腔肿瘤的控制率,但无助于改善长期生存率。化疗的疗效目前还缺少大样本的研究,一般选用IAP(异环磷酰胺+表柔比星+顺铂)方案。而宫颈腺肉瘤病例少,无公认的手术及放化疗标准[9],可参考宫颈癌的手术治疗方案,因腺肉瘤的病程及生物学行为偏温和,预后较好,术后可不单一列为病理危险因素来补充放化疗。本文术后病理存在有深肌层浸润或伴肉瘤过度生长的患者给予辅助化疗或放化疗。宫颈腺肉瘤ⅠB1期行Ⅲ型根治术,无宫颈癌及腺肉瘤的术后高危因素,所以未补充放化疗。
本研究根据是否行术后辅助放、化疗的随访结果:3例死亡病例中2例行术后放化疗,1例行术后化疗,3例复发转移患者中亦有1例化疗。且有2例患者在放化疗过程中分别出现Ⅳ度骨髓抑制、电解质紊乱、多脏器功能衰竭死亡;肺栓塞死亡。有1例术后复发行放化疗,反复出现Ⅳ度骨髓抑制而终止治疗。虽然数据较少,但仍能显现出放化疗毒副反应重,且不能提高患者生存率,但有文献[10]报道术后行盆腔局部放疗的患者无局部复发。故建议早期患者,彻底手术后无需辅助放、化疗,为减少术后复发主张对于存在肉瘤过度生长或深肌层浸润的患者行辅助治疗。
2.3 预后
子宫腺肉瘤的整体预后较好,但是有子宫肌层浸润的腺肉瘤患者生存率下降到63%~69%,而子宫外转移者生存率更是低于50%[11],本组患者中1例ⅠA期患者行宫腔镜下病灶切除术后24个月复发,原因考虑与局部切除病灶不彻底有关;1例ⅠC期患者于术后1个月化疗过程中出现肺栓塞死亡属于突发死亡,而真正死于子宫腺肉瘤疾病本身者为ⅡB和ⅢB期。表1中除1例突发肺栓塞意外死亡及1例单纯腺肉瘤复发考虑病灶残留所致,其他4例术后病理均提示侵犯深肌层,2例死亡患者病理均有腺肉瘤伴肉瘤过度生长、脉管见瘤栓。佐证了子宫肌层浸润、肉瘤成分过度增生和子宫外转移是影响腺肉瘤预后的主要因素。
6例绝经患者中除1例ⅠC期患者在术后22个月出现盆腔复发(现仍然生存良好),其他5例健康生存,目前最长时间有85个月,且仍在继续随访中。而3例死亡患者平均年龄仅42岁,明显低于本组病例平均年龄。与戴梓悦[12]认为的年轻患者会有更好的预后相悖。原因可能是绝经期妇女症状典型能及早诊治,较年轻的女性出现阴道出血原因较多较复杂,患者本身因素及诊疗因素都可能延误治疗时机。
本文中6例患者的血清CA125高于正常,有2例死亡、2例复发(CA125:48.9~73.7 U·mL-1),1例CA125:3248 U·mL-1(可能与阴道宫颈分泌物见铜绿假单孢杆菌,宫腔肿瘤坏死伴出血有关)术后3月降为正常,现存活20个月,继续监测随访中,1例健康存活85个月(CA125:39.7 mmol·L-1)。CA125存在于苗勒管衍生物和胎儿及成人浆膜表面上皮,亦可因间皮细胞受到非特异性刺激导致生成增加而升高,而腺肉瘤的上皮成分为苗勒氏管源性,且子宫腺肉瘤患者阴道出血症状居多,瘤体可伴出血坏死,存在感染及炎症刺激的可能。故子宫腺肉瘤的患者CA125可升高,但本研究显示CA125大于50 U·mL-1的患者均出现复发转移或死亡,认为血清CA125大于50 U·mL-1可能是影响腺肉瘤愈后的又一危险因素,应引起高度重视。本文13例患者肿瘤最大径线1~8 cm,平均4.7 cm,死亡复发转移组肿瘤最大径线1~7 cm,平均4 cm,可见子宫腺肉瘤的预后与肿瘤大小关系不密切。
综上所述,子宫腺肉瘤恶性程度低,预后良好,治疗以手术为主,放、化疗为辅,早期患者行术后辅助放化疗的毒副反应大于可能的收益。预后不仅与手术病理分期、病理类型、年龄有关,还可能和血清CA125值有关,与肿瘤大小的关系不密切。以上观点基于单中心的临床回顾性分析,且病例数据少,因此对于子宫腺肉瘤的治疗和预后评估,仍有待于进一步研究。
[1] Clement P B.Scully R E.Mullerian adenosarcoma of the uterus.A clinicopath-ologic analysis of ten cases of a distinctive type of Mullerian mixed tumor[J].Cancer,1974,34(4):1138-1149.
[2] Verschraegen C F.Vasuratna A,Edwards C,et al.Clinicopathologic analysis of mullerian adenosarcoma:the M.D.Anderson Cancer Center experience[J].Oncol Rep,1998,5(4):939-944.
[3] 连利娟,林巧稚.妇产科肿瘤学[M].北京:人民卫生出版社,2006:484.
[4] 回允中.妇女生殖道病理学[M].北京:北京大学出版社,2005:516-517.
[5] Mc Cluggage W G.Mullerian adenosarcoma of the female genital tract[J].Advan Anato Pathol,2010,17(2):122-129.
[6] Michener C M.Simon N L.Ovarian conservation in a woman of reproductive age with mullerian adenosarcoma[J].Gynecol Oncol,2001,83(2):427.
[7] 梅又文,李金科,胡丽娜.青年女性子宫腺肉瘤诊治[J].华西医学,2011,26(5):717-719.
[8] Arend R, Bagaria M,Lewin S N,et al.Long-term outcome and natural history of uterine adenosarcomas[J].Gynecol Oncol,2010,119(2):305-308.
[9] 王树鹤,徐婉,刘艳红.宫颈腺肉瘤一例[J].中国妇产科临床杂志,2011,12(3):229-230.
[10] 乔力.子宫腺肉瘤1例分析[J].中国老年学杂志,2015,16(35):4687-4688.
[11] Arend R,Bagaria M,Lewin S N,et al.Long-term outcome and natural history of uterine adenosarcomas[J].Gynecol Oncol,2010,119(2):305-308.
[12] 戴梓悦.子宫腺肉瘤3例[J].实用妇产科杂志,2015,31(9):699-700.
2017-07-15
吴海根,主任医师,教授,E-mail:wlwhg163@163.com。
R737.33
A
1009-8194(2017)10-0048-03
10.13764/j.cnki.lcsy.2017.10.019
罗芳)

