吐鲁番地区哈密瓜品种对细菌性果斑病抗性研究
(1.新疆吐鲁番市农业技术推广中心,新疆吐鲁番 838000;2.石河子大学绿洲农作物病害防控重点实验室,新疆石河子 832000)
doi:10.6048/j.issn.1001-4330.2017.11.012
吐鲁番地区哈密瓜品种对细菌性果斑病抗性研究
毛 亮1,吉艳玲1,张 娟1,王宣仓1,潘卫萍1,张以和1,王晓东2
(1.新疆吐鲁番市农业技术推广中心,新疆吐鲁番 838000;2.石河子大学绿洲农作物病害防控重点实验室,新疆石河子 832000)
目的研究吐鲁番地区哈密瓜品种对细菌性果斑病的抗病性,为哈密瓜细菌性果斑病防治和抗病育种提供理论依据。方法以吐鲁番地区10份哈密瓜品种为材料,采用苗期人工接种进行病情指数调查;观察不同抗性品种苗期叶面绒毛数和气孔数及测定叶片自身防御酶PPO、POD。结果供试10个品种中无免疫品种,西州密25号和皇妃表现为中抗,新密36号表现为高感,其余7个品种表现为中感;高感品种新密36号和中感品种9818(绿皮)叶毛数无明显差距,西州密25号的叶毛数是新密36号的叶毛数1.68倍,气孔数是中感品种9818(绿皮)的1.42倍,是新密36号1.91倍;不同抗性品种PPO酶活性呈现感病品种﹥中感品种﹥抗病品种,POD酶活性呈现感病品种﹥中感品种﹥抗病品种。结论供试品种对哈密瓜细菌性果斑病抗病性有明显差异,未发现免疫和高抗品种,西州密25号和皇妃表现为中抗,新密36号为高感品种,其余品种表现为中感;品种抗病性与下表皮叶面叶毛数量和气孔数量有关,呈正相关趋势,自身防御酶PPO酶呈下降趋势,与品种抗病性呈负相关,POD酶呈上升趋势,与品种抗病性呈负相关。
哈密瓜;细菌性果斑病;抗性
0 引 言
【研究意义】哈密瓜是新疆主要特色水果之一,种植哈密瓜不仅经济效益高,可以和粮棉油等作物间套作,随着近几年新疆农业产业结构调整,哈密瓜种植面积逐年增大,2013年新疆甜瓜种植面积7.3×104hm2,产量150×104t[1],极大推动新疆农业经济发展,但随着种植面积扩大和复种指数的提高,哈密瓜病害危害面积和危害程度逐年增大,尤其是瓜类细菌性果斑病传入新疆后,给新疆的哈密瓜产业带来了严重危害,严重时可以引起绝产的损失。【前人研究进展】张昕等[2]报道了哈密瓜细菌性果斑在新疆的危害,此病害主要以种子带菌传播,随后哈密瓜细菌性果斑病迅速在新疆哈密瓜主要产区扩展开来。田间发生瓜类细菌性果斑病主要是病原菌通过伤口和气孔侵染,抗病品种哈密瓜叶片上气孔的数量明显多于感病品种[3],该病害生产上防治主要以化学防治方法,但生产上使用的化学药剂对细菌性果斑病防治效果不理想[4],抗病育种和筛选抗病品种是防治哈密瓜细菌性果斑病非常有效的办法。【本研究切入点】近年来吐鲁番地区哈密瓜细菌果斑病有零星发生。研究针对吐鲁番地区主栽的哈密瓜品种,通过室内盆栽人工接种法进行抗瓜类细菌性果斑病性的测定;观察抗、感品种叶片形态特征;测定抗、感品种自身防御酶PPO和POD变化,对吐鲁番哈密瓜品种进行细菌性果斑病抗性进行评价。【拟解决的关键问题】筛选出较抗细菌性果斑病的哈密瓜品种,为哈密瓜细菌性果斑病防治和抗病育种提供理论依据。
1 材料与方法
1.1 材 料
供试哈密瓜品种:西州密25号和西州密17号由新疆维吾尔自治区葡萄瓜果研究所提供,新密14号、新密28号、新密36号、新密杂9号、9818(绿皮)、9818(黄皮)、白玫(0901)和皇妃(1028)由新疆农业科学院哈密瓜研究中心提供。
供试菌株:哈密瓜细菌果斑病菌菌株XJ05-1(Aac)由石河子大学农学院植保系王晓东提供。
供试瓜苗:供试哈密瓜品种的种子分别经2%HCl溶液浸泡处理10 min后,用流水反复冲洗几遍,然后将种子放入铺有湿润滤纸的培养皿中,置于30℃恒温培养箱中催芽12 h后播入营养钵中,每盆5~6粒,待瓜苗长到两叶一心时备用。
1.2 方 法
1.2.1 哈密瓜苗期抗病性检测
哈密瓜细菌性果斑菌菌株XJ05-1在KBA固体平板上进行活化,28 ℃培养48 h后挑取单菌落接种于KB液体培养基中,28℃、220 r/min,培养24 h后,用无菌水稀释,用紫外分光光度计将菌悬液的浓度调到OD600≈0.3,采用喷雾法接种,接种后用塑料薄膜保湿48 h,7 d后开始调查叶片的发病情况,并计算病情指数。病情分级调查参考Hopkins[5]略有改动,病情指数分级标准如下: 0级,叶片无病斑;1级,叶片病斑少,病斑面积占整叶面积的10%以下;2级,叶片病斑多,病斑面积占整叶面积的10%~30%;3级,叶片病斑多,病斑面积占整叶面积的31%~50%;4级,叶片病斑很多或融合成大斑,病斑面积占整叶面积的51%~70%;5级,叶片病斑很多或融合成大斑,病斑面积占整叶面积的71%以上。病情指数(Disease index,DI)计算公式如下:

其中,i代表病害级别;Li代表与各病级相对应的病叶数。
相对病情指数=供试品种病情指数/对照品种病情指数(DI最高者为对照品种).
相对抗病指数=1-相对病情指数.
采用相对抗病性方法[6]评价其抗病程度,相对抗病程度分为免疫(1.00)、高抗(0.80~0.99)、中抗(0.40~0.79)、中感(0.20~0.39)、感病(0.20以下)。
1.2.2 不同抗病性哈密瓜品种幼期叶片绒毛及气孔显微镜观察
采集瓜苗同一部位叶片,用蒸馏水浸泡后,采用撕取法[7]撕取叶片相近部位的下表皮放在生物显微镜下观察叶片表面气孔的密度和绒毛数,并随机选择5个视野内的绒毛和气孔进行计数。
1.2.3 不同抗病性哈密瓜品种苗期叶片防御酶PPO和POD的测定
选取中抗、中感和高感品种采取人工接种XJ05-1后,分别在12 h、24 h、36 h后摘取活体叶片,每一次摘取同一节位叶片,测定活体叶片PPO和POD酶活性参照文献进行[8-9]。
2 结果与分析
2.1 哈密瓜品种苗期抗病性
研究表明,供试10个哈密瓜品种幼苗对瓜细菌性果斑病菌均感病,无免疫品种,但品种间抗性存在显著差异。西州密25号和皇妃表现为中抗,其中西州密25号的病情指数为25.37。新密36号表现为高感,病情指数为56.28。其余7个品种表现为中感。表3
2.2 不同抗病性哈密瓜品种苗期叶片绒毛及气孔密度观察
研究表明,中抗品种与感病品种和中感品种之间叶片绒毛数量有明显差距,中抗品种西州密25号叶片绒毛数达到66.2个,是新密36号的叶毛数1.68倍。感病品种新密36号和中感品种9818(绿皮)叶片绒毛数无明显差距。中抗品种西州密25号气孔数达到76.2个,是中感品种9818(绿皮)气孔数的1.42倍,是新密36号1.91倍。图1~3
表1 不同哈密瓜品种病情指数及抗性评价
Table 1 Disease index and resistance evaluation of different hami melon cultivar used
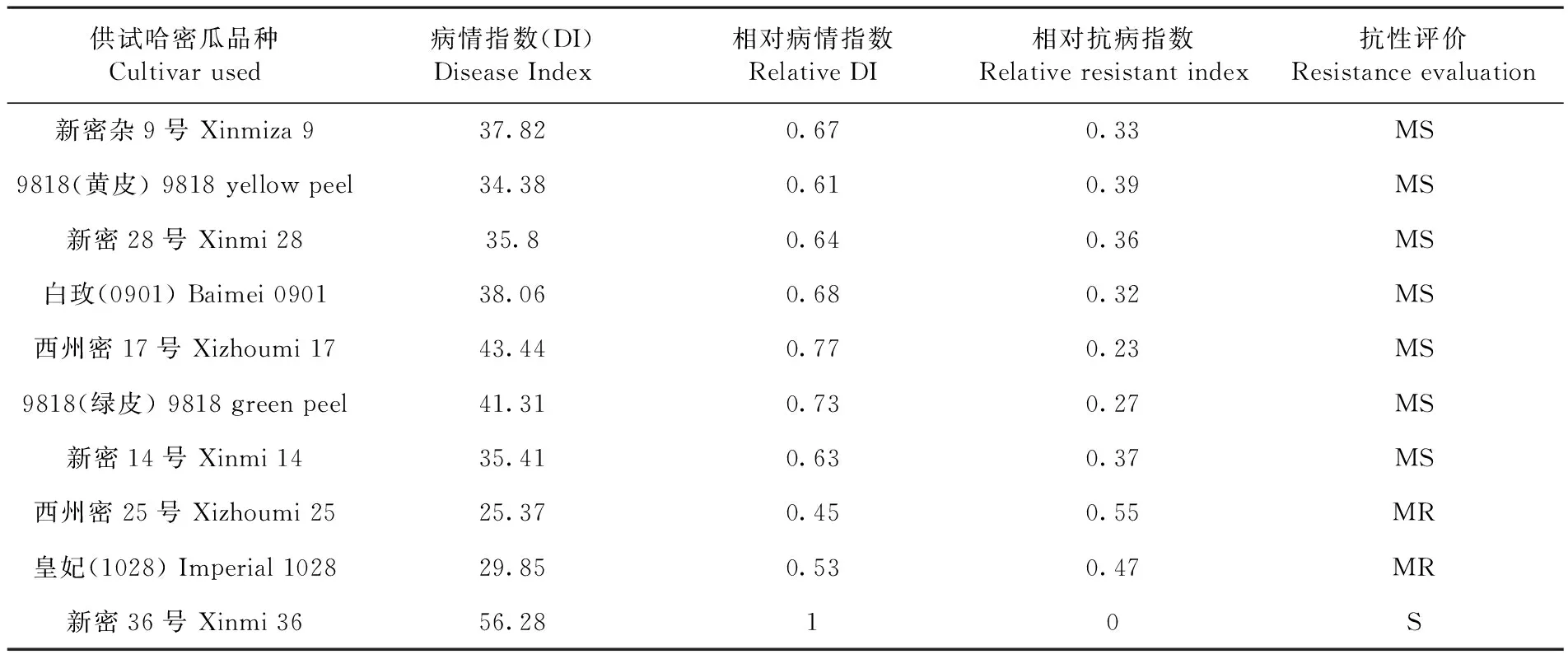
供试哈密瓜品种Cultivarused病情指数(DI)DiseaseIndex相对病情指数RelativeDI相对抗病指数Relativeresistantindex抗性评价Resistanceevaluation新密杂9号Xinmiza937.820.670.33MS9818(黄皮)9818yellowpeel34.380.610.39MS新密28号Xinmi2835.80.640.36MS白玫(0901)Baimei090138.060.680.32MS西州密17号Xizhoumi1743.440.770.23MS9818(绿皮)9818greenpeel41.310.730.27MS新密14号Xinmi1435.410.630.37MS西州密25号Xizhoumi2525.370.450.55MR皇妃(1028)Imperial102829.850.530.47MR新密36号Xinmi3656.2810S
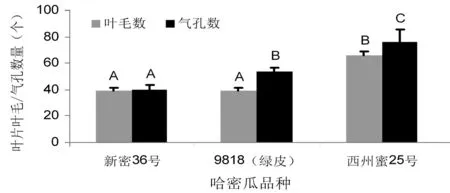
图1 不同抗性哈密瓜品种叶片绒毛和气孔数
Fig.1 Leaf hairs and stomata number in different resistant hami melon cultivars

注:A, 新密36号;B,9818(绿皮);C,西州密25号
Note: A, Xinmi 36;B,9818 greenpeel;C,Xizhoumi 25
图2 不同抗性哈密瓜品种叶片绒毛着生形态
Fig.2 Comparison of pubescence number of leaf suface between different resistance hami melon cultivars

注:A:新密36号;B: 9818(绿皮);C:西州密25号
Note: A, Xinmi 36;B,9818 greenpeel;C,Xizhoumi 25
图3 不同抗性哈密瓜品种叶片气孔着生形态
Fig.3 Comparison of stomatal number of leaf suface between different resistance hami melon varieties
2.3 不同抗病哈密瓜品种苗期叶片防御酶PPO、POD的测定
研究表明,不同抗性哈密瓜品种接种后PPO酶活性都是整体呈下降趋势,在不同时段感病品种新密36号的PPO酶活性比抗病品种西州密25号酶活性要高,酶活性呈现感病品种﹥中感品种﹥抗病品种;各抗性品种在接种后,POD酶活性呈现升高趋势,在前24 h酶活升高较平缓,24~36 h酶活性升高幅度较大,各抗性品种升高近2倍,POD酶活性呈现感病品种﹥中感品种﹥抗病品种。图4,图5

图4 不同抗性哈密瓜品种PPO酶活性变化
Fig.4 Changes of PPO activity in different resistant of hami melon cultivars
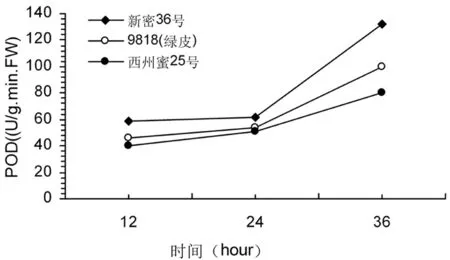
图5 不同抗性哈密瓜品种POD酶活性变化
Fig.5 Changes of POD activity in different resistant of hami melon cultivars
3 讨 论
植物抗病性体现在结构抗病性和生理生化抗病性。结构性抗病性体现在植物体表面结构,与叶片表面覆盖的蜡质和角质层、表皮细胞壁的结构、气孔和皮孔等组织有关。叶片表面的绒毛能显著减少病原菌接触侵染的机会。试验通过显微观察哈密瓜叶面下表皮叶毛数和气孔数,发现中抗品种叶毛数和气孔数明显高于感病品种和中感品种,与翟艳霞等[10]研究哈密瓜品种与细菌性果斑病的抗病关系,抗病品种叶片单位面积气孔数量多于感病品种,叶毛密度大于感病品种的结果是一致的。另一方面,生理生化抗病性表现在植物收到外界环境刺激、化学药剂诱导、病原菌侵入植物,植物自身生理生化系统会发生变化,自身防御酶系统被激活,PPO、POD、PAL、SOD等自身防御酶在植物病原菌侵染的防御反应中起着重要作用,其酶活性的高低与植物抗病性能力有着十分密切的关系。通过对不同抗性哈密瓜品种自身防御酶PPO和POD进行测定,发现PPO酶在病原菌接种后,防御酶活有下降趋势,且不同时段酶活性呈现感病品种﹥中感品种﹥抗病品种,表明PPO酶活与抗病性成负相关,这一结果与郑喜清[8]研究结果一致,在病原菌接种后,防御酶POD活性有上升趋势,这一研究结果与郑喜清[8]、李俊阁[11]研究一致,且不同时段酶活性呈现感病品种﹥中感品种﹥抗病品种,这一研究结果与辛建华等[12]在哈密瓜不同品系苗期抗病性及生化分析的研究表明接种后抗病品种的酶活性比感病的低结果一致,但这一研究结果与翟艳霞[10]、李俊阁[11]研究结果接种后POD酶活性抗病品种高于感病品种,且表明POD酶活与抗病性成正相关不一致,防御酶POD酶活性在不同品种表现的不一致,可能跟品种自身特性及外在环境条件不同有关。
4 结 论
通过不同哈密瓜品种苗期对细菌性果斑病抗性筛选,确定各品种对哈密瓜细菌性果斑病抗病性有明显差异,供试10个品种中未发现免疫和高抗品种,表现为中抗的有西州密25号和皇妃,新密36号为高感品种,其余品种表现为中感;品种抗病性与下表皮叶面叶毛数量和气孔数量有关,呈正相关趋势,自身防御酶PPO与品种抗病性呈负相关,POD与品种抗病性呈负相关。
参考文献(References)
[1] 杨军, 廖新福, 马新力, 等. 2013年新疆维吾尔自治区西甜瓜产业技术发展报告[J]. 新疆农业科技, 2014, (2): 38-39.
YANG Jun, LIAO Xin-fu, MA Xin-li, et al. (2014). Report on the development of watermelon and melon industry in Xinjiang Uygur Autonomous Region in 2013 [J].XinjiangAgriculturalScienceandTechnology, (2): 38-39. (in Chinese)
[2]张昕, 李国英, 任毓忠, 等. 新疆哈密瓜上两种病原细菌比较鉴定及其田间消长动态的研究[J].中国农业科学, 2002, 35(7):888-893.
ZHANG Xin, LI Guo-ying, REN Yu-zhong, et al. (2002). Comparative identification and field dynamics of two pathogenic bacteria on Hami melon in Xinjiang [J].ChineseAgriculturalScience, 35(7):888-893. (in Chinese)
[3]胡俊, 胡宁宝, 翟艳霞, 等. 哈密瓜对细菌性果斑病抗性机制的初步研究[J]. 中国植物保护学会2006学术年会论文集,727.
HU Jun, HU Ning-bao, ZHAI Yan-xia, et al. (2006). A preliminary study on the resistance mechanism of Hami melon to bacterial leaf spot [J].Proceedingsofthe2006AnnualAcademicConferenceofChinaSocietyforPlantProtection, 727. (in Chinese)
[4]李国英, 任毓忠, 张昕, 等. 甜瓜细菌性病害药剂防治实验[J]. 中国西瓜甜瓜, 2003,(4):12 -14.
LI Guo-ying, REN Yu-zhong, ZHANG Xin, et al. (2003). Test of bactericides for controlling bacterial fruit blotch [J].ChinaWatermelonandMuskmelon, (4):12-14. (in Chinese).
[5] Hopkins, D. L., & Thompson, C. M. (2002). Seed transmission of acidovorax avenae subsp. citrulli in cucurbits.HortscienceAPublicationoftheAmericanSocietyforHorticulturalScience, 37(6):924-926.
[6]贾宋楠, 王惠林, 郑健, 等. 籽用西瓜种质资源对细菌性果斑病的抗性鉴定[J]. 新疆农业科学, 2013,50(5): 864-869.
JIA Song-nan, WANG Hui-lin, ZHENG Jian, et al. (2013). Identification of resistance to Acidovorax avenae subsp. citrulli of edible seed watermelon germplasm resources [J].XinjiangAgriculturalSciences, 50(5): 864-869. (in Chinese)
[7]刘世鹏, 刘长海, 曹娟云, 等. 用煮沸撕取法观察表皮气孔的方法[J].安徽农业科学, 2007, 35(10): 2 839-2 840.
LIU Shi-peng, LIU Chang-hai, CAO Juan-yun, et al. (2007). A method for observing epidermis stoma by boiling and tearing epidermis from leaf [J].JournalofAnhuiAgriculturalScience, 35(10): 2,839-2,840. (in Chinese)
[8]郑喜清.哈密瓜品种对细菌性果斑病抗性指标的研究[D]. 呼和浩特:内蒙古农业大学硕士学位论文,2007.
ZHENG Xi-qing. (2007).StudiesonresistanceindexofHamimelonvarietiestoAcidovoraavenaesubsp.Citrulli[D]. Master Thesis. Inner Mongolia Agricultural University, Hohhot. (in Chinese)
[9]王晓东. 防治哈密瓜细菌性果斑病拮抗酵母菌的筛选及其生防机理研究[D].武汉:华中农业大学博士学位论文, 2009.
WANG Xiao-dong. (2009).Selectionandmechanismofactionofantagonistyeastagainstbacterialfruitblotch[D]. PhD Thesis. Huazhong Agricultural University,Wuhan. (in Chinese)
[10]翟艳霞. 哈密瓜品种对细菌性果斑病菌的抗性鉴定及抗性机制的研究[D]. 呼和浩特:内蒙古农业大学硕士学位论文, 2006.
ZHAI Yan-xia. (2006).ResistanceidentificationofHamimelonvarietiestoAcidovoraxavengesubsp.citrulliandstudiesonmechanismofdiseaseresistance[D]. Master Thesis. Inner Mongolia Agricultural University, Hohhot. (in Chinese)
[11]李俊阁. 甜瓜细菌性果斑病抗性鉴定及抗性相关生理研究[D]. 乌鲁木齐:新疆农业大学硕士学位论文, 2015.
LI Jun-ge. (2015).ResistanceidentificationofdifferentmuskmelonstoAcidovoraxcitrulliandstudiesonmechanismofdiseaseresistance[D]. Master Thesis. Xinjiang Agricultural University, Urumqi. (in Chinese)
[12]辛建华, 傅振清. 哈密瓜不同品系苗期抗病性及生化分析[J].中国西瓜甜瓜, 1997, (2):13-17.
XIN Jian-hua, FU Zhen-qing. (1997). Disease resistance and biochemical analysis of different strains of melon at seedling stage [J].ChinaWatermelonandMuskmelon, (2):13-17. (in Chinese)
APreliminaryStudyonResistanceofHamiMelonVarietiestoAcidovoraxavenaesubsp.citrulliinTurpanArea
MAO Liang1, JI Yan-ling1, ZHANG Juan1, WANG Xuan-cang1,PAN Wei-ping1, ZHANG Yi-he1, WANG Xiao-dong2
(1.XinjiangTurpanAgriculturalTechnologyExtensionCenter,TurpanXinjiang838000,China; 2.KeyLaboratoryofOasisCropDiseaseControlandPrevention,ShiheziUniversity,ShiheziXinjiang832000,China)
ObjectiveThis project aims to provide the theoretical basis for the prevention and breeding of bacterial fruit blotch of Hami melon through the study on the resistance toAcidovoraxavenaesubsp.Citrulliin Turpan,Method10 Hami melon varieties planted in Turpan area were used as materials,and the disease index of resistance toAcidovoraxavenaesubsp.citrulliwas investigated by artificial inoculation at the seedling stage. At the same time, the stomatal and leaf hair number of seedlings leaf surface between different resistant cultivars were compared and the defense enzymes PPO and POD in seedling leaves were measured.ResultAmong the 10 cultivars, there were no immune varieties, Xizhoumi No. 25 and Imperial Concubine showed the middle resistance, Xinmi No. 36 showed a high susceptibility, and the other seven varieties showed a middle susceptibility; There were no significant differences in leaf hair number between susceptible varieties Xinmi No. 36 and middle susceptible varieties 9818 (green leaf trichomes). Leaf hair number of the middle resistance Xizhoumi No.25 was 1.68 times that of Xinmi No. 36. The number of stomata of Xizhoumi No. 25 was 1.42 times that of 9818 (green leaf trichomes) and 1.91 times that of Xinmi No.36. The PPO enzyme activities of different resistant varieties showed susceptible varieties > middle susceptible varieties > resistant varieties, POD enzyme activity showed susceptible varieties > middle susceptible varieties > resistant varieties.ConclusionDifferent Hami melon varieties have significant difference resistance toAcidovoraxavenaesubsp.Citrulli, and no immune and high resistant varieties among them have been found. Xizhoumi No. 25 and Imperial Concubine show middle resistance, Xinmi No. 36 is a high susceptible variety, other varieties are middle and high susceptible varieties. There was a positive correlation between disease resistance and the number of leaf hair and stomata, showing positive correlation trend. The PPO enzyme showed a downward trend, which was negatively related to disease resistance, and POD enzyme showed an upward trend, which was negatively related to disease resistance of varieties.
Hami melon; bacterial fruit blotch; resistance
Supported by: The National Natural Science Foundation of China "Study on Pichia anomala 0732-1 metabolic product acetic acid to the mechanism of preventing and controlling bacterial fruit blotch of Hami melon"(31460485) and Science and Autonomous region youth science and technology innovation talent training project "Grassroots young scientific and technological personnel training project" (qn2015jc073)
WANG Xiao-dong (1975- ), male, native place: Laizhou, Shangdong. Associate Professor,research field: Biological control of plant diseases. (E-mail)wxdong11@163.com
ZHANG Yi-he (1966- ), male, native place: Suqian, Jiangsu. Agricultural extension researcher, research field: Facility cultivation technology. (E-mail) 1057065635@qq.com
S652.1;S436.42
A
1001-4330(2017)11-2054-06
2017-07-20
国家自然科学基金项目“Pichia anomala 0732-1代谢产物乙酸在生防哈密瓜细菌性果斑病中的作用机制研究”(31460485);自治区青年科技创新人才培养工程“基层青年科技人才培养项目”(qn2015jc073)
毛亮(1981-),男,山东即墨人,高级农艺师,硕士,研究方向为设施病虫害,(E-mail)mao2548@163.com
王晓东(1975-),男,山东莱州人,副教授,博士,研究方向为植物病害生物防治,(E-mail)wxdong11@163.com
张以和(1966-),男,江苏宿迁人,农业推广研究员,研究方向为设施栽培技术,(E-mail)1057065635@ qq.com

