基于ITK多图谱配准的脑部皮质下核团的分割研究
聂秀玲 刘任远 陆加明 张 冰 孙 钰 万遂人#∗
1(东南大学医学电子学实验室,南京 210096)
2(南京大学医学院附属鼓楼医院医学影像科,南京 210008)
基于ITK多图谱配准的脑部皮质下核团的分割研究
聂秀玲1刘任远2陆加明2张 冰2孙 钰1万遂人1#∗
1(东南大学医学电子学实验室,南京 210096)
2(南京大学医学院附属鼓楼医院医学影像科,南京 210008)
大量研究表明,阿尔茨海默症(AD)的病变与大脑皮质下核团的萎缩息息相关,某些核团的萎缩(如海马)可能成为AD疾病早期诊断的标志,而皮质下核团的分割是研究核团萎缩模式的重要前提。基于AD患者和正常人各30例3DT1W-MR图像,先结合直方图分析和三维形态学分析方法对图像进行脑组织提取,后采用ITK配准算法将10个脑图谱图像经两阶段分别配准到提取脑组织后的图像空间。第一阶段实现基于均方差的仿射配准,第二阶段实现基于互信息的B样条形变配准,两阶段的配准均采用线性插值法和梯度下降的优化搜索方法。最后采用STAPLE融合算法,对配准后得到的10个目标图像进行图像融合,得到最终的分割结果。结果表明:除尾状核外,分割得到的其余6对核团的体积与常用的FSL-FIRST算法的分割结果无统计学差别(P>0.05);AD患者的右侧伏核和双侧海马发生萎缩(P<0.05)。因此,基于ITK配准框架的多图谱配准分割方法能有效分割MR图像上边界不明确的皮质下核团。
皮质下核团;多图谱分割;图像配准;ITK
引言
阿尔茨海默症(Alzheimer′s disease,AD)是一种伴随各种认知功能障碍的慢性神经系统退行性疾病,患者一旦出现疾病症状,病情会快速加重,它是导致痴呆症的最主要的病因。调查表明,60%~70%的痴呆是由AD转化而来的[1-2]。目前,对AD没有行之有效的治疗方法,其治疗的关键在于对AD的及早诊断,从而采取措施延缓病情[3]。
大量医学研究表明,大脑的皮质下核团与记忆、学习、空间导航等功能息息相关[4-5],这些核团主要包括7对,分别为左右侧海马、伏核、杏仁核、尾状核、苍白球、壳核和丘脑。医学研究者发现,AD患者的海马、丘脑、杏仁核等结构较健康对照组会出现统计学意义上的显著萎缩[6-10],并且这些核团的萎缩与临床量表评分具有显著相关性,从而推断AD疾病的成因或许与皮质下核团有关。因此,对皮质下核团的分割,对研究AD疾病的成因以及早期诊断都非常有意义。
由于皮质下核团在MR图像上的灰度强度值非常相似,像素值高度重叠,并且各核团的轮廓不清晰可辨,因此采用传统的基于灰度信息或边界信息的图像分割方法均不能得到良好的分割效果[11]。目前,国外对于皮质下核团的分割主要集中在3种方法:一是基于图谱的分割算法[12];二是基于统计建模的分割算法[3,11],三是基于形变模型的分割算法[13]。而国内关于皮质下核团的分割研究主要集中在对海马体的分割[3,14-15],对其他核团(如丘脑)的分割研究较少。以上提到的3种分割算法都需要大量的手工描绘的核团图像作为训练集进行统计建模,而核团的精确勾勒需要依靠经验丰富的神经影像专家,这项工作无疑需要耗费大量的人力和时间。但是对于基于图谱的分割算法,开源项目MICCAI 2012 Multi-Atlas Labeling[16]提供了由专家标记的大脑各结构的图谱图像,从而节省了研究者训练图谱的工作。
ITK是一个强大的开源的医学图像处理平台[17],提供了多种图像配准算法,被越来越多地应用于实际的2D/3D医学图像处理中。本研究利用ITK配准框架,实现三维MR图像的多图谱配准,采用先仿射配准后形变配准的流水线处理,将多个图谱图像配准到同一个目标图像,得到多个已配准的目标图像,再采用STAPLE融合算法对这些标签图像进行融合,实现大脑7对皮质下核团的分割。
1 材料和方法
1.1 材料
图谱采用的MR图像来源于免费数据库OASIS(Open Access Series of Imaging Studies,http://www.oasis-brains.org/)[18],这些 MR 图像被应用于项目MICCAI 2012 Multi-Atlas Labeling,由神经影像学专家标记大脑各结构,共成功标记了28个大脑皮质下的结构,所有图像的分辨率均为1 mm×1 mm×1 mm。该项目共提供了15组已经分割好的图谱图像。
实验图像数据均由南京鼓楼医院提供,扫描设备是飞利浦Achieva 3.0T磁共振成像仪。采用三维turbo快速回波T1WI加权序列扫描来获取全脑结构图像。序列参数如下:重复周期(TR)/回波时间(TE)=9.7 ms /4.6 ms,翻转角(flip angle)=8°,层厚(slice thickness)=1 mm,FOV(field of view)=256 mm ×256 mm,平面内分辨率1 mm×1 mm,扫描层数为192。
1.2 方法
1.2.1 图像预处理
为了降低算法运算量,提高运算效率和分割精度,需要将图像中的非脑部组织剔除,只保留脑部组织。常用的脑组织提取工具是FSL-BET[19-20],但BET算法对本研究采用的图像数据的脑提取准确率较低,其阈值参数的选取范围为[0,1],设置的阈值过大或过小,会造成图像的过/欠分割,最坏情况下,即使设置的阈值覆盖[0,1],脑组织提取的效果也不好。因此,本研究结合直方图分析和形态学处理的算法进行脑组织的提取[21]。
算法思想是计算图像的灰度直方图,用等能量的高斯曲线与直方图曲线进行两次拟合,第一次获得图像与背景之间的阈值,第二次获得脑部组织与头骨等非脑部组织之间的阈值,两次阈值处理后得到初始的脑部二值图像,然后使用SDC Morphology工具箱进行三维形态学处理,得到脑组织提取后的图像。具体算法流程如下:
1)获取图像的灰度直方图,用等面积的高斯曲线拟合直方图,取两曲线间最大差值的灰度值为阈值;
2)取两个阈值,一个用于消除图像背景,另一个用于获得脑部组织,处理后得到一个初始的brain mask;
3)对初始的brain mask进行3D的二值形态学处理,先腐蚀后膨胀处理,再获取图像的最大连通域,得到剥脑后的brain mask;
4)对剥脑后的brain mask恢复对应像素点中原始的灰度值,得到最终剥脑后的图像。
算法的关键在于两次曲线拟合时选取的面积的百分比A1和A2,以及腐蚀膨胀处理时结构因子的半径r1、r2的大小。A1、A2分别表示第一、二次拟合的高斯曲线的面积与图像直方图曲线总面积的比值。在本研究中,参数设置为A1=70%,A2=30%。图1显示了高斯曲线拟合图像直方图的过程,其中t1和t2为求得的两个阈值。

图1 高斯曲线拟合图像直方图Fig.1 Fitting image histogram using Gaussian curve
1.2.2 基于多图谱配准的分割方法
配准实质上是一个寻找目标图像和模板图像之间的对应变换函数的过程[14]。基于图谱配准的分割方法是把分割问题看作配准问题,将已经分割好的模板图像(即图谱图像)映射到待分割图像上。如图2所示,多图谱分割算法是将多个已标记好的图谱配准到目标图像上,得到多个分割后的label图像,然后采用图像融合策略处理label图像,从而获得最佳的分割结果。从15个图谱中随机选择10个图谱,分别将10个图谱配准到待分割图像中。
1.2.3 ITK配准框架
ITK是一款开源、跨平台的医学图像处理软件包,包含一个C++类库,其封装了多种图像配准的相关算法,并且支持 Png、Dicom、Meta、Nifty、VTK 等多种图像格式[17]。研究者只需要根据实际需要调用相应算法的函数接口,无需关心算法内部的具体实现细节。图3显示了ITK的图像配准框架,包括5部分:输入图像、插值算法、空间变换、相似性测度和优化器,各模块功能如下:
1)相似性测度:用于衡量图像配准的程度。

图2 基于多图谱配准的图像分割流程Fig.2 Flow chart of multi-atlas based segmentation
2)空间变换模型:用于约束浮动图像形变到参考图像的方式,一般采用多个参数指定特定的形变。
3)插值算法:浮动图像经过变换后,像素坐标可能落在非整数区域,通过图像插值函数计算出合适的坐标,并将对应像素变换到该点。
4)优化算法:用于寻找形变模型的最优参数,从而获得能量函数的最优值。
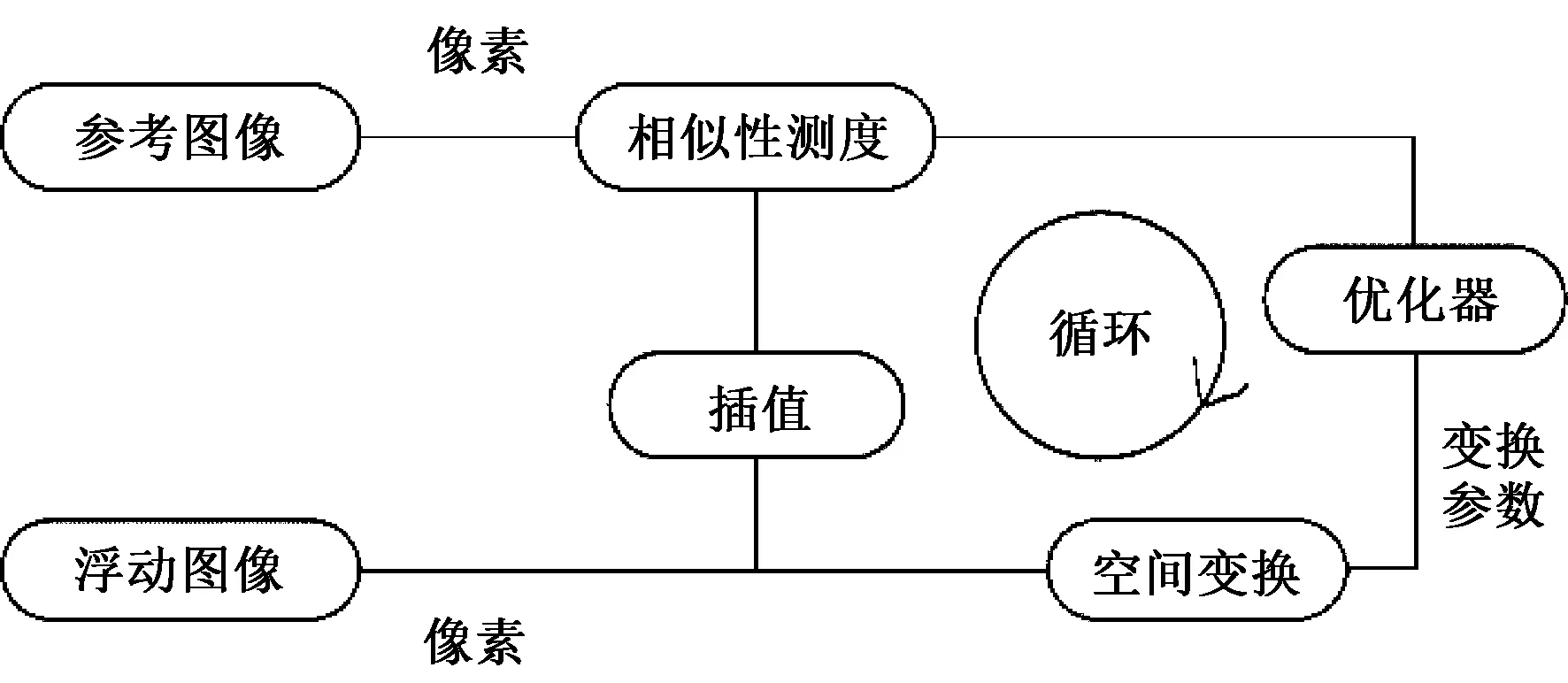
图3 ITK医学图像配准框架Fig.3 Registration framework of ITK
1.2.4 基于ITK的多图谱配准的实现
1.2.4.1 相似性测度
ITK提供多种相似性测度的类,本研究使用了均方和互信息作为配准的相似性尺度。
1)均方。均方尺度计算图像A和B中用户定义的区域的方形像素在亮度上不同程度的均方值,即
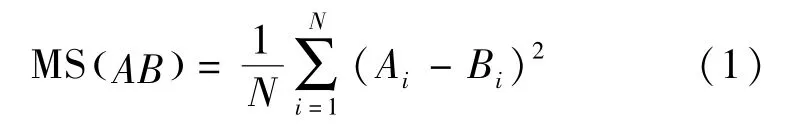
式中,Ai是图像A的第i个像素,Bi是图像B的第i个像素,N是涉及的像素的数目,理想情况下MS(AB)的值为0。
2)互信息。交互信息测量一个随机变量(一幅图像中的图像亮度)传递给另外一个随机变量多少信息,交互信息以熵的形式定义为

式中,H(A)是随机变量A的熵,H(A,B)是A和B的联合熵。
互信息定义为

1.2.4.2 仿射配准
仿射变换的效果是将直线映射为直线,保持直线之间的平行性,可以实现图像的平移、旋转、剪切与缩放[17]。因此往往使用仿射变换对图像进行预配准,然后使用形变配准进行全局的精确配准。ITK软件包提供了itk::AffineTransform类实现一个由旋转、缩放、剪切和平移组成的仿射变换。在3D空间上的一点应用仿射变换的效果可表示为

式中,Mij中系数能够表示旋转、各向异性的缩放和修剪,Ti定义了每个维上的平移,Ci是用户设置的旋转中心的坐标。
ITK配准方法中的每个成分都应该先被实例化,每一个配准要素都是通过New()方法创建的,并且通过各自的itk::SmartPointer赋值。定义输入图像的像素类型为float,图像维数为3,定义相似性尺度为itk::MeanSquaresImageToImageMetric,优化器为itk::RegularStepGradientDescentOptimizer,使用默认的线性插值算法,并使用itk::CenteredTransformInitializer初始化中心变换的旋转和平移。
1.2.4.3 B-spline形变配准
B-spline变换是常用的非线性配准算法,能将图像的直线映射为曲线,更合理地描述目标结构的形变和位移。ITK中的 Itk::BSplineDeformableTransform类可以解决变形配准的问题,空间变换后产生一个变形域,域中的变形向量赋值给空间中的每个点。因为BSplineDeformableTransform的参数空间由所有与BSpline网格的结点有关联的变形集合构成,因此配准精度随网格控制点分辨率的增加而增加,本实验设置B-splined网格结点大小为5×5。
1.2.5 STAPLE算法实现图像融合
STAPLE 算法的目标是利用函数f(D,Tr|p,q)的似然函数估计性能水平参数(p,q)。f(D,Tr|p,q)的最大化实现了参数(p,q)的最优值[22],可表示为
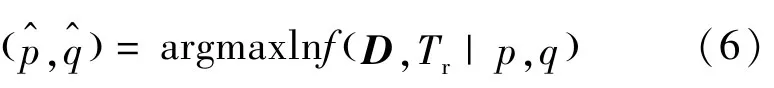
式中:D为N×R的矩阵,表示图谱对应的标记图像的每个像素在每个分割中的结果;R为标记图像的数量;N为每个图像的体素个数;Tr表示用于与分割结果进行对比的人工分割的参考图像。
1.2.6 统计学处理
为减少不同的头颅体积对测量数据的影响,对所测的7对核团体积进行标准化处理,即Vs=Vi·Va/Vh。Vs为标准化后的核团体积,Vi为原始测量的核团体积,Va为平均颅腔体积,Vh为个体颅腔体积。
采用SPSS 21.0统计分析软件,完成数据处理、统计分析。对本研究算法与FIRST算法测得的7对核团体积进行左右侧比较,以及对本研究算法测得的核团体积进行AD患者与健康对照组之间的比较。比较均采用两样本t检验统计方法,以P<0.05差异有统计学意义。
2 结果
2.1 提取脑组织
图4(a)显示了两例分别用直方图分析法和BET工具提取脑组织的图像。可见,对于第1例图像,直方图分析法剥脑后得到的脑组织更加完整,轮廓更加圆滑。而对于第2例图像,BET工具的剥脑精度明显不及直方图分析法,与大脑连着的颈部组织并不能剔除,存在欠分割现象。图4(b)为用户操作界面,分为载入图像、保存图像、参数设置、显示等模块。参数的默认设置为A1=0.7,A2=0.3,r1=3,r2=7,实验中采用的是默认参数设置。
2.2 ITK三维配准
图5显示了图谱图像配准到待分割图像的效果。未配准前,由于两幅图像间的差异大,因此不能显示在同一图像空间。图5(c)显示了经仿射配准后的图像(彩色部分)与原图像之间的差异,可以看出,图像整体上已经被配准到待分割图像的空间,只是边缘轮廓部分未完全匹配,而再经过形变变换更加精细的配准后,图谱与原图像完全贴合,包括边缘部分(见图5(d))。
2.3 图像融合
采用STAPLE算法进行图像融合,得到最终的皮质下核团结构的分割,其结果如图6所示。其中,(a)中的10幅图像分别代表10个图谱配准到目标图像得到的label图像,(b)是10幅图像经融合后得到的分割图像,(c)是使用FSL-FIRST工具分割同一例图像得到的核团结构。图中只显示了丘脑、壳核和尾状核核团,由于角度原因,其他核团没有显示。
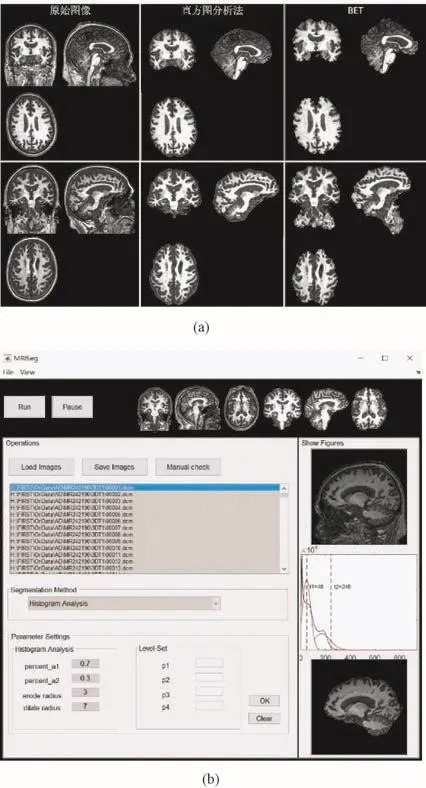
图4 预处理结果。(a)直方图分析法和BET对相同图像的脑提取效果对比;(b)提取脑组织的用户操作界面Fig.4 Result of pre-processing.(a)Comparison of brain tissue extraction on the same images between histogram analysis and BET;(b)User interface for brain tissue extraction
2.4 算法评估
表1显示了本研究算法和FIRST算法所测7对核团体积的统计学比较。除了双侧尾状核外,两种分割算法在其余6对核团体积经t检验统计学方法比较,均无显著统计学差异(P>0.05)。将本算法应用于AD患者和健康对照组,其t检验比较结果如表2所示(30例AD患者和30例健康对照组在年龄、性别上没有统计学差异),这30例AD患者在右侧伏核和双侧海马上均发现体积显著减少(P<0.05)。

图5 图像配准结果。(a)配准前的待分割图像;(b)配准前的图谱图像;(c)仿射配准后的图像与原图像的叠加显示;(d)形变配准后的图像与原图像的叠加显示。Fig.5 Result of image registration.(a)Target image before registration;(b)Atlas image before registration;(c)Image after affine registration is overlay displayed on the original image;(d)Image after deformation registration is overlay displayed on the original image
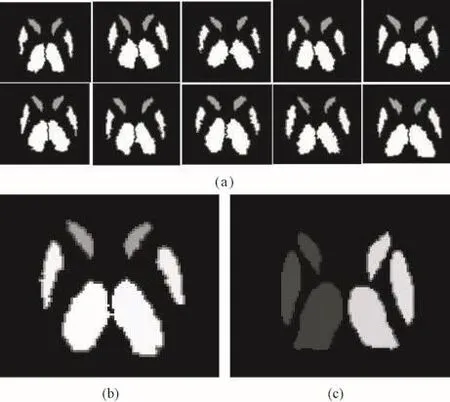
图6 图像分割结果。(a)Label图像;(b)本算法分割的核团;(c)FSL-FIRST算法分割的核团Fig.6 Result of image segmentation.(a)Label images;(b)Segmentation of subcortical structures in our study;(c)Segmentation of subcortical structures using FSL-FIRST algorithm

表1 本算法和FIRST算法所测核团体积的组间差异Tab.1 Group differences of volumes of 7 pairs structures between our algorithm and FIRST algorithm
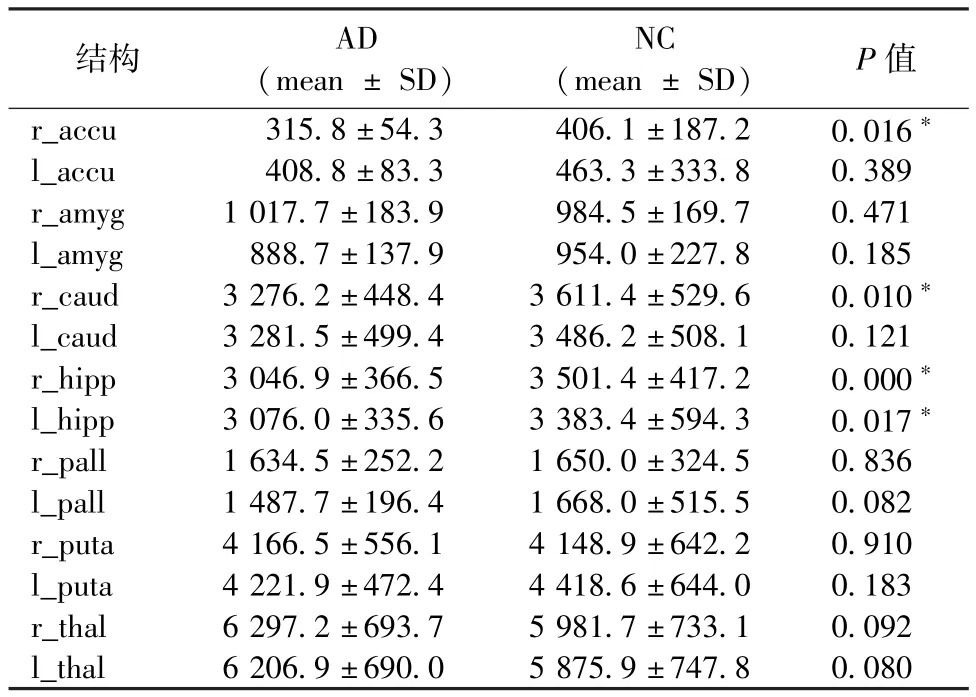
表2 AD患者与健康对照组的7对核团体积的组间差异Tab.2 Group differences of volumes of 7 pairs structures between AD patients and normal controls
3 讨论和结论
过去对AD疾病的结构学测量一般是基于感兴趣区域的测量方法。然而,这种方法需要人工勾画感兴趣区,不仅费时费力,而且要求勾画者具有较高的影像学和解剖水平。由于操作人员个人主观因素的影响,不同人勾画出的感兴趣区也存在客观性误差。由于以上原因,近年来,学者们趋于采用自动分割方法进行AD疾病的结构学测量,其中使用最广泛的工具是FIRST。
FIRST是一种强大的自动分割三维结构MR图像中皮质下核团结构的工具。研究人员证实,FIRST的分割结果与手动分割结果相当一致,各核团体积间并无统计学差异[23]。学者们使用FIRST进行海马等结构的体积测量,并且得到了良好的结论[6,8-9]。然而,FIRST 对图像对比度要求较高,在预处理阶段,对某些图像的处理达不到预期要求(见图4(a)),导致之后的分割结果不理想。另外,FIRST工具是基于Linux系统开发的,一切操作依靠于命令行代码,对于医师来说,操作上存在一定困难。
本研究提出的算法基于Windows操作系统,采用基于ITK多图谱配准算法分割皮质下的结构。基于图谱配准的分割方法是一种强大的自动分割算法,被广泛应用于图像中复杂结构的分割。根据选择的图谱数量,可分为基于单图谱、基于平均形状图谱和基于多图谱配准的分割3种。基于多图谱配准的分割方法由于图谱数量增加,可在一定程度上减少分割结果的误差,其被证明对克服不同个体的差异性、降低图谱选择的不确定性有更好的效果,分割精度更高。在本实验中,基于ITK多图谱配准算法和FIRST算法在双侧伏核、杏仁核、海马、苍白球、壳核和丘脑的体积测量上经t检验比较无显著统计学差异(P>0.05);另外,30例AD患者在右侧伏核和双侧海马上均发现体积显著减少(P<0.05)。
海马在空间导航、语义和情景记忆中起着非常重要的作用。众多研究表明,海马萎缩与AD患者的记忆障碍息息相关。最近的研究表明,在AD患者中,海马的CA1亚区出现明显的萎缩,尤其是在以后会转变成AD的轻度认知障碍患者中[24]。除了海马外,伏核参与了学习和执行功能的信息整合,并且与动机、奖励和厌恶等认知处理紧密相关。伏核是纹状体的一部分,其与海马和杏仁核的边缘结构和前额叶皮层具有密切联系。学者们发现,晚发性AD患者的伏核体积会出现显著减少[25],但是伏核在认知功能下降中的作用还有待研究。
本研究通过对AD患者的7对核团结构的体积分析,得出双侧海马和右侧伏核均出现显著萎缩。结果表明,海马和伏核的结构变化能作为区分AD和正常老年人的一种客观性指标。从De Jong等的研究发现,AD患者的海马较轻度认知障碍者明显萎缩,这与本研究的结果是一致的[6]。综合这种体积指标和其他研究报道的识别AD的敏感指标,未来可构建更为有效的计算机辅助诊断系统。
关于大脑皮质下核团结构萎缩模式的研究一直是AD疾病研究领域的热点,因此分割出脑部核团结构至关重要。本研究提出了利用基于ITK配准框架的多图谱分割方法,结合STAPLE融合策略,对与AD疾病息息相关的7对皮质下核团结构进行分割,得到的分割结果与被广泛使用的FIRST算法的结果较为一致(双侧尾状核除外)。实验结果表明,基于ITK配准框架的多图谱分割方法能有效应用于大脑深部复杂结构的分割问题中。本研究的局限性在于仅仅研究了各核团结构的体积变化,而没有对核团的形态变化做出分析,这也将是下一步工作的研究方向。
[1] Burns A,Iliffe S.Alzheimer’s disease [J].BMJ,2009,338:b158.
[2] Mucke L.Neuroscience:Alzheimer’s disease[J].Nature,2009,461(7266):895-897.
[3] 罗竹人,申宝忠,王丹,等.MR脑图像海马自动分割法在AD早期诊断中的应用研究 [J].现代生物医学进展,2012,1:80-86.
[4] Herrero MT,Barcia C,Navarro JM.Functional anatomy of thalamus and basal ganglia[J].Childs Nerv Syst,2002,18(8):386-404.
[5] Rugg MD,Yonelinas AP. Human recognition memory:a cognitive neuroscience perspective[J].Trends in Cognitive Sciences,2003,7(7):313-319.
[6] De Jong LW,Van der Hiele K,Veer IM,et al.Strongly reduced volumes of putamen and thalamus in Alzheimer’ s disease:An MRI study[J].Brain,2008,131(12):3277-3285.
[7] Pievani M,Bocchetta M,Boccardi M,et al.Striatal morphology inearly-onset and late-onset Alzheimer’ s disease:a preliminary study [J].Neurobiology of Aging,2013,34(7):1728-1739.
[8] Hilal S,Amin SM,Venketasubramanian N,et al.Subcortical Atrophy in Cognitive Impairment and Dementia[J].Journal of Alzheimer’s Disease,2015,48(3):813-823.
[9] Jiji S,Smitha KA,Gupta AK,et al.Segmentation and volumetric analysis of the caudate nucleus in Alzheimer's disease[J].European Journal of Radiology,2013,82(9):1525-1530.
[10] Zarei M,Patenaude B,Damoiseaux J,et al.Combining shape and connectivity analysis:An MRI study of thalamic degeneration in Alzheimer’s disease[J].Neuro Image,2010,49(1):1-8.
[11] Tu Zhouwen,Katherine LN,Piotr D,et al.,Brain anatomical structure segmentation by hybrid discriminative/generative models[J].IEEE Transactions on Medical Imaging,2008,27(4):1-14.
[12] Wang J,Vachet C,Rumple A,et al.Multi-atlas segmentation of subcortical brain structures via the AutoSeg software pipeline[J].Frontiers in Neuroinformatics,2014,8:1-11.
[13] Liu CY,Iglesias JE,Tu Zhouwen.Deformable templates guided discriminative models for robust 3D brain MRI segmentation[J].Neuroinformatics,2013,11(4):447-468.
[14] 陈雯艳.基于ROI多图谱配准的海马磁共振图像分割 [D].长沙:湖南大学,2012.
[15] 胡昊.基于多图谱配准的海马体自动分割方法研究[D].广州:南方医科大学,2014.
[16] Landman B,Warfield S.MICCAI 2012 Grand Challenge and Workshop onMulti-Atlas Labeling [M].Nice:Create Space Independent Publishing Platform,2012.
[17] Hans JJ,Matthew MM,Luis Ibáñez,et al.The ITK Software Guide[EB/OL].http://itk.org,2015-07-03/2016-10-08.
[18] Asman A,Landman B.Non-local statistical label fusion for multiatlas segmentation [J].Med.Image Anal,2013,17(2):194-208.
[19] Jenkinson M,Beckmann CF,Behrens TEJ,et al.FSL [J].Neuro Image,2012,62(2):782-790.
[20] Smith SM.Fast robust automated brain extraction[J].Human Brain Mapping,2002,17(3):143-155.
[21] Balan AGR,Traina AJM,Ribeiro MX,et al.,Smart histogram analysis applied to theskull-stripping problem in T1-weighted MRI[J].Computers in Biology and Medicine,2012,42(5):509-522.
[22] Warfield SK,Zou KH,Wells WM.Simultaneous truth and performance level estimation(STAPLE):An algorithm for the validation of image segmentation [J].IEEE Transactions on Medical Imaging,2004,23(7):903-921.
[23] Nugent AC,Luckenbaugh DA,Wood SE,et al.Automated subcortical segmentation using FIRST:Test-retest reliability,interscanner reliability,and comparison to manual segmentation[J].Human Brain Mapping,2013,34:2313-2329.
[24] Tang X,Holland D,Dale AM,et al.The diffeomorphometry of regional shape change rates and its relevance to cognitive deterioration in mild cognitive impairment and Alzheimer's disease[J].Human Brain Mapping,2015,36:2093-2117.
[25] Pievani M,Bocchetta M,Boccardi M,et al.Striatal morphology inearly-onset and late-onset Alzheimer's disease:A preliminary study [J].Neurobiology of Aging,2013,34(7):1728-1739.
Multi-atlas Segmentation of Brain Subcortical Structures Based on ITK Registration Framework
Nie Xiuling1Liu Renyuan2Lu Jiaming2Zhang Bing2Sun Yu1Wan Suiren1#∗
1(Lab of Medical Electronics,Southeast University,Nanjing210096,China)
2(Department of Radiology,Drum Tower Hospital Affiliated to Nanjing University Medical School,Nanjing210008,China)
Numerous studies indicated that the process of Alzheimer's disease(AD)was closely correlated with atrophy of subcortical structures.Atrophy of some subcortical structures like hippocampi,could be a biomarker of early diagnosis of AD,which makes the segmentation of subcortical structures very important.Based on 3DT1W-MR images of 30 AD and 30 normal controls,we firstly performed brain tissue extraction combining histogram analysis and three-dimensional morphological processing method,then registered 10 brain atlas to the preprocessed image based on ITK registration framework.A two-stage images registration was applied to register multiple atlas on the subject MR scan.First,we applied affine registration with mean squares as metric.Second,B-spline transform based on mutual information model was applied to further registration.In the twostage registration method,linear interpolation model and the optimizer named regular step gradient descent were used.After registration,STAPLE algorithm was achieved to perform image fusion on the obtained 10 registered images to get the final segmented image.The results show that all volumes of subcortical structures except caudate show no statistical differences between our method and FSL-FIRST algorithm(P>0.05);bilateral hippocampus and right nucleus accumbens suffer atrophy in AD(P<0.05).Our experimental data shows the validity of the multi-atlas-based segmentation method on segmentation of the brain subcortical structures.
subcortical structure;multi-atlas segmentation;image registration;ITK
R318 文献标志码:A 文章编号:0258-8021(2017)05-0529-07
10.3969 /j.issn.0258-8021.2017.05.003
2016-12-23,录用日期:2017-03-17
∗通信作者(Corresponding author),E-mail:srwan@seu.edu.cn

