急性分离的脊髓腹角神经元膜片钳记录技术
(皖南医学院 细胞电生理研究室,安徽 芜湖 241002)
·基础医学·
急性分离的脊髓腹角神经元膜片钳记录技术
高凌云, 张环环, 查盈盈, 郑 超, 汪萌芽
(皖南医学院 细胞电生理研究室,安徽 芜湖 241002)
目的:建立急性分离的脊髓腹角神经元膜片钳记录技术以深入研究脊髓腹角神经元上受体的作用。方法选用6~11 d的新生SD大鼠,麻醉后分离出含腰骶膨大的脊髓,制备切片,给予酶消化,切除背角,将腹角吹打分离出单细胞,进行膜片钳记录。结果①分离的腹角神经元形态良好,胞体呈纺锤形、三角形和多边形伴多条细长突起;②7个神经元记录到自发动作电位,其细胞电生理特性为:静息电位(-61.88±16.70)mV;阈电位(-47.39±8.02)mV;锋电位幅值(55.79±17.17)mV;超射(8.39±7.70)mV;放电频率(13.54±9.97)Hz;③7个神经元给予1 mmol/L谷氨酸诱发电流幅值(324.56±90.54)pA,翻转电位(19.43±12.10 )mV;8个神经元给予2 mmol/L尼古丁诱发电流幅值(296.91±77.44)pA,翻转电位(29.06±14.88)mV。结论急性分离脊髓腹角神经元膜片钳记录技术切实可行,可用于脊髓腹角神经元相关调质或药物的作用机理研究。
脊髓;急性分离;腹角神经元;膜片钳记录;新生大鼠
作为中枢神经系统的一部分,脊髓是感觉、运动神经冲动传导的重要通路,其内部的上、下行纤维束构成脊髓与高级中枢功能联系的结构基础。而运动功能的实现,有赖于脊髓腹角运动神经元引起肌肉活动。因此,深入系统地研究脊髓腹角神经元的形态和功能,将有助于进一步阐明运动的发生机制。既往已有急性分离脊髓腹角神经元的报道[1-2],但由于缺乏功能研究,尚不能明确分离的腹角细胞的健康水平以及是否适合开展深入的科学研究,因而有必要进一步探索和改进脊髓腹角细胞的分离技术。通过反复摸索,我们建立脊髓腹角神经元急性分离结合膜片钳记录技术,进一步优化分离细胞的方法,提高实验效率和可靠性,为开展更深入的功能研究奠定基础。
1 材料与方法
1.1 实验动物 6~11 d的新生SD大鼠,雌雄不拘,由南京市江宁区青龙山动物繁殖场提供。动物许可证号码 SCXK(苏):2017-0001。
1.2 溶液及药品 配制人工脑脊液 ( Artificial Cerebral Spinal Fluid,ACSF) ,配方(mmol/L)[3]:NaCl 124.0;NaHCO324.0;KCl 5.0;KH2PO41.2;CaCl22.4;MgSO41.3;Glucose 10.0;通混合氧(95% O2+5% CO2)使pH至7.4。配制标准细胞外液,配方(mmol/L)[3]:NaCl 150.0;KCl 5.0;MgCl21.0;CaCl22.0;HEPES 10.0;Glucose 10.0;用Tris-base调节pH至7.4。配制电极内液,配方(mmol/L)[4]:K-gluconate 120.0;KCl 20.0;MgCl22.0;EGTA 0.5;HEPES 20.0;Na2-ATP 2.0;Na-GTP 0.5;用KOH调节pH至7.4,并调节渗透压至290~300 mOsm/(kg·H2O),最后用滤头(Millex GV filter unit,0.22 μm)过滤后,-20℃冷冻保存。烧制琼脂:4.0 g琼脂粉溶于80 mL ACSF中,煮沸,倒入培养皿,冷却后冷藏备用。配制实验所需药品的母液:0.5 mol/L尼古丁(Nicotine,Nic),1.0 mol/L 谷氨酸(Glutamate,Glu),冷藏备用。上述HEPES、Tris-base、K-gluconate、EGTA、Na2-ATP、Na-GTP、Nicotine、Glutamate均购自SIGMA公司;普通试剂购自国药集团化学试剂有限公司。配液用水均为超纯水(Purelab Flex,ELGA LabWater,UK)。使用玻璃微电极毛坯(Sutter Instrument, Inc., USA),借助微电极拉制仪(WD-2型,成都仪器厂),拉制实验所需的微电极,灌注电极内液后,入液电阻为5~10 MΩ。
1.3 制备脊髓切片 预先冷冻适量ACSF(形成冰水混合物)用作切片液,常温下准备适量ACSF用作孵育液(预通混合氧)和适量标准细胞外液(预通纯氧);准备乳鼠手术器械(深圳市瑞沃德生命科技有限公司)、振荡切片机(Vibratome,Technical Products International Inc.,USA)等,切片机浴槽内充以碎冰,保证低温环境;从烧制成形的琼脂上切出一块立方体(1.3 cm3),并在一个侧面上切出一条垂直凹槽,冷藏。将麻醉后的乳鼠以俯卧位固定于自制的泡沫手术台上,剪开皮肤,暴露脊柱;用剃须刀片沿脊柱两侧划开软组织、切断神经根;然后剪开椎管,暴露脊髓,游离出含腰骶膨大的部分,并在ACSF冰水混合物中(通混合氧),修剪残留的神经根。再用超能胶水(Pattex,汉高粘合剂有限公司)将脊髓尾端朝上背侧固定于琼脂块的凹槽中,再将琼脂块(脊髓正对刀片方向)固定于浴碟中央,加入ACSF冰水混合物,继续通混合氧;用震荡切片机将腰骶膨大部切成400~500 μm的薄片,置于常温ACSF中复温,通混合氧,孵育1 h。
1.4 酶消化处理 将脊髓切片移入含酶溶液(Papain,0.18 g/30 mL ACSF)的烧杯中,并置于恒温水浴箱内33℃通氧消化20~35 min。待消化完成,将脊髓切片转入常温ACSF孵育40 min;之后,借助体视显微镜,以中央管为界切去双侧背角;用自制的不同口径的巴斯德吹管,按由大到小的顺序,在含标准细胞外液(预通纯氧40 min)的培养皿(35 mm×10 mm, Corning, NY, USA)中轻柔地机械吹吸腹角切片,直至切片分散成单细胞;静置,待细胞贴壁后备用。
1.5 快速给药系统 本实验采用的是重力排管快速给药系统(SF-77B Perfusion Fast-step,Warner Instrument Corporation,USA),实验时先用一定量的标准液排出所有给药管中的空气,以实现通畅;然后将工具药(Glutamate、Nicotine等)用标准液稀释成所需浓度,加至相应给药管中;标准液加至冲洗管中,备用。
1.6 膜片钳记录 依次打开不间断电源(UPS,SANTAK)、电脑、倒置显微镜(Leica DMI 3000 B,Germany)、微操纵仪(MP-225,Sutter Instrument, Inc.,USA)、恒流泵、数模转换器(Axon Instrument, Inc., USA)、放大器(Axon Instrument, Inc., USA)等设备预热,后打开Multiclamp 700B和Clampex 10.6记录软件。将含分离细胞的培养皿放置于倒置显微镜下观察,找到形态良好、健康的腹角神经元后,移入视野中央;在低倍镜下调整给药管口于细胞附近,冲洗管口正对细胞胞体。取拉制成形的电极,灌注内液,安装电极,调节微操纵仪使电极尖端入液,检测电极电阻,若在5~10 MΩ,补偿失调电位。镜下缓慢调节微操纵仪,将电极尖端移至细胞上方,缓慢下移触碰细胞,给予适量负压吸引,使电极电阻上升直至GΩ封接,并给予电极电容补偿。在电流钳模式下,记录自发动作电位等;给予负压配合ZAP破膜后,在I=0模式下记录静息电位(resting potential,RP);观察接入电阻Ra等参数,当Ra<20 MΩ,适用于全细胞电压钳记录(whole-cell voltage clamp recording),并给予细胞电容补偿。在电压钳模式下,通过快速给药系统给予谷氨酸受体激动剂Glu和N型乙酰胆碱受体激动剂Nic,记录所钳制神经元的电流变化。在此基础上,从静息电位开始,由负及正分别给予不同钳制电位(VH:-60~40 mV),记录电流反应的变化,直至电流翻转。
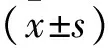
2 结果
2.1 新生大鼠急性分离的脊髓腹角神经元形态 采用上述方法分离脊髓腹角神经元,待细胞贴壁后,置于倒置显微镜载物台上,在高倍镜下找到形态良好的神经元进行膜片钳记录,并拍摄照片(图1)。分离的神经元胞体较大(长径>30 μm;短径>20 μm),呈纺锤形、三角锥形或多角形,边缘光整;神经元的突起从极端发出,形态较为完整,具有分支。拉制的玻璃微电极尖端能较好地接触所分离的神经元,并进行封接和记录。
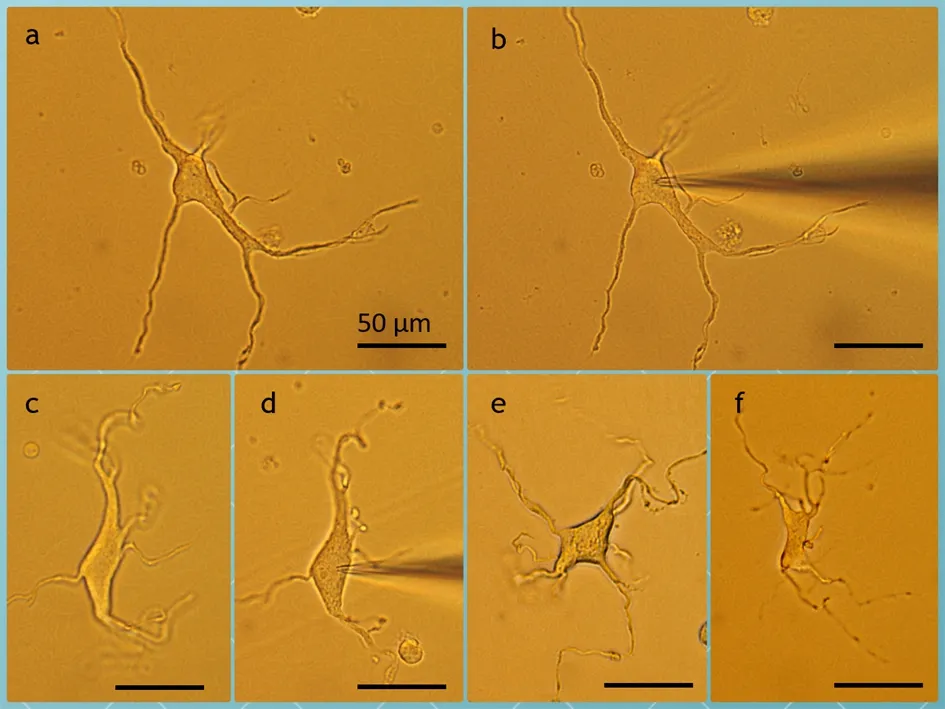
a.胞体呈纺锤形的神经元,从极端发出四条突起,并有分支;b.玻璃微电极尖端钳制于a细胞;c.胞体呈菱形的神经元;d.玻璃微电极尖端钳制于c细胞;e.胞体呈菱形的神经元,四角分别有突起向外延伸;f.胞体呈四角形的神经元,突起较多。图中所有标尺均为50 μm。
图1 新生大鼠急性分离的脊髓腹角分离神经元形态照片
2.2 分离的脊髓腹角神经元自发动作电位 选择如上形态良好的腹角神经元,进行膜片钳记录。当玻璃微电极与细胞膜高阻封接后,在电流钳模式下,记录了7个神经元的自发动作电位,测量细胞电生理参数,结果见表1。在对记录的自发放电分析中,我们发现腹角神经元的放电频率和幅值有不同的模式(图 2),图2A和2B显示一种神经元的放电模式,幅值较大( >65 mV),频率较低 (11 Hz);图2C和2D显示另一种神经元的放电模式,幅值较小(<50 mV),频率较高(20 Hz)。
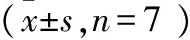
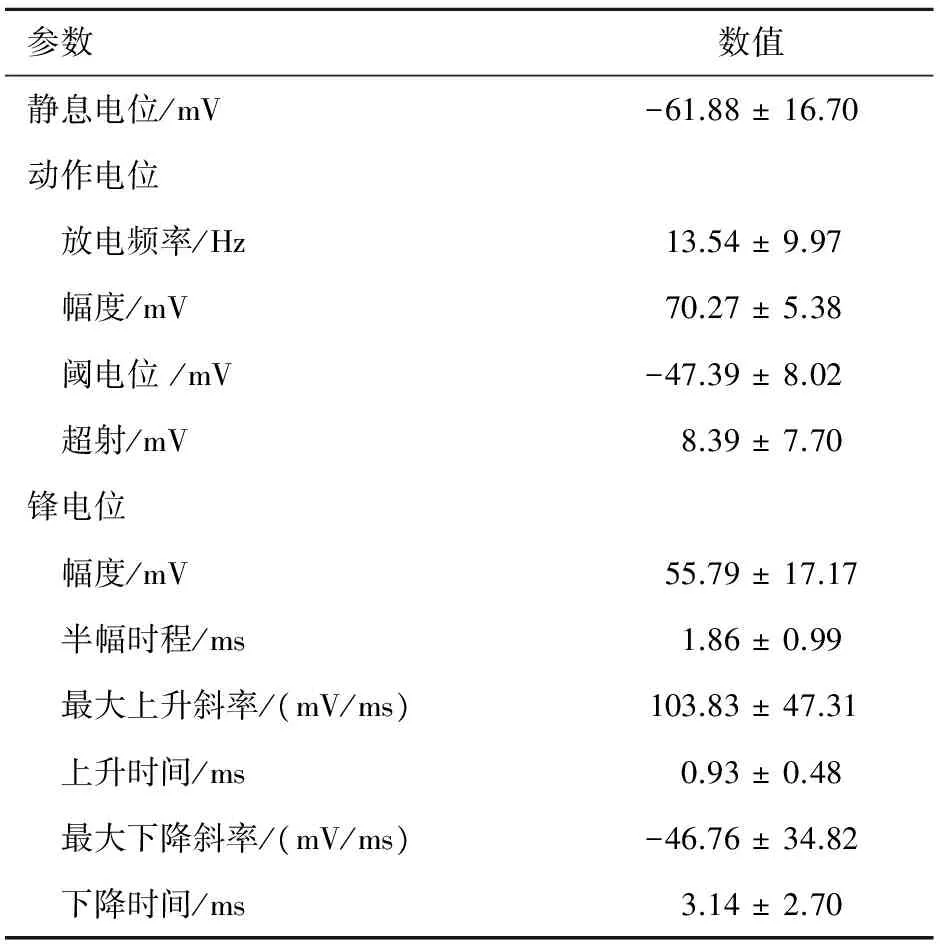
参数数值静息电位/mV-61.88±16.70动作电位 放电频率/Hz13.54±9.97 幅度/mV70.27±5.38 阈电位/mV-47.39±8.02 超射/mV8.39±7.70锋电位 幅度/mV55.79±17.17 半幅时程/ms1.86±0.99 最大上升斜率/(mV/ms)103.83±47.31 上升时间/ms0.93±0.48 最大下降斜率/(mV/ms)-46.76±34.82 下降时间/ms3.14±2.70
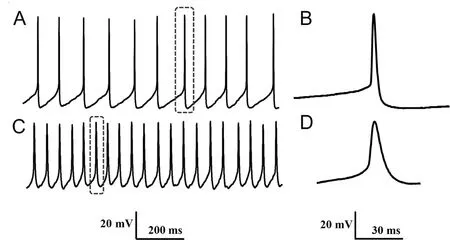
A和C分别为两例神经元在1 s内的自发放电;全细胞电流钳模式下RP分别为-64.16 mV和-46.35 mV。B和D分别为A和C相应放大后的单个动作电位。
图2 新生大鼠脊髓腹角分离神经元的自发动作电位
2.3 谷氨酸、尼古丁在脊髓腹角分离神经元诱发的全细胞电流及翻转电位 如图 3显示,对每一例神经元记录的反应结果进行分析,7个神经元给予1 mmol/L谷氨酸诱发的全细胞电流平均幅值为(324.56±90.54) pA,平均翻转电位为(19.43±12.10)mV;8个神经元给予2 mmol/L 尼古丁诱发的全细胞电流平均幅值为(296.91±77.44) pA,平均翻转电位为(29.06±14.88) mV。
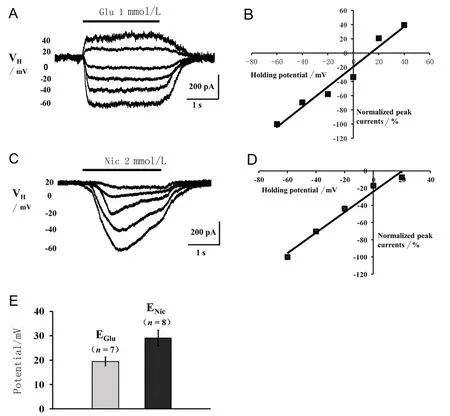
A.在不同钳制电位下(-60~40 mV),谷氨酸诱发的系列全细胞电流,RP=-63.14 mV;B.根据图A作出I-V拟合线,其与X轴的交点为谷氨酸电流翻转电位13.60 mV;C.不同钳制电位下(-60~20 mV),尼古丁诱发的系列全细胞电流,RP=-61.24 mV;D.对应C作出I-V拟合线,与X轴的交点为尼古丁电流翻转电位20.09 mV;E.脊髓腹角神经元谷氨酸、尼古丁电流翻转电位的统计图。
图3 分离的典型腹角神经元谷氨酸或尼古丁诱发的全细胞电流及其翻转电位
3 讨论
尽管已有通过酶消化结合机械吹打来进行中枢神经元分离的报道[1-2,5-8],并有初步电生理实验结果,但多见于海马神经元分离和电生理记录[1-2,6,8],而脊髓腹角神经元的分离技术仅有少量形态学实验的报道,缺乏功能研究[1-2];我们实验中记录的细胞形态(图1)与报道的基本一致[1-2],另有胞体呈现纺锤形、三角形或多边形;突起从极端向外延伸,发出分支,并被较为完整的分离保留,提示我们分离的细胞形态更加健康,适合开展功能研究。以往的文献报道使用不同的消化酶处理各类神经元[9-13],为了分离出健康的脊髓腹角神经元,我们首先沿用实验室长期制备脑片的经验,制备脊髓腰骶部切片,在酶消化中,我们应用papain(木瓜蛋白酶),它是一种蛋白水解酶,作用迅速,消化时间短,对神经元伤害小。而早先的文献报道[1]使用胶原蛋白酶和链霉蛋白酶联合消化,时间超过1 h。此外,我们也曾使用papain处理大鼠视网膜分离出神经节细胞和无长突细胞,并开展相关调质作用的胞内信号转导机制研究[14],效果颇好。最后我们使用抛光的巴斯德管机械吹打,打散细胞间的连接,分解细胞外基质,最终得到分离的单细胞。更重要的是,通过此方法获得的单细胞能保持原有的形态学和电生理特性,使得电生理实验结果更加真实可靠。近年来,由于细胞培养技术的建立,采用培养的神经元开展电生理研究的报道屡见不鲜,如采用培养的胚胎大鼠及成年大鼠脊髓运动神经元进行膜片钳记录[15-16]。虽然培养的细胞状态较好,但是有学者认为培养的细胞不同于在体状态,其形态、功能等方面在外界环境的影响下,可能发生变化,而急性分离的神经元却能保持相对完好的生理特性[5,9-10],因而更适合进行功能研究。
现阶段,离体的膜片钳记录根据应用的标本不同,主要分为脑片(slice)膜片钳和分离细胞(单细胞)膜片钳两种。利用脑片膜片钳记录开展脊髓腹角神经元的研究已有报道[17-18],而在急性分离的脊髓腹角神经元结合膜片钳研究尚未见报道,其可能原因为:脊髓腹角神经元特别是运动神经元较为脆弱,耐缺氧能力差,胞体较大,经过酶解消化和机械吹打后,细胞状态一般比较差,不太适合作功能研究。而我们的实验结果显示,应用我们的方法急性分离脊髓腹角神经元并开展膜片钳实验,在大多数腹角神经元上可以记录到自发动作电位(图 2),其电生理参数(表1)与本实验室传统的细胞内记录研究结果以及培养的运动神经元自发放电参数基本一致[15,18-19],自发动作电位连续而稳定,基本上皆有超射,提示分离的腹角神经元状态良好。此外,我们对分离的腹角神经元给予谷氨酸或尼古丁,皆可记录到稳定的全细胞电流(图3),这也与相关研究结果[16-18]基本一致。我们利用记录到的谷氨酸或尼古丁诱发的全细胞电流还进行了翻转电位等研究,这些皆证实我们设计的方法具有可行性、可靠性。但从图 2的实验结果来看,新生大鼠脊髓腹角神经元的自发放电模式不止一种,提示分离的细胞中存在不同类型的神经元。后期,根据文献[20-21],我们将采用荧光试剂逆行标记的方法,鉴定出脊髓运动神经元,以便专一地研究运动神经元在运动控制中的作用及其机制。当然,分离细胞膜片钳记录技术也有其局限性,通过酶解分离的细胞已不具有突触前成分,因而不适合突触前机制的研究,在今后的工作中,可以结合脑片膜片钳或细胞内记录技术来联合开展脊髓腹角突触传递的系统研究,更全面深入地揭示脊髓运动控制的机制。
【参考文献】
[1] KANEDA M, NAKAMURA H, AKAIKE N. Mechanical and enzymatic isolation of mammalian CNS neurons[J]. Neurosci Res, 1988, 5(4): 299-315.
[2] KAY AR, WONG RK. Isolation of neurons suitable for patch-clamping from adult mammalian central nervous systems[J]. J Neurosci Methods, 1986, 16(3): 227-238.
[3] YANG CX, ZHANG XB, GONG N,etal. Differential effects of thiopental and pentobarbital on spinal GABA(A) receptors[J]. Neurochem Res, 2008, 33(10): 2159-2165.
[4] ZHANG Y, XIAO X, ZHANG XM,etal. Estrogen facilitates spinal cord synaptic transmission via membrane-bound estrogen receptors: implications for pain hypersensitivity[J]. J Biol Chem, 2012, 287(40): 33268-33281.
[5] 李从德,陆永利,周敏,等. 以膜片钳技术急性分离新生大鼠尾核神经元[J]. 中国组织工程研究与临床康复,2009,13(37):7322-7325.
[6] LI XM, LI JG, YANG JM,etal. An improved method for acute isolation of neurons from the hippocampus of adult rats suitable for patch-clamping study[J]. Acta Physiol Sin, 2004, 56(1): 112-117.
[7] 杨雷,李玉荣,苏莉芬,等. 大鼠皮层神经元急性分离改良方法[J]. 哈尔滨医科大学学报,2005,39(3):285-287.
[8] 李刚,程立君,林凌,等. 小鼠海马神经元急性分离和膜片钳技术的应用[J]. 天津大学学报,2008,41(10):1157-1161.
[9] YANG K, HU J, LUCERO L,etal. Distinctive nicotinic acetylcholine receptor functional phenotypes of rat ventral tegmental area dopaminergic neurons[J]. J Physiol, 2009, 587(2): 345-361.
[10] CHO JH, CHOI IS, NAKAMURA M,etal. Proton-induced currents in substantia gelatinosa neurons of the rat trigeminal subnucleus caudalis[J]. Eur J Pharmacol, 2015, 762: 18-25.
[11] LEO M, ARGALSKI S, SCHAFERS M,etal. Modulation of Voltage-Gated Sodium Channels by Activation of Tumor Necrosis Factor Receptor-1 and Receptor-2 in Small DRG Neurons of Rats[J]. Mediators Inflamm, 2015,124942.
[12] NAKAMURA M, JANG IS. Acid modulation of tetrodotoxin-resistant Na+channels in rat nociceptive neurons[J]. Neuropharmacology, 2015, 90: 82-89.
[13] GAO DY, ZHANG BL, LEUNG MC,etal. Coupling of TRPV6 and TMEM16A in epithelial principal cells of the rat epididymis[J]. J Gen Physiol, 2016, 148(2): 161-182.
[14] ZHENG C, DENG QQ, LIU LL,etal. Orexin-A differentially modulates AMPA-preferring responses of ganglion cells and amacrine cells in rat retina[J]. Neuropharmacology, 2015, 93: 80-93.
[15] OWENS GC, WALCOTT EC. Extensive fusion of mitochondria in spinal cord motor neurons[J]. PLoS One, 2012, 7(6): e38435.
[16] RECIO-PINTO E, MONTOYA-GACHARNA JV, XU F,etal. Isoflurane, but Not the Nonimmobilizers F6 and F8, Inhibits Rat Spinal Cord Motor Neuron CaV1 Calcium Currents[J]. Anesth Analg, 2016, 122(3): 730-737.
[17] MINE N, TANIGUCHI W, NISHIO N,etal. Synaptic modulation of excitatory synaptic transmission by nicotinic acetylcholine receptors in spinal ventral horn neurons[J]. Neuroscience, 2015, 290: 18-30.
[18] 汪萌芽. 新生大鼠脊髓切片运动神经元的电生理参数测定[J]. 中国应用生理学杂志,1993,9(2):164-167.
[19] 郑超,汪萌芽. 依托咪酯对离体大鼠脊髓运动神经元感觉传入的差异性作用[J]. 中国危重病急救医学,2011,23(10):593-598.
[20] LI HF, WANG MY, KNAPE J,etal. Ethanol tachyphylaxis in spinal cord motorneurons: role of metabotropic glutamate receptors[J]. Br J Pharmacol, 2003, 138(8): 1417-1424.
[21] TAKAHASHI T. Membrane currents in visually identified motoneurones of neonatal rat spinal cord[J]. J Physiol, 1990, 423: 27-46.
Patch-clamprecordingtechniqueforacutelydissociatedspinalcordventralhornneurons
GAOLingyun,ZHANGHuanhuan,ZHAYingying,ZHENGChao,WANGMengya
Cell Electrophysiology Laboratory, Wannan Medical College, Wuhu 241002, China
Objective: To establish a technique of patch-clamp recording of acutely dissociated spinal cord ventral horn neurons for further investigation of roles of diverse receptors on the neurons.Methods: Neonatal SD rats(aged 6 to 11 days) were included and received lumbosacral laminectomy after anesthesia. Then the lumbosacral spinal cord was removed and transverse slices were prepared. Dorsal horn of the slice was cut off after digestion with Papain. Patch-clamp recording was then performed on mechanically dissociated ventral horn neurons.Results: ①Dissociated ventral horn neurons had characteristic morphology with a fusiform, triangular, or polygonal soma and broad dendrites emanating from the poles; ②Electrophysiological parameters for spontaneous firings of the dissociated neurons (n=7)were: resting potential, (-61.88±16.70) mV; threshold, (-47.39±8.02) mV; spike amplitude, (55.79±17.17) mV; overshoot, (8.39±7.70) mV; and firing frequency, (13.54±9.97)Hz; ③The amplitudes of 1 mmol/L glutamate-induced currents recorded in the 7 ventral horn neurons were (324.56±90.54) pA, the average equilibrium potentials (EGlus), (19.43±12.10) mV, whereas amplitudes of 2 mmol/L nicotine-induced currents in the 8 ventral horn neurons were (296.91±77.44) pA, the average equilibrium potentials (ENics),(29.06±14.88) mV.Conclusion: The whole-cell patch-clamp recording technique for acutely dissociated spinal cord ventral horn neurons was successfully established, and this technique can be applied to investigate the receptors and their distributions, classifications and functional mechanisms underlying related modulators or drugs.
spinal cord; acute isolation; ventral horn neuron; patch-clamp recording; neonatal rat
1002-0217(2017)06-0511-05
国家自然科学基金项目(31200828,31271155,81601158);安徽省高校优秀青年人才支持计划项目(gxyqZD2016175,gxyq2017034);皖南医学院博士科研启动基金(rcqd201609)
2017-04-28
高凌云(1991-),女,2015级硕士研究生,(电话)18055382113,(电子信箱)gao-ly@hotmail.com;
郑 超,男,副教授,硕士生导师,(电子信箱)chaozheng10@fudan.edu.cn,通信作者;
汪萌芽,男,教授,硕士生导师,(电子信箱)wangmy@wnmc.edu.cn,通信作者。
R 33-33;R 338.2
A
10.3969/j.issn.1002-0217.2017.06.001

