胶原蛋白的重组微生物发酵生产研究
冷迎慧
(青海大学生态环境工程学院青海西宁810016)
胶原蛋白的重组微生物发酵生产研究
冷迎慧
(青海大学生态环境工程学院青海西宁810016)
胶原蛋白是一种所有的细胞生物都含有和动物体内含量最丰富的蛋白质,应用十分广泛,近几年,人们试图用重组发酵技术生产胶原蛋白,本篇文章对胶原蛋白的结构、功能以及重组微生物发酵工艺等进行了综述。
胶原蛋白;发酵;微生物
胶原蛋白被认为是动物体内含量最高的一类蛋白质,几乎所有的细胞生物都含有胶原蛋白。胶原蛋白广泛存在于皮肤、肌肉、骨骼中,应用广泛。例如可以添加入化妆品、饲料中,可以用于整容手术、临床止血,还可以作为医学生物材料、组织支架材料等。目前胶原蛋白的需求量逐年增加,但是胶原蛋白的提取方法限制了它的大批量生产,采用基因工程的手段,使用发酵工程表达目的基因产物成为解决这一问题的有效措施。
1 胶原蛋白的结构功能及生产
1.1 胶原蛋白的结构。胶原蛋白结构为三股相互缠绕的多肽链组成的长且稳定的三螺旋结构。根据胶原蛋白的三条氨基酸链组合的方式不同,胶原蛋白被分为I、II、III等多种类型,目前已经发现28种[1~3]。蛋白质结构由于其初级结构的组合方式不同导致其呈现不同的形态,进而表现出一些功能不同的生物学性质。早在1951年,美国的Paining便已经阐述了胶原蛋白的结构。麻省理工学院的Buehler在2006年再一次在纳米水平上详解了胶原蛋白的结构[4,5]。据研究,胶原蛋白具有一定的生物活性且不溶于水,因此一般情况下不能被蛋白酶利用,而在酸、碱、高温的条件下,会因为降解而发生性质的改变[6],明胶可以为蛋白酶所利用。
1.2 胶原蛋白的功能。胶原蛋白对哺乳动物来说十分重要且含量多,具有很多生理调节功能。主要包括:①免疫作用。调节人体的免疫力、抗氧化等。②保健作用。降血压、防止贫血等。③美容作用。减肥、促进皮肤代谢等。④助吸收。保护胃黏膜、协助母乳分泌等。⑤其他作用。预防和治疗骨质疏松症、缓解关节疼痛等。有些研究显示,缺少胶原蛋白或蛋白分子缺失会导致人机体性能的改变,导致很多疾病的发生,比如血管基质的动脉粥状硬化、结缔组织遗传性疾病、血管和肾胶原性基底膜的糖尿病、软骨发育不良、奥尔波特综合症、角膜和晶状体异常等。
1.3 胶原蛋白的生产。胶原蛋白的生产一般是直接提取、纯化自动物组织中,大体过程是先去除油脂,再去除杂蛋白,经过析出、纯化等得到胶原蛋白。在很多情况下,单一的提取方法往往得不到预期的效果。提取的方法有:①热水提取法。热水提取法是从动物组织中提取胶原蛋白的最常用的一种方法。②酸、碱、中性盐提取法。酸、碱、中性盐提取法是指原料在酸性、碱性或中性盐环境中破坏其分子间的键和作用力,引起胶原纤维溶解的一种胶原蛋白提取方法。③酶提取法。酶提取法是采用不同的蛋白酶在一定的外界环境条件下对胶原蛋白进行降解,从而将末端肽切割下来,最终把胶原蛋白提取出来的一种方法。
用传统的提取方法提纯出的胶原蛋白存在动物源疾病的风险,制约了胶原蛋白的开发。且传统的提取方法所得到的数量有限,虽然已经有美国和日本依赖全化学合成的手段合成出类胶原蛋白,但因化学合成蛋白质技术复杂、产量少、代价昂贵和难于标准化,目前还不能应用于工业化的生产中,因此,利用基因工程方法生产重组的胶原蛋白就越来越成为现在研究发展的趋势。
2 胶原蛋白在重组系统中的表达
目前许多重组表达系统被应用于人胶原蛋白的重组表达,例如大肠杆菌、酵母、动物细胞、转基因植物和转基因动物等,重组人胶原蛋白的表达情况见表2[7]。
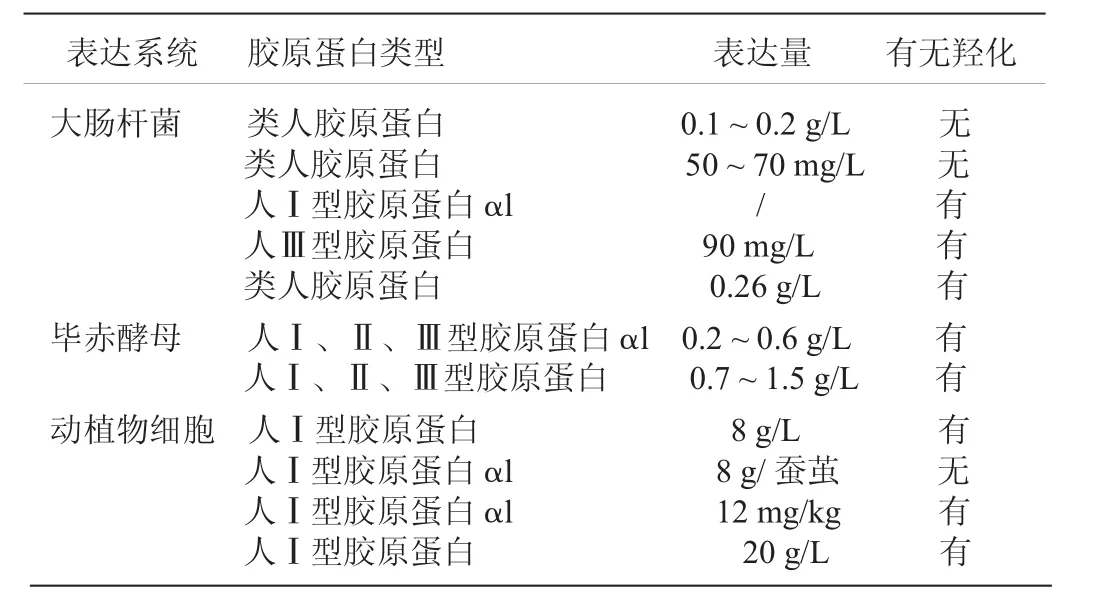
表1 人胶原蛋白在各表达系统中的表达总结
2.1 大肠杆菌系统表达胶原蛋白。应用最广泛的是大肠杆菌表达系统。大肠杆菌表达系统在培养操作上较为简单,菌种生长迅速,表达量较高且生产成本低廉,发酵周期较短,可规模化发酵培养,抗污染能力也强,且该系统包含多种宿主菌和载体,可以适应不同的表达过程。但是,由于大肠杆菌表达属于原核生物,在表达真核蛋白过程中目的蛋白常在胞内形成不溶性的包涵体,不具有生物活性。另外,大肠杆菌表达系统还具有原核表达系统的翻译后的加工修饰体系不完善、产生的致热原使胶原蛋白难以应用于临床等,也使得表达产物的生物活性较低。
2.2 酵母表达系统表达胶原蛋白。鉴于大肠杆菌表达系统的种种缺点,于是引入真核表达系统——酵母表达系统,它能保证胶原蛋白经过工程菌足够的翻译后修饰,包括糖基化、羟基化等。分泌生产的胶原蛋白具有更好的性能,此研究在国内外也已经取得了许多突破性的成果。构建酵母表达系统首先要选择合适的宿主菌。较为常用的酵母表达类型有以下几种:①酿酒酵母。虽然酿酒酵母是最早使用的性状优良的酵母表达系统,但是它存在着质粒不稳定、表达蛋白产量低等缺点。②乳酸克鲁维娅酵母。乳酸克鲁维娅酵母最大的特点就是它是一种安全的微生物表达宿主,可以用来大规模工业生产蛋白。③甲醇营养型酵母。甲醇营养型酵母生长所需的碳源及能源是甲醇,迄今为止应用最为广泛。甲醇营养型酵母中,毕赤酵母表达系统是运用重组生产胶原蛋白的最多的一种。④解脂耶氏酵母。解脂耶氏酵母拥有大量分泌表达蛋白的能力,并且它分泌的蛋白糖基化程度低。⑤栗酒裂殖酵母。栗酒裂殖酵母表达系统最大的优点就是其表达产物形式更贴近于其天然的形式,适用于工业大规模生产应用。
2.3 动植物细胞表达胶原蛋白。利用哺乳动物和昆虫细胞来生产胶原蛋白,被认为是最早采用重组发酵的一种方式。然而,在哺乳动物细胞中的表达水平极低,不足以应用于商业化的生产中。除此之外,细胞发酵培养的生产成本会比大肠杆菌或者酵母表达系统的成本高5~10倍[8]。近十几年的研究,有1998年Nokelainen等构建两株杆状病毒表达系统,共感染昆虫细胞后,成功表达具有稳定三螺旋结构的人胶原蛋白,表达量达到50mg/L。2009年,Eskelin等以大麦种子作为宿主成功表达人源I型胶原的全长α-1链和45-kDa片段,其中45-kDa片段的产量达到150g/hm2,该产量已具有商业应用前景。
3 发酵条件及工艺研究
3.1 重组大肠杆菌发酵研究
3.1.1 重组大肠杆菌发酵的培养方式。可供重组大肠杆菌高密度发酵培养方式的主要有分批发酵、补料分批发酵、连续分批发酵及透析发酵等。这些发酵方式一般情况下会相互结合使用。①分批发酵,是一种相对封闭的发酵方式,只有气体流通,发酵液不流通。在发酵过程中,微生物生长符合细菌生长曲线。②补料—分批发酵,被认为是高密度发酵中效果最好的方法,是在分批发酵过程中添加新鲜料液,发酵过程中发酵液的体积在增加的一种方法。③连续发酵,在发酵过程中发酵液新进旧出,原来的体积保持不变。④透析培养,指的是通过半透膜滤去有害代谢产物,并向培养液中添加新的营养物质的培养方式。
3.1.2 影响重组大肠杆菌高密度发酵的因素。①培养基成分。朱才庆等研究的实验数据表明,在培养大肠杆菌DA19时,在基本培养基中添加混合微量元素更有益于菌体生长。②菌种的质量及接种量。它们会影响菌种在发酵过程中的生长状况。③培养温度是影响细菌生长代谢的关键。一般大肠杆菌的最适生长温度和质粒稳定温度有所不同,故适当地调整培养温度有利于促进大肠杆菌的生长、提高重组产物的表达量、缩短培养周期[9]。④把pH控制在适宜范围内。在发酵过程中,大肠杆菌会产生有机酸等代谢产物,使发酵液酸度增加,这对大肠杆菌生长代谢和表达产物不利,因此必须及时调节pH。⑤溶解氧浓度也是一个重要的影响因素。发酵罐内溶解氧浓度过低会抑制菌体生长,过高则会发生Crebtree效应。
3.2 重组酵母发酵研究。研究最多的是针对于毕赤酵母的高密度发酵。毕赤酵母高密度发酵分为两个阶段。第一阶段为分批发酵阶段,甘油为碳源,直到菌体生长到一定程度。第二阶段是当生长到一定程度的菌体“饥饿”约半小时后开始的,此阶段属于补料—分批发酵阶段,所补的料为甲醇。培养基的组成及各成分的含量直接影响高密度发酵的效果。①对于一些容易被蛋白酶降解的分泌型蛋白,为减少目的蛋白的降解,一般就要使用含有蛋白陈或者酵母粉的培养基。②培养基中营养物质的含量也需要保持在适当的范围内,基质浓度过低菌体得不到充足营养,而达不到高密度发酵的效果,基质浓度过高则有可能抑制目的产物的表达而导致生产效率下降。③优化培养基中的组分及其配比可以满足细胞生长对基质的消耗。刘彦丽等的研究发现PTM1和0.05%的油酸(作消泡剂)能显著提高外源蛋白的表达。④毕赤酵母虽然在pH值一定范围内均可生长,但控制pH值为5.0时菌体生长水平和表达外源蛋白水平都达到最高,pH值超过7时菌体量及表达量均不理想。一般BMM培养基自然状态下的初始pH值为5.5,当pH值在5.0左右改变1个单位或以上,发酵第二阶段目的蛋白的表达量就会受到很大的影响。对pH值的调控主要是通过补加氨水或者盐酸。⑤发酵培养基中溶氧量对好氧菌生长来说也是非常重要的,在发酵过程中可以提供充足的氧气供应,满足生产菌对氧的需求,这也是提高菌体发酵表达量的重要因素之一。⑥温度通过影响酶的活性从而影响发酵。研究表明,当温度超过32℃,毕赤酵母表达胶原蛋白将受到严重影响。
4 发展前景
为了能充分利用胶原蛋白的作用,使胶原蛋白的应用更加广泛,利用现代生物技术重组发酵生产制备胶原蛋白已成为目前的主流。现在来看,虽然微生物发酵生产胶原蛋白取得了一些进展,但还是存在很多问题。且对于产业化而言,优化发酵工艺是一个永恒的话题。相信随着技术的发展,胶原蛋白的生产也会逐步优化。
[1]Sato K,Yomogida K,Wada T,et al.Type XXVI collagen,a new member of the collagen family,is specifically expressed in the testis and ovary[J].Journal of Biological Chemistry,2002,277(40):37678.
[2]MC Gmezguilln,B Gimnez,ME Lpezcaballero,et al.Functional andbioactive properties of collagen and gelatin from alternative sources:A review[J].Food Hydrocolloids,2011,25(8):1813~1827.
[3]王珊珊.结鱼骨胶原肤与活性钙的制备及其抗骨质疏松活性研究[D].青岛:中国海洋大学,2013.
[4]Pauling L,Corey RB.The structure of fibrous proteins of the collagen-gelatin group[J].Proceedings of the National Academy of Sciences of the United States of America,1951,37(5):272~281.
[5]Buehler MJ.Nature designs tough collagen:Explaining the nanostructure of collagenfibrils[J].Proceedings of the National Academy of Sciences of the United States of America,2006,103(33):12285~12290.
[6]王志聪.鳍鱼皮胶原蛋白肤对大鼠胃薪膜的保护作用研究[D].青岛:中国海洋大学,2013.
[7]唐云平,郑强,胡斌,等.重组胶原蛋白制备及其应用研究进展[J].食品工业科技,2016(18):384~387.
[8]Celik E,Calik P.Production of recombinant proteins by yeast cells[J].Biotechnol Adv,2011(2):19.
[9]尹淑琴,范艳,常乱.基因工程菌的高密度发酵研究[J].安徽农业科学,2007,35(11):3175~3176,3192.

