衡阳市女性生殖道无乳链球菌的带菌状况及分子特征
,,, ,,*
(1.南华大学公共卫生学院卫生检验系,湖南 衡阳 421001;2.南华大学附属第一医院检验科)
·基础医学·
衡阳市女性生殖道无乳链球菌的带菌状况及分子特征
柏琴琴1,刘芸槾1,王秋平2,胡倩1,邓仲良1,陈丽丽1*
(1.南华大学公共卫生学院卫生检验系,湖南 衡阳 421001;2.南华大学附属第一医院检验科)
目的了解衡阳市女性生殖道无乳链球菌的带菌状况及分离株的分子特征。方法收集衡阳市3家教学医院的女性生殖道分泌物棉签拭子样本,对其中的无乳链球菌进行分离、鉴定和药敏分析,并对分离株的耐药基因、血清型、菌毛岛类型进行分析。结果无乳链球菌的检出率为0.88%(3/339)。1株分离株保存失败,另外2株分离株HY66和HY9-2均对四环素和红霉素耐药,并携带ermB和tetO耐药基因。此外,HY9-2对克林霉素、左氧氟沙星、加替沙星耐药,还携带tetM和tetL耐药基因。2株分离株的血清型为Ⅲ型,同时携带PI-1和PI-2a菌毛岛。结论衡阳市女性生殖道无乳链球菌的带菌率低。分离株都对红霉素和四环素耐药,并出现了多重耐药菌株。为防治无乳链球菌的感染,应加强无乳链球菌的流行及耐药情况监测。
无乳链球菌; 女性生殖道; 耐药; 分子特征
无乳链球菌(Streptococcus agalactiae),兰氏分群为B群,又称B 群链球菌(group B streptococcus, GBS),是一种常见的条件致病菌,常寄生在人体的泌尿生殖道以及下消化道[1]。无乳链球菌能突破宿主的免疫防御系统,引起侵袭性感染和组织损伤。尤其是血清型为Ⅰa、Ⅱ、Ⅲ和Ⅴ 型的菌株常常引起人类感染[2]。孕妇围产期感染无乳链球菌可能会导致流产、早产、胎膜早破及新生儿肺炎等并发症,严重者可出现母婴垂直传播导致新生儿脑膜炎、败血症等,危及新生儿生命[1]。此外,无乳链球菌还能感染非孕妇成年人,尤其是老年人,可引起泌尿生殖道、皮肤软组织感染和心内膜炎等[3-4]。随着抗生素的大量使用,无乳链球菌的耐药菌株也不断出现,部分菌株表现对青霉素耐药[5-6]。因此,研究人群中无乳链球菌的带菌情况,血清型别及药物的敏感性,对于防治无乳链球菌的感染具有重要意义。
本文拟收集衡阳市3家教学医院女性生殖道分泌物标本,分离鉴定无乳链球菌,进行药敏试验,检测耐药基因,并分析血清型及菌毛岛类型,以了解衡阳市女性生殖道无乳链球菌的带菌状况及分子特征。
1 材料与方法
1.1材料与试剂339份女性生殖道棉签拭子样本来源于2014年11月~2015年1月衡阳市3家教学医院门诊和体检中心。TSB肉汤和脱纤维绵羊血购自北京索莱宝科技有限公司。庆大霉素和萘啶酸为Amresco公司产品。2×Taq PCR Mix购自广州东盛生物科技有限公司。DNA Marker Ⅲ为TIANGEN公司产品。细菌基因组提取试剂盒为OMEGA公司产品。无乳链球菌参考菌株ATCC 12403,ATCC BAA-611,ATCC 13813和 A909购自美国菌种保存中心,本实验室保存。
1.2细菌的分离培养与纯化样本处理参照美国疾病预防控制中心制定的无乳链球菌预防指南(2010版)进行[7]。简述如下:将样本接种于含庆大霉素(8 μg/mL)和萘啶酸(15 μg/mL)TSB培养基中,37 ℃培养18~24 h。观察细菌的生长情况,记录浑浊生长的样本。取浑浊生长管中的液体在含5%脱纤维绵羊血的TSA平板上分区划线, 37 ℃培养24 h。观察血平板上的菌落特征,挑取疑似菌落作革兰氏染色镜检。革兰阳性球菌,链状排列的疑似菌落接种TSB斜面培养基,37 ℃培养24 h后,放于4 ℃冰箱中保存备用。
1.3无乳链球菌的鉴定
1.3.1 触酶试验 在干净的玻片上滴加1~2 滴无菌生理盐水,用接种环挑取菌落于生理盐水中抹匀制备浓的菌悬液,然后滴加1~2滴3% 过氧化氢溶液,静置1 min内产大量气泡的为阳性,不产生气泡的为阴性。同时用无乳链球菌参考菌株(ATCC 12403)作阴性对照,用金黄色葡萄球菌参考菌株(ATCC 25923)作阳性对照。
1.3.2 无乳链球菌16S rRNA种特异性引物快速鉴定 触酶阴性的菌株用无乳链球菌16S rDNA种特异性引物进行PCR鉴定[8]。反应体系(25 μL):2×Taq PCR Mix 12.5 μL,上下游引物各1 μL,模板1 μL,加ddH2O终体积至25 μL。反应参数为94 ℃预变性5 min;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸30 s,30个循环;72 ℃延伸5 min。PCR产物于3%的琼脂糖凝胶中进行电泳检测,目的片段大小为220 bp。
1.4药敏试验药敏试验采用天地人全自动微生物鉴定与药敏仪(TDR-1002)进行,按照美国临床实验室标准协会(CLSI) 2010版标准判定药敏试验结果。
1.5细菌基因组提取无乳链球菌基因组的提取按照OMEGA细菌DNA提取试剂盒(D3350-01)说明书操作。提取的细菌基因组DNA于-20 ℃保存待用。
1.6耐药基因检测以细菌基因组为模板,表1中引物分别检测红霉素耐药基因ermA、ermB、ermC、mefA和四环素耐药基因tetO、tetK、tetM、tetL[9]。反应体系见1.3.2。反应条件为:94 ℃预变性5 min;94 ℃ 30 s,55 ℃ 30s,72 ℃ 30 s 或90 s(tetK、tetM、tetL 为90 s,其他为30 s),30 个循环; 最后 72 ℃延伸10 min。
1.7荚膜多糖合成相关基因检测参照Imperi M等[10]报道的多重PCR方法检测无乳链球菌的荚膜多糖合成相关基因,根据检测结果可以确定菌株的血清型。引物见表1。反应体系(25 μL):DNA模板 1 μL,2×Taq PCR Mix 12.5 μL,引物cpsI-Ia-6-7-F和cpsI-7-9-F为1 μL ,其余引物0.5 μL,加ddH2O终体积至25 μL。反应程序为94 ℃预变性5 min;94 ℃变性60 s,54 ℃退火60 s,72 ℃延伸2 min,15个循环;然后,94 ℃变性60 s,56 ℃退火60 s,72 ℃延伸2 min,25个循环;最后72 ℃延伸10 min。反应结束后用1.5%琼脂糖凝胶进行电泳鉴定。以参考菌株ATCC12403,ATCCBAA-611,ATCC 13813和A909为对照。
1.8菌毛骨架蛋白基因检测参照Margarit I等[11]报道的方法检测无乳链球菌的菌毛岛PI-1、PI-2a或PI-2b的骨架蛋白BP-1、BP-2a和BP-2b的编码基因spb1、spb2a和spb2b,由此判断菌毛岛类型。引物序列见表1,反应体系同1.3.2,反应程序为94 ℃ 5 min,94 ℃ 45 s,54 ℃ 45 s,72 ℃ 90 s to 120 s(spb2a和spb2b为120 s)反应35个循环, 72 ℃延伸10 min。

表1 本文所用引物
2 结 果
2.1无乳球菌的分离鉴定339份样本中分离到了3株无乳链球菌,分离率为0.88%。3株分离株分别命名为HY66、HY9-2和HY68,其中HY68保存失败。分离株在绵羊血平板上的菌落呈圆形、隆起、半透明、光滑、湿润、边缘整齐,呈α溶血。革兰染色阳性,链状排列。用无乳链球菌16S rRNA种特异性引物进一步鉴定,3株分离株均扩增出了大小为220 bp的目的条带(图1)。
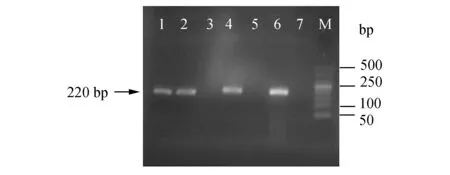
图1 无乳链球菌16S rRNA种特异性引物检测M:marker;泳道1、2、4、6分别为HY66、HY9-2、HY68和ATCC 12403;泳道3、5为阴性检测结果;泳道7为阴性对照
2.2耐药性分析药敏试验结果显示:HY66对四环素和红霉素耐药;HY9-2为多重耐药菌,对林可霉素类药物克林霉素、四环素类药物四环素、喹诺酮类药物左氧氟沙星和加替沙星及大环内酯类药物红霉素耐药(表2)。菌株HY66检出了红霉素耐药基因ermB和四环素耐药基因tetO。菌株HY9-2检出了红霉素耐药基因ermB,四环素耐药基因tetO、tetM和tetL(图2)。
表2药敏试验结果

抗生素测试结果HY66HY9-2青霉素SS万古霉素SS氨苄西林SS头孢吡肟SS头孢曲松SS利奈唑胺SS美罗培南SS克林霉素SR四环素RR左氧氟沙星SR加替沙星SR红霉素RR
S:敏感,R:耐药
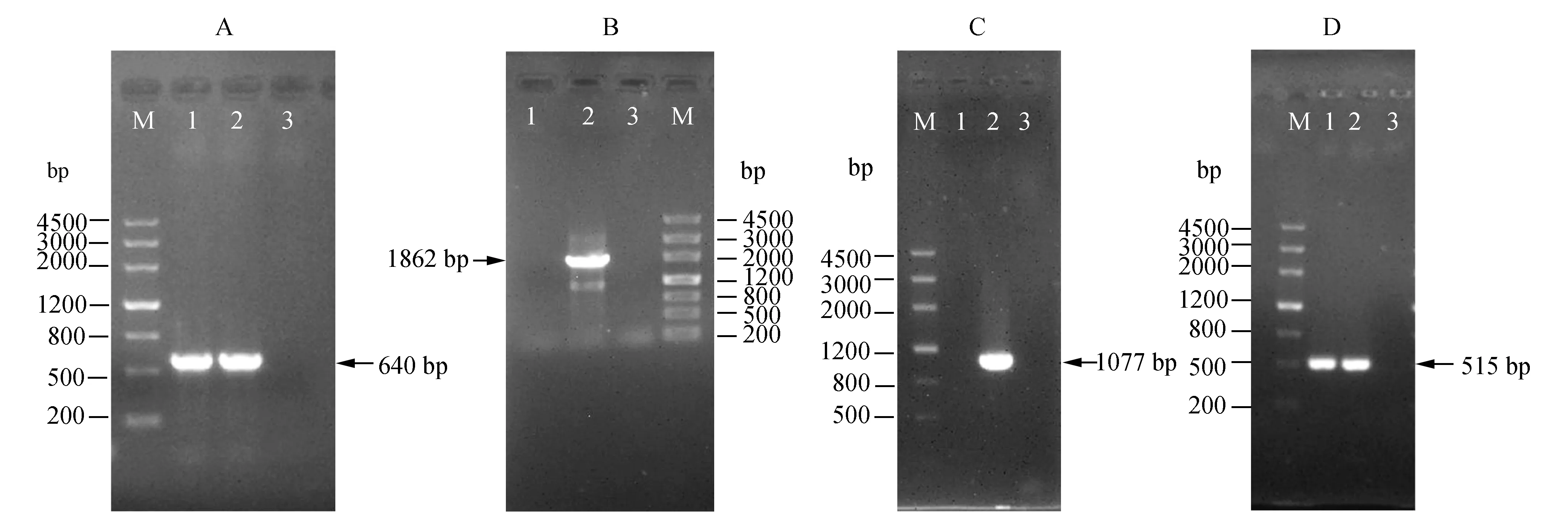
图2 耐药基因检测A:ermB基因检测,泳道1~3分别 为HY66、 HY9-2和阴性对照;B:tetM基因检测,泳道1~3分别为HY66、HY9-2和阴性对照;C:tetL基因检测,泳道1~3分别为HY66、HY9-2和阴性对照;D:tetO基因检测,泳道1~3分别为HY66、HY9-2和阴性对照
2.3荚膜多糖合成相关基因检测采用多重PCR方法,对分离株和参考菌株ATCC12403,ATCC BAA-611,ATCC13813和A909的荚膜多糖合成相关基因进行鉴定,结果如图3所示,2株分离株的带型与参考株ATCC12403(Ⅲ型)一致,均为Ⅲ型(图3)。
2.4菌毛骨架蛋白基因检测2株分离株都缺乏spb2b基因,均有1型和2a型菌毛岛骨架蛋白基因spb1和spb2a(图4)。
3 讨 论
无乳链球菌在女性生殖道中的定植率较高。Meta分析显示全球不同国家孕妇生殖道中无乳链球菌的定植率平均达17.9% ,非洲地区最高为22.4%,亚洲地区最低为11.1%[12]。国内学者张传飞等[5]和钱香等[6]报道育龄女性生殖道无乳链球菌感染率达3.79%~5.9%。本研究从339份女性生殖道分泌物棉签拭子样本中,检出3份无乳链球菌阳性标本,检出率为 0.88%,明显低于国内其他学者的报道。可能与下列因素有关:①样本数量相对较少,调查的时间跨度短。国内学者多采取回顾性分析的方法,样本数量较多,调查的时间跨度较长。例如钱香等[6]回顾性分析了2004~2011年间临床送检的11484份标本,共分离到471株无乳链球菌,分离率为4.1%。②样本的采集部位不同,对分离结果有影响。Quinlan等[13]报道18.5%的GBS阳性患者阴道分泌检测结果为阴性,但直肠分泌物标本检测结果为阳性。本研究的标本均为阴道分泌物棉签拭子标本,故检出率可能偏低。此外,本次调查中,高校职工和企业员工的健康体检样本占43.3%。这部分人群大多接受较高层次的教育,卫生意识和生活环境良好,无乳链球菌的带菌率可能相对较低。

图3 多重PCR检测荚膜多糖合成相关基因1:A909(Ⅰa);2:ATCC 13813(Ⅱ);3:ATCC BAA-611(Ⅴ);4:ATCC 12403(Ⅲ);5~7:HY66、HY9-2和阴性对照

图4 菌毛骨架蛋白基因检测A:菌毛岛PI-1骨架蛋白BP-1编码基因spb1检测,泳道1~5分别为A909、ATCCBAA-611、HY66、HY9-2和阴性对照;B:菌毛岛PI-2a和PI-2b的骨架蛋白BP-2a、BP-2b的编码基因spb2a和spb2b的检测,泳道1~5分别为ATCC12403、ATCCBAA-611、HY66、HY9-2和阴性对照,泳道7~10分别为A909、ATCCBAA-611、HY66和HY9-2,泳道11~12为阴性对照
近年来,无乳链球菌对四环素、红霉素、克林霉素及左氧氟沙星的耐药率较高,其中对四环素的耐药率可达80%以上,红霉素的耐药率可达50%以上[5-6]。本研究中,2株分离株均对红霉素和四环素耐药,其中分离株HY9-2为多重耐药菌株,对克林霉素、四环素、左氧氟沙星、加替沙星和红霉素均耐药。Lee和Lai报道红霉素耐药基因ermB的检出率最高[14]。本研究2株分离株均检测到ermB基因,未检测到 ermA、ermC、mefA基因,这与Lee和Lai的报道一致。四环素耐药基因中,tetM检出率最高,tetL和tetO的检出率低,少数四环素耐药菌株中同时存在多种耐药基因[15]。本研究分离株HY-9-2同时携带tetO、tetM和tetL基因。
根据荚膜多糖的化学组成、结构和血清学特性,无乳链球菌分为十个血清型即Ⅰa、Ⅰb、Ⅱ~Ⅸ[8]。引起人类感染的主要为血清型为Ⅰa、Ⅱ、Ⅲ和 Ⅴ型[2],我国流行的型别主要是Ⅲ型[2,15]。本研究通过多重PCR鉴定荚膜多糖合成酶基因结果显示,2株分离株均为Ⅲ型,这与国内其他学者报道一致。
菌毛是无乳链球菌重要的毒力因子,在细菌的粘附、侵袭和生物被膜的形成过程中发挥重要作用,并且还是一种良好的抗原,是制备疫苗的候选[11]。无乳链球菌有三种菌毛岛即:菌毛岛-1(pilus islands-1,PI-1)、菌毛岛2a(pilus islands-2a,PI-2a)和菌毛岛-2b(pilus islands-2bPI-2b)[11]。无乳链球菌人源分离菌株至少含有一种菌毛岛,大多数菌株携带PI-2a,同时携带PI-1和PI-2a菌株可达40%以上[11]。本研究中2株分离株不含PI-2b,同时携带PI-1和PI-2a。
综上所述,本研究分离的无乳链球菌均对四环素和红霉素耐药,血清型为Ⅲ型,同时携带PI-1和PI-2a菌毛岛。多重耐药菌株的检出提示无乳链球菌对抗生素的耐药情况有加剧的趋势,临床应加强对无乳链球菌的流行及耐药情况监测。
[1] Rajagopal L. Understanding the regulation of Group B Streptococcal virulence factors[J]. Future Microbiol,2009,4(2):201-221.
[2] Lu B,Chen X,Wang J,et al. Molecular characteristics and antimicrobial resistance in invasive and noninvasive group B streptococcus between 2008 and 2015 in China[J]. Diagn Microbiol Infect Dis,2016,86(4):351-357.
[3] Skoff TH,Farley MM,Petit S,et al. Increasing burden of invasive group B streptococcal disease in nonpregnant adults,1990-2007[J]. Clin Infect Dis,2009,49(1):85-92.
[4] Fujita H,Nakamura I,Tsukimori A,et al. Severe infective endocarditis in a healthy adult due to Streptococcus agalactiae[J]. Int J Infect Dis,2015,38:43-45.
[5] 张传飞. 中国育龄妇女泌尿生殖道无乳链球菌感染情况与耐药性分析[J]. 中国微生态学杂志,2016,28(9):1094-1096.
[6] 钱香,崔巍,王莉.育龄女性生殖道无乳链球菌感染及药敏分析[J].中华医院感染学杂志,2013,23(22) :5612-5614.
[7] Verani JR,McGee L,Schrag SJ. Prevention of Prenatal Group Streptococcal disease[R]. MMWR Recomm Rep,2010,59(RR10):1-36.
[8] Martinez G,Harel J,Gottschalk M. Specific detection by PCR of Streptococcal agalactiae in milk[J]. Can J Vet Res.2001,65(1):68-72.
[9] 杨永春.华东地区奶牛无乳链球菌的分子流行病学调查及BP亚单位疫苗免疫效力分析[D]. 南京:南京农业大学, 2013:29-32.
[10] Imperi M,Pataracchia M,Alfarone G,et al. A multiplex PCR assay for the direct identification of the capsular type (Ia to IX) of Streptococcus agalactiae[J]. J Microbiol Methods,2010,80(2):212-214.
[11] Margarit I,Rinaudo CD,Galeotti CL,et al. Preventing bacterial infections with pilus-based vaccines:the group B streptococcus paradigm[J].J Infect Dis,2009,199(1):108-115.
[12] Kwatra G,Cunnington MC,Merrall E,et al. Prevalence of maternal colonisation with group B streptococcus:a systematic review and meta-analysis[J]. Lancet Infect Dis,2016,16(9):1076-1084.
[13] Quinlan JD,Hill DA,Maxwell BD,et al. The necessity of both anorectal and vaginal cultures for group B streptococcus screening during pregnancy[J].J Fam Pract,2000,49(5):447-448.
[14] Lee WT,Lai MC. High prevalence of Streptococcus agalactiae from vaginas of women in Taiwan and its mechanisms of macrolide and quinolone resistance[J]. J Microbiol Immunol Infect,2015,48(5):510-516.
[15] Wang H,Zhao C,He W,et al. High prevalence of fluoroquinolone-resistant group B streptococci among clinical isolates in China and predominance of sequence type 19 with serotype III[J]. Antimicrob Agents Chemother,2013,57(3):1538-1541.
PresenceandmolecularcharacterizationofStreptococcusagalactiaeingenitaltractspecimensofwomeninHengyang
BAI Qinqin,LIU Yunman,WANG Qiuping,et al
(DepartmentofSanitaryInspection,SchoolofPublicHealth,UniversityofSouthChina,Hengyang421001,Hunan,China)
ObjectiveTo investigate the prevalence rate and molecular characterization of Streptococcus agalactiae in genital tract swabs of women in Hengyang city.MethodsThe genital tract swabs of women which were collected from 3 teaching hospitals in Hengyang,were used to screen for S. agalactiae colonization. Then,isolates were detected for antimicrobial susceptibility,and their serotypes,pilus island types and genes encoding resistance were studied.ResultsAmong 339 genital tract swabs,3(0.88%) were positive for S. agalactiae. Except for one isolate that was failed for storage,the other two isolates HY66 and HY9-2 was both resistant to erythromycin and tetracycline,and carried the ermB gene with tetO gene. The isolate HY9-2 was also resistant to climdamycin,levofloxacin and gatifloxacin,and carried another two tetracycline resistance gene:tetM and tetL. The 2 isolates belong to serotype Ⅲ,their pilus island type consisted in the concomitant presence of PI-1 and PI-2a.ConclusionThe prevalence rate of S. agalactiae in genital tract swabs of women in Hengyang is low. The 2 isolate was resistant to erythromycin and tetracycline,and a multi-drug resistance isolates was obtained. The monitoring of prevalence of S. agalactiae and drug resistance should be strengthened for the prevention of S. agalactiae infection in Hengyang.
S. agalactiae; women genital tract; antimicrobial susceptibility; molecular characterization
10.15972/j.cnki.43-1509/r.2017.05.008
2017-02-06;
2017-08-28
南华大学博士启动基金项目(2013XQD21);衡阳市科技局项目(2015KS11).
*通讯作者,E-mail: chlili720612@163.com.
R378.12
A
蒋湘莲)

