盐碱胁迫对草地早熟禾生长和生理代谢的影响
张强,刘宁芳,向佐湘,杨知建,蒋元利,胡龙兴*
(1.湖南农业大学农学院,湖南 长沙 410128;2.湖南生物机电职业技术学院,湖南 长沙 410127)
盐碱胁迫对草地早熟禾生长和生理代谢的影响
张强1,刘宁芳1,向佐湘1,杨知建1,蒋元利2,胡龙兴1*
(1.湖南农业大学农学院,湖南 长沙 410128;2.湖南生物机电职业技术学院,湖南 长沙 410127)
以两个耐盐碱性差异较大的草地早熟禾品种‘午夜’(Midnight,耐盐碱性强)和‘旅行者Ⅱ号’(Voyager Ⅱ,耐盐碱性弱)为试验材料,分析了在生长箱水培模拟中性盐和碱性盐两种条件下,盐碱胁迫对早熟禾生长、电导率、叶绿素、光合特性、脯氨酸和有机酸代谢的影响。结果表明,盐碱胁迫下早熟禾两个品种的生长率下降,叶片电导率升高,叶绿素含量和光合作用显著下降,尤其是在碱胁迫下,但在耐性强的品种中变化程度均小于耐性弱的品种;两个品种叶片脯氨酸含量主要在盐胁迫下升高,碱胁迫下无显著变化甚至下降;根系分泌的有机酸主要为草酸,且仅在碱胁迫下升高;盐碱胁迫下草酸在叶片和根系中的含量均呈下降趋势,尤其是根系在碱胁迫下;叶片和根系的苹果酸、柠檬酸和琥珀酸在盐胁迫下无显著变化,在碱胁迫下则显著升高,其中‘午夜’显著高于‘旅行者Ⅱ号’。由此可见,碱性盐比中性盐对草地早熟禾的伤害更大,中性盐胁迫下主要以积累脯氨酸等物质来调节渗透压,而在碱性盐胁迫下主要通过加强有机酸的代谢、积累和分泌来调节植株体内和根际环境的pH值;耐盐碱的品种在盐碱胁迫下能维持较高的光合作用和有机酸代谢,提高了植株内和根际环境pH的调节能力,因此具有较强的耐盐碱能力。
草地早熟禾;盐碱胁迫;有机酸;生理代谢
盐碱地在世界各地分布广,遍及六大洲的30多个国家,总面积约9.56亿hm2,已成为全球严重和最受关注的环境问题之一[1]。中国有各类盐碱地2600多万hm2,主要分布在滨海地区、西北、华北和东北三省,严重影响了我国的农牧业生产。土壤盐渍化也成为了草坪建植和养护管理的难题之一,盐碱地上建植的草坪生长不良,易出现秃斑,秋季早衰,甚至出现大面积死亡等现象,从而增加了草坪的管理难度,降低了草坪的坪用价值[2]。盐碱胁迫是盐胁迫和碱胁迫的总称,是主要环境逆境胁迫之一,其中以Na2CO3和NaHCO3为主要成分的碳酸盐胁迫称为碱胁迫,源于成土母质中Na2CO3和NaHCO3水解后CO32-和HCO3-的积累而使土壤呈强碱性反应,pH值为8.5~11.0[3],是我国东北地区松嫩平原西部主要的逆境[4]。
草地早熟禾(Poapratensis)原产于欧亚大陆和中亚细亚地区,它广泛适应于寒冷潮湿地带,在我国东北、华北、西北和西南等地均有分布,既是一种在北温带利用最广泛的优质冷季型草坪草,已成为各种草坪和绿地建植必不可少的组分之一,也是一种禾本科牧草。低浓度的碳酸盐对植物不会造成盐胁迫,但由于CO32-和HCO3-的存在会对植物造成高pH胁迫。高pH土壤环境既可以降低土壤养分的有效性,抑制植物对阴离子的吸收而打破植物体内的离子平衡,从而影响植物体内的代谢,同时还可以降低细胞壁的酸化度,从而阻止细胞壁中微纤维素的松解,破坏质膜的完整性,最终导致细胞壁的形成减少以及细胞的伤害,这样间接地抑制了植物生长[5]。有机酸是一类低分子质量、带有羧基的具有缓冲作用的化合物,是植物体内代谢调节和根系分泌的主要成分之一,主要在线粒体中产生,大部分在TCA循环中产生,在环境适应调节等方面都具有重要的功能[6]。前人研究均发现在盐碱胁迫下,有机酸在碱地肤(Kochiasievesiana)[7]、星星草(Puccinelliatenuiflora)[8]、羊草(Leymuschinensis)[9]和向日葵(Helianthusannuus)[10]等植物的体内发生变化,但不同种类的植物其体内的有机酸种类变化不同。以往对草地早熟禾的抗逆性研究多集中于耐热、抗旱、耐盐等方面[11-14],对于碳酸盐引起的高pH胁迫对草地早熟禾的生长和生理影响少有报道。本研究以两个耐盐碱性差异较大的草地早熟禾品种‘午夜’(Midnight,耐盐碱性强)和‘旅行者Ⅱ号’(Voyager Ⅱ,耐盐碱性弱)为试验材料,探讨在生长箱水培模拟中性盐和碱性盐两种条件下,盐碱胁迫对早熟禾生长、电导率、叶绿素、光合特性、脯氨酸和有机酸代谢的影响以及不同耐盐碱性品种生理响应的差异,以期揭示草地早熟禾耐盐碱胁迫的机制,为培育耐盐碱草地早熟禾品种提供理论依据和实践指导。
1 材料与方法
1.1 试验材料与培养
试验于2016年9-11月进行。试验材料采用草地早熟禾耐盐碱性强的品种‘午夜’和耐盐碱性弱的品种‘旅行者Ⅱ号’[15]。将两个品种的种子种植于直径为6.5 cm、高度为9.5 cm且装有细沙的塑料杯中。种子发芽后每周浇一次1/2的霍格兰(Hoagland’s)营养液,在生长箱中培养两个月后用自来水冲洗掉沙子,然后将植株移栽至装有1/2的霍格兰营养液的三角瓶中培养。缓苗两周后开始试验处理,在处理前将植株冠层修剪至同一高度(约8 cm)。在种子发芽和幼苗培养期间的环境条件为:温度25 ℃/20 ℃(昼/夜),相对湿度60%~80%,14 h光照时间和500 μmol/(m2·s)的光照强度。
1.2 试验设计与处理
试验采用完全随机设计,共设4个处理:1)对照,无钙的1/2霍格兰营养液,pH 5.8;2)盐胁迫,75 mmol/L Na+, pH 5.8;3)轻度碱胁迫,75 mmol/L Na+,pH 8.0;4)重度碱胁迫,75 mmol/L Na+,pH 10.0。用无钙的1/2霍格兰营养液先分别配制成50 mmol/L Na2CO3和50 mmol/L NaHCO3溶液,再按体积比分别配制成以上处理浓度的Na+和pH值[16]。试验重复3次,每次试验处理设4次重复,材料在生长箱中每天换位以减少实验误差。
试验处理7 d后进行取样和测定分析。将植株分成地下部和地上部,地上部直接称重取样,地下部用蒸馏水冲洗,滤纸吸净表面水分后称重取样,样品立即置于液氮中,然后转移至-80 ℃冰箱保存直至测定分析。同时取一部分培养液测定pH。
1.3 测定项目与方法
1) 培养液pH值:试验处理前与处理后的培养液采用BPH-220型pH计进行测定,每瓶培养液测3次。
2) 垂直生长速率:处理前将冠层修剪至同一高度,处理7 d后植株地上部的高度除以7 d为垂直生长速率(cm/d)。
3) 细胞膜稳定性:用相对电导率表示,取约0.1 g叶片,用去离子水冲洗干净,剪成1 cm的小段置于试管中,加去离子水10 mL后在室温条件下振荡24 h后,测外渗液的电导率(E1),然后封口在高压灭菌锅中高温高压灭菌15 min,冷却至室温后测电导率(E2),再按下式计算:相对电导率=[(E2-E1)/E2]×100%。
4) 叶绿素含量:采用分光光度计法,用二甲基亚砜浸提48 h后于波长663、645和470 nm下测定吸光值并计算其含量。
5) 光合作用:用Licor-6400光合仪在10:00至14:00之间测定草地早熟禾倒数第3片叶的净光合速率、蒸腾速率和气孔导度,测定条件设定为400 μmol/mol CO2,400 μmol/(m2·s)的光照强度。
6) 脯氨酸含量:准确称取植物样品0.2 g,用3%磺基水杨酸溶液研磨后在沸水浴中提取10 min,冷却后过滤并用3%磺基水杨酸定容至5 mL,即为脯氨酸的提取液;提取液用冰醋酸及酸性茚三酮试剂在沸水浴中加热显色,显色液冷却后加入甲苯振荡分层, 吸取上层脯氨酸红色溶液在分光光度计上520 nm波长测吸光度值,样品中脯氨酸含量根据已知浓度的脯氨酸标准曲线计算获得。
7) 有机酸含量:取1.0 g植物鲜样在液氮下研磨成粉,再加5 mL 去离子水研磨成匀浆后装入试管中超声提取30 min。将提取液于2000 r/min条件下离心20 min,取上清液过微孔滤膜(水系、孔径0.22 μm)后进样检测;处理后的培养液直接过微孔滤膜后进样检测。检测仪采用配置为Diamonsil C18(2)柱(4.6 mm×250 mm, 5 μm)的高效液相色谱仪(安捷伦1100)进行。流动相条件为0.5% KH2PO4(pH 2.4),紫外检测波长为214 nm,柱温25 ℃,进样量10 μL,流速0.8 mL/min。基于峰面积参照草酸、苹果酸、柠檬酸、琥珀酸的标准曲线进行浓度计算[15]。
1.4 数据处理与统计分析
利用SAS for Window 9.0软件进行试验数据统计和方差分析,采用Duncan多重比较检验不同处理间的差异(P<0.05),用Sigmaplot 10.0软件作图。
2 结果与分析
2.1 培养液pH值的变化
由表1可知,在对照和盐胁迫处理下,两个品种的培养液pH值在处理7 d后均呈上升趋势且显著高于处理前的pH值水平,但品种间无显著差异;在轻度和重度碱胁迫下处理7 d后,两个早熟禾品种培养液中的pH值均下降且显著低于处理前的pH值,但两个品种的培养液pH值下降程度不同,其中在耐盐碱品种‘午夜’中下降程度更大且显著低于‘旅行者Ⅱ号’。
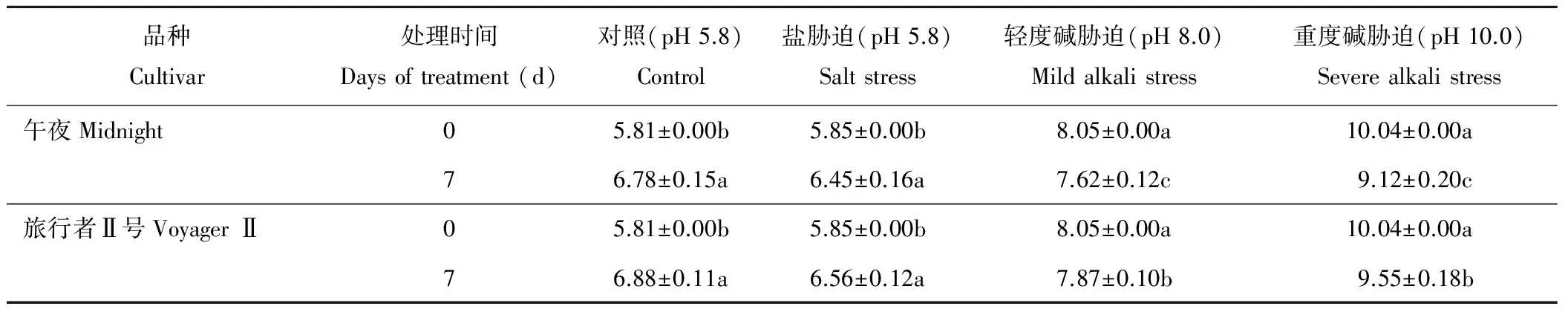
表1 处理前和处理后培养液pH值的变化Table 1 Changes of pH values before and after treatment in the culture solution
注:表中数值为平均值±SD;同列中不同小写和大写字母表示同一处理内两个品种在不同处理时间上的差异显著性(P<0.05和P<0.01)。下同。
Note: Values in the Table are means±SD; Values followed by different lowercase letters and capital letters within a column indicate significant differences between two cultivars at different treatment days atP<0.05 andP<0.01 levels. The same below.
2.2 盐碱胁迫对草地早熟禾生长的影响

图1 盐碱胁迫对草地早熟禾垂直生长速率的影响Fig.1 Effect of salt and alkali stress on the vertical growth rate in Kentucky bluegrass A:对照Control;B:盐胁迫Salt stress;C:轻度碱胁迫 Mild alkaline stress;D:重度碱胁迫Severe alkaline stress. 图中标注的数值为平均值±SD;图中同一品种内不同小写字母表示不同处理的差异显著性(P<0.05),*表示同一处理不同品种间的差异显著性(P<0.05),下同。The error bars indicate means±SD; Bars followed by different lower-case letters within a cultivar indicate significant differences among treatments and * on the bar indicate significant differences between treatment in a cultivar at P<0.05 levels, the same below.
植物的生长速率直接反映受环境胁迫的影响程度。图1表明,在盐胁迫和碱胁迫下,两个品种的垂直生长速率均显著下降;在盐胁迫、轻度碱胁迫和重度碱胁迫下,品种‘午夜’的生长速率分别下降至对照的89%,74%和40%,而‘旅行者Ⅱ号’则分别下降至对照的77%,69%和11%。在对照、盐胁迫和轻度碱胁迫条件下两个品种的垂直生长速率没有显著差异,但在重度碱胁迫下耐盐碱品种‘午夜’的生长速率显著高于‘旅行者Ⅱ号’。
2.3 盐碱胁迫对叶片细胞膜稳定性的影响
叶片相对电导率的高低直接反映了细胞膜稳定性的大小。从图2可以看出,在盐胁迫和碱胁迫下草地早熟禾两个品种的叶片细胞膜稳定性下降,电导率显著升高;与对照相比,在盐胁迫、轻度碱胁迫和重度碱胁迫下,品种‘午夜’的电导率分别升高至对照的2.5,3.6和6.6倍,而‘旅行者Ⅱ号’则分别升高至对照的3.0,4.5和9.0倍。在对照、盐胁迫和轻度碱胁迫条件下两个品种的叶片电导率没有显著差异,但在重度碱胁迫下耐盐碱品种‘午夜’的电导率显著低于‘旅行者Ⅱ号’。
2.4 盐碱胁迫对叶绿素含量的影响
叶绿素含量的高低在一定程度上反映了植物光合潜力的大小。由图3可知,盐碱胁迫对草地早熟禾的叶绿素生物学合成与降解产生了显著影响。在盐胁迫和碱胁迫下两个不同耐性的早熟禾品种叶绿素含量均呈下降趋势,其中在轻度和重度碱胁迫下叶绿素含量显著低于对照水平,品种‘午夜’的叶绿素含量分别下降至对照的70%和51%,而品种‘旅行者Ⅱ号’则下降至对照的60%和33%。在对照和盐胁迫下,两个品种的叶绿素含量没有显著差异,但在轻度和重度碱胁迫下,耐盐碱品种‘午夜’的叶绿素含量显著高于‘旅行者Ⅱ号’。
2.5 盐碱胁迫对光合作用的影响
表2显示,盐碱胁迫对草地早熟禾的光合作用产生了显著影响,在盐胁迫和碱胁迫下两个不同耐性的早熟禾品种的净光合速率、气孔导度和蒸腾速率均显著下降;在盐胁迫、轻度碱胁迫和重度碱胁迫条件下,品种‘午夜’的净光合速率分别下降至对照的69%,42%和23%,而品种‘旅行者Ⅱ号’则下降至对照的61%,27%和8%;品种‘午夜’的气孔导度分别下降至对照的54%,37%和28%,而‘旅行者Ⅱ号’则下降至对照的39%,28%和9%;品种‘午夜’的蒸腾速率分别下降至对照的74%,48%和24%,而‘旅行者Ⅱ号’则分别下降至对照的69%,37%和17%。在对照和盐胁迫下,两个品种的净光合速率和蒸腾速率没有显著差异,但在轻度和重度碱胁迫下,耐盐碱品种‘午夜’的净光合速率、气孔导率和蒸腾速率均显著高于‘旅行者Ⅱ号’。
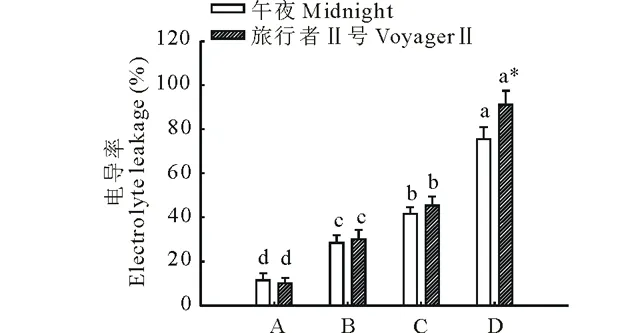
图2 盐碱胁迫对草地早熟禾叶片电导率的影响 Fig.2 Effect of salt and alkali stress on the electrolyte leakage in Kentucky bluegrass

图3 盐碱胁迫对草地早熟禾叶片叶绿素含量的影响Fig.3 Effect of salt and alkali stress on the leaf chlorophyll content in Kentucky bluegrass
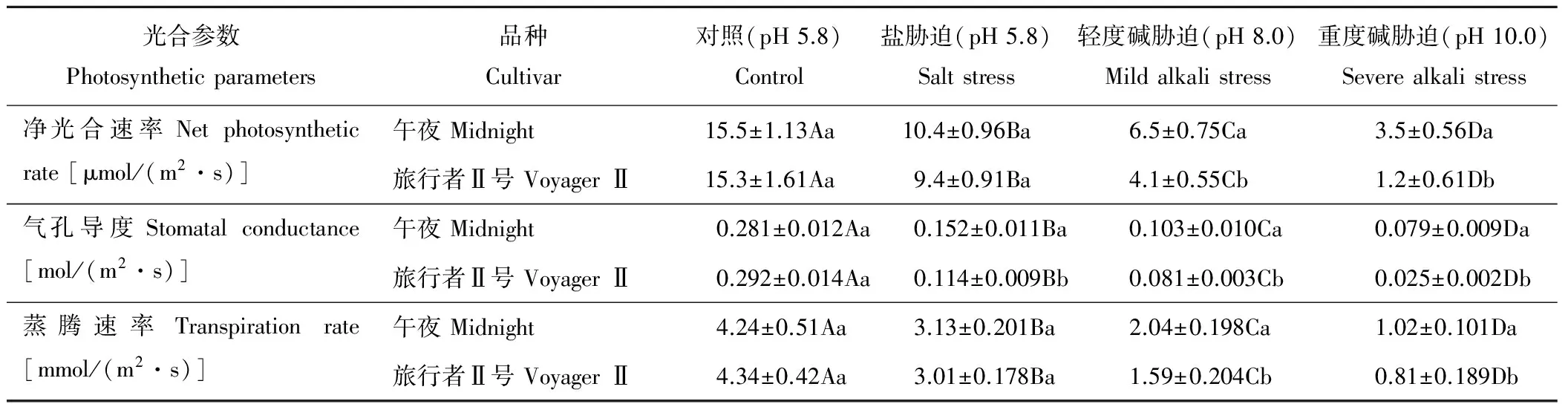
表2 盐碱胁迫对草地早熟禾光合作用的影响 Table 2 Effect of salt and alkali stress on the photosynthesis in Kentucky bluegrass
2.6 盐碱胁迫对脯氨酸含量的影响

图4 盐碱胁迫对草地早熟禾叶片脯氨酸含量的影响 Fig.4 Effect of salt and alkali stress on the leaf proline content in Kentucky bluegrass
从图4可知,在盐胁迫下,两个不同耐盐碱性的早熟禾品种叶片的脯氨酸含量显著升高,与对照相比,‘午夜’和‘旅行者Ⅱ号’的脯氨酸含量分别增加至对照的2.8和2.2倍;与对照相比,‘午夜’的脯氨酸含量在轻度碱胁迫下显著升高,而在重度碱胁迫下无显著差异;但‘旅行者Ⅱ号’的脯氨酸含量在轻度碱胁迫下无显著差异,在重度碱胁迫下则显著低于对照。两个不同耐盐碱性的早熟禾品种在对照条件下脯氨酸含量无显著差异,但在盐胁迫,轻度和重度碱胁迫下,耐盐碱的品种‘午夜’中均显著高于‘旅行者Ⅱ号’。
2.7 盐碱胁迫对植株内有机酸含量的影响
由表3可以看出,两个早熟禾品种叶片中的草酸含量在盐胁迫下与对照相比无显著性差异,而在轻度和重度碱胁迫下均显著下降;除了重度碱胁迫处理外,叶片的草酸含量在对照、盐胁迫和轻度碱胁迫下两个品种间均无显著差异。在盐胁迫下,两个品种叶片的苹果酸、柠檬酸和琥珀酸含量与对照相比无显著性差异,但是在碱胁迫下,两个品种叶片的苹果酸、柠檬酸和琥珀酸含量与对照比均显著升高,尤其是重度胁迫处理下。两个早熟禾品种叶片的苹果酸、柠檬酸和琥珀酸含量在对照和盐胁迫条件下均无显著性差异,但在轻度和重度碱胁迫下,耐盐碱品种‘午夜’叶片的苹果酸、柠檬酸和琥珀酸含量均显著高于‘旅行者Ⅱ号’。
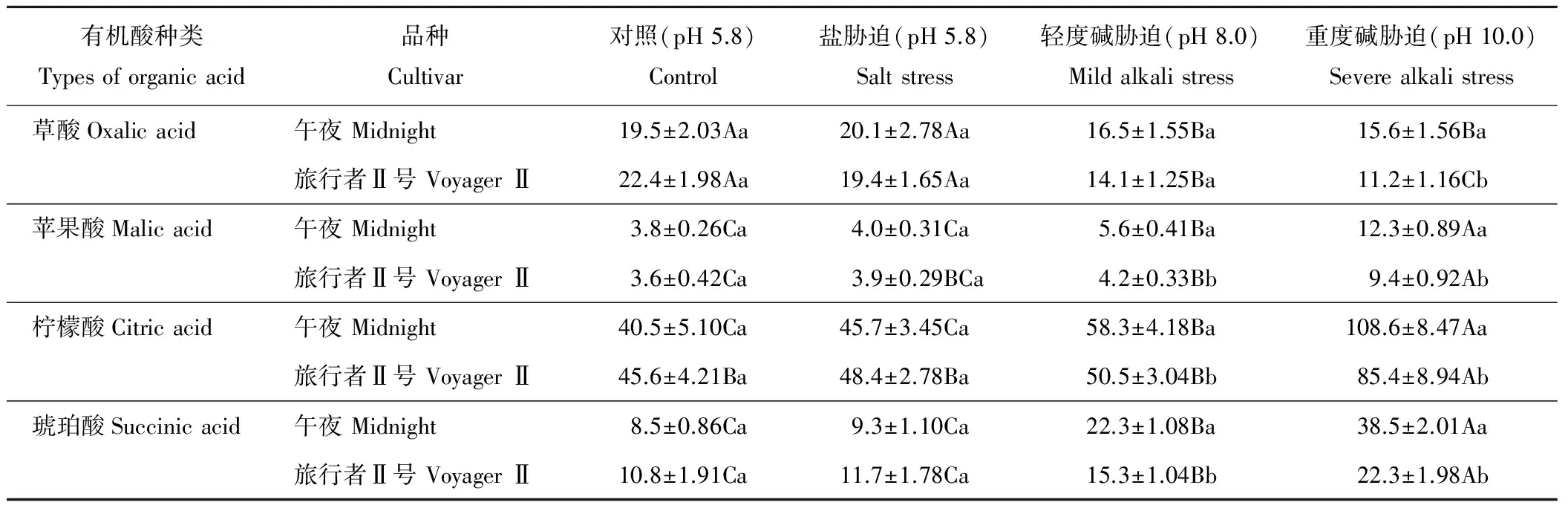
表3 盐碱胁迫对草地早熟禾叶片有机酸含量的影响 Table 3 Effect of salt and alkali stress on the organic acid content in leaves of Kentucky bluegrass mg/g FW
从表4可以看出,两个早熟禾品种根系的草酸含量在盐胁迫和碱胁迫下与对照比均显著降低,尤其是在碱胁迫处理下,但两个品种间均无显著性差异。耐盐碱品种‘午夜’根系的苹果酸含量与对照比在盐胁迫下显著下降,在轻度碱胁迫下显著升高,而‘旅行者Ⅱ号’根系的苹果酸含量在盐胁迫下显著下降,在碱胁迫下无显著变化。柠檬酸在‘午夜’根系中的含量与对照比仅在轻度碱胁迫下显著升高,而在盐胁迫和重度碱胁迫下则无显著性差异;‘旅行者Ⅱ号’根系柠檬酸含量则在盐和碱胁迫下均显著降低,尤其是碱胁迫处理下。耐盐碱品种‘午夜’根系的琥珀酸含量与对照在盐胁迫下无显著差异,在碱胁迫下则显著升高,而‘旅行者Ⅱ号’根系的琥珀酸含量则在盐胁迫和重度碱胁迫下显著下降,而在轻度碱胁迫下无显著性差异。在盐胁迫下‘午夜’根系的苹果酸和柠檬酸含量显著高于‘旅行者Ⅱ号’,但两个品种根系的琥珀酸含量无显著性差异;在轻度和重度碱胁迫下,品种‘午夜’根系的苹果酸、柠檬酸和琥珀酸含量均显著高于‘旅行者Ⅱ号’。

表4 盐碱胁迫对草地早熟禾根系有机酸含量的影响 Table 4 Effect of salt and alkali stress on the organic acid content in roots of Kentucky bluegrass mg/g FW
2.8 盐碱胁迫对根系有机酸分泌的影响
在试验处理结束后对培养液中的有机酸进行检测,在‘午夜’和‘旅行者Ⅱ号’根系分泌的有机酸中均只检测到了草酸。由图5可知,不同pH值的盐碱胁迫对草地早熟禾根系分泌草酸影响不同。在盐胁迫下两个品种根系分泌的草酸含量与对照相比均没有显著差异,在轻度和重度碱胁迫下耐盐碱品种‘午夜’根系分泌的草酸含量均显著高于对照,而‘旅行者Ⅱ号’仅在中度碱胁迫下分泌的草酸含量高于对照,在重度碱胁迫下则显著低于对照水平。

图5 盐碱胁迫对草地早熟禾根系有机酸分泌的影响Fig.5 Effect of salt and alkali stress on the organic acid secreted by root in Kentucky bluegrass
3 讨论
3.1 盐碱胁迫对草地早熟禾生长和光合特性的影响
盐碱胁迫条件下对植物造成了离子和pH胁迫双重伤害,因此,生长在碳酸盐条件下的植物,除了要忍受Na+胁迫外,还要对抗因土壤的高pH所造成的胁迫,但在低盐浓度下pH是主要的胁迫因子[10]。本研究结果表明,在水培模拟中性盐和碱性盐两种条件下,两个品种的垂直生长速率均显著下降,但碱性盐对草地早熟禾生长速率的抑制程度要远大于同浓度的中性盐,并且叶片电导率也显著大于中性盐胁迫且随着处理液pH值的升高而加大,表明碱性盐对草地早熟禾的伤害比中性盐胁迫更大。在本研究中,碳酸盐处理溶液中的Na+浓度为50~75 mmol/L,离造成草地早熟禾受胁迫的盐浓度还具有一定的距离[17],因此,草地早熟禾受碱胁迫后表现出的生长速率降低,电导率升高等明显的胁迫症状,可能主要是由于CO32-和HCO3-离子的存在而导致的高pH胁迫所至,这与前人在蚕豆(Viciafaba)[18]和虎尾草(Chlorisvirgata)[19]上的研究结果相一致。
叶片衰老最初的症状是失绿变黄,因此常用叶绿素含量作为叶片衰老的标志。此外,叶绿素作为植物进行光合作用的主要光合色素,其含量的高低与叶片的光合能力和光合潜力密切相关,因此也通常把叶绿素含量作为叶片功能的一个重要指标[20]。本研究结果显示,在盐胁迫和碱胁迫下两个早熟禾品种叶绿素含量均呈下降趋势,表明盐碱胁迫诱导了草地早熟禾叶片的衰老,这种因叶绿素的生物学合成和降解而引起的叶片衰老可能是由于在盐碱胁迫条件下,草地早熟禾植株内的Na+升高,多余的钠离子使叶绿素与叶绿体蛋白结合变松,致使叶绿素遭到破坏,其中碱胁迫下叶绿素含量显著低于盐胁迫水平,表明叶绿素的生物学合成和降解对植物体根际和细胞内微环境pH值的变化非常敏感,高pH值加速了早熟禾叶片的衰老[21]。研究还表明不同耐盐碱性的两个品种的蒸腾速率与光合速率变化趋势基本保持一致,随着盐碱胁迫的增强,蒸腾速率、净光合速率不断降低。据报道,轻度盐碱胁迫下植物净光合速率的下降受气孔因素的影响,重度盐碱胁迫下净光合速率的下降受非气孔因素与气孔因素的协同作用[22],这有待进一步研究。在盐胁迫和碱胁迫下两个品种叶片叶绿素含量均显著降低,而植物的叶绿素含量与光合速率和蒸腾速率是密切相关的[23],因此叶绿素含量的降低也可能是导致草地早熟禾光合和蒸腾速率降低的重要原因。
3.2 草地早熟禾对中性盐和碱性盐胁迫的响应差异
有机酸是一类带有羧基的低分子化合物,是光合作用的中间产物,主要于TCA循环中在线粒体上产生,在环境胁迫下,植物体内有机酸的合成、积累、转运及根分泌增加在渗透调节和离子平衡等适应环境调节方面起着重要作用[18,24]。在本研究中发现,无论是在对照还是在盐碱胁迫条件下,草地早熟禾品种‘旅行者Ⅱ号’和‘午夜’叶中的草酸、柠檬酸、苹果酸和琥珀酸含量为根中的3~40倍,表明在植物中叶片是合成有机酸的主要场所[25]。在植物体内,草酸主要以可溶性钠、钾盐及不溶性钙、镁盐等形式存在于细胞中[26],以游离酸的形式存在较少。当植物细胞处在酸性微环境时,草酸盐晶体会形成游离草酸,同时根系也会分泌大量的草酸以调节大量的H+[27]。在本研究中,‘旅行者Ⅱ号’与‘午夜’在正常条件下分泌的草酸含量均较多,而在盐碱胁迫下分泌量降低,表明草酸可能是主要用于调节营养液中的H+来适应Hoagland营养液的酸性环境而在草地早熟禾耐碱胁迫中没有起明显的调控作用。
植物体内柠檬酸含量的升高与碳酸盐胁迫条件下的高pH值密切相关。在低碱胁迫(pH 8.0)下,柠檬酸的积累不明显, 在pH值达到10后,柠檬酸大幅增加,并且在耐盐碱品种‘午夜’叶中的积累量要远远大于碱敏感品种‘旅行者Ⅱ号’叶中的积累量,说明柠檬酸对草地早熟禾的抗碱胁迫起着主要的调节作用,这与在星星草[28]和大麦(Hordeumvulgare)[29]中的研究结果一致。郭立泉[30]研究认为星星草对碳酸盐胁迫下高pH的适应性调节作用主要是通过细胞质膜上ATP酶的作用向外分泌H+或通过体内积累具缓冲作用的酸性代谢产物进行细胞外微环境pH调节。当pH值达到一定程度时,星星草体内会积累柠檬酸等有机酸以保持细胞内pH的稳定[8]。本研究结果表明,在中性盐胁迫下,草地早熟禾体内有机酸含量无显著变化,而在碳酸盐胁迫下(高pH值)积累苹果酸、柠檬酸和琥珀酸,其作用可能主要是用于弥补细胞内阴离子的不足以及中和过多的阳离子以维持内环境的电荷平衡,调节植物体内pH及根际微环境pH值的稳定[31-32]。在盐碱胁迫下,碱地肤植株内的有机酸积累主要以草酸为主[7],而在星星草[8]、羊草[9]和向日葵[10]中以柠檬酸为主。在本研究中,草地早熟禾在碱胁迫下积累的有机酸主要为柠檬酸和琥珀酸,这些结果表明了不同物种的植物在适应盐碱胁迫的过程中其有机酸代谢特性不同,因而积累的有机酸种类也不一样,其具体的生理作用还需进一步研究。
脯氨酸作为一种重要的细胞渗透调节物质,在盐胁迫下大量累积是植物对盐离子胁迫的一种适应,对提高植物抗盐性起着重要作用[33];但也有研究认为盐胁迫下脯氨酸累积量更适于作为胁迫伤害指标[34]。本研究显示,在盐胁迫下,两个不同耐盐碱性的早熟禾品种叶片的脯氨酸含量显著升高,与对照相比,‘午夜’和‘旅行者Ⅱ号’的脯氨酸含量分别增加至对照的2.8和2.2倍;但在盐胁迫、轻度和重度碱胁迫下,脯氨酸在耐盐碱的品种‘午夜’中的含量均显著高于‘旅行者Ⅱ号’,表明盐胁迫下早熟禾叶片脯氨酸的积累有利于其维持较高的盐胁迫抗性,可作为盐胁迫下早熟禾抗盐性的一个重要指标,这与前人在番茄[35]和黄瓜[36]上的研究结果一致。但脯氨酸含量在盐胁迫条件下远高于碱胁迫条件下,且植株体内多种有机酸含量不同程度的增加,表明脯氨酸含量的升高主要与离子胁迫有关,而有机酸可能与细胞pH值胁迫密切相关[37]。
4 结论
碱性盐比中性盐对草地早熟禾的伤害更大,中性盐胁迫下主要以积累脯氨酸等渗透调节物质来调节渗透压,而在碱性盐胁迫下,主要通过加强植株内有机酸的代谢和积累,提高根系有机酸的分泌来调节植株体内和根际环境的pH值;耐盐碱的草地早熟禾品种在盐碱胁迫下能维持较高的光合作用和三羧酸循环中的有机酸代谢,促进了根系分泌有机酸,提高了植株内和根际环境pH的调节能力,因此具有较强的耐盐碱能力。
References:
[1] Li B, Wang Z C, Sun Z G,etal. Resources and sustainable resource exploitation of salinized land in China. Agricultural Research in the Arid Areas, 2005, 23(2): 154-158.
李彬, 王志春, 孙志高, 等. 中国盐碱地资源与可持续利用研究. 干旱地区农业研究, 2005, 23(2): 154-158.
[2] Zhou Z H. Study on the physiological response of three cool-season turfgrass species to salt stress. Grass and Turf, 2014, 34(2): 81-85.
周志红. 3种冷季型草坪草对盐胁迫的生理响应. 草原与草坪, 2014, 34(2): 81-85.
[3] Zhao L P, Feng J, Wang Y,etal. Theoretical and technological problems in the development of planting paddy in saline-alkali land of Songnen plain. Journal of Jilin Agricultural University, 2012, 34(3): 237-241.
赵兰坡, 冯君, 王宇, 等. 松嫩平原盐碱地种稻开发的理论与技术问题. 吉林农业大学学报, 2012, 34(3): 237-241.
[4] Gao S M, Zhou J W. Present situation and improvement measures of saline-alkaline soil in Songnen plain. Modernizing Agriculture, 2011, 6: 13-15.
高淑梅, 周继伟. 松嫩平原盐碱土现状及改良措施. 现代化农业, 2011, 6: 13-15.
[5] Jayasundara H, Thomson B, Tang C. Responses of cool season grain legumes to soil abiotic stresses. Advances in Agronomy, 1997, 63: 77-151.
[6] Ma J F, Ryan P R, Delhaize E. Aluminium tolerance in plants and the complexing role of organic acids. Trends in Plant Science, 2001, 6(6): 273-278.
[7] Ma Y, Qu B B, Guo L Q,etal. A characteristic of the growth and solute accumulation in shoots of an alkali-tolerantKochiasieversianaunder salt-alkaline mixed stress. Acta Prataculturae Sinica, 2007, 16(4): 25-33.
麻莹, 曲冰冰, 郭立泉, 等. 盐碱混合胁迫下抗碱盐生植物碱地肤的生长及其茎叶中溶质积累特点. 草业学报, 2007, 16(4): 25-33.
[8] Guo L Q, Chen J X, Cui J J,etal. Comparative studies of metabolic regulation of organic acids inPuccinelliatenuifloraunder salt and alkali stresses. Journal of Northeast Normal University (Natural Science Edition), 2009, 41(4): 123-128.
郭立泉, 陈建欣, 崔景军, 等. 盐、碱胁迫下星星草有机酸代谢调节的比较研究. 东北师范大学学报(自然科学版), 2009, 41(4): 123-128.
[9] Yan H, Shi D C, Yin S J,etal. Effects of saline-alkaline stress on the contents of nitrogen and several organisms ofAneurolepidiumchinense. Journal of Northeast Normal University (Natural Science Edition), 2000, 32(3): 47-52.
颜宏, 石德成, 尹尚军, 等. 盐、碱胁迫对羊草体内N及几种有机代谢产物积累的影响. 东北师范大学学报(自然科学版), 2000, 32(3): 47-52.
[10] Shi D, Sheng Y. Effect of various salt-alkaline mixed stress conditions on sunflower seedlings and analysis of their stress factors. Environmental and Experimental Botany, 2005, 54(1): 8-21.
[11] Yu J J, Li R, Liu M X,etal. Ecophysiological mechanisms associated with drought tolerance and post-drought recovery in warm- and cool-season turfgrasses. Acta Prataculturae Sinica, 2016, 25(11): 86-93.
于景金, 李冉, 刘梦娴, 等. 暖季型与冷季型草坪草差异响应干旱及旱后复水的生理生态机制. 草业学报, 2016, 25(11): 86-93.
[12] He Y L, Liu Y L, Cao W X,etal. Effects of salicylic acid on heat tolerance associated with antioxidant metabolism in Kentucky bluegrass. Crop Science, 2005, 45: 988-995.
[13] Bushman B S, Amundsen K L, Warnke S E,etal. Transcriptome profiling of Kentucky bluegrass (PoapratensisL.) accessions in response to salt stress. BMC Genomics, 2016, 17: 48.
[14] Qian Y L, Wilhelma S J, Marcum K B. Comparative responses of two Kentucky bluegrass cultivars to salinity stress. Crop Science, 2001, 41(6): 1895-1900.
[15] Hu L X, Zhang P P, Jiang Y,etal. Metabolomic analysis revealed differential adaptation to salinity and alkalinity stress in Kentucky bluegrass (Poapratensis). Plant Molecular Biology Reporter, 2015, 33: 56-68.
[16] Zhang P P, Fu J M, Hu L X. Effects of alkali stress on growth, free amino acids and carbohydrates metabolism in Kentucky bluegrass (Poapratensis). Ecotoxicology, 2012, 21: 1911-1918.
[17] Marcum K. Handbook of Turfgrass Management and Physiology. Boca Raton: CRC Press, 2008.
[18] Qiao F, Luo G H, Geng G G. Physiological responses ofViciafabaL. seedlings under NaCl and NaHCO3stress. Journal of Anhui Agricultural University, 2011, 38(5): 783-787.
乔枫, 罗桂花, 耿贵工. 蚕豆幼苗对NaCl和NaHCO3胁迫的生理响应. 安徽农业大学学报, 2011, 38(5): 783-787.
[19] Yang C W, Jianaer A, Li C,etal. Comparison of the effects of salt-stress and alkali-stress on photosynthesis and energy storage of an alkali-resistant halophyteChlorisvirgata. Photosynthetica, 2008, 46(2): 273-278.
[20] Lu S Y, Guo Z F. Physiological responses of turfgrass to abiotic stresses. Acta Prataculturae Sinica, 2003, 12(4): 7-13.
卢少云, 郭振飞. 草坪草逆境生理研究进展. 草业学报, 2003, 12(4): 7-13.
[21] Ke Y Q, Pan T G. Effects of salt stress on the ultrastructure of chloroplast and the activities of some protective enzymes in leaves of Sweet Potato. Acta Phytophysiologica Sinica, 1999, 25(3): 229-233.
柯玉琴, 潘廷国. NaCl 胁迫对甘薯叶片叶绿体超微结构及一些酶活性的影响. 植物生理学报, 1999, 25(3): 229-233.
[22] Kong D, Shi H B, Li Y L,etal. Studies on photosynthetic rate of oil sunflower under difference salt stresses. Agricultural Research in the Arid Areas, 2005, 23(1): 111-115.
孔东, 史海滨, 李延林, 等. 不同盐分条件下油葵光合日变化特征研究. 干旱地区农业研究, 2005, 23(1): 111-115.
[23] Wu Y B, Xue J H. Impacts of salt stress on the growth and photosynthesis of threeFraxinusspecies. Journal of Nanjing Forestry University (Natural Sciences Edition), 2002, 26(3): 19-22.
吴永波, 薛建辉. 盐胁迫对3种白蜡树幼苗生长与光合作用的影响. 南京林业大学学报(自然科学版), 2002, 26(3): 19-22.
[24] López-Bucio J, Nieto-Jacobo M F, RamIrez-RodrIguez V,etal. Organic acid metabolism in plants from adaptive physiology to transgenic varieties for cultivation in extreme soils. Plant Science, 2000, 160(1): 1-13.
[25] Liu Y H, Yu L. Review of research on oxalate function and its metabolism regulation in plant. Journal of Anhui Agricultural Sciences, 2006, 34(15): 3572-3573.
刘拥海, 俞乐. 植物草酸的功能及其代谢调控研究进展. 安徽农业科学, 2006, 34(15): 3572-3573.
[26] Çaliskan M. The metabolism of oxalic acid. Turkish Journal of Zoology, 2000, 24(1): 103-106.
[27] Liu J F. Effect of pH and Fe2+Stress on the Metabolism of Oxalate in Alfalfa (MedicagosativaL.). Lanzhou: Gansu Agricultural University, 2008.
刘剑锋. 酸和铁胁迫对紫花苜蓿草酸代谢的影响. 兰州: 甘肃农业大学, 2008.
[28] Shi D C, Yin S J, Yang G H,etal. Citric acid accumulation in an alkali-tolerant plantPuccinelliatenuifloraunder alkaline stress. Acta Botanica Sinica, 2002, 44(5): 537-540.
[29] Jiao W H. Study on Osmotic Adjusting Physiological Mechanism of Oat Under Salt Stress and Alkali Stress. Hohhot: Inner Mongolia Agricultural University, 2011.
焦伟红. 燕麦耐盐碱渗透调节机制研究. 呼和浩特: 内蒙古农业大学, 2011.
[30] Guo L Q. Comparison of Organic Acids Accumulation inPuccinelliatenuifloraunder Salt Stress and Alkali Stress. Changchun: Northeast Normal University, 2005.
郭立泉. 盐、碱胁迫下星星草体内有机酸积累比较. 长春: 东北师范大学, 2005.
[31] Guo L Q, Shi D C, Wang D L. The key physiological response to alkali stress by the alkali-resistant halophytePuccinelliatenuifloraisthe accumulation of large quantities of organic acids and into the rhizosphere. Journal of Agronomy and Crop Science, 2010, 196(2): 123-135.
[32] Xu H H. The Response of Organic Acid Metabolism, Photosynthesis and ChlorophyⅡ Fluorescence in an Alkali-tolerant HalophyteChlorisvirgataunder Alkali Stress and Salt Stress. Changchun: Northeast Normal University, 2010.
徐华华. 盐碱胁迫对虎尾草有机酸代谢、光合及荧光特性的影响. 长春: 东北师范大学, 2010.
[33] Bai B Z. Plant Physiology. Beijing: China Agriculture Press, 1999: 257-260.
白宝璋. 植物生理学. 北京: 中国农业科技出版社, 1999: 257-260.
[34] Lutts S, Majerus V, Kinet J M. NaCl effects on proline metabolism in rice (Oryzasativa) seedlings. Physiologia Plantarum, 1999, 105(3): 450-458.
[35] Santacruz A, Acosta M, Rus A,etal. Short term salt tolerance mechanisms in differentially salt tolerant tomato species. Plant Physiology and Biochemistry, 1999, 37(1): 65-71.
[36] Duan J J, Guo S R, Fan H F,etal. Effect of salt stress on the proline and polyamine metabolism in the roots of cucumber. Acta Botanica Boreali-Occidentalia Sinica, 2006, 26(12): 2486-2492.
段九菊, 郭世荣, 樊怀福, 等. 盐胁迫对黄瓜幼苗根系脯氨酸和多胺代谢的影响. 西北植物学报, 2006, 26(12): 2486-2492.
[37] Guo C Y, Wang X Z, Chen L,etal. Physiological and biochemical responses to saline-alkaline stress in two halophytic grass species with different photosynthetic pathways. Photosynthetica, 2015, 53(1): 128-135.
EffectsofneutralandalkalinesaltstressesonthegrowthandphysiologicalmetabolismofKentuckybluegrass
ZHANG Qiang1, LIU Ning-Fang1, XIANG Zuo-Xiang1, YANG Zhi-Jian1, JIANG Yuan-Li2, HU Long-Xing1*
1.CollegeofAgronomy,HunanAgriculturalUniversity,Changsha410128,China; 2.HunanBiologicalandElectromechanicalPolytechnic,Changsha410127,China
In order to investigate the effects of neutral and alkaline salt stresses on growth, leaf electrolyte leakage, chlorophyll content, photosynthetic characteristics, proline content and organic acid metabolism, two Kentucky bluegrass (Poapratensis) cultivars, ‘Midnight’ (tolerant of saline-alkaline conditions) and ‘Voyager Ⅱ’ (sensitive to saline-alkaline conditions) were subjected to neutral and alkaline salt treatments in hydroponic culture in growth chambers. The growth rate, chlorophyll content and photosynthesis decreased and leaf electrolyte leakage increased significantly under both types of salt stress, particularly under alkali stress. The tolerant cultivar showed less variation in response to the two salt stresses than the sensitive one. Leaf proline content only increased under neutral salt stress in both cultivars and no increase was observed under alkali stress. Oxalic acid was the only organic acid secreted by roots of either cultivar and increased significantly under alkali stress. The contents of leaf and root malic acid, citric acid and succinic acid in both cultivars hardly changed under neutral salt stress, but increased under alkali stress, with greater increase in ‘Midnight’ than in ‘Voyager Ⅱ’. Alkaline salt stress caused more damage to Kentucky bluegrass than neutral salt stress. Under neutral salt stress, proline accumulation was the key metabolite associated with change in the osmotic potential. Under alkaline salt stress, organic acids were linked to regulation of pH values in the plant and the rhizosphere. Midnight, the cultivar tolerant of both types of salt stress, can maintain a higher photosynthesis rate and organic acid metabolism, and stronger ability to regulate pH in the plant and in the rhizosphere under neutral and alkaline salt stresses. In summary, Midnight possesses stronger tolerance to neutral and alkaline salt stresses in Kentucky bluegrass.
Kentucky bluegrass; salt and alkali stress; organic acid; physiological metabolism
10.11686/cyxb2017086http//cyxb.lzu.edu.cn
张强, 刘宁芳, 向佐湘, 杨知建, 蒋元利, 胡龙兴. 盐碱胁迫对草地早熟禾生长和生理代谢的影响. 草业学报, 2017, 26(12): 67-76.
ZHANG Qiang, LIU Ning-Fang, XIANG Zuo-Xiang, YANG Zhi-Jian, JIANG Yuan-Li, HU Long-Xing. Effects of neutral and alkaline salt stresses on the growth and physiological metabolism of Kentucky bluegrass. Acta Prataculturae Sinica, 2017, 26(12): 67-76.
2017-03-02;改回日期:2017-05-27
湖南省教育厅课题(17B120)和湖南农业大学校人才引进基金(15YJ04)资助。
张强(1993-),男,湖南常德人,在读硕士。E-mail: 752769036@qq.com*通信作者Corresponding author. E-mail: grass@hunau.edu.cn

