免疫抑制剂血药浓度两种检测方法对比分析
王陆军
·临床医学·
·论著·
免疫抑制剂血药浓度两种检测方法对比分析
王陆军
目的采用化学发光微粒子免疫法(CMIA)监测2种免疫抑制剂普乐可复和环孢霉素血药浓度,比较CMIA与酶增强免疫(EMIT)2种方法之间的相关性。方法将检测对象按测定项目分别用EMIT和CMIA同时进行检测,以EMIT法为基准进行配对t检验和相关性分析。结果普乐可复2种方法相关性r=0.982(P<0.05),检测结果偏差为-0.71 μg/L(95%可信区间:-0.91~-0.50 μg/L),差异有统计学意义(P<0.05);环孢霉素2种方法相关性r=0.976(P<0.05),检测结果偏差为0.57 μg/L(95%可信区间:0.37~0.77 μg/L),差异有统学意义(P<0.05)。结论CMIA和EMIT均可对该2种免疫抑制剂治疗药物进行浓度检测,二者之间有良好的相关性,但患者要建立各自新的治疗窗范围。
普乐可复;环孢霉素;化学发光微粒子免疫;酶增强免疫
普乐可复(tacrolimus)、环孢霉素(cyclosporine)是器官移植手术后和自身免疫性疾病常用的免疫抑制剂。二者均有治疗窗窄,药代动力学差异大等特点,临床使用过程中需经常监测血药浓度[1-3]。近几年临床普遍采用重组葡萄糖-6-磷酸脱氢酶增强免疫法(EMIT)检测2种药物的血药浓度[4-5];近年美国雅培体外诊断有限公司推出了基于化学发光微粒子的免疫分析技术(CMIA),应用于ARCHI-TECTi2000或i1000系统的tacrolimus和cyclosporine检测试剂盒,代替了重组葡萄糖-6-磷酸脱氢酶增强免疫分析法对2种治疗药物进行监测。通过检测78例次肝移植和/或肾移植患者全血普乐可复和52例次环孢霉素的浓度,比较CMIA与EMIT之间的偏差及相关性。现报道如下。
1 资料与方法
1.1 一般资料
因各自的标准品、质控品都适用于各自的检测体系无可比性,通用的质控品难以购买,所以采用本实验室的130例次临床样本进行对比分析,130例次临床样本均来自肝移植和/或肾移植患者,标本采集多为口服相应药前30 min或口服相应药120 min后,分别抽取2 ml静脉血,注入EDTA抗凝的血常规管内,颠倒混匀2~3次,所有样本均采用全血于当日检测。因本研究是采用自身配对比较,测定中病例的选择、给药的方式方法、移植类型、移植时间等因素不会或较小影响2种测定方法的结果,因而未进一步进行影响因素分析。
1.2 仪器与试剂
CIMA法:采用美国雅培体外诊断生物有限公司生产的Architect i2000全自动化学发光免疫分析仪、配套的Tacrolimus和Cyclosporine试剂盒及相应的标准品、质控品和样本前处理试剂;EMIT法:采用德国西门子公司生产的SYVA Viva-E临床化学分析仪(简称SYVA Viva-E)、配套的Tacrolimus、Cyclosporine试剂盒及相应标准品、质控品和样本前处理试剂。G16型医用高速台式离心机,由河北省安新白洋离心机生产提供,XH-C型漩涡混合器,由江苏省金坛金伟实验仪器厂生产提供。50~250 μl、100~1 000 μl加样器由上海狄氏医疗器械有限公司提供。
1.3 检测方法
1.3.1 EMIT法 测试前开机,按照仪器操作规定常规进行日常保养。用配套的标准品定标后,每次测试用MODE 1标准品对标准曲线进行对比或校正,常规进行室内质量控制。所有试剂盒、标准品、质量控制品和临床样本均严格按照试剂说明书进行操作:4 ℃冰箱取出各种试剂后平衡至室温,试剂盒放入仪器试剂槽内,Tacrolimus加200 μl 全血样本于1.5 ml离心管,然后加入200 μl甲醇,再加50 μl样本前处理液,充分涡旋混匀,13 000 r/min(r=8 cm)高速离心6 min后,立即将上清液按顺序倒入样品杯,置于样品架子后立即上机测试。30 min后自动打印测试结果,所有质控品全部在控。Cyclosporine加100 μl 全血样本于1.5 ml离心管,然后加300 μl环孢霉素样本预处理试剂,充分涡旋混匀,13 000 r/min高速离心6 min后,同样立即将上清液按顺序倒入样品杯,置于样品架子后立即上机测试。30 min后自动打印测试结果,所有质控品全部在控。
1.3.2 CMIA法 该仪器开机后24 h运转,按照仪器操作规定常规进行日常保养,放置试剂于仪器试剂仓内,用配套标准品定标。所有标准品、质控品和临床样品均严格按说明进行操作:Tacrolimus加200 μl全血样品于1.5 ml离心管,然后加入200 μl全血沉淀剂,充分涡旋混匀,13 000 r/min(r=8 cm)高速离心5 min,上清液按顺序倒入移植预处理管,置于急诊样品架上机立即测定,30 min后测试结果自动传送至中文处理系统。Cyclosporine测定加200 μl全血样品于1.5 ml离心管,然后加入100 μl全血溶解剂,再加400 μl环保霉素全血沉淀剂,充分涡旋混匀,13 000 r/min高速离心5 min,上清液按顺序倒入移植预处理管,置于急诊样品架上机立即测定,30 min后测试结果自动传送至中文处理系统。
1.3.3 临床样本分组 根据Architect i2000对普乐可复检测体系的检测结果,将普乐可复浓度小于3.0 μg/L的16例样本设置为低浓度组;在3.0~<14.0 μg/L之间的43例样本设置为中浓度组;大于14.0 μg/L的19例样本设置为高浓度组。根据Architect i2000对环孢霉素检测体系的检测结果,将环孢霉素浓度小于80.0 μg/L的9例样本设置为低浓度组;在80.0~<300 μg/L之间的32例样本设置为中浓度组;大于300 μg/L的11例样本设置为高浓度组。
1.4 统计学处理
根据Architect i2000与SYVA Viva-E对普乐可复和环孢霉素的检测结果,应用SPSS 13.0统计软件。计量资料采用均数±标准差(x±s)表示,同种药物2种方法检测结果采用配对t检验,相关性采用直线回归分析。P<0.05 为差异有统计学意义。
2 结果
2.1 2种方法检测78例次患者样本tacrolimus结果
2种方法的检测结果比较见表1。由表1可知,在低浓度组CMIA法检测tacrolimus水平显著低于EMIT法(P<0.05),而在中浓度和高浓度组CMIA法检测tacrolimus水平虽低于EMIT法,但差异无统计学意义(P>0.05)。
2.2 2种方法检测52例次患者样本cyclosporine结果
2种方法检测结果比较见表2。低、中、高2浓度组的52例次患者样本cyclosporine检测结果,CMIA法均低于EMIT法,且差异有统计学意义(P<0.05)。

表1 2种方法检测78例次患者样本tacrolimus结果比较(x±s)
注:CMIA:化学发光微粒子免疫分析技术,EMIT:酶增强免疫法
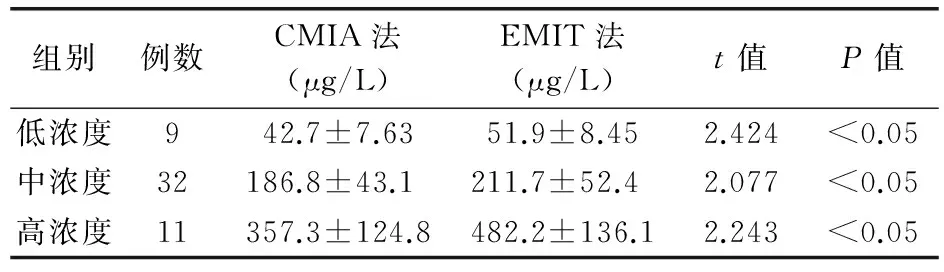
表2 2种方法检测52例次患者样本cyclosporine结果比较(x±s)
注:CMIA:化学发光微粒子免疫分析技术,EMIT:酶增强免疫法
2.3 比对结果
分别对78例次普乐可复和52例次环孢霉素样本检测结果进行方法学比对及回归分析,2种方法检测tacrolimus结果的相关性r=0.982(P<0.05);检测cyclosporine结果的相关性r=0.976(P<0.05),均具有显著的相关性。
3 讨论
3.1 普乐可复和环孢霉素浓度监测的重要性
普乐可复和环孢霉素是2种高效免疫抑制药,临床上广泛应用于预防器官移植的排斥反应和自身免疫性疾病的治疗[5]。2种药物在药动学和药效学上又存在着明显的个体差异,且都具有治疗的窗口范围较窄、药物之间具有复杂的相互作用、给药剂量与血药浓度具有显著的相关性不佳等特点。因此,临床必须不断根据患者体内药物监测结果适时调整用药剂量,真正实施个体化给药,这样对减少移植物排斥反应发生的频次、减少免疫抑制剂的不良反应及改善移植物长期生存率具有非常重要的临床意义[6-7]。
3.2 EMIT和CMIA法的测定原理
用于生物样本内普乐可复和环孢霉素2种免疫抑制剂的定量分析法,主要有免疫分析和色谱分析,其中免疫分析主要包括放射受体分析法、放射免疫法、荧光偏振免疫分析、ELISA法、EMIT法、化学发光法(CL)和CMIA等[8-9]。色谱分析目前主要有液相色谱和气相色谱。不同的方法对样本提取的过程不同,对代谢物的识别亦不同,因此所得的结果也不相同。CMIA测定原理是用吖啶脂标记药物分子作为竞争物,用相应普乐可复或环孢霉素单克隆抗体包被的顺磁微珠作为捕获物,将处理完的样品与包被的单克隆抗体的顺磁微珠混合反应,然后加入吖啶脂标记的相应药物分子,共同竞争磁微珠上的药物抗体空位,然后外加磁场使磁微珠分离,清洗后加入预激发液与激发液试剂产生化学发光反应,化学发光的强度与样品中的药物浓度成反比,根据标准曲线,即可求得样品中普乐可复或环孢霉素的浓度。而SYVA Viva-E是根据抗原抗体结合后酶活性的多少计算药物浓度。SYVA Viva-E的检测原理是将样本中被测药物与酶试剂中标记有重组酶葡萄糖-6-磷酸脱氢酶(rG6PDH)的药物竞争,活性(游离)的rG6PDH将抗体试剂中的氧化型烟酰胺腺嘌呤二核苷酸(NADPH)转化为还原型烟酰胺腺嘌呤二核苷酸(NAD),致使动态吸光度改变,计算出其浓度。
3.3 2种检测体系的结果分析
实验结果表明,CMIA药物浓度测定操作系统的智能化自动化程度高[10],普乐可复和环孢霉检测的精密度分别为0.3 μg/L和4.7 μg/L,检测范围分别为0~30 μg/L和0~1 500 μg/L,线性范围分别为0.9~30 μg/L和11.7~1 500 μg/L。而EMIT法检测血普乐可复和环孢霉检测的精密度分别为0.6 μg/L和10.6 μg/L,检测范围分别为0~30 μg/L和0~1 000 μg/L,线性范围分别为2.0~30 μg/L和40~1 000 μg/L,2者之间有显著差异。在对ARCHITECT i2000系统检测2种血药浓度初步评价和分析性能验证[11]的基础上,我们进行了该项比对实验及相关性分析。表1和表2显示2种检测方法检测对该2种药物浓度的检测结果都有差异,CMIA 在检测普乐可复浓度时结果低于 EMIT法,在低浓度时有显著差异,而在中浓度和高浓度时虽有降低但差异无统计学意义,CMIA在检测环孢霉素时3组均低于EMIT法,且有显著差异,但2种方法具有较高的相关性。其CMIA法检测普乐可复和环孢霉素的结果低于EMIT法,可能与其代谢产物的交叉反应率要比EMIT 低有关,其抗体特异性比EMIT要高,所以CMIA系统测试结果普遍低于EMIT系统测试结果,即系统偏差。由此可以看出,方法学的不同及与代谢产物发生交叉反应的非特异性是产生偏倚的主要原因[12]。多项研究表明,CMIA试剂盒在检测全血普乐可复和环孢霉素浓度时,有非常好的效果[10-13]。
3.4 临床使用性及推广应用
虽然色谱分析的结果较为准确,但临床难以推广。ARCHITECT i2000检测系统是近年来发展起来的一种高灵敏度的检测方法,至于其检测结果与EMIT 法检测结果的相关性如何,是我们要提供给临床医师调整用药的关健参考依据。基于以上分析及本检测结果,我们认为可以选择CMIA法和EMIT法进行普乐可复和环孢霉素治疗药物的检测。因其自动化程度高、样本用量少,样本预处理简单、快速,测定结果与临床符合程度较好,并且适用急诊和大样本分析测定等优点,现国内应用较多。因2种方法的检测结果存在偏倚,故临床医师对2种方法的检测结果之间不应直接比较,并且各个实验室得到的结果也可能会存在差异,这可能给临床医师的治疗带来一定的困惑[14]。所以作者认为,由于临床状态的复杂性,建议患者连续使用同一种检测方法,或者是连续在同一个实验室检测,医师应根据患者情况及临床经验确立患者的血药浓度范围,以便合理有效地调整该2种免疫抑制剂用量,避免或减少排斥反应和药物不良反应的发生[14-15]。
[1] Djebli N,Rousseau A,Hoizey G,et al. Cyclosporine pop-ulation harmacokinetic / pharmacogenetic analysis andBayesian modelling in kidney transplant recipient[J].Clin pharmacokinet,2010,45(11):1135-1148.
[2] Benkali K,Prémaud A,Picard N,et al. Tacrolimuspopulation harmacokinetic - pharmacogenetic analysisand Bayesian estimation in renal transplant recipients[J]. Clin pharmacokinet,2009,48(8):805-816.DOI:10.2165/11318080-000000000-00000.
[3] 沈燕,严春寅,丁翔,等. 肾移植术后普乐可复应用的临床研究[J].苏州大学学报( 医学版) ,2010,30(3):560-562.DOI:10.1111/j.1365-2125.2008.03251.x.
[4] Mathew BS,Fleming DH,Jeyaseelan V,et al. Alimitedsampling strategy for tacrolimus in renal transplant pa-tients[J]. Br J Clin Pharmacol,2008,66( 4) : 467-472.
[5] 田野,解泽林,唐雅望,等. 肾移植术后免疫抑制剂的合理应用[J]. 中国医学科学院学报,2009,31(3):256-258.
[6] 张培环.化学发光微粒子免疫分析与荧光偏振免疫分析检测环孢霉素血药浓度比较[J]. 实用医药杂志,2012,29(5):424-425.DOI:10.3969/j.issn.1671-4008.2012.05.029.
[7] 张善堂,唐丽琴,聂松柳. 免疫抑制剂的治疗药物监测研究进展[J]. 中国临床保健杂志,2012,15(4):433-436.DOI:10.3969/J.issn.1672-6790.2012.04.044.
[8] Mu Y, Zhang J, Zhang S, et al.Traditional Chinese medicines wu-wei-zi(Schisandra chinensis)and gan-cao(Glycyrrhiza ura-lensis Fisch)activatepregnane X recptor and increase warfarin clearance in rats[J].J Pharmacol ExpTher,2006;316:1369-1377.DOI:10.1124/jpet.105.094342.
[9] 沈景芬. 环孢素A血药浓度监测方法的研究进展[J].安徽医药,2009,13(1):83-85.DOI:10.3969/j.issn.1009-6469.2009.01.044.
[10] 冯艳青,刘振红,张杨丽,等.三种他克莫司测定试剂盒测定移植病人全血中他克莫司浓度的比较[J].中国卫生检验杂志,2012,22(8):1993-1996.
[11] 毕波,吕元. 定量检测系统的方法学性能验证实验结果的评价[J].中华检验医学杂志,2007,30(12):1332-1334.DOI:10.3760/j.issn:1009-9158.2007.12.003.
[12] 张弋,付鹏,郑虹. 普乐可复在151例肝移植受者的常规检测的群体药动学研究[J].中国药学杂志,2008,43(24):1897-1902.
[13] 袁明生. 化学发光微粒子免疫分析法检测梅毒螺旋体抗体的应用评价[J]. 检验医学,2010,25(7): 571-572.
[14] 姬怀雪.他克莫司血药浓度监测注意事项与用药指导[J].中国现代医药杂志,2011,13(10):112-113.DOI:10.3969/j.issn.1672-9463.2011.10.053.
[15] 逄晓云,沈金芳.植物药对他克莫司血药浓度的影响[J].中国临床药理学与治疗学,2009,14.
Comparison and analysis of two different detection methods for blood concentration levels of immunosuppressant
WangLujun
(TraditionalChineseMedicineHospital,LingchengDistrict,DezhouCity,Dezhou253500,China)
ObjectiveTo investigate the sensitivity of chemoluminescent micro-particle immunoassay (CMIA) and enzyme multiplied immunoassay (EMIT) for the detection of blood drug concentration levels of tacrolimus and cyclosporine, and analyze the relationship between the CMIA and EMIT methods.MethodsIn accordance with measuring items, the 2 immunosuppressant agents were detected simultaneously by EMIT and CMIA. EMIT method was used as a detection standard for pairt-test and correlation analysis.ResultsThe correlation between the 2 detection methods for tacrolimus wasr=0.982 (P<0.05), and the deviation of the detected results was -0.71 μg/L (95% confidential interval: -0.91~-0.50μg/L), and statistical significance could be seen, when comparisons were made between them (P<0.05). The correlation between the 2 detection methods for cyclosporine wasr=0.976 (P<0.05), and the deviation of the detected results was 0.57μg/L(95% confidential interval: 0.37~0.77μg/L), and statistical significance could also be found, when comparisons were made between them (P<0.05).ConclusionCMIA and EMIT could all be used for the detection of these 2 immunosuppressant agents, and there was good correlation between these 2 detection methods. However, their own range of therapeutic window should be established for the patients, when CMIA was used.
Tacrolimus; Cyclosporine; Chemoluminescent micro-particle immunoassay; Enzyme multiplied immunoassay
R446.1
A
10.3969/j.issn.1009-0754.2017.06.021
253500 山东 德州,德州市陵城区中医院
2017-09-28)
(本文编辑:彭润松)

