巴西橡胶树HbMYB62转录因子基因的克隆和表达分析
陆燕茜 张 冬 王立丰 王纪坤
(1.海南省热带生物资源可持续利用重点实验室,海南大学热带农林学院,海口 570228; 2.中国热带农业科学院橡胶研究所,农业部儋州热带作物科学观测试验站,儋州 571737)
巴西橡胶树HbMYB62转录因子基因的克隆和表达分析
陆燕茜1张 冬1王立丰2*王纪坤2
(1.海南省热带生物资源可持续利用重点实验室,海南大学热带农林学院,海口 570228;2.中国热带农业科学院橡胶研究所,农业部儋州热带作物科学观测试验站,儋州 571737)
R2R3-MYB类转录因子参与包括逆境胁迫反应等多种生物反应。为鉴定橡胶树中MYB转录因子的结构与功能,从橡胶树叶片中克隆HbMYB62全长的cDNA序列。该基因片段大小为1 013 bp,包含945 bp的ORF,编码314个氨基酸残基。其推导的氨基酸序列具有植物HTH_MYB的特异性结构域,并与拟南芥AtMYB62具有高度相似性。qRT-PCR发现HbMYB62主要在橡胶树花中表达,而在树皮、叶和乳胶中表达量较少。其叶片表达量在过氧化氢(H2O2)、脱落酸(ABA)、水杨酸(SA)等处理下显著上调。表明HbMYB62与橡胶树的抗逆反应和激素信号传导过程有关,为进一步研究其结构和功能打下基础。
巴西橡胶树;HbMYB62;机械伤害;激素;基因表达
MYB转录因子是植物最大的转录因子家族成员之一,参与植物激素信号转导和各种应激反应[1]。MYB类转录因子由3个保守的结构域组成,即DNA结合结构域、转录激活结构域和一个不完全界定的负调节区[2]。根据MYB结构域重复个数,把MYB类转录因子分为4种类型,即单一的MYB结构域蛋白(R1/R2)、包含2个重复的2R蛋白(R2R3)、包3个重复的3R蛋白(R1R2R3)和含4个MYB重复的4R-MYB序列[3]。R2R3-MYB蛋白构成植物中MYB蛋白的最大的亚家族并调节植物特有的细胞功能。它们在初级和次级代谢,细胞形态和形态发生,发育过程和对植物中生物和非生物胁迫的反应中起作用[4]。例如,AtLHY和AtCCA1参与昼夜节律控制[5]。AtCPC是根毛形成所需要的[6]。水稻OsMYBS2和OsMYBS3调节α-淀粉酶基因在糖和赤霉素信号反应中的表达[7],GmMYB176调节大豆中的CHS8表达和异黄酮合成[8],AtMYBL2参与拟南芥中类黄酮生物合成和油菜素类固醇信号通路[9~10]。AtMYB62为R2R3-MYB类转录因子,定位在细胞核上,是磷饥饿诱导基因(Pi starvation-induced,PSI)的负调控因子,过表达AtMYB62能改变植株对磷饥饿的响应,如改变根系结构并促进植株对Pi的吸收[11]。虽然在不同的植物物种中已经鉴定出大量的MYB基因家族[12~16],但大多数MYBs在植物细胞中的功能仍不清楚。
橡胶树是橡胶制品和木材制造中最重要的天然橡胶来源[17],天然橡胶的生产受到各种植物生理条件、环境变异和病原性疾病的影响。例如机械伤害、过氧化氢(H2O2)、植物激素和干旱等对橡胶树的生长发育均有一定影响。橡胶树中MYB转录因子的结构与功能研究较少,已证明HbMYB1基因在橡胶树死皮病(tapping panel dryness,TPD)树的树皮中的表达显着降低[18],在烟草中过表达HbMYB1能抑制胁迫反应从而引起细胞死亡[19]。为探究MYB基因在橡胶树中的生物学功能,本研究克隆并鉴定HbMYB62的cDNA全长序列,并利用荧光定量PCR技术分析该基因表达模式,为阐明其在橡胶树逆境抗性的功能打下基础。
1 材料与方法
1.1 实验材料
用中国热带农业科学院橡胶研究所培育的巴西橡胶树品种‘CATAS7-33-97’正常割胶的10年生成龄树为材料,进行MYB62基因克隆和不同组织的表达分析。用‘CATAS7-33-97’品种1~1.1m高,2年生顶棚稳定芽接苗为材料,进行脱落酸(abscisic acid,ABA)、水杨酸(salicylic acid,SA)、茉莉酸甲酯(methyl jasmonate,MeJA)、乙烯利(ethephon,ETH)、过氧化氢(hydrogen peroxide,H2O2)、干旱和机械伤害处理。
1.2 实验方法
1.2.1总RNA的提取和cDNA的合成
提取巴西橡胶树不同组织和处理样品中的总RNA,方法参照庄海燕等的方法[20],使用Thermo Fisher NanoDrop2000超微量核酸蛋白分析仪(Gene Company Limited,上海)检测所提RNA的浓度、纯度,并用1%甲醛变性胶电泳检测RNA的完整性[21]。最后利用RNA反转录试剂盒(Revert AidTMFirst Strand c DNA Synthesis Kit,Fermentas)进行cDNA的合成。
1.2.2克隆HbMYB62cDNA的全长
为了获得HbMYB62的全长,设计了用于RACE的引物(表1),通过使用由3′提供的寡聚dT-3位点连接引物(5′-CCAGTGAGCAGAGTGACGAGGACTCGAGCTCAAGCTTTTTTTTTTTTTTT-3′)反转录1μg总RNA。将3′-RACE试剂盒(Takara,Dalian,China)中的特异性引物来合成分别设计为基于MYB保守片段的引物3HbMYB62F和嵌套引物3HbMYB62R。使用通用引物(5′-CCAGTGAGCAGAGTGACG-3′)和总体积为50μL的含有2.5μL3′-ready cDNA的特异性引物3HbMYB62进行第一轮3′-RACE,之后进行31个循环的扩增(94℃1min,55℃1min,72℃1min)。使用通用引物(5′-GAGGACTCGAGCTCAAGC-3′)和特异性引物3HbMYB62R,在与第一轮扩增的相同条件下将PCR产物稀释10倍作为第二轮3′-RACE的模板。纯化产物并克隆到pGEM-T easy载体中,随后测序。
表1HbMYB62全长扩增和荧光定量引物序列
Table1PrimerSequencesoffulllengthcloningandqRT-PCRofHbMYB62
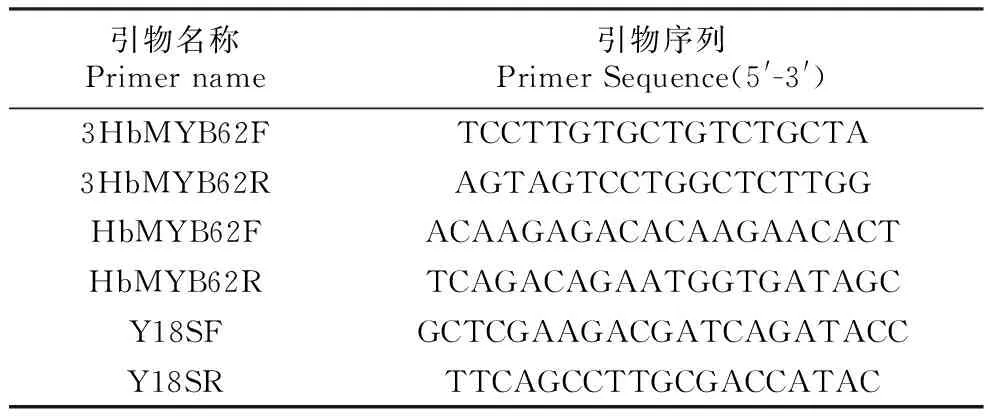
引物名称Primername引物序列PrimerSequence(5'-3')3HbMYB62FTCCTTGTGCTGTCTGCTA3HbMYB62RAGTAGTCCTGGCTCTTGGHbMYB62FACAAGAGACACAAGAACACTHbMYB62RTCAGACAGAATGGTGATAGCY18SFGCTCGAAGACGATCAGATACCY18SRTTCAGCCTTGCGACCATAC
1.2.3 HbMYB62生物信息学分析
利用在线工具PROSITE,ProtParam,SignalP,Tmpred,TMHMM,PSORT,Mitoprot和TargetP对HbMYB62保守结构域和其他生物信息学进行分析。使用NCBI保守结构域分析网站(http://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi?)和SMART(http://smart.embl-heidelberg.de/)鉴定蛋白质结构域的结构[22]。ExPASy服务器上的ProtParam工具(http://web.expasy.org/compute_pi/)用于计算HbMYB62蛋白的理论等电点和分子量。TMHMM 2.0工具(http://www.cbs.dtu.dk/services/TMHMM/)用于预测HbMYB62蛋白中的跨膜螺旋[23]。使用DNAMAN软件和ClustalX软件进行多个序列比对[24]。使用版本6.0的MEGA进行系统发育分析[25]。
1.2.4 HbMYB62的表达分析
干旱处理采用Wang的方法[26],在处理前采集芽接苗叶片作为处理0 d的样品,当天上午10:00开始干旱处理,第2天上午10:00采样作为处理1 d之后的样品,第3天上午10:00采样作为处理2 d后的样品,以此类推,采集处理3、4、5、6、7、8、9和10 d后的样品。机械伤害处理采用Piffanelli等方法[27],采集处理前的叶片和处理了0.5、1、2、6、10、24 h后的叶片。在芽接苗上分别喷施200 μmol·L-1(w/v)ABA,1.0%(V/V)ET,5 mmol·L-1(w/v) SA,200 mmol·L-1MeJA和2%(V/V) H2O2,所有药剂用0.05%(V/V)乙醇进行溶解,对照植株喷施0.05%乙醇水溶液,收集处理前和处理完成后0.5、2、6、10、24、48和72 h的叶片做进一步表达分析。荧光定量引物为HbMYB62F、HbMYB62R、Y18SF和Y18SR(表1),采用伯乐CFX96 TouchTMReal-Time PCR Detection System(Bio-Rad Laboratories,Inc,Hercules,California,USA),程序为95℃ 13 min退火,随后40个循环的扩增(94℃ 10 s,60℃ 20 s,72℃ 30 s)。相对表达量采用伯乐荧光定量PCR仪软件进行分析。每批处理3个生物学重复,数据为3个生物学重复和3次技术重复的均值和标准误。
1.2.5 数据统计分析
使用SAS检验的单因素方差分析,ANVOA和Duncan检验分析差异显著性,使用Origin数据分析和绘图软件OriginPro2017(Origin Lab Corporation,Massachusetts,USA)作图。

图1 HbMYB62基因编码区的核苷酸和推导的氨基酸序列Fig.1 Nucleotide and deduced amino acid sequences of HbMYB62 coding region
2 结果与分析
2.1 HbMYB62的克隆
从橡胶树‘CATAS7-33-97’叶片中克隆得到HbMYB62 cDNA全长序列,通过PCR扩增ORF,并测序确认,将该cDNA命名为HbMYB62(Genbank:JQ178240.1)。其长度为1 013 bp,包含945 bp的ORF,其编码314个氨基酸残基,两端为31 bp的5′-UTR(非翻译区)上游起始密码子和55 bp的3′-UTR下游终止密码子(图1)。蛋白质的分子量约为35.2 kDa,理论等电点(pI)为6.50。HbMYB62推导的氨基酸序列具有植物MYB转录因子家族的特异性结构域SANT-mybDNA结合结构域。(图2),分别位于51-74氨基酸WNLLAKCAG-LRRTGKSCRLRWLNY和103-126氨基酸WSKIAQHLP-GRTDNEIKNYWRTRV处(图3)。Ser、Leu、Asn在氨基酸序列组成中出现频率较高,分别占15.6%、9.2%和6.1%,而一些氨基酸如Pyl、Sec在氨基酸序列中则没有出现。通过TMHMM Server V.2.分析发现HbMYB62无跨膜蛋白,通过TargetP 1.1分析发现,HbMYB62蛋白无信号肽。采用MitoProtII、亚细胞定位分析表明其位于线粒体或者细胞核中。
该基因与其他植物桉树EgMYB1(Eucalyptusgunnii,CAE09058)、白云杉PgMYB1(Piceaglauca,ABQ51217)、火炬松PtMYB1(Pinustaeda,AAQ62541)、豌豆PsMYB26(Pisumsativum,CAA71992)和黑云杉PmMYBF1(Piceamariana,AAA82943)的蛋白进行同源性分析发现,它们的相似性分别为25.70%,23.01%,25.11%,37.50%和23.86%。系统进化树分析显示橡胶树HbMYB62与拟南芥的AtMYB62聚在一起,表明它们之间亲缘关系最近(图4)。
2.2 HbMYB62的表达分析
通过qRT-PCR数据分析发现,HbMYB62基因在橡胶树花、树皮、叶、胶乳中均有所表达,但在树皮、叶、胶乳中表达量相对极低,花中表达量是树皮的700倍左右(图5)。
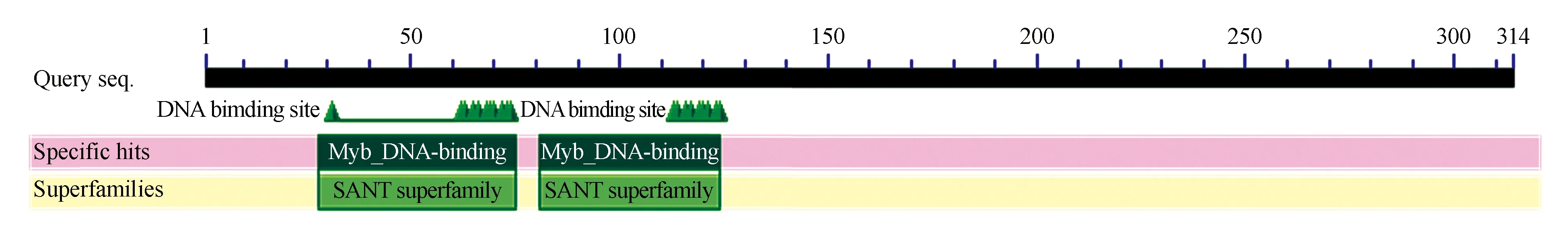
图2 HbMYB62推导氨基酸保守结构域Fig.2 The conserved domain of HbMYB62 deduced amino acid sequence
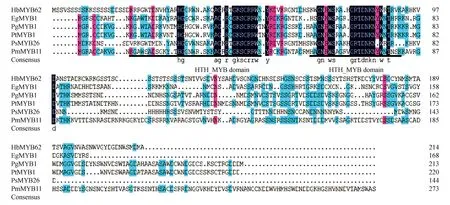
图3 橡胶树HbMYB62与其他植物MYB蛋白序列多重比对Fig.3 Multiple protein sequence alignment of HbMYB62 with other plant MYB proteins
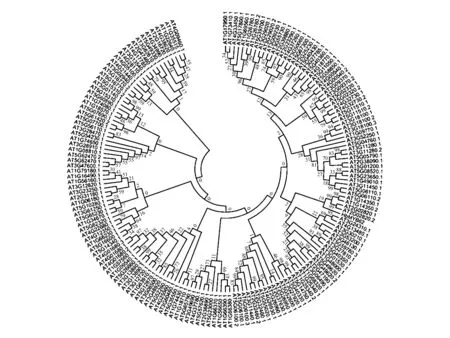
图4 橡胶树HbMYB62蛋白与拟南芥中MYB家族成员的系统树聚类分析Fig.4 Phylogenetic tree of HbMYB62 from rubber tree and MYB gene members from Arabidopsis with indicated GenBank accession numbers
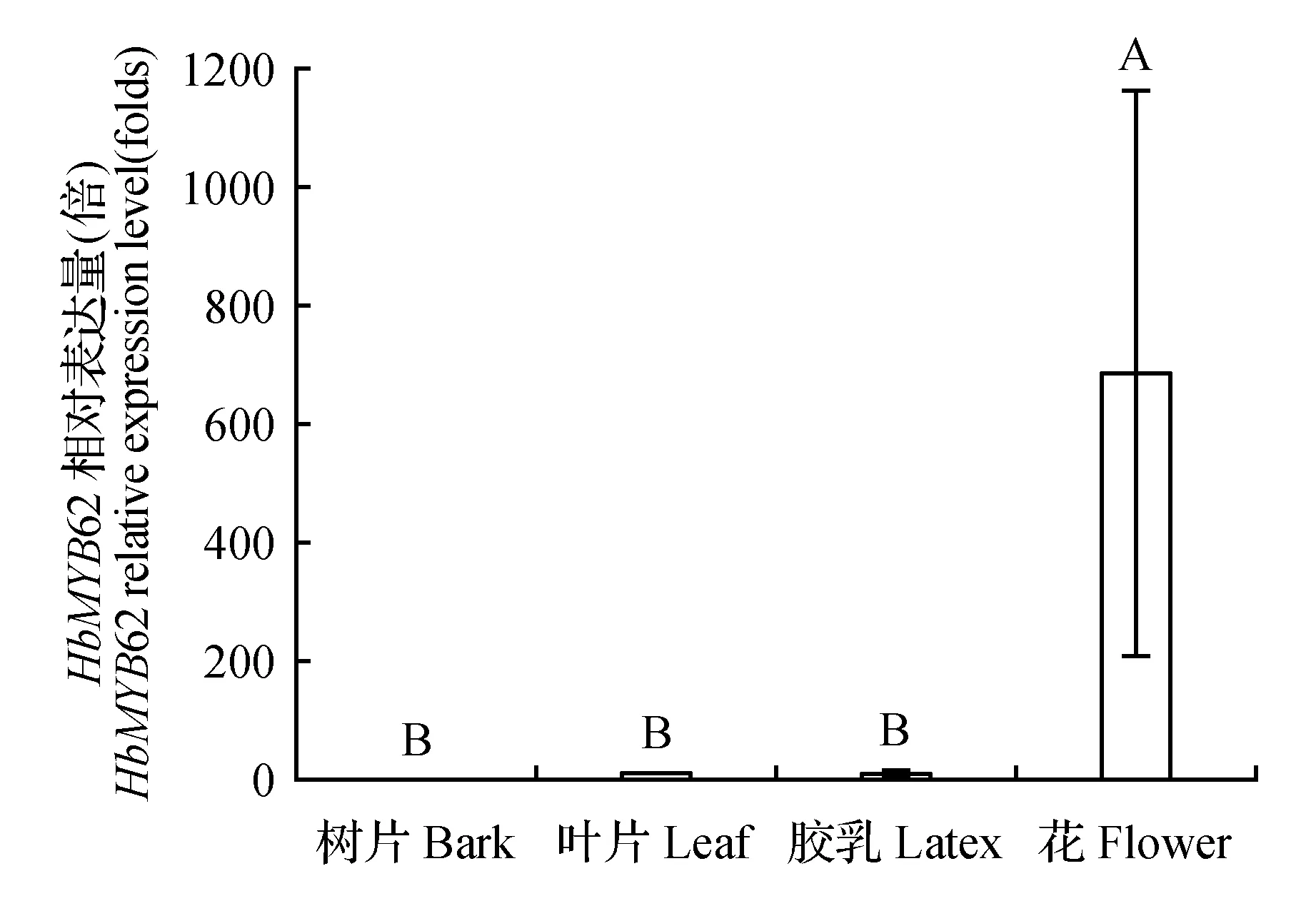
图5 HbMYB62基因的组织表达分析 各柱形图上用不同大写字母标识表示数据间差异极显著(P<0.01) 下同。Fig.5 Tissue expression analysis of HbMYB62 Different uppercase letters above each column means significant at P<0.01 level The same as below.
如图6所示,HbMYB62基因的表达量在ABA作用下,0~24 h无显著性差异,48 h时表达量显著升高,且达到最高值,72 h时下降到处理前水平。在干旱处理下HbMYB62基因表达量在1 d无显著性差异,2 d时表达量显著性升高,达到最高值,为0 d的70倍左右。之后表达量下降,但相对于处理前都为上调表达。从图中可看出,在ABA、干旱处理下,HbMYB62基因的表达量都是在处理48 h时显著升高且达到最高值。
如图7所示,叶片在经机械伤害处理后,HbMYB62基因的表达量在0.5~2 h首先上调,在2 h期间表现出最高的表达水平,随后下调,在10 h时又有所上调,随着处理时间的延长,表达量逐渐下降。在H2O2处理下HbMYB62的表达量初期无显著性变化,在6 h时表达量显著上升,10 h时基因表达量达到最高值。HbMYB62基因的表达量在H2O2、机械伤害处理下都上调,这表明H2O2、机械伤害均正调控HbMYB62的表达。
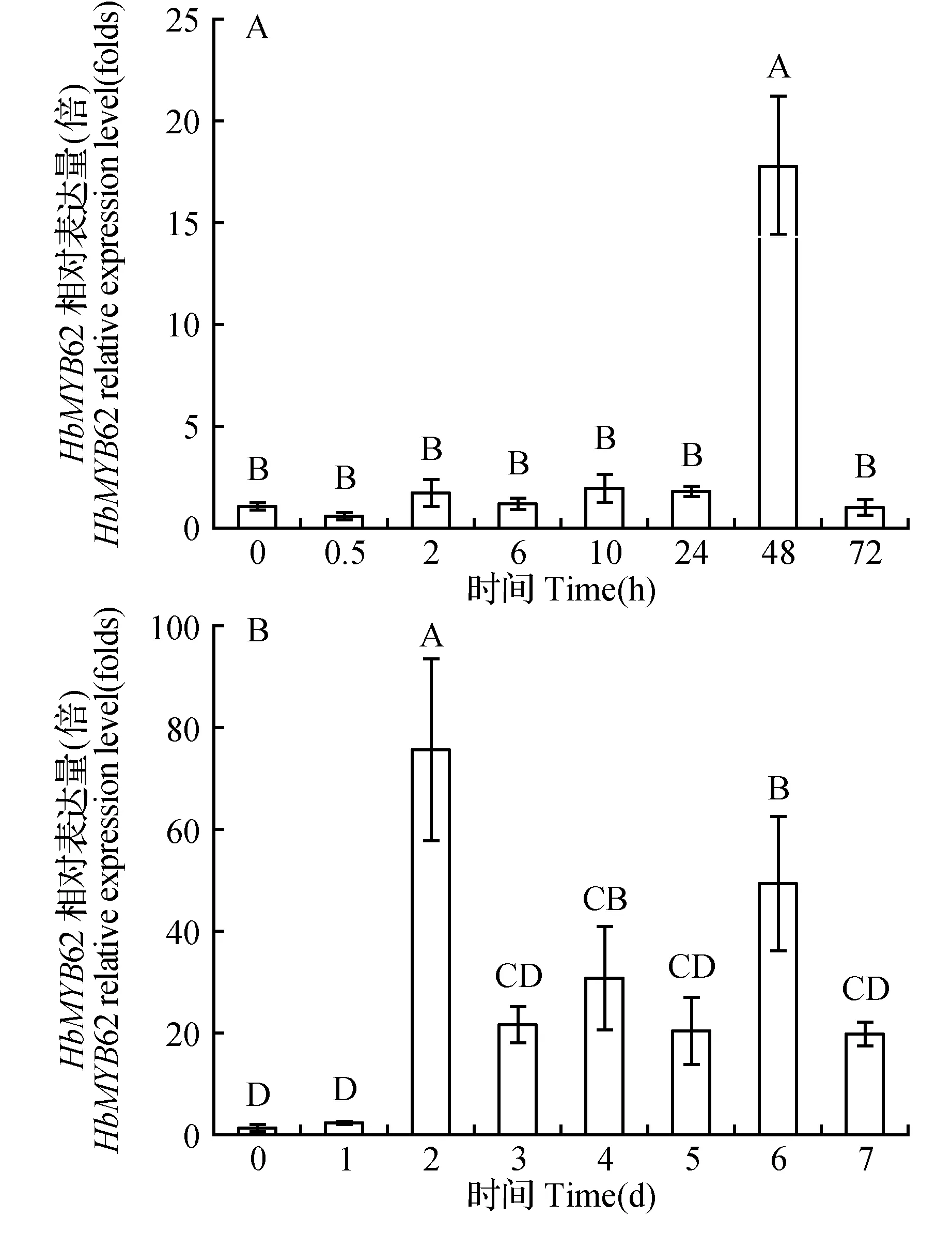
图6 橡胶树叶片中HbMYB62基因在ABA(A)和干旱(B)条件下的表达分析Fig.6 Expression analysis of HbMYB62 in H.brasiliensis leaves after ABA(A) and drought(B) treatment
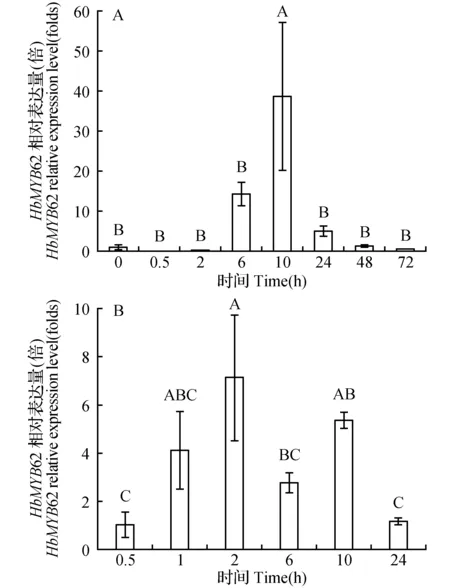
图7 过氧化氢(A)和机械伤害(B)处理下HbMYB62基因的表达分析Fig.7 HbMYB62 expression analysis under H2O2(A) and mechanical wounding(B) treatment
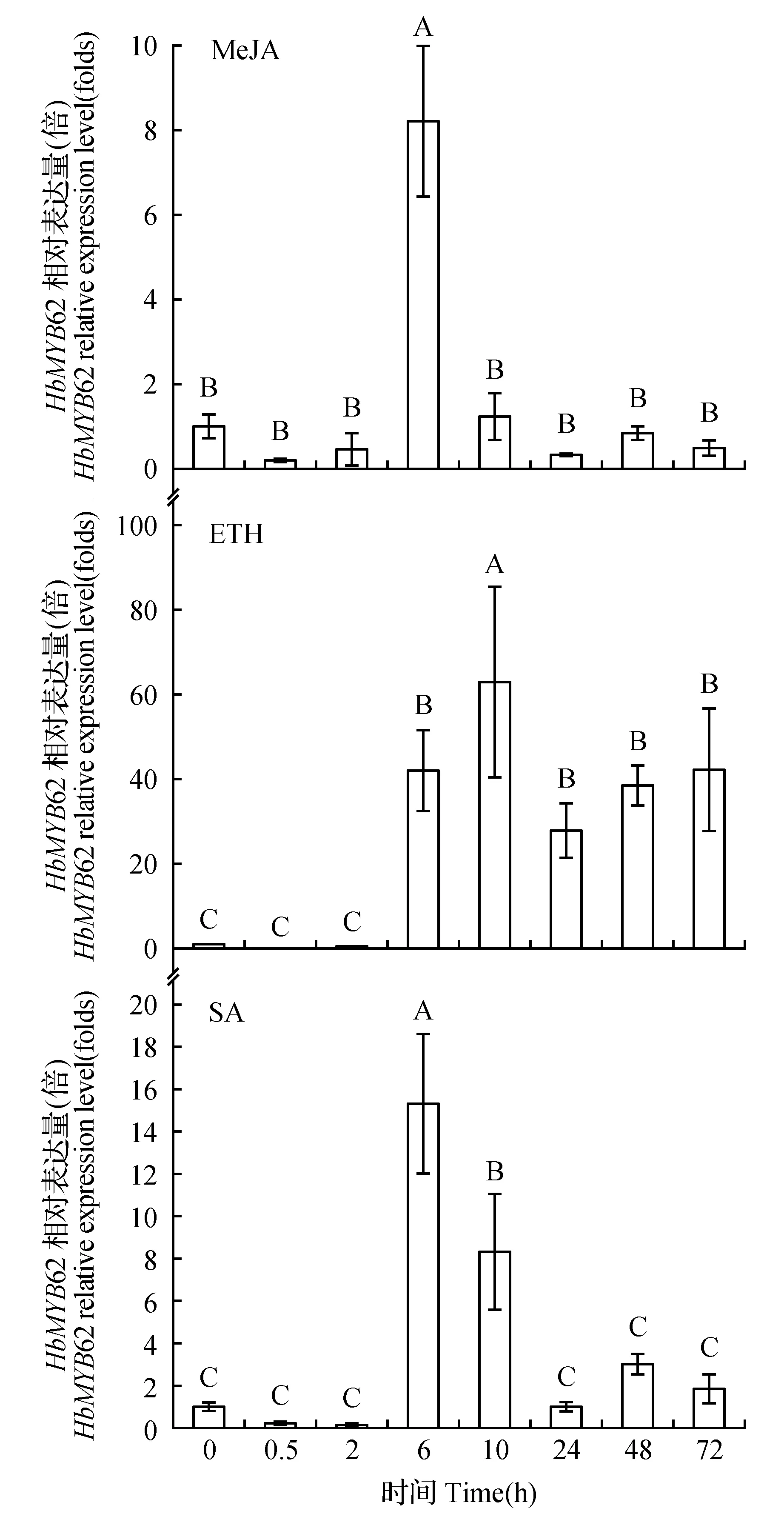
图8 HbMYB62基因在不同激素处理下的表达分析Fig.8 HbMYB62 expression analysis under different hormones treatment
如图8所示,在MeJA,ETH,SA处理6 h后,橡胶树HbMYB62表达量相对于处理前均有所上调。处理0~2 h,HbMYB62因的表达量无显著性变化,但都在处理6 h时表达量显著性上升,且在MeJA和SA处理6 h时基因表达量升到最高,ETH处理10 h时达到表达水平最高点。
3 讨论
MYB类转录因子家族是植物中最大的转录因子家族之一,广泛参与植物细胞分化、环境因子和激素应答等生物过程[18],对次生代谢以及叶片等器官形态建成具有重要的调节作用[28~29]。大多数植物MYB蛋白是R2R3型。R2R3-MYB蛋白构成植物中MYB蛋白的最大的亚家族,它们在初级和次级代谢、细胞形态和形态发生、发育过程和对植物中生物和非生物胁迫的反应中都起到一定作用[4,30]。
橡胶树中关于MYB结构与功能相关报道还较少,本研究克隆得到橡胶树HbMYB62其推导的氨基酸序列具有植物HTH_MYB家族的特异性结构域。与其他植物EgMYB1,PgMYB1,PtMYB1,PsMYB26和PmMYBF1的蛋白相似性分别为25.70%,23.01%,25.11%,37.50%和23.86%。通过HbMYB62蛋白与拟南芥MYB家族成员的聚类分析结果发现,该蛋白与AtMYB62属于同一分支并具有高度相似性。研究证明,AtMYB62定位在细胞核上,是一个参与低磷胁迫转录调控的MYB超家族转录因子,可能通过调控赤霉素生物合成途径中的基因来影响植物体内赤霉素浓度,进而调节植物对低磷的响应[11]。因此,预测HbMYB62蛋白和AtMYB62蛋白的功能相近,即与调节植物对低磷的响应有关。
本研究利用qRT-PCR技术分析发现,HbMYB62在橡胶树花、树皮、胶乳、叶中均有表达,在花中表达量较高,但树皮、叶、胶乳中表达量相对极低。根据HbMYB62在各组织中表达程度,表明它在花中比在树皮、叶和胶乳中发挥着更重要的作用。在ET处理下,橡胶树HbMYB62基因的表达量显著上调最高能达到处理前65倍左右。乙烯对植物生长和发育等多方面都有影响,其中包括花的发育,器官的脱落和衰老等。由此推测HbMYB62基因可能参与乙烯信号途径来调控花的发育。
与植物干旱胁迫相关的主要有MYB、NAC和MYC类等转录因子,基因表达分析表明,这些转录因子通过与顺式作用元件特异结合来调控其下游基因表达的过程中存在两种途径:依赖ABA转录调控途径以及不依赖ABA的转录调控途径[31]。例如AtMYB44、AtMYB60与AtMYB2均被证实参与了植物的干旱胁迫应答反应。其中,AtMYB2的合成依赖于内源ABA的积累,并通过ABA途径参与调控干旱胁迫基因RD22的表达调控[32~34]。如图6所示,HbMYB62基因的表达量在ABA、干旱处理的初期无显著性差异,处理48 h时都表现为显著性升高。推测HbMYB62可能在依赖ABA的转录调控途径中发挥重要作用,与相应顺式作用元件结合来参与调控下游抗旱相关基因的表达。
植物在正常的生理代谢过程中都可能会有活性氧(reactive oxygen species,ROS)的产生,如光合成、光呼吸、脂肪酸氧化和衰老等过程中都能自然产生ROS。尤其在干旱、高温、低温、机械损伤、强光照、气体污染、真菌浸染等外界环境胁迫下会产生大量的活性氧。越来越多的证据表明,H2O2在植物面临环境胁迫反应中发挥着重要的作用,比如应对逆境产生抗病防御反应、调控植物的生长发育、参与保卫细胞气孔运动等诸多生理过程。同时,为了减轻和防止H2O2的毒害,植物体内已形成了复杂和有效的氧化应激机制[35]。HbMYB62基因的表达量在H2O2、机械伤害处理下显著上调,表明HbMYB62基因可能参与植物氧化应激机制,并且在植物受到机械损伤时,通过此机制对植物进行调节以应对机械伤害。JA作为与损伤相关的植物激素和信号分子,广泛地存在于植物体中,外源应用能够激发防御植物基因的表达,诱导植物的化学防御,产生与机械损伤和昆虫取食相似的效果[36]。SA可作为植物抗病反应所需的信号分子来激活植物防御保护机制,在植物信号传导和抗逆反应中起着关键作用。SA还可与其他植物激素如ABA、JA、ET等协同作用,保护植物[37]。在MeJA,ETH和SA作用下,橡胶树HbMYB62基因的表达量均有所上调,推测HbMYB62基因与植物的MeJA,ET和SA的信号传导过程有关,与Duan等结果一致[38]。本研究为进一步阐明HbMYB62在橡胶树的抗逆反应和激素信号传导过程中的功能打下基础。
1.Ambawat S,Sharma P,Yadav N R,et al.MYB transcription factor genes as regulators for plant responses:an overview[J].Physiology and Molecular Biology of Plants,2013,19(3):307-321.
2.Rosinski J A,Atchley W R.Molecular evolution of the Myb family of transcription factors:evidence for polyphyletic origin[J].Journal of Molecular Evolution,1998,46(1):74-83.
3.Ogata K,Morikawa S,Nakamura H,et al.Solution structure of a specific DNA complex of the Myb DNA-binding domain with cooperative recognition helices[J].Cell,1994,79(4):639-648.
4.Dubos C,Stracke R,Grotewold E,et al.MYB transcription factors inArabidopsis[J].Trends in Plant Science,2010,15(10):573-581.
5.Alabadí D,Oyama T,Yanovsky M J,et al.Reciprocal regulation betweenTOC1 andLHY/CCA1 within theArabidopsiscircadianclock[J].Science,2001,293(5531):880-883.
6.Wada T,Tachibana T,Shimura Y,et al.Epidermal cell differentiation inArabidopsisdetermined by aMybhomolog,CPC[J].Science,1997,277(5329):1113-1116.
7.Lu C A,Ho T H D,Ho S L,et al.Three novel MYB proteins with one DNA binding repeat mediate sugar and hormone regulation of α-amylase gene expression[J].The Plant Cell,2002,14(8):1963-1980.
8.Yi J X,Derynck M R,Li X Y,et al.A single-repeat MYB transcription factor,GmMYB176,regulatesCHS8 gene expression and affects isoflavonoid biosynthesis in soybean[J].The Plant Journal,2010,62(6):1019-1034.
9.Dubos C,Le Gourrierec J,Baudry A,et al.MYBL2 is a new regulator of flavonoid biosynthesis inArabidopsisthaliana[J].The Plant Journal,2008,55(6):940-953.
10.Ye H X,Li L,Guo H Q,et al.MYBL2 is a substrate of GSK3-like kinase BIN2 and acts as a corepressor of BES1 in brassinosteroid signaling pathway inArabidopsis[J].Proceedings of the National Academy of the Sciences of the United States of America 2012,109(49):20142-20147.
11.Devaiah B N,Madhuvanthi R,Karthikeyan A S,et al.Phosphate starvation responses and gibberellic acid biosynthesis are regulated by theMYB62 transcription factor inArabidopsis[J].Molecular Plant,2009,2(1):43-58.
12.Cai H S,Tian S,Dong H S.Large scaleinsilicoidentification ofMYBfamily genes from wheat expressed sequence tags[J].Molecular Biotechnology,2012,52(2):184-192.
13.Matus J T,Aquea F,Arce-johnson P.Analysis of the grapeMYBR2R3 subfamily reveals expanded wine quality-related clades and conserved gene structure organization acrossVitisandArabidopsisgenomes[J].BMC Plant Biology,2008,8(1):83.
14.Stracke R,Werber M,Weisshaar B.TheR2R3-MYBgene family inArabidopsisthaliana[J].Current Opinion in Plant Biology,2001,4(5):447-456.
15.Wilkins O,Nahal H,Foong J,et al.Expansion and diversification of thePopulusR2R3-MYB family of transcription factors[J].Plant Physiology,2009,149(2):981-993.
16.Chen Y H,Yang X Y,He K,et al.The MYB transcription factor superfamily ofArabidopsis:expression analysis and phylogenetic comparison with the rice MYB family[J].Plant Molecular Biology,2006,60(1):107-124.
17.Bandurski R S,Teas H J.Rubber biosynthesis in latex ofHeveabrasiliensis[J].Plant Physiology,1957,32(6):643-648.
18.Chen S C,Peng S Q,Huang G X,et al.Association of decreased expression of a Myb transcription factor with the TPD(tapping panel dryness) syndrome inHeveabrasiliensis[J].Plant Molecular Biology,2003,51(1):51-58.
19.Peng S Q,Wu K X,Huang G X,et al.HbMyb1,a Myb transcription factor fromHeveabrasiliensis,suppresses stress induced cell death in transgenic tobacco[J].Plant Physiology and Biochemistry,2011,49(12):1429-1435.
20.庄海燕.巴西橡胶树水通道蛋白基因cDNA的克隆及其在乙烯利刺激下表达的初步分析[D].杨陵:西北农林科技大学,2010.
Zhuang H Y.Cloning and preliminary expression analysis stimulated by ethephon on aquaporin genes fromHeveabrasiliensis[D].Yangling:Northwest Agriculture and Forestry University,2010.
21.朱家红.巴西橡胶树半胱氨酸蛋白酶基因HbCP1的克隆与表达分析[D].儋州:华南热带农业大学,2007.
Zhu J H.Cloning and expression analysis on of cysteine protease geneHbCP1 fromHeveabrasiliensis[D].Danzhou:South China University of Tropical Agriculture,2007.
22.Letunic I,Copley R R,Schmidt S,et al.SMART 4.0:towards genomic data integration[J].Nucleic Acids Research,2004,32(S1):D142-D144.
23.Krogh A,Larsson B,Von Heijne G,et al.Predicting transmembrane protein topology with a hidden Markov model:application to complete genomes[J].Journal of Molecular Biology,2001,305(3):567-580.
24.Thompson J D,Gibson T J,Higgins D G.Multiple sequence alignment using ClustalW and ClustalX[M].//Baxevanis A D.Current protocols in bioinformatics.West Sussex:John Wiley and Sons,Inc.,2003,doi:10.1002/0471250953.bi0203s00.
25.Kumar S,Tamura K,Jakobsen I B,et al.MEGA2:molecular evolutionary genetics analysis software[J].Bioinformatics,2001,17(12):1244-1245.
26.Wang L F.Physiological and molecular responses to drought stress in rubber tree(HeveabrasiliensisMuell.Arg.)[J].Plant Physiology and Biochemistry,2014,83:243-249.
27.Piffanelli P,Zhou F,Casais C,et al.The barley MLO modulator of defense and cell death is responsive to biotic and abiotic stress stimuli[J].Plant Physiology,2002,129(3):1076-1085.
28.Uimari A,Strommer J.Myb26:a MYB-like protein of pea flowers with affinity for promoters of phenylpropanoid genes[J].The Plant Journal,1997,12(6):1273-1284.
29.Lee M M,Schiefelbein J.Cell pattern in the Arabidopsis root epidermis determined by lateral inhibition with feedback[J].The Plant Cell,2002,14(3):611-618.
30.Golldack D,Li C,Mohan H,et al.Tolerance to drought and salt stress in plants:Unraveling the signaling networks[J].Frontiers in Plant Science,2014,5:151.
31.Shinozaki K,Yamaguchi-shinozaki K.Gene networks involved in drought stress response and tolerance[J].Journal of Experimental Botany,2007,58(2):221-227.
32.Jung C,Seo J S,Han S W,et al.Overexpression ofAtMYB44 enhances stomatal closure to confer abiotic stress tolerance in transgenicArabidopsis[J].Plant Physiology,2008,146(2):623-635.
33.Hoeren F U,Dolferus R,Wu Y R,et al.Evidence for a role for AtMYB2 in the induction of theArabidopsisalcohol dehydrogenase gene(ADH1) by low oxygen[J].Genetics,1998,149(2):479-490.
34.Cominelli E,Galbiati M,Vavasseur A,et al.A guard-cell-specific MYB transcription factor regulates stomatal movements and plant drought tolerance[J].Current Biology,2005,15(13):1196-1200.
35.宋喜贵,佘小平.植物体内过氧化氢的产生及其生理作用[J].连云港师范高等专科学校学报,2010,27(4):99-103.
Song X G,She X P.The Generation and the role of hydrogen peroxide in plant[J].Journal of Lianyungang Teachers College,2010,27(4):99-103.
36.徐伟,严善春.茉莉酸在植物诱导防御中的作用[J].生态学报,2005,25(8):2074-2082.
Xu W,Yan S C.The function of Jasmonic acid in induced plant defence[J].Acta Ecologica Sinica,2005,25(8):2074-2082 .
37.孟雪娇,邸昆,丁国华.水杨酸在植物体内的生理作用研究进展[J].中国农学通报,2010,26(15):207-214.
Meng X J,Di K,Ding G H.Progress of study on the physiological role of salicylic acid in plant[J].Chinese Agricultural Science Bulletin,2010,26(15):207-214.
38.Duan C F,Rio M,Leclercq J,et al.Gene expression pattern in response to wounding,methyl jasmonate and ethylene in the bark ofHeveabrasiliensis[J].Tree Physiology,2010,30(10):1349-1359.
National Natural Science Foundation of China(31570591,31270643)
introduction:LU Yan-Xi(1992—),female,master,mainly engaged in the study of molecular plant pathology.
date:2017-05-03
CloningandExpressionalAnalysisofHbMYB62underMulti-stimulationinHeveabrasiliensisMuell.Arg.
LU Yan-Xi1ZHANG Dong1WANG Li-Feng2*WANG Ji-Kun2
(1.Hainan Key Laboratory for Sustainable Utilization of Tropical Bioresource,Institute of Tropical Agriculture and Forestry,Hainan University,Haikou570228;2.Danzhou Investigation and Experiment Station of Tropical Crops,Ministry of Agriculture,Rubber Research Institute,Chinese Academy of Tropical Agricultural Sciences,Danzhou571737)
R2R3-type MYB transcription factor participates in versatile biological process including stress response process. To identify the structure and function of the MYB gene in rubber tree, the full length cDNA ofHbMYB62was cloned in leaves of rubber tree. It was1013bp in length, containing a945bp ORF which encodes314amino acid residues. The deduced amino acid sequence had the specific domains of plant HTH_MYB DNA binding domain. It showed the highest identity with AtMYB62in all AtMYB family. This gene is mainly expressed in flower, whilst less expressed in bark, latex and leaf. The gene expression ofHbMYB62were differentially upregulated by H2O2, ABA, and SA. TheHbMYB62gene may play an important role in stress resistance and plant hormones signal transduction pathway in rubber tree. This study provides a fundamental knowledge for further study the structure and functions ofHbMYB62.
Heveabrasiliensis;HbMYB62;wounding;hormone;gene expression
国家自然科学基金(31570591,31270643)
陆燕茜(1992—),女,硕士研究生,主要从事分子植物病理学研究。
* 通信作者:E-mail:lfwang@catas.cn
2017-05-03
* Corresponding author:E-mail:lfwang@catas.cn
S794.1
A
10.7525/j.issn.1673-5102.2017.06.020

